La sensibilidad al gluten no celiaca (SGNC) es una entidad emergente caracterizada por síntomas gastrointestinales y extraintestinales dependientes del gluten en pacientes no celiacos, cuya prevalencia se estima hasta 10 veces superior a la de la enfermedad celiaca (EC). La dieta sin gluten es el tratamiento recomendado, pero el agente causal es desconocido y no existen criterios diagnósticos consensuados. Bajo la denominación de SGNC se han incluido pacientes con potenciales formas menores de EC o con síndrome de intestino irritable sin percepción de intolerancia al gluten, pero respondedores a la dieta sin gluten. Estudios recientes han propuesto los FODMAP (oligo, di, monosacáridos fermentables y polioles) como componente del trigo causante de los síntomas en la SGNC, en vez del gluten. Esta revisión actualiza la evidencia sobre la etiopatogenia y el beneficio de diversas intervenciones dietéticas en la SGNC, enfatizando la necesidad de un despistaje previo riguroso de la EC.
Non-celiac gluten sensitivity (NCGS) is an emerging disorder characterized by intestinal and extra-intestinal symptoms related to the ingestion of gluten-containing food in non-celiac patients. Its prevalence has been estimated to be six to ten-times higher than that of celiac disease (CD). A gluten-free diet is the most widely recommended therapy, but the causative agent remains unknown and there are no consensus diagnostic criteria. Recent studies on NCGS have included patients with possibly overlooked minor CD and diarrhea-predominant irritable bowel syndrome without self-reported gluten intolerance, but showing a response to a gluten-free diet. Furthermore, FODMAPs (Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols) have recently been postulated as the culprit component for NCGS in wheat, instead of gluten. This review updates evidence on the pathophysiology of NCGS and the efficacy of different dietary interventions in its treatment, stressing the need for proper screening for CD before a diagnosis of NCGS is made.
A lo largo de la última década, ha surgido de manera emergente la sensibilidad al gluten no celiaca (SGNC) como una nueva entidad nosológica. La observación clínica de pacientes, habitualmente mujeres entre la 2.a y la 5.a década de la vida, etiquetados con síndrome de intestino irritable (SII), que experimentan síntomas gastrointestinales y extraintestinales, claramente dependientes de la exposición y la retirada del gluten y en los que se ha descartado enfermedad celiaca (EC) y alergia al trigo, ha hecho enfrentarse a la comunidad científica a un nuevo concepto dentro de los trastornos asociados al gluten. Los síntomas y signos más característicos descritos en esta nueva entidad se encuentran reflejados en la tabla 11. Sin embargo, el concepto de que existen pacientes no celiacos con síntomas gastrointestinales dependientes del gluten, especialmente diarrea y/o distensión abdominal, no es nuevo. En 1978 fueron comunicados en The Lancet los casos clínicos de 2 pacientes no celiacos, un hombre con cefalea y distensión abdominal y de una mujer con diarrea, cuyos sintomas revirtieron con DSG y recidivaron tras exposición a gluten o centeno2,3. En este último caso, es probable que fuera la primera vez que se acuñaba el término «sensibilidad al gluten no celiaca»3. Posteriormente, en 1980 fue publicada en Gastroenterology la primera serie de pacientes con biopsias yeyunales normales y síntomas gastrointestinales que desaparecieron tras la retirada del gluten4.
Signos y síntomas más comunes en la SGNC
| 1. Intestinales (%) |
| • Dolor abdominal (77) |
| • Distensión abdominal (72) |
| • Diarrea (40) |
| • Estreñimiento (18) |
| 2. Extraintestinales (%) |
| • Bradipsiquia (42) |
| • Astenia (36) |
| • Cefalea (32) |
| • Dolores articulares (28) |
| • Parestesias en manos y pies (17) |
| • Ánimo depresivo (15) |
Fuente: Volta1.
Algunos autores, basándose en su propia experiencia, han formulado recientemente criterios diagnósticos para la SGNC, que se encuentran reflejados en la tabla 21. Su diagnóstico, al ser una entidad de reciente descripción y carente de herramientas o marcadores diagnósticos específicos, se realiza actualmente por exclusión, no existiendo en este punto un claro consenso. Pese a ello, la trascendencia de la SGNC ha sobrepasado el mundo científico y múltiples medios de comunicación han alertado sobre su creciente prevalencia, que ha llegado a ser estimada hasta del 6% en EE. UU. y del 10% en España5,6. En paralelo, se ha incrementado exponencialmente la venta de productos sin gluten, especialmente en EE. UU., donde supone un mercado que mueve un billón de dólares al año y que ha crecido un 19% en 20127,8. La principal motivación, por parte de la población no celiaca para adoptar una DSG es la percepción de que se trata de una dieta saludable9. De hecho, la integración del trigo en la dieta durante siglos ha sido considerada por algunos autores y partidarios de la medicina natural como un «error evolutivo»1,10, dada la incapacidad del hombre para digerir las proteínas y azúcares de los mismos. En el otro lado de la balanza, la DSG es cara, no se encuentra financiada en muchos países (por ejemplo, España) y puede producir limitaciones sociales importantes, ya que el trigo es la base de la alimentación, especialmente en los países mediterráneos como España.
Criterios diagnósticos de la SGNC
| 1. La ingesta de gluten condiciona la aparición de síntomas intestinales y extraintestinales de manera rápida |
| 2. Los síntomas desaparecen rápidamente al retirar el gluten de la dieta |
| 3. Resultados negativos de IgE y test cutáneos frente al trigo |
| 4. Serología negativa para enfermedad celiaca (anticuerpos IgA antiEmA, anti-TG2) |
| 5. Anticuerpos IgG antigliadina positivos en el 50% de los pacientes |
| 6. Biopsias duodenales normales o con incremento moderado de linfocitos intraepiteliales |
| 7. Haplotipo HLA-DQ2 y/o HLA-DQ8 positivo en el 40% de los pacientes |
Fuente: Volta1.
El objetivo de esta revisión es abordar de manera crítica la SGNC, buscando evidencia objetiva del papel del gluten en su fisiopatología y del beneficio de la DSG en estos pacientes, así como ahondar en las controversias surgidas acerca de la existencia real de la SGNC en los últimos años.
PatogeniaSe desconoce el mecanismo exacto por el cual el gluten, o tal vez otro componente del trigo, puede inducir síntomas en los pacientes con SGNC. Los distintos componentes del trigo postulados como desencadenantes de la SGNC10 son:
- 1)
Proteínas
- 1.
Gluten
- -
Prolaminas (proteínas solubles en alcohol). Según su origen, se clasificarían en gliadina (trigo), secalina (centeno), hordenina (cebada) y avenina (avena).
- -
Glutelinas (proteínas insolubles en alcohol). Glutenina (trigo).
- -
- 2.
Proteínas distintas del gluten, como los inhibidores de la α-amilasa-tripsina o las aglutininas del germen de trigo.
- 2)
Hidratos de carbono (oligo, di, monosacáridos, fermentables y polioles [FODMAP] u oligosacáridos, disacáridos, monosacáridos y polialcoholes fermentables).
- 3)
Otros componentes (lípidos, polifenoles…).
- 1.
La hipótesis más prevaleciente en la actualidad es que, a diferencia de la EC, en la que existe una activación de la respuesta inmune adaptativa, en la SGNC existe únicamente una respuesta inmune innata contra el agente nocivo. Esta respuesta, que no precisa de los heterodímeros HLA-DQ2/DQ8, puede ocasionar un aumento de la permeabilidad intestinal, seguida de una respuesta inflamatoria de baja intensidad en la mucosa intestinal, con liberación de citocinas y péptidos gastrointestinales. La afectación del sistema nervioso entérico colinérgico por estos mediadores favorecería en última instancia la aparición de síntomas digestivos como dolor abdominal, flatulencia, dispepsia o diarrea (tabla 3)11.
Mecanismos patogénicos potencialmente implicados en la aparición de síntomas en pacientes con SGNC
| 1. Acción tóxica directa de la gliadina y otros péptidos del gluten |
| • Aumento de la permeabilidad intestinal secundaria a la liberación de zonulina |
| • Activación de una respuesta inmune innata, con liberación de IL-15 y estimulación de linfocitos intraepiteliales |
| • Activación de macrófagos de la lamina propia con liberación de citocinas (IFN γ, TNF-α, IL-10) |
| • Afectación de la integridad de las uniones intercelulares, inhibición crecimiento celular e inducción de apoptosis |
| • Activación del sistema nervioso colinergico 2ª a liberación de acetilcolina |
| 2. Fermentación de fructanos y proteínas del gluten |
| • Malabsorción de fructanos, presentes en los cereales |
| • Producción de amonio y sulfuro de hidrógeno, secundaria a la fermentación de proteínas del gluten por bacterias reductoras de sulfatos |
Sin embargo, los resultados de todos los estudios (experimentales, in vitro y clínicos) realizados para conocer la patogenia de la SGNC ofrecen en muchas ocasiones resultados discordantes, sin poder extraer, por tanto, conclusiones definitivas. El motivo principal en la divergencia de resultados es sin duda la marcada variabilidad de la definición de SGNC en los criterios de inclusión de los estudios, desde pacientes con probable EC Marsh I (serología de EC negativa, pero con haplotipo HLA compatible, enteritis linfocitaria (EL) e incluso depósitos de anticuerpos anti-TG (anticuerpos antitranglutaminasa) 2 en las biopsias duodenales) hasta pacientes en los que se ha descartado adecuadamente la EC (haplotipo HLA negativo o positivo pero sin linfocitos intraepiteliales (LIE) en la histología duodenal)11–13, sin olvidar que en algunos estudios se incluyeron pacientes con intolerancia al gluten percibida por el propio paciente y en otros pacientes con SII no asociado a este rasgo.
Alteración de la permeabilidad intestinalExisten varios trabajos que han evaluado la permeabilidad intestinal en pacientes con SGNC con resultados contradictorios. Un primer estudio no reveló alteración de la permeabilidad intestinal en pacientes con SGNC, en condiciones basales, medida tanto por el test de lactulosa/manitol como mediante la expresión de proteínas reguladoras de la permeabilidad intestinal (claudina, ocludina y zonulina)14. Un segundo ensayo clínico, aleatorizado, doble ciego, controlado con placebo en 34 pacientes con SNGC, no observó desarrollo de alteraciones en la permeabilidad intestinal ni en biomarcadores de inflamación intestinal (proteína C reactiva y lactoferrina fecal) tras la exposición a gluten15. Un tercer estudio, sin embargo, igualmente doble ciego y controlado con placebo, demostró que los pacientes que recibieron gluten presentaban un incremento superior de la permeabilidad en el intestino delgado y el colon, medida mediante test de lactulosa/manitol y expresión de ARNm de proteínas de la unión intercelular (claudina, ocludina y zonulina) en el colon16. Estos efectos fueron más marcados en los pacientes con haplotipos HLA-DQ2 o DQ8, lo que sugiere que entre estos podía haber pacientes con formas leves de EC o celiaquía potencial. Cabe destacar además que los pacientes incluidos en este último estudio fueron pacientes con SII con predominio de diarrea sin intolerancia al gluten percibida por el paciente, a diferencia de los 2 estudios consignados anteriormente.
Activación de la inmunidad innata y adaptativaSe ha demostrado recientemente que la gliadina tiene capacidad de inducir la producción de interleuquina (IL)-15, tanto en pacientes con EC como en controles17. De hecho, la IL-15 se ha considerado como la primera señal que desencadena la cascada inflamatoria adaptativa en la EC. El mismo grupo de investigadores demostró in vitro que la exposición a la gliadina produce enfermedad en pacientes con EC por una sobreexpresión del receptor de la IL-15 (IL-15R) unido a un umbral de respuesta inmune disminuido18. Por tanto, estos autores han teorizado acerca de la posibilidad de que la SGNC implique una activación de la respuesta inmune innata a la gliadina, pero con fallo de la respuesta adaptativa posterior, en probable relación con falta de algunos elementos clásicamente considerados necesarios para ponerla en marcha, como el genotipo HLA o una alteración en la permeabilidad intestinal19. Todo ello explicaría a su vez la existencia de una respuesta inflamatoria de baja intensidad, inferior a la observada en la EC, pero superior a la de los controles sanos.
Los resultados de los estudios evaluando marcadores de respuesta inflamatoria innata en la SGNC han sido igualmente contradictorios. Dos estudios recientes provenientes del mismo grupo de trabajo14,20, comparando biomarcadores en pacientes con EC y SGNC, han demostrado un aumento de marcadores de inmunidad adaptativa en la EC (IFN-γ, IL-6. IL-7, IL-21, FOXP3) y de inmunidad innata en la SGNC (toll-like receptors [TLR] 2 y 1). Por el contrario, un estudio reciente demostró un aumento de la expresión de IFN-γ (inmunidad adaptativa) en los pacientes con SGNC, con mayor expresión de TNF-α e IL-8 en los pacientes con EC21.
De igual manera, 2 estudios, realizados en pacientes con SII tipo diarrea, han demostrado que la gliadina condiciona activación de basófilos y de IL-10, TNF-α y factor estimulante de granulocitos (en cultivos de células mononucleares periféricas)16,22. Sin embargo, otro estudio experimental más reciente, en pacientes con SGNC, no ha podido demostrar sobreexpresión de marcadores de inflamación ni activación de basófilos tras exposición a gliadina de los enterocitos23.
Alteración del sistema nervioso colinérgicoEn un subgrupo de pacientes con SII presuntamente relacionada con SGNC se ha demostrado la existencia de una respuesta inflamatoria de baja intensidad, con aumento de LIE CD3 (+) y mastocitos en la mucosa24, así como una reducción de la expresión del transportador de recaptación de la serotonina, que podría favorecer una actividad prolongada de la 5-hidroxitriptamina, con mayor liberación de acetilcolina y, por tanto, activación del sistema nervioso colinérgico25. Dado que estos cambios en el sistema nervioso entérico se encuentran descritos en la EC, algunos autores sugieren que una liberación de acetilcolina inducida por el gluten podría desencadenar la aparición de síntomas digestivos en los pacientes con SGNC11. En un estudio experimental con ratones transgénicos HLA-D, se observó que la administración de gliadina ocasionó un aumento en la liberación de acetilcolina por el plexo mientérico, seguida de hipercontractilidad en la musculatura intestinal y un estado hipersecretor intestinal26. Otro modelo experimental reciente con ratones demostró que antígenos endoluminales de la dieta como el gluten pueden contribuir a un aumento de la respuesta inflamatoria27.
Fermentación de hidratos de carbono (FODMAP: oligo, di y monosacáridos fermentables y polioles)Durante el último año se han publicado estudios de gran importancia que apoyan el papel de los FODMAP como agentes capaces de inducir síntomas en el SII y en la SGNC28–30. La fermentación bacteriana de estos hidratos de carbono produce ácidos grasos de cadena corta, lactato y gas, y se ha asociado con la aparición de hinchazón abdominal, meteorismo, dolor abdominal y diarrea31,32. La aparición de síntomas digestivos tras la ingesta de trigo se ha relacionado con su alto contenido en fructanos, oligosacáridos de cadena larga que son pobremente absorbidos y por tanto susceptibles de fermentación bacteriana, así como con la presencia intestinal de bacterias reductoras de sulfatos. La fermentación de proteínas del gluten por estas bacterias intestinales podría producir liberación de amonio y sulfuro de hidrógeno, que pueden ocasionar tanto síntomas digestivos locales como sistémicos (astenia)28,32.
Enteritis linfocitaria y síntomas dependientes del gluten: ¿sensibilidad al gluten no celíaca o enfermedad celíaca Marsh I?¿Qué es la enteritis linfocitaria?La EL, también denominada en la bibliografía médica como enteropatía linfocitaria o duodenosis linfocítica, es una entidad caracterizada por un aumento de LIE en las vellosidades intestinales (>25 LIE por cada 100 células epiteliales) intestinales, sin hiperplasia de las criptas ni atrofia vellositaria (corresponde con la lesión tipo Marsh I del espectro de la enfermedad celiaca). Se trata de una lesión histológica inespecífica, característica de las fases iniciales de la EC, aunque puede encontrarse asociada a la infección por Helicobacter pylori (H. pylori), el sobrecrecimiento bacteriano intestinal, el uso de algunos fármacos (principalmente antiinflamatorios no esteroideos [AINE]), otras infecciones (víricas, parasitarias, bacterianas), sensibilidad a otras proteínas alimentarias (leche de vaca, huevo, etc.) o la enfermedad inflamatoria intestinal. Tradicionalmente se ha considerado que las formas leves de EC (EL sin atrofia vellositaria) no se asociaban a síntomas o signos de malabsorción. Sin embargo, un primer estudio español demostró que la frecuencia de síntomas observados en familiares de primer grado de pacientes celiacos, tras cribado con HLA y biopsias, era significativamente superior en presencia de lesiones tipo Marsh I y 3 respecto a aquellos con mucosa duodenal normal (56 y 54 vs 21%; p=0,002)33. Un segundo trabajo italiano mostró tasas similares de manifestaciones clínicas entre pacientes celiacos con EL y atrofia vellositaria (manifestaciones gastrointestinales: 70 vs 70%; y manifestaciones extraintestinales: 66 vs 57%)34. De igual manera, ha quedado demostrado en otros 2 estudios recientes el beneficio de la DSG en pacientes con EL, con mejoría clínica e histológica, similar a la obtenida en un grupo control con atrofia vellositaria, en pacientes con enteropatía leve (Marsh 1-2), independientemente de la positividad35 o negatividad de la serología36.
¿Cómo se confirma el diagnóstico de enfermedad celiaca en pacientes con enteritis linfocitaria?La prevalencia de EC comunicada en pacientes evaluados por EL varía entre el 16-48%, dependiendo de la estrategia diagnóstica utilizada y los criterios empleados para establecer el diagnóstico de EC33,37–39. No existe consenso respecto a la manera de diagnosticar la EC en pacientes sin atrofia vellositaria, donde las dificultades diagnósticas son mayores dado que hasta el 80% de pacientes pueden tener serología negativa40. Pese a la evidencia expuesta anteriormente de que la EL presenta síntomas del espectro de la EC y respuesta tanto clínica como histológica a la DSG, muchos trabajos siguen considerando la posibilidad del diagnóstico de EC únicamente ante la presencia de atrofia de las vellosidades. En la actualidad, existen al menos 2 referentes claros acerca de cómo diagnosticar la EC en pacientes sin atrofia vellositaria: las guías actualizadas de diagnóstico de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)41 y los criterios diagnósticos de EC («regla 4 de 5») de Catassi y Fasano42.
Guías clínicas de diagnóstico de enfermedad celiaca (2012) de la European Society of Paediatric Gastroenterology, Hepatology and NutritionLas guías actualizadas de la European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN), aunque estiman una prevalencia final baja de EC (10%) en pacientes con EL, apuntan 3 variables que sugieren el diagnóstico de EC: 1) un recuento elevado de LIE que expresan el TCR gamma-delta, determinado en las biopsias mediante citometría de flujo (biopsias en fresco) o inmunohistoquímica (biopsias congeladas), 2) distribución apical de LIE en las biopsias y 3) depósitos de anticuerpos de tipo IgA frente a la transglutaminasa tisular en la mucosa intestinal. La expresión de anti-tTG IgA en la mucosa duodenal implicaría la activación de una respuesta inmune adaptativa típica de la EC43. En un estudio reciente en niños, se detectaron depósitos de anti-tTG IgA hasta en el 66% de 18 pacientes con EL y serología celiaca negativa44. Respecto a los adultos, un primer estudio en 22 pacientes con enteropatía leve y serología celiaca negativa detectó depósitos de anti-tTG IgA en el 100% de los casos45. En otro estudio, los mismos autores realizaron un seguimiento medio de 7 años a un total de 50 pacientes con diagnóstico incierto de EC (25 con serología celiaca positiva y biopsia normal, 25 con serología celiaca negativa y EL) y 25 controles (serología celiaca negativa y ausencia de enteropatía). Diecisiete pacientes fueron diagnosticados finalmente de EC. La detección de depósitos de anti-tTG IgA en las biopsias iniciales tuvo una sensibilidad y una especificidad superior al 90% para predecir un diagnóstico final de EC46. Esta estrategia se ha mostrado igualmente eficaz en nuestro medio para detectar casos dudosos de EC47.
En conclusión, los depósitos de anti-tTG IgA pueden ser un marcador diagnóstico altamente sensible y específico para el diagnóstico de la EC, siendo especialmente útil en aquellos casos de enteropatía leve o serología celiaca negativa. Sin embargo, tanto las técnicas de inmunofluorescencia como la citometría de flujo, no se hallan disponibles en la mayoría de los laboratorios en la práctica clínica habitual.
Regla diagnóstica (4 de 5) de Catassi y FasanoEn ausencia de técnicas de laboratorio especializadas, el diagnóstico de EC en pacientes con EL se debe apoyar en las reglas diagnósticas propuestas en 2010 por Catassi y Fasano42. Estos autores proponen una estrategia simplificada de diagnóstico de la EC consistente en 5 criterios, de tal manera que la gran mayoría de los pacientes con EC se pueden diagnosticar si cumplen 4 de los 5 requisitos (o 3 de 4 en ausencia de estudio genético) (tabla 4). En los pacientes con serología celiaca negativa, ante la presencia de 3 criterios (HLA compatible, síntomas típicos y lesión histológica Marsh I), es indispensable documentar la respuesta clínica y, sobre todo, histológica a la DSG48, y en algunos casos puede ser útil realizar una nueva evaluación tras realizar una sobrecarga con gluten49. Debe tenerse en cuenta que ninguna de las lesiones histológicas descritas en el EC es patognomónica y que especialmente en los pacientes con serología negativa y formas leves de enteropatía (Marsh 1 y 2) deben considerarse firmemente aquellas otras entidades capaces de inducir cambios morfológicos similares, especialmente la infección por H. Pylori, el sobrecrecimiento bacteriano intestinal y/o el consumo de AINE.
Criterios diagnósticos de enfermedad celiaca
| • Síntomas típicos de enfermedad celiacaa |
| • Anticuerpos séricos de celiaquía de clase IgA positivos a títulos altosb |
| • Haplotipos HLA-DQ2 o DQ8c |
| • Enteropatía tipo celiaco en la biopsia de intestino delgadod |
| • Respuesta a la dieta sin glutene |
Fuente: regla «4 de 5»42.
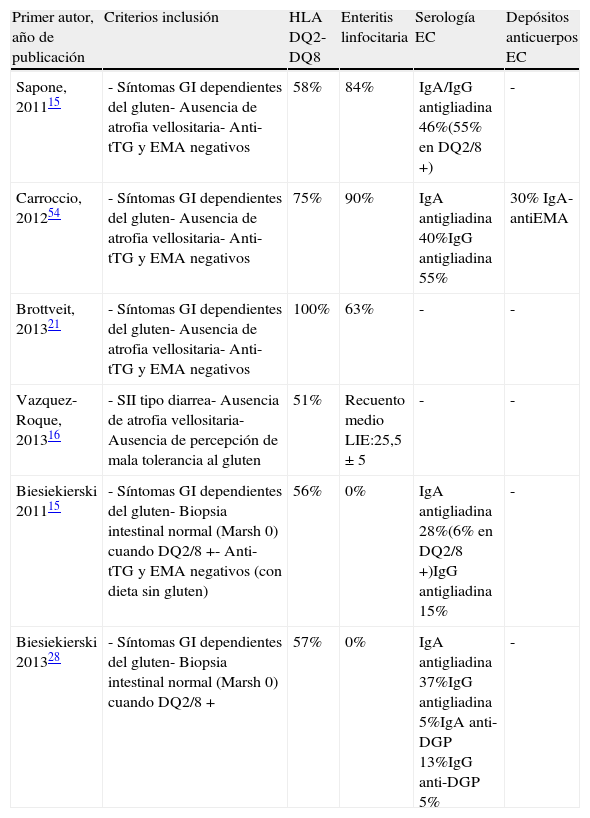
Un número importante de estudios sobre SGNC presenta limitaciones metodológicas como la inclusión de pacientes con SII sin mala tolerancia al gluten percibida por el paciente o de pacientes con EL que podrían haberse categorizado como celiacos según los criterios diagnósticos actuales. Es factible que los pacientes con SII tipo diarrea sin percepción de mala tolerancia al gluten sean distintos de los pacientes con criterios clínicos de SGNC, mientras que la inclusión de pacientes con EL siempre generará la duda sobre si estos pacientes presentan una forma leve de EC, sobre todo, si además presentan HLA-DQ2/8 positivo y no se realizan maniobras diagnósticas adicionales para un diagnóstico de EC, como la determinación de linfocitos gamma-delta, la detección de depósitos de anti-tTG IgA o la evaluación de una respuesta clínica e histológica a la DSG. Esta problemática queda ilustrada en la tabla 5, que recoge los criterios de inclusión y las características basales (genéticas, histológicas y serológicas) de los pacientes con presumible SGNC en estudios realizados en los últimos 3 años.
Características basales de los pacientes incluidos en los estudios más importantes sobre SGNC realizados en los últimos 3 años, destacando la heterogeneidad en los criterios de selección y la inclusión de pacientes potencialmente celiacos
| Primer autor, año de publicación | Criterios inclusión | HLA DQ2-DQ8 | Enteritis linfocitaria | Serología EC | Depósitos anticuerpos EC |
| Sapone, 201115 | - Síntomas GI dependientes del gluten- Ausencia de atrofia vellositaria- Anti-tTG y EMA negativos | 58% | 84% | IgA/IgG antigliadina 46%(55% en DQ2/8+) | - |
| Carroccio, 201254 | - Síntomas GI dependientes del gluten- Ausencia de atrofia vellositaria- Anti-tTG y EMA negativos | 75% | 90% | IgA antigliadina 40%IgG antigliadina 55% | 30% IgA-antiEMA |
| Brottveit, 201321 | - Síntomas GI dependientes del gluten- Ausencia de atrofia vellositaria- Anti-tTG y EMA negativos | 100% | 63% | - | - |
| Vazquez-Roque, 201316 | - SII tipo diarrea- Ausencia de atrofia vellositaria- Ausencia de percepción de mala tolerancia al gluten | 51% | Recuento medio LIE:25,5±5 | - | - |
| Biesiekierski 201115 | - Síntomas GI dependientes del gluten- Biopsia intestinal normal (Marsh 0) cuando DQ2/8+- Anti-tTG y EMA negativos (con dieta sin gluten) | 56% | 0% | IgA antigliadina 28%(6% en DQ2/8+)IgG antigliadina 15% | - |
| Biesiekierski 201328 | - Síntomas GI dependientes del gluten- Biopsia intestinal normal (Marsh 0) cuando DQ2/8+ | 57% | 0% | IgA antigliadina 37%IgG antigliadina 5%IgA anti-DGP 13%IgG anti-DGP 5% | - |
Anti-DGP: anticuerpos anti-péptidos de gliadina deamidada; Anti-EmA: anticuerpos antiendomisio; Anti-tTG: anticuerpos antitransglutaminasa tisular; EC: enfermedad celiaca; SII: síndrome del intestino irritable.
En este sentido, los estudios del grupo australiano que se enumeran a continuación en la sección de tratamiento dietético15,28 son los únicos trabajos en los que, a nuestro entender, se ha descartado con seguridad la EC mediante criterios de inclusión restrictivos (HLA DQ2-DQ8 negativo o positivo pero con biopsias duodenales normales, sin LIE) antes de realizar una intervención dietética. Los autores de esta revisión planteamos unos criterios diagnósticos de la SGNC (tabla 6) en los que debe ser imprescindible la existencia de síntomas dependientes del gluten y un despistaje exhaustivo de la EC, como se ha explicado anteriormente.
Criterios diagnósticos de la SGNC propuestos por los autores de la revisión
| 1. Presencia de síntomas gastrointestinales (principalmente dolor abdominal, distensión abdominal y/o diarrea) dependientes de la exposición dietética al gluten |
| 2. Despistaje adecuado de la enfermedad celiaca |
| - HLA DQ2/DQ8 y serología de celiaquía negativos |
| - Si HLA DQ2/DQ8 positivo (uno/ambos heterodímeros) y serología negativa¶ |
| 1) Biopsia duodenal normal o bien |
| 2) Linfocitosis epitelial>25 LIE/100 células epiteliales con: |
| 2.1. Ausencia de depósitos de anticuerpos IgA frente a la transglutaminasa tisular en la mucosa intestinal |
| 2.2. Ausencia de recuento elevado de linfocitos que expresan el TCR gamma-delta en la mucosa intestinal |
| 2.3. Si no están disponibles las técnicas anteriores, descartar otras etiologías de EL (infección por H. pylori, AINE, sobrecrecimiento bacteriano, etc.) y EC definida como la respuesta clínica e histológica tras la retirada y la reintroducción del gluten |
| 3. Resultados negativos de IgE y test cutáneos frente al trigo |
| 4. Tras realización de dieta sin gluten con mejoría clínica durante un mes, reaparición de los síntomas al reintroducir el gluten, de manera abierta o doble ciego controlado con placebo |
¶ La serología negativa implica la ausencia de anticuerpos anti-TG2 y anti-EmA. Los anticuerpos antigliadina IgG pueden ser positivos en población no celiaca.
Las primeras descripciones de pacientes que hoy en día podrían ser categorizados como portadores de una SGNG (de acuerdo con la nomenclatura vigente) fueron realizadas hace décadas. En 1980 se comunicó una serie de 9 pacientes en los que se había descartado la EC, con dolor abdominal y diarrea que relacionaban con la ingesta de gluten, que presentaron una mejoría espectacular de los síntomas tras iniciar una DSG4. Veinte años después, un trabajo escandinavo comunicó una serie de 93 pacientes adultos que presentaban síntomas abdominales después de la ingesta de cereales, en los que se llegó al diagnóstico final de EC en el 9%, EC latente en el 8% y alergia a cereales en el 20%. Cabe destacar que el 63% restante de pacientes no pudieron ser clasificados como pacientes celiacos o alérgicos al trigo, pero sus síntomas guardaban una clara relación con la ingesta de alimentos que contenían gluten50.
En los años 2001 y 2007, 2 estudios controlados pero sin doble ciego, realizados por el mismo grupo de investigadores, en pacientes con SII con predominio de diarrea, serología de celiaquía negativa y biopsia duodenal sin atrofia (aunque sí podían tener aumento de LIE), demostraron una mejoría estadísticamente significativa en el número de deposiciones al día con una DSG51,52. Este efecto fue más pronunciado en aquellos pacientes que presentaban HLA-DQ2 o HLA-DQ8 positivos. Es de destacar la presencia de anticuerpos anti-transglutaminasa tisular y antigliadina IgA en el fluido duodenal de estos pacientes, planteando de nuevo la duda sobre si eran pacientes realmente celiacos y no pacientes con SGNC.
Estudios recientes (2011-2013)La evidencia más sólida sobre la existencia de la SGNC como una entidad clínica diferente proviene de un grupo de investigadores australianos que ha publicado 2 estudios doble ciego y controlados con placebo realizados en pacientes que se habían autocatalogado como sensibles al gluten15,28. En el primero de estos ensayos clínicos15, se incluyeron 34 pacientes diagnosticados de SII, con remisión clínica siguiendo una DSG y en los que se había descartado adecuadamente la EC (DQ2/8 negativo o si tenían DQ2 o DQ8 positivo biopsia intestinal normal -Marsh 0-). Posteriormente, los pacientes reintrodujeron gluten (16g/d) o placebo de forma aleatorizada y ciega durante 6 semanas mientras se proseguía con la DSG. Los pacientes del grupo que contenía gluten presentaron un empeoramiento significativo de los síntomas gastrointestinales y de astenia, ya en la primera semana, en comparación con los que recibieron placebo. No hubo diferencias en la producción de síntomas dependiente del haplotipo DQ2/DQ8 y tampoco se objetivaron cambios en las determinaciones de anticuerpos antigliadina y anti-tGT tras la exposición a gluten. Estos resultados fueron considerados como la primera evidencia científica sólida sobre la existencia de la SGNC.
En 2012, se publica un estudio donde 920 pacientes con SII sin alergia al trigo (IgE negativo) realizaron una dieta de eliminación de trigo durante 4 semanas y fueron posteriormente aleatorizados a recibir cápsulas de trigo o placebo, con doble ciego53. Se identificó un total de 276 pacientes con sensibilidad al trigo, de los que 206 presentaban múltiples intolerancias a alimentos y 70 fueron catalogados como pacientes con sensibilidad al trigo no celiaca. Sin embargo, el 96% de estos últimos presentaban EL, el 75% HLA-DQ2/8 positivo, un 40% IgA antigliadina positivo y un 8% anticuerpos anti-EmA (anticuerpos antiendomisio) positivos en el cultivo de mucosa duodenal, por lo es probable que un porcentaje aproximadamente entre el 10-40% de estos pacientes deberían haberse categorizado como EC12. Un estudio más reciente, realizado en EE. UU., evaluó el efecto de una DSG en comparación con una dieta con gluten en 45 pacientes con SII tipo diarrea, sin percepción de mala tolerancia al gluten, tanto HLA-DQ2/DQ8 positivos como HLA-DQ2/DQ8 negativos16. Se observó una reducción significativa en el número de deposiciones al día con la DSG, más pronunciado en los pacientes con HLA-DQ2/DQ8 positivo. Por tanto, todos estos estudios presentan datos que sugieren que el gluten es el agente causal de la SGNC, si bien un subgrupo de los pacientes tipificados como sensibles al gluten/trigo podrían realmente pertenecer al espectro de la EC.
Por último, el mismo grupo australiano reseñado anteriormente realizó otro estudio de seguimiento dietético en pacientes con los mismos criterios de inclusión, incluyendo algunas innovaciones en el diseño respecto al estudio previo28. El gluten que se utilizó estaba libre de contaminación con hidratos de carbono que potencialmente podrían inducir síntomas (es decir, no contenía FODMAP) y se evaluó la presencia de células T específicas para gliadina, que identifica respuestas específicas de EC. Treinta y siete pacientes con SII y SGNC asintomáticos siguiendo una DSG realizaron durante 2 semanas una dieta con bajo contenido en FODMAP y posteriormente fueron aleatorizados con doble ciego para recibir durante una semana placebo (proteína de soja, 16g/d), dosis bajas de gluten (2g/día) o dosis altas de gluten (16g/día), durante la DSG y con bajo contenido en FODMAP. Los 3 grupos de pacientes mejoraron significativamente durante las 2 semanas previas de dieta con bajo contenido en FODMAP, mientras los síntomas empeoraron de manera similar tanto con la reintroducción del gluten como con la del placebo. No se objetivó un efecto dependiente de la dosis de gluten ni se apreciaron cambios en la serología celiaca o en las células T específicas inducidas por gliadina tras la reintroducción de gluten. Posteriormente, se invitó a los pacientes para una nueva fase de reintroducción de 3 días, en la que participaron 22 de los 37 pacientes iniciales, siendo aleatorizados para recibir gluten (16g/día), soja (16g/día) o placebo. Los resultados de nuevo mostraron una baja reproducibilidad de los síntomas con la reintroducción del gluten o placebo. Se observó un efecto nocebo (empeoramiento de los síntomas o signos con el tratamiento placebo por la expectativa, consciente o no, de efectos negativos de una medida terapéutica) elevado en los 2 ensayos del estudio. Se concluyó que o bien los pacientes no presentaban SGNC o bien el diseño cruzado del estudio, con el efecto nocebo descrito, no fue capaz de reconocer esta entidad. También se concluyó que era posible que el gluten no fuera el desencadenante específico de los síntomas intestinales si se ha restringido la ingesta de FODMAP. De hecho, un estudio controlado previo realizado por los mismos autores demostró que una dieta baja en FODMAP mejoraba de forma significativa los síntomas gastrointestinales en pacientes con SII54.
ConclusionesLa SGNC es una entidad emergente, cuya verdadera prevalencia es aún desconocida, con unas manifestaciones clínicas marcadamente solapadas con la EC y el SII. Al carecer de criterios diagnósticos consensuados, únicamente se puede diagnosticar mediante exclusión de otras entidades y mejoría/empeoramiento tras retirada/reintroducción del gluten (síntomas dependientes del gluten). Su agente causal es desconocido y existen dudas acerca de si es realmente el gluten o algún otro componente del trigo, especialmente los hidratos de carbono (FODMAP), el desencadenante de los síntomas. Un número importante de estudios sobre SGNC presenta limitaciones metodológicas que probablemente justifican divergencias notables en los resultados, los cuales deben ser interpretados con cautela. Se ha postulado, también con resultados contradictorios, que en individuos con SII genéticamente susceptibles (HLADQ2-DQ8), el consumo de gluten puede generar una respuesta inmune de baja intensidad y desarrollo de anticuerpos antigliadina55. Los estudios recientes sobre restricciones dietéticas en la SGNC no permiten hoy en día concluir de forma definitiva si es la retirada del gluten, la exclusión del trigo o una dieta baja en FODMAP lo que verdaderamente beneficia a los pacientes con SGNC. Pese al pretendido papel adquirido por los FODMAP como mediadores en la mejoría sintomática observada tras retirar el gluten, un grupo de expertos ha argumentado que los FODMAP no pueden ser el único factor causal de los síntomas de estos pacientes, ya que experimentan una resolución de sus síntomas con una DSG a pesar de continuar la ingesta de FODMAP de otros orígenes, como las legumbres (una fuente mucha más rica de FODMAP que el trigo)56. Todos estos estudios demuestran el gran potencial de las intervenciones dietéticas específicas en las enfermedades gastrointestinales, además de la EC. Es necesario realizar ensayos clínicos de alta calidad, con pacientes bien seleccionados y en diferentes lugares del mundo para poder concluir definitivamente si existe o no la SGNC como una entidad propia y, en caso de confirmarse, evaluar cuál es el mejor tratamiento dietético (tabla 7).
Retos y desafíos futuros para la investigación en la SGNC
| • Descubrir el agente causal de la enfermedad para: |
| - Encontrar una nomenclatura adecuada para la entidad (sensibilidad agluten/trigo/FODMAP) |
| - Mejorar el conocimiento de su fisiopatología y de las posibles dianas terapéuticas |
| - Acotar las restricciones dietéticas a aquellas estrictamente necesarias |
| • Definir adecuadamente los criterios diagnósticos de la enfermedad, con el objetivo de delimitar una distinción adecuada entre la EC, especialmente tipo Marsh I, y la SGNC |
| • Estudios de prevalencia rigurosos, prospectivos y con inclusión de pacientes bien seleccionados, claramente diferenciados de la EC, y en los que se hayan descartado otras causas de los síntomas |
| • Encontrar biomarcadores para el diagnóstico y monitorización de la enfermedad |
| • Descripción de la historia natural, complicaciones y pronóstico de la enfermedad |
| • Evaluar el impacto de la restricción alimentaria en biomarcadores, historia natural y complicaciones |
| • Valorar el impacto social y económico de la SGNC |
Los autores declaran no tener ningún conflicto de intereses.