El cáncer de ovario constituye una complicación poco frecuente durante la gestación, aunque cuando se produce representa un problema complejo y controvertido desde el punto de vista terapéutico. Su manejo deberá ser individualizado, teniendo en cuenta la edad gestacional, el estadio, el tipo histológico y los deseos genésicos de la paciente, tratando de minimizar los riesgos, tanto para la madre como para el feto.
Presentamos un caso clínico de cáncer de ovario que complica la gestación y procedemos a revisar la bibliografía médica actual sobre esta rara asociación.
Ovarian cancer is an uncommon complication during pregnancy and its therapeutic management is complex and controversial. Management should be individually tailored, bearing in mind gestational age, tumoral stage, histological type and the patient's wishes, with the aim of reducing the risks to both mother and child. We report a case of ovarian cancer during pregnancy and review the current literature on this infrequent association.
Primigesta de 37 años, sin antecedentes personales ni familiares de interés, salvo cuadros ansioso-depresivos frecuentes. Nunca revisiones ginecológicas.
Durante el primer control obstétrico realizado a las 9 semanas de amenorrea se observa formación quística de ±50×48mm dependiente de ovario derecho.
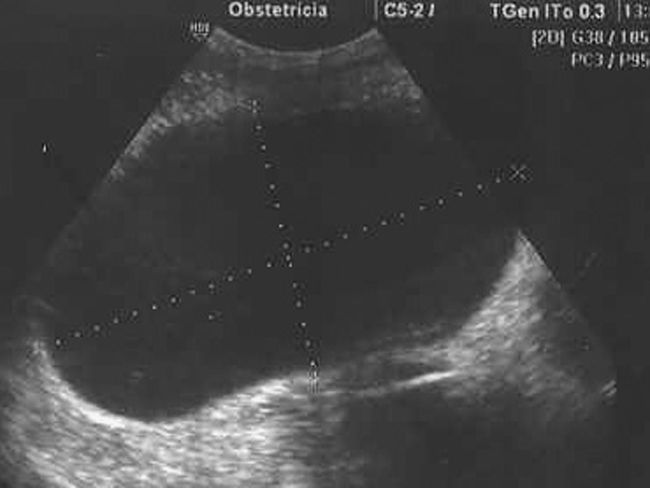
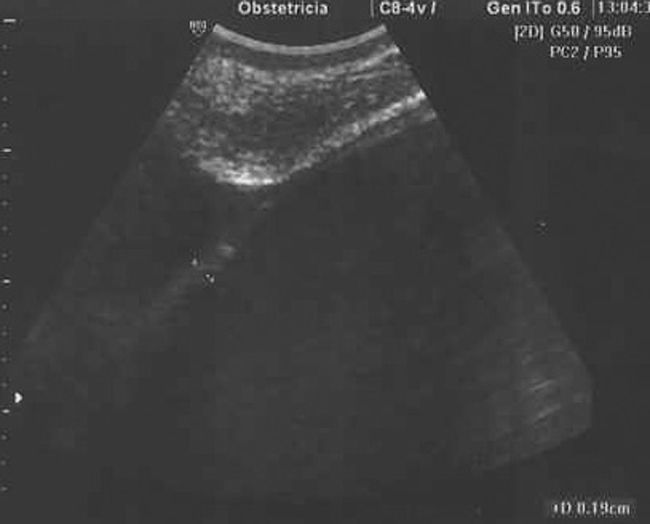
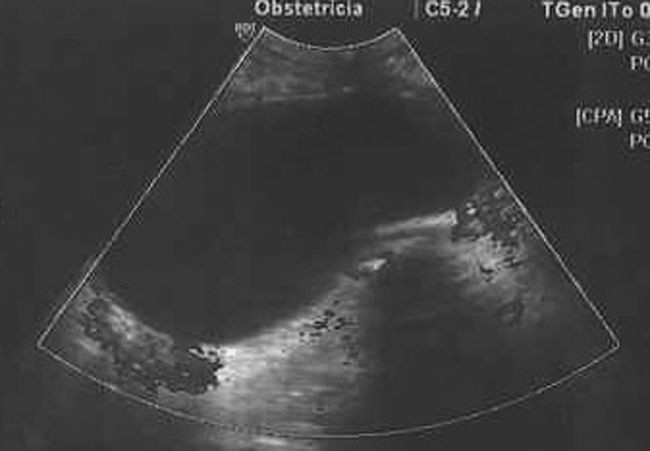
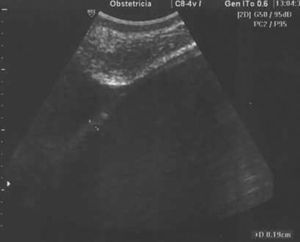
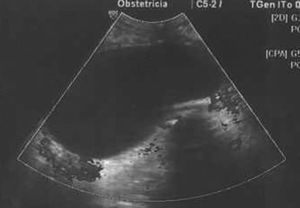
Estudio ecográfico por vía vaginal: imagen hipoecogénica, redondeada, bien delimitada, de ±50×48mm, sin papilas ni excrecencias ni trabéculas, dependiente de ovario derecho. Tamaño de borde <1mm. Estudio Doppler-color y Power Doppler color negativo en su interior. Índice de resistencia en vasos de periferia de 0,78 (figs. 1, 2 y 3). Útero y anejo izquierdo normales. Embrión único, vivo, corresponde con amenorrea.
Hemograma, bioquímica y serologías normales. Cribado de cromosomopatías combinado del primer trimestre negativo.
La paciente refería episodios repetitivos y cada vez más frecuentes de dolor abdominal, por lo que en la semana 13, previo consentimiento informado, se decide punción-aspiración ecoguiada teniendo en cuenta las características de benignidad del quiste ovárico. Se aspiran 600ml de líquido de aspecto claro que se remite a Anatomía Patológica para un estudio citológico, siendo éste negativo para malignidad.
En el control ecográfico realizado a las 3 semanas de la punción, se observan ambos ovarios con ecoestructura normal.
A las 5 semanas pospunción se observa una imagen hipoecogénica, con las mismas características ecográficas, de ±48×47mm.
Control ecográfico a las 7 semanas de la punción (20 semanas de amenorrea): imagen con las mismas características, de ±150×80mm. Estudio anatómico fetal normal.
Se decide laparotomía para exéresis de la formación con ovariectomía derecha.
A las 21 semanas de amenorrea se practica anexectomía derecha. Hallazgos operatorios: gran quiste líquido que alcanza región hepática, bien delimitado, sin adherencias. Útero gestante y anejo izquierdo macroscópicamente sano. Revisión de la cavidad sin hallazgos. Postoperatorio sin incidencias.
El estudio patológico concluyó que se trataba de un cistoadenocarcinoma mucinoso moderadamente diferenciado de ±3cm sobre cistoadenoma mucinoso de 16cm. No había evidencia de tumor en la superficie externa de la cápsula. Trompa de Falopio sin evidencia de malignidad.
Se informa a la paciente del resultado de la intervención y conjuntamente se decide esperar a la viabilidad fetal, con controles ecográficos y analíticos de la enfermedad ovárica, para luego plantear la cirugía definitiva de estadiaje.
Marcadores tumorales seriados (antígeno carcinoembrionario, CA 125, CA 19-9) dentro de la normalidad durante toda la gestación. El embarazo transcurre sin otras incidencias, salvo interconsulta al Servicio de Psiquiatría por cuadro ansioso-depresivo.
Tras reunión con la Comisión de Oncología de nuestro Hospital, se decide finalizar la gestación en la semana 35 y dadas las características favorables del cérvix se programa la inducción.
Parto eutócico, recién nacido mujer, Apgar 10/10, peso 3.100g. Puerperio sin incidencias.
Al mes del parto, se practica cirugía de estadiaje con histerectomía total, anexectomía izquierda, apendicectomía, omentectomía infracólica, linfadenectomía (se obtienen más de 20 ganglios linfáticos), lavados peritoneales y biopsias ciegas múltiples. El estudio anatomopatológico de las piezas quirúrgicas fue negativo para malignidad, quedando la enfermedad clasificada como un estadio IA GII.
Valorado el caso por el Servicio de Oncología se decide no realizar quimioterapia. En la actualidad la paciente se encuentra libre de enfermedad.
DiscusiónLa presencia de una masa ovárica en el curso de la gestación es una complicación poco frecuente, pero que va a generar una situación compleja y de gran incertidumbre tanto en la pareja como en el ginecólogo, hasta que logremos definir el carácter benigno/maligno de la tumoración.
Al realizar una revisión de la literatura médica encontramos que la coincidencia de masa anexial y gestación presenta una incidencia muy variable según los diferentes autores, oscilando desde 1 por cada 79 hasta 1 por cada 2.660 embarazos1–6 con una media de 1 tumoración anexial por cada 800 gestaciones. Esta variación tan notable en la incidencia viene determinada por los diferentes métodos de diagnóstico empleados (ecografía, exploración clínica, intervención, etc.), por las diferentes poblaciones de estudio o también por los distintos criterios empleados en la definición de masa ovárica. La gran mayoría de las masas ováricas diagnosticadas durante la gestación van a ser de tipo funcional y se estima que sólo el 2–5% van a ser tumores malignos5.
El diagnóstico de masa anexial asociada a gestación se suele realizar por exploración física, ecografía o bien durante la intervención de cesárea7,8,10,11.
Con la generalización de la ecografía, sobre todo por vía transvaginal, es frecuente el diagnóstico de formación anexial durante el primer trimestre de gestación, cuando éstas son bien delimitadas, hipoecogénicas sin papilas ni excrecencias ni septos, de tamaño menor a 5cm, con bordes finos (menores a 3mm) y sin mapa color central suelen ser funcionales y desaparecer sobre la semana 14 de la amenorrea11,12.
En cuanto al papel de la ecografía para la valoración de benignidad/malignidad de las tumoraciones ováricas durante la gestación, nos podemos remitir al trabajo de Bromley y Benacerraf13, que estudiaron 131 masas anexiales de más de 4cm en gestantes con amenorrea superior a 12 semanas, observaron que sólo el 7% de las lesiones catalogadas como malignas por sonografía lo eran en el estudio anatomopatológico.
La mayor parte de las masas anexiales detectadas durante el primer trimestre desaparecerán a medida que avance el embarazo, por lo que serán indetectables alrededor de la semana 14. Se ha observado que el tamaño de la masa anexial en el momento del diagnóstico está inversamente relacionado con la probabilidad de regresión espontánea. La tasa de complicaciones aumenta con el tamaño de la masa14 de tal modo que Chih-Feng et al14 (2008) observan que el 14,84±3,05% de las masas anexiales asociadas a la gestación van a sufrir fenómenos de torsión estudiando una cohorte de 174 embarazadas con masa anexial; pero cuando valoran el riesgo de torsión en masas con un tamaño mayor a 6cm el riesgo se incrementa con significación estadística (el 22,41 vs. el 9,48%; odds ratio de 2,8, intervalo de confianza del 95%: 1,1 a 6,6). También refieren que el 60% de las torsiones va a ocurrir entre la semana 10 y 17 de la gestación y sólo el 5,9% sucede después de la semana 20.
Todos los autores revisados coinciden en que cuando se trata de una tumoración compleja y con aumento de tamaño debe ser intervenida hacia la semana 18, dada la posibilidad de que se trate de una neoplasia ovárica. Debemos destacar que, en el caso presentado por nosotros, llama poderosamente la atención el que una tumoración ovárica que presentaba todos los criterios de benignidad (formación regular, bien delimitada, hipoecogénica, sin papilas, ni septos ni trabéculas, con bordes finos, sin mapa color central) (figs. 1, 2 y 3) resultase en el estudio anatomopatológico un cistoadenocarcinoma de ovario.
Se ha comunicado una incidencia del cáncer ovárico que oscila entre 1:10.000 y 1:25.000 embarazos7, que concuerda con la frecuencia esperada de esta entidad en los pacientes de la misma edad, sólo el 20% de los cánceres epiteliales de ovario ocurre en la premenopausia y sólo el 10% acontece en menores de 35 años.
El cáncer de ovario representa la quinta neoplasia que complica la gestación por orden de frecuencia, tras mama, cérvix, tiroides y melanoma, seguido de Hodgkin y leucemias.
La mayoría de estas pacientes (66%) suelen ser asintomáticas, tratándose de un hallazgo casual del estudio sonográfico gestacional. La clínica más frecuentemente encontrada es el dolor abdominal agudo o crónico. La mayoría de las pacientes van a ser diagnosticadas durante el segundo trimestre (Machado9: el 46,6%; Behtash8: el 43,47%) durante el estudio ecográfico fetal, si bien tampoco son pocos los casos diagnosticados durante la intervención de cesárea, pero es de prever que con la sistematización de los ultrasonidos y con la mejora tecnológica de éstos la gran mayoría de los diagnósticos serán incidentales en el curso de la gestación.
Los marcadores tumorales son de poca o nula utilidad en el diagnóstico del cáncer de ovario asociado al embarazo. En el caso del Ca 12515 sus valores aumentan fisiológicamente durante la gestación, lo que limita su uso. De igual manera ocurre con la alfafetoproteína y otros marcadores.
Los factores de riesgo tradicionalmente relacionados con el cáncer de ovario no quedan claros en el caso de las pacientes gestantes, probablemente porque necesitaríamos estudios con mayor número de casos o bien metaanálisis de la literatura médica. En el caso particular de la paridad, Leiserowitz5 encuentra mayor proporción de mujeres gestantes multíparas afectas de cáncer de ovario, lo cual implicaría que la protección de la gestación no es clara al menos durante la edad fértil.
En las series publicadas en la literatura médica encontramos datos discordantes sobre la histología de los cánceres de ovario que ocurren durante la gestación; así, Leiserowitz5 con la serie más amplia estudiada (202 casos) encuentra una composición histológica similar a la reportada por Novak16 donde los tumores de bajo potencial maligno o borderline presentan la mayor frecuencia (n=115, el 56,93%). Si utilizamos la clasificación de la OMS de 1994 el subtipo histológico de tumores del epitelio-estroma superficiales (incluyendo los borderline y los malignos) sería la variedad más comúnmente encontrada por estos autores. Por otro lado, el tumor de células germinales fue muy común en las mujeres gestantes (39,1%), comparado con el esperado 15–20% de la población no gestante. Los disgerminomas son los tumores de células germinales más frecuentes. Otros autores como Behtash et al (2008)8 refieren una distribución histológica diferente con el 47,8% de tumores de células germinales malignos, el 21,7% de tumores borderline, el 17,4% de tumores epiteliales invasivos y el 13,7% de tumores del mesénquima de los cordones sexuales. En España, Machado et al9 al analizar una serie de 15 cánceres de ovario durante la gestación encuentran que el 40% corresponde a los tumores epiteliales invasivos, el 26,6% al borderline y sólo el 20% son tumores de células germinales.
En lo que sí coinciden todos los autores es que un alto porcentaje del cáncer de ovario diagnosticado durante la gestación, se hace en una etapa precoz de la enfermedad, generalmente limitado al ovario; así, encontramos frecuencias mayores al 60% en los estadios IA y IB (Leiserowitz5 estadios IA y IB: el 74,75%; Behtash8: el 73,9%; Machado9: el 59,9%). Igual ocurre con el grado de diferenciación, siendo la mayoría de las neoplasias bien diferenciadas.
El pronóstico en las pacientes con cáncer de ovario depende del tamaño del tumor, del grado histológico y de la enfermedad residual tras la cirugía de debulking. Se cree que el embarazo no afecta por sí mismo al pronóstico de la enfermedad.
Las cifras de mortalidad debidas al cáncer de ovario referidas por Leiserowitz5 son bajas (4,9%), quizás debido a que las mujeres por debajo de los 40 años suelen presentar con mayor frecuencia tumores de bajo potencial de malignidad, bien o moderadamente diferenciados, y en estadios precoces. También se ha visto una mayor incidencia de tumores de células germinales como los disgerminomas o los teratomas inmaduros que tienen un excelente pronóstico17,18. El cáncer epitelial invasivo es el tipo histológico que presenta peores resultados8.
Tradicionalmente se refiere que el cáncer en sí no altera el curso del embarazo; sin embargo, la mayoría de la literatura médica5,8 revisada encuentra una mayor frecuencia de cesáreas y sus complicaciones, al igual que de fetos prematuros, se deben probablemente a yatrogenia obstétrica con el fin de proporcionar lo antes posible el tratamiento completo a la madre. Zemlickis et al19 documentaron que la presencia de una neoplasia materna va a determinar unas condiciones subóptimas intrauterinas, aumentando el riesgo de crecimiento intraútero retardado (riesgo relativo de 4,23) en las pacientes que no recibieron quimioterapia en el curso de la gestación.
En cuanto al tratamiento de las masas ováricas durante la gestación, tradicionalmente el abordaje quirúrgico era la opción elegida, por el riesgo de torsión, ruptura, resultados perinatales adversos y malignidad. Hoy en día se cree que las masas asintomáticas descubiertas en un examen ecográfico de rutina se resuelven frecuentemente de forma espontánea y que, por lo tanto, pueden ser seguidas con observación11. La intervención se indicaría en el caso de masas sintomáticas o altamente sospechosas de malignidad (crecimiento rápido, ascitis o evidencia de enfermedad extraovárica).
El tratamiento conservador es la estrategia más frecuente en el manejo de las neoplasias ováricas5. La anexectomía es el procedimiento más común, seguido de la histerectomía con anexectomía. En las mujeres jóvenes las intervenciones que preservan la fertilidad deberían ser la norma en los tumores de bajo potencial de malignidad y son aceptables en los cánceres epiteliales invasivos en estadio IA o IC. En el caso de enfermedad avanzada debería aplicarse cirugía citorreductora y quimioterapia postoperatoria adyuvante, prestando especial atención a la maduración del feto, a la progresión de la enfermedad materna y al deseo de la madre de continuar el embarazo. Debe resaltarse que la quimioterapia está contraindicada en el primer trimestre del embarazo por la alta tasa de abortos y desarrollo fetal anómalo, pero no en el segundo y tercer trimestre20, donde el riesgo de malformaciones en fetos expuestos no es mayor que el de la población general, aunque se ha comunicado un incremento de retrasos de crecimiento intraútero21. Hasta la actualidad no existen estudios que evalúen las consecuencias a largo plazo para los niños expuestos a la quimioterapia intrauterina. La lactancia materna ha sido contraindicada por la mayoría de los autores.
Nosotros creemos que el tratamiento del cáncer de ovario durante la gestación debe ser individualizado y consensuado con la gestante, dado que van a intervenir múltiples factores determinantes para la toma de decisiones. Entre estos factores debemos citar la amenorrea al diagnóstico, el deseo genésico de la paciente, la histología, grado y estadio del tumor. Así, ante una paciente con diagnóstico histológico de carcinoma ovárico antes de la semana 22 y con deseo genésico completado, sería lógico ofertar la interrupción de la gestación para realizar la cirugía completa de estadificación y tratamiento. Esto vendría determinado porque entre un 30 y un 40% de los carcinomas de ovario, tipificados inicialmente como estadios i o ii, demuestran tener enfermedad más avanzada cuando se completa el estudio de extensión.
En otro extremo encontraríamos a las pacientes diagnosticadas próximas al tercer trimestre, en las cuales se debería realizar un meticuloso control clínico, analítico y ecográfico hasta alcanzar o acelerar la madurez fetal, cara finalizar la gestación y completar el tratamiento quirúrgico. En las pacientes de este grupo con estadios no iniciales sería posible la asociación de quimioterapia durante la gestación.