La utilización inapropiada de los medicamentos en los pacientes mayores tiene graves consecuencias en su salud —aumento del riesgo de sufrir reacciones adversas o síndromes geriátricos, mayor morbimortalidad— y en el sistema sanitario —aumento de costes, estancias hospitalarias excesivas. Para detectar y prevenir la utilización inadecuada de fármacos se está imponiendo progresivamente el uso de criterios explícitos, que pueden usarse dentro de la evaluación geriátrica exhaustiva o como parte de la actuación de diversos equipos multidisciplinares geriátricos.
Los criterios STOPP-START, publicados por vez primera en 2008 (y en español en 2009), se están imponiendo como criterios de referencia en el ámbito europeo. Se presenta aquí la versión en español de la nueva edición (2014) de estos criterios, recientemente publicados en inglés. Además, se revisan en este artículo las publicaciones que han usado la versión inicial de los criterios STOPP-START en España desde su aparición, con la intención de fomentar su utilización e investigación en los distintos niveles asistenciales.
Inappropriate use of drugs in older patients may have an adverse impact on several individual health outcomes, such as increasing the prevalence of adverse drug reactions, morbidity and mortality, and geriatric syndromes, as well as on health care systems, such as increased costs and longer hospital stays. Explicit criteria of drug appropriateness are increasingly used to detect and prevent inappropriate use of drugs, either within a comprehensive geriatric assessment or as tool used by different multidisciplinary geriatric teams.
STOPP-START criteria, first published in 2008 (in Spanish in 2009), are being adopted as reference criteria throughout Europe. The Spanish version of the new 2014 edition (recently published in English) of the STOPP-START criteria is presented here. A review of all the papers published in Spain using the former version of these criteria is also presented, with the intention of promoting their use and for research in different health care levels.
El paciente mayor es especialmente vulnerable a la prescripción inadecuada (PI) de medicamentos por muchas razones, entre las que se encuentran los cambios fisiológicos asociados a la edad, el diferente comportamiento farmacocinético y farmacodinámico de los medicamentos, la presencia de comorbilidades, la malnutrición y caquexia, la polimedicación, la atención por múltiples especialistas y en diferentes niveles asistenciales, y algunas características de la interacción con el paciente en el momento de la prescripción1-5.
La PI de medicamentos constituye en la actualidad un problema sanitario de gran magnitud, que ocasiona la aparición de problemas relacionados con los medicamentos y de reacciones adversas a medicamentos (RAM), un aumento de la morbimortalidad y de los costes sanitarios derivados6-11. Desde un punto de vista conceptual, la PI puede deberse tanto al uso de fármacos que causan daño como a la omisión de fármacos necesarios para tratar o prevenir una patología o problema de salud; esta omisión también genera costes sanitarios por incremento de las visitas médicas, reingresos hospitalarios o visitas a urgencias12.
Uso de criterios explícitos para detectar la prescripción potencialmente inapropiadaDado el impacto de la PI en las personas mayores, a lo largo del tiempo se han propuesto diferentes estrategias para optimizar el uso de medicamentos en estos pacientes, si bien sus resultados en mejorar variables de salud son todavía limitados13-16. Entre estas estrategias se encuentran los métodos de detección de prescripciones potencialmente inapropiadas (PPI), cuyo desarrollo comenzó en los años noventa, y que pueden clasificarse en implícitos y explícitos6,17,18. Los métodos implícitos se basan en juicios clínicos que evalúan cada medicamento considerando las características del paciente y la indicación de la prescripción. Quizás el más utilizado sea el Medication Appropriateness Index (MAI)19. Estos métodos son muy fiables, pero resultan extremadamente laboriosos, consumen mucho tiempo y sus resultados dependen en gran medida de los conocimientos del profesional que los está aplicando. Los métodos explícitos utilizan criterios predefinidos, normalmente basados en datos científicos y consenso de expertos, para definir medicamentos potencialmente inapropiados. Estos métodos son más sencillos de utilizar, son reproducibles, permiten sistematizar la detección de PPI y consumen menos recursos, pero tienen la desventaja de requerir actualizaciones constantes20.
Los primeros criterios explícitos, publicados en 1991, fueron los criterios de Beers21, que se han actualizado en varias ocasiones y han sido, en su última edición, asumidos como oficiales por la American Geriatrics Society22. A pesar de su gran difusión internacional, su aplicación en el ámbito europeo ha sido limitada por varias razones. Por ello surgió en Europa la necesidad de desarrollar unos criterios más acordes con las necesidades y con el arsenal terapéutico de este continente. Los criterios STOPP-START fueron publicados por primera vez en el año 2008 por Gallagher et al.23 en Irlanda y fueron pronto avalados por la European Union Geriatric Medicine Society Posteriormente se publicó su versión traducida al español en el año 200924, lo que ha colaborado de forma significativa a su difusión en los países que usan este idioma, e incluso se ha publicado en 2013 una adaptación para su uso en atención primaria25. Estos criterios fueron creados aplicando una técnica de consenso de Delphi y basados en la evidencia disponible en ese momento. Los criterios STOPP-START recogen los errores más comunes de tratamiento y omisión en la prescripción en las personas mayores, son fáciles de relacionar con el diagnóstico (ya que están agrupados por sistemas fisiológicos) y pueden integrarse en los sistemas informáticos de prescripción. Respecto a los criterios de Beers, su aportación más novedosa fue la inclusión de una lista que buscaba detectar la falta de uso de medicamentos potencialmente indicados (criterios START).
En los últimos años han surgido muchos otros criterios explícitos de detección de PPI, en Canadá26, en Europa (entre los que se encuentran los NORGEP y los PRISCUS27-32), en Australia33 y en Asia34, entre otros. La mayoría de estos criterios han sido escasamente validados en diversos ámbitos sanitarios, están pensados para su utilización local y no han demostrado por el momento su capacidad de disminuir la aparición de RAM18..
Utilidad clínica y valor pronóstico de los criterios STOPP-STARTDesde su publicación inicial, los criterios STOPP-START han sido ampliamente difundidos y validados en muchos países de varios continentes y en diferentes niveles de asistencia sanitaria (atención primaria, hospital de agudos, residencias). Su aplicación en la revisión del tratamiento farmacológico de pacientes mayores ha encontrado que son superiores a los criterios de Beers en detectar y prevenir eventos adversos y RAM9,35-37. Por ejemplo, un estudio realizado en pacientes mayores hospitalizados por patología aguda mostró que las RAM estaban relacionadas 2,5 veces de forma más frecuente con los criterios STOPP que con los criterios de Beers. Las RAM evitables o potencialmente evitables se debieron a medicamentos detectados por los criterios STOPP en el 67,7% de los casos, frente a solo un 28,5% de los medicamentos señalados por los criterios de Beers. Las PPI detectadas por los criterios STOPP multiplicaban por 1,85 el riesgo de presentar una RAM, algo que no sucedía con los criterios de Beers32. Utilizando los criterios STOPP, Cahir et al.38 encontraron que los pacientes con 2 o más PPI tuvieron 2 veces más riesgo de presentar RAM y de acudir al servicio de urgencias, presentando además una disminución significativa de calidad de vida relacionada con la salud. En general, los criterios STOPP han mostrado ser superiores a otros criterios explícitos en la detección de pacientes que requieren una hospitalización como consecuencia de una RAM32,39,40, si bien la nueva edición de los criterios de Beers podría haber mejorado su rendimiento41. Los criterios STOPP, y especialmente los START, también ayudan a predecir el riesgo de reingreso en los 12meses posteriores al alta hospitalaria42.
Aunque parece claro que los criterios explícitos ayudan a mejorar la prescripción y predicen la aparición de problemas, es importante que demuestren también que su aplicación puede mejorar resultados de salud en el paciente. Empieza a existir alguna evidencia de que esto puede ser así. Por ejemplo, un estudio multicéntrico en residencias mostró que un programa educativo basado en los criterios STOPP-START reducía el uso de antipsicóticos, el riesgo de delirium y caídas y el uso de recursos sanitarios, incluidas las hospitalizaciones43. Otro estudio (aún solo publicado en forma de resumen) encontró que el uso de estos criterios al ingreso hospitalario y la mejora del tratamiento reducían la aparición de RAM durante la hospitalización44. En la actualidad está en marcha un ambicioso proyecto multicéntrico europeo (Senator, www.senator-project.eu) para intentar determinar si el uso de los criterios STOPP-START en pacientes mayores hospitalizados es capaz de reducir la aparición de RAM.
Es interesante también la utilización de los criterios STOPP-START para mejorar la formación de los estudiantes de medicina en el manejo de la polifarmacia45.
Un último aspecto a considerar es el económico. El coste de la omisión de fármacos indicados detectado por los criterios START se estimó en 112.745euros para una población de 600pacientes en un año12. Utilizando los criterios STOPP, Cahir et al. describieron que el coste neto de PPI en 2007 en Irlanda supuso un gasto de 38.664.640euros, siendo la media por paciente y año de 318euros, y Bradley et al. estimaron que el coste bruto total anual asociado a PPI supuso un 5,38% del gasto farmacéutico total en mayores de edad igual o superior a 70años en este periodo34,46.
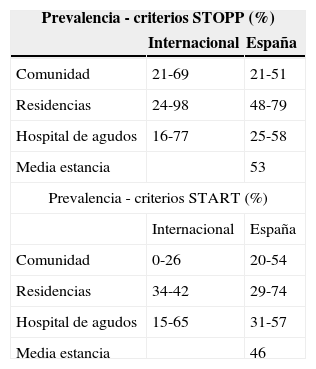
Prevalencia de prescripciones potencialmente inapropiadas en España con los criterios STOPP-STARTAunque la prevalencia de PPI utilizando los criterios STOPP-START presenta una gran variabilidad según el entorno sanitario del que se trate, esta prevalencia es generalmente elevada, siendo generalmente mayor en las residencias que en los hospitales y en la comunidad (tabla 1).
Prevalencia de prescripción inapropiada usando los criterios STOPP-START en estudios internacionales y en España en distintos niveles asistenciales
| Prevalencia - criterios STOPP (%) | ||
|---|---|---|
| Internacional | España | |
| Comunidad | 21-69 | 21-51 |
| Residencias | 24-98 | 48-79 |
| Hospital de agudos | 16-77 | 25-58 |
| Media estancia | 53 | |
| Prevalencia - criterios START (%) | ||
| Internacional | España | |
| Comunidad | 0-26 | 20-54 |
| Residencias | 34-42 | 29-74 |
| Hospital de agudos | 15-65 | 31-57 |
| Media estancia | 46 | |
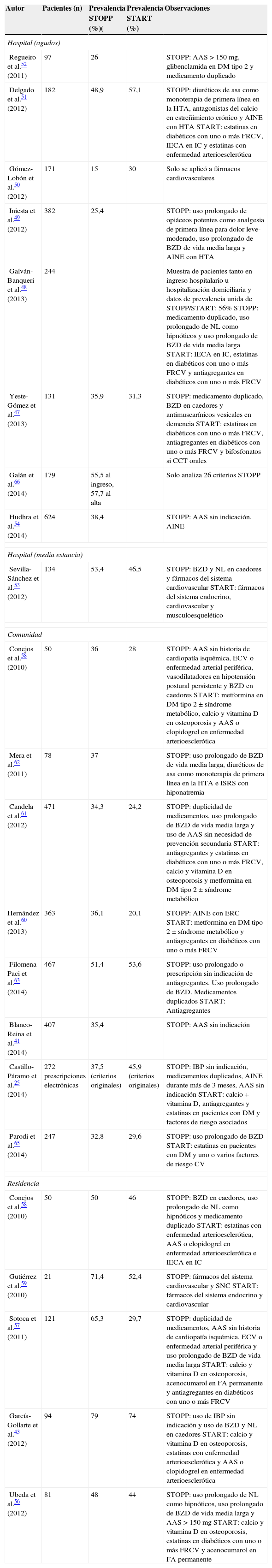
La tabla 2 muestra la prevalencia de PPI publicada en estudios hechos en España. Los criterios STOPP más frecuentemente detectados a nivel hospitalario están relacionados con la utilización de benzodiacepinas de vida media larga, el uso de neurolépticos como hipnóticos, especialmente en pacientes con caídas frecuentes, la utilización de AINE en pacientes con hipertensión arterial y la duplicidad de medicamentos del mismo grupo. En relación con los criterios START, los errores de omisión de fármacos más frecuentemente detectados son los relacionados con patología cardiovascular y/o diabética y el uso de suplementos de calcio y vitaminaD47-54.
Resultados de estudios españoles sobre prevalencia de prescripción inapropiada con los criterios STOPP-START
| Autor | Pacientes (n) | Prevalencia STOPP (%)( | Prevalencia START (%) | Observaciones |
|---|---|---|---|---|
| Hospital (agudos) | ||||
| Regueiro et al.52 (2011) | 97 | 26 | STOPP: AAS>150mg, glibenclamida en DM tipo2 y medicamento duplicado | |
| Delgado et al.51 (2012) | 182 | 48,9 | 57,1 | STOPP: diuréticos de asa como monoterapia de primera línea en la HTA, antagonistas del calcio en estreñimiento crónico y AINE con HTA START: estatinas en diabéticos con uno o más FRCV, IECA en IC y estatinas con enfermedad arterioesclerótica |
| Gómez-Lobón et al.50 (2012) | 171 | 15 | 30 | Solo se aplicó a fármacos cardiovasculares |
| Iniesta et al.49 (2012) | 382 | 25,4 | STOPP: uso prolongado de opiáceos potentes como analgesia de primera línea para dolor leve-moderado, uso prolongado de BZD de vida media larga y AINE con HTA | |
| Galván-Banqueri et al.48 (2013) | 244 | Muestra de pacientes tanto en ingreso hospitalario u hospitalización domiciliaria y datos de prevalencia unida de STOPP/START: 56% STOPP: medicamento duplicado, uso prolongado de NL como hipnóticos y uso prolongado de BZD de vida media larga START: IECA en IC, estatinas en diabéticos con uno o más FRCV y antiagregantes en diabéticos con uno o más FRCV | ||
| Yeste-Gómez et al.47 (2013) | 131 | 35,9 | 31,3 | STOPP: medicamento duplicado, BZD en caedores y antimuscarínicos vesicales en demencia START: estatinas en diabéticos con uno o más FRCV, antiagregantes en diabéticos con uno o más FRCV y bifosfonatos si CCT orales |
| Galán et al.66 (2014) | 179 | 55,5al ingreso, 57,7 al alta | Solo analiza 26 criterios STOPP | |
| Hudhra et al.54 (2014) | 624 | 38,4 | STOPP: AAS sin indicación, AINE | |
| Hospital (media estancia) | ||||
| Sevilla-Sánchez et al.53 (2012) | 134 | 53,4 | 46,5 | STOPP: BZD y NL en caedores y fármacos del sistema cardiovascular START: fármacos del sistema endocrino, cardiovascular y musculoesquelético |
| Comunidad | ||||
| Conejos et al.58 (2010) | 50 | 36 | 28 | STOPP: AAS sin historia de cardiopatía isquémica, ECV o enfermedad arterial periférica, vasodilatadores en hipotensión postural persistente y BZD en caedores START: metformina en DM tipo 2 ± síndrome metabólico, calcio y vitamina D en osteoporosis y AAS o clopidogrel en enfermedad arterioesclerótica |
| Mera et al.62 (2011) | 78 | 37 | STOPP: uso prolongado de BZD de vida media larga, diuréticos de asa como monoterapia de primera línea en la HTA e ISRS con hiponatremia | |
| Candela et al.61 (2012) | 471 | 34,3 | 24,2 | STOPP: duplicidad de medicamentos, uso prolongado de BZD de vida media larga y uso de AAS sin necesidad de prevención secundaria START: antiagregantes y estatinas en diabéticos con uno o más FRCV, calcio y vitamina D en osteoporosis y metformina en DM tipo 2 ± síndrome metabólico |
| Hernández et al.60 (2013) | 363 | 36,1 | 20,1 | STOPP: AINE con ERC START: metformina en DM tipo 2 ± síndrome metabólico y antiagregantes en diabéticos con uno o más FRCV |
| Filomena Paci et al.63 (2014) | 467 | 51,4 | 53,6 | STOPP: uso prolongado o prescripción sin indicación de antiagregantes. Uso prolongado de BZD. Medicamentos duplicados START: Antiagregantes |
| Blanco-Reina et al.41 (2014) | 407 | 35,4 | STOPP: AAS sin indicación | |
| Castillo-Páramo et al.25 (2014) | 272 prescripciones electrónicas | 37,5 (criterios originales) | 45,9 (criterios originales) | STOPP: IBP sin indicación, medicamentos duplicados, AINE durante más de 3 meses, AAS sin indicación START: calcio + vitamina D, antiagregantes y estatinas en pacientes con DM y factores de riesgo asociados |
| Parodi et al.65 (2014) | 247 | 32,8 | 29,6 | STOPP: uso prolongado de BZD START: estatinas en pacientes con DM y uno o varios factores de riesgo CV |
| Residencia | ||||
| Conejos et al.58 (2010) | 50 | 50 | 46 | STOPP: BZD en caedores, uso prolongado de NL como hipnóticos y medicamento duplicado START: estatinas con enfermedad arterioesclerótica, AAS o clopidogrel en enfermedad arterioesclerótica e IECA en IC |
| Gutiérrez et al.59 (2010) | 21 | 71,4 | 52,4 | STOPP: fármacos del sistema cardiovascular y SNC START: fármacos del sistema endocrino y cardiovascular |
| Sotoca et al.57 (2011) | 121 | 65,3 | 29,7 | STOPP: duplicidad de medicamentos, AAS sin historia de cardiopatía isquémica, ECV o enfermedad arterial periférica y uso prolongado de BZD de vida media larga START: calcio y vitamina D en osteoporosis, acenocumarol en FA permanente y antiagregantes en diabéticos con uno o más FRCV |
| García-Gollarte et al.43 (2012) | 94 | 79 | 74 | STOPP: uso de IBP sin indicación y uso de BZD y NL en caedores START: calcio y vitamina D en osteoporosis, estatinas con enfermedad arterioesclerótica y AAS o clopidogrel en enfermedad arterioesclerótica |
| Ubeda et al.56 (2012) | 81 | 48 | 44 | STOPP: uso prolongado de NL como hipnóticos, uso prolongado de BZD de vida media larga y AAS>150mg START: calcio y vitamina D en osteoporosis, estatinas en diabéticos con uno o más FRCV y acenocumarol en FA permanente |
AAS: ácido acetil salicílico; AINE: antiinflamatorios no esteroideos; BZD: benzodiacepinas; CCT: corticoesteroides; DM: diabetes mellitus; ECV: enfermedad cerebrovascular; ERC: enfermedad renal crónica; FA: fibrilación auricular; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IBP: inhibidores bomba de protones; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima convertidora de angiotensina; ISRS: inhibidores selectivos de la recaptación de serotonina; NL: neurolépticos; SNC: sistema nervioso central.
En residencias, las PPI más frecuentes están relacionados con la utilización inapropiada de fármacos del sistema nervioso central (neurolépticos y benzodiacepinas), especialmente en pacientes con caídas frecuentes, el abuso de los inhibidores de la bomba de protones, la utilización de ácido acetilsalicílico sin indicación y las duplicidades terapéuticas. Los criterios START muestran una infrautilización del calcio más vitaminaD en osteoporosis, estatinas en enfermedad arterioesclerótica, antiagregantes en diabetes, anticoagulantes orales en fibrilación auricular crónica e IECA en insuficiencia cardiaca crónica55-59.
Por último, en los estudios de pacientes que viven en la comunidad atendidos por profesionales de atención primaria, los fármacos o grupos de fármacos con PPI más prevalentes son la utilización prolongada de benzodiacepinas de vida media larga, la utilización de ácido acetilsalicílico en pacientes sin indicación para ello y el uso de otros fármacos del sistema cardiovascular y de AINE. Los fármacos más frecuentemente omitidos (START) son los antiagregantes y estatinas en la diabetes (coexistiendo uno o más factores de riesgo) o en pacientes con patología cardiovascular, el calcio y la vitaminaD en la osteoporosis y la metformina en la diabetes o el síndrome metabólico37,50,60-65.
Es interesante destacar que, en general, la prevalencia de PPI encontrada en España es algo menor que la encontrada a nivel internacional (tabla 1). Por ejemplo, en hospitales de agudos está en torno a un 25-58%41,43,45,12,66, frente al 16-77% a nivel internacional16,32,67-69. Analizando los datos de prevalencia de START, hay mayor dispersión, siendo el menor el detectado en atención primaria en estudios hechos fuera de España40,70-73 y el mayor en residencias a nivel nacional47,51. Estas diferencias en los datos de prevalencia podrían ser debidas a los diferentes hábitos de prescripción de cada país, pero también hay que considerar las diferencias metodológicas de los estudios analizados.
Actualización de los criterios STOPP-STARTLos criterios explícitos de prescripción deben actualizarse periódicamente para poder seguir siendo válidos y aplicables en la práctica médica diaria, ya que el avance del conocimiento puede cambiar muchos de ellos. Los investigadores que desarrollaron los criterios STOPP-START han trabajado desde su aparición, en cooperación con un grupo internacional de expertos, para elaborar una versión actualizada de los mismos, que ha sido publicada recientemente74. Esta nueva versión de los criterios STOPP-START consta de 87 recomendaciones STOPP y 34 START, lo que supone un aumento considerable en el número de criterios.
Nuestro equipo ha trabajado de nuevo en la elaboración de una versión en español de esta nueva edición de los criterios STOPP-START, mediante una cuidadosa traducción y revisión de la redacción de cada criterio por un equipo compuesto por médicos geriatras y farmacéuticos especializados en este campo. Los nuevos criterios se muestran en las tablas 3 y 4.
Versión española de los criterios STOPP (Screening Tool of Older Persons’ Prescriptions) 2014
| Sección A. Indicación de la medicación |
| 1. Cualquier medicamento prescrito sin una indicación basada en evidencia clínica |
| 2. Cualquier medicamento prescrito con una duración superior a la indicada, cuando la duración del tratamiento esté bien definida |
| 3. Cualquier prescripción concomitante de dos fármacos de la misma clase, como dos AINE, ISRS, diuréticos de asa, IECA, anticoagulantes (debe optimizarse la monoterapia dentro de esa clase de fármacos antes de considerar un nuevo fármaco) |
| Sección B. Sistema cardiovascular |
| 1. Digoxina para la insuficiencia cardiaca con función sistólica ventricular conservada (no hay evidencia clara de su beneficio) |
| 2. Verapamilo o diltiazem en la insuficiencia cardiaca gradoiii o iv de la NYHA (pueden empeorar la insuficiencia cardiaca) |
| 3. Betabloqueantes en combinación con verapamilo o diltiazem (riesgo de bloqueo cardíaco) |
| 4. Betabloqueantes con bradicardia (<50lpm), bloqueo cardiaco de segundo o tercer grado (riesgo de bloqueo cardiaco completo o asistolia) |
| 5. Amiodarona como tratamiento antiarrítmico de primera elección en las taquiarritmias supraventriculares (mayor riesgo de efectos secundarios que betabloqueantes, digoxina, verapamilo o diltiazem) |
| 6. Diuréticos de asa como tratamiento de primera línea de la hipertensión (existen alternativas más seguras y efectivas) |
| 7. Diuréticos de asa para los edemas maleolares sin evidencia clínica, bioquímica o radiológica de insuficiencia cardíaca, insuficiencia hepática, síndrome nefrótico o insuficiencia renal (la elevación de los miembros inferiores o las medias de compresión son generalmente más apropiadas) |
| 8. Diuréticos tiazídicos cuando existe hipopotasemia (potasio sérico<3,0mmol/l), hiponatremia (sodio sérico<130mmol/l) o hipercalcemia (calcio sérico corregido >2,65mmol/l) significativas o con antecedentes de gota (las tiazidas pueden producir hipopotasemia, hiponatremia, hipercalcemia y gota) |
| 9. Diuréticos de asa para el tratamiento de la hipertensión cuando existe incontinencia urinaria (pueden empeorar la incontinencia) |
| 10. Antihipertensivos de acción central (p.ej., metildopa, clonidina, moxonidina, rilmenidina, guanfacina), salvo que exista intolerancia clara o falta de eficacia de otras clases de antihipertensivos (los antihipertensivos de acción central son generalmente peor tolerados por los mayores que los jóvenes) |
| 11. IECA o ARA-II en pacientes con hiperpotasemia |
| 12. Antagonistas de la aldosterona (p.ej., espironolactona, eplerenona) junto con otros fármacos que pueden aumentar los niveles de potasio (p.ej., IECA, ARA-II, amilorida, triamtereno) sin monitorizar el potasio (riesgo de hiperpotasemia grave >6,0mmol/l; el potasio sérico debería monitorizarse periódicamente, al menos cada 6meses) |
| 13. Inhibidores de la fosfodiesterasa 5 (p.ej., sildenafilo, tadalafilo, vardenafilo) en insuficiencia cardiaca grave con hipotensión (presión arterial sistólica <90mmHg) o asociados al tratamiento de la angina de pecho con nitratos (riesgo de colapso cardiovascular) |
| Sección C. Antiagregantes/anticoagulantes |
| 1. AAS en tratamiento crónico a dosis superiores a 160mg al día (aumento del riesgo de sangrado sin evidencia de mayor eficacia) |
| 2. AAS con antecedentes de enfermedad ulcerosa péptica sin uso concomitante de IBP (riesgo de recurrencia de la úlcera péptica) |
| 3. AAS, clopidogrel, dipiridamol, antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en presencia de un riesgo significativo de sangrado (p.ej., hipertensión grave no controlada, diátesis hemorrágicas, sangrado reciente espontáneo significativo) (alto riesgo de sangrado) |
| 4. AAS más clopidogrel para la prevención secundaria del ictus, salvo que el paciente tenga un stent coronario implantado en los 12meses previos, un síndrome coronario agudo o una estenosis carotídea grave y sintomática (no hay evidencia de beneficios respecto al clopidogrel en monoterapia) |
| 5. AAS combinada con un antagonista de la vitaminaK, un inhibidor directo de la trombina o un inhibidor del factorXa en pacientes con fibrilación auricular crónica (el AAS no aporta beneficios) |
| 6. Antiagregante con antagonista de la vitaminaK, inhibidor directo de la trombina o inhibidor del factorXa en pacientes con enfermedad coronaria, cerebrovascular o arterial periférica estables (el tratamiento combinado no aporta beneficios) |
| 7. Ticlopidina en cualquier circunstancia (clopidogrel y prasugrel tienen eficacia similar, mayor evidencia y menores efectos adversos) |
| 8. Antagonista de la vitaminaK, inhibidor directo de la trombina o inhibidor del factorXa para un primer episodio de trombosis venosa profunda sin que persistan los factores desencadenantes (p.ej., trombofilia) durante >6meses (no se han demostrado beneficios) |
| 9. Antagonista de la vitaminaK, inhibidor directo de la trombina o inhibidor del factorXa para un primer episodio de tromboembolismo pulmonar sin que persistan los factores desencadenantes (p.ej., trombofilia) durante un periodo >12meses (no se han demostrado beneficios) |
| 10. AINE en combinación con antagonista de la vitaminaK, inhibidor directo de la trombina o inhibidor del factorXa (riesgo de hemorragia digestiva grave) |
| 11. AINE con otro antiagregante sin tratamiento profiláctico con IBP (aumenta el riesgo de enfermedad ulcerosa péptica) |
| Sección D. Sistema nervioso central y psicótropos |
| 1. Antidepresivos tricíclicos (ATC) en presencia de demencia, glaucoma de ángulo estrecho, trastornos en la conducción cardiaca, prostatismo o antecedentes de retención urinaria (riesgo de empeoramiento de estas enfermedades) |
| 2. Introducción de ATC como tratamiento antidepresivo de primera línea (mayor riesgo de efectos secundarios con ATC que con ISRS o ISRN) |
| 3. Neurolépticos con efectos antimuscarínicos moderados-graves (clorpromazina, clozapina, flupentixol, flufenazina, pipotiazina, promazina, zuclopentixol) con antecedentes de prostatismo o retención urinaria (alto riesgo de retención urinaria) |
| 4. ISRS con hiponatremia significativa concurrente o reciente (sodio sérico <130mmol/l) (riesgo de precipitar o exacerbar una hiponatremia) |
| 5. Benzodiazepinas durante ≥4semanas (no hay indicación para tratamientos más prolongados; riesgo de sedación prolongada, confusión, pérdida de equilibrio, caídas, accidentes de tráfico; todas las benzodiazepinas deberían suspenderse de forma gradual si el tratamiento ha superado las 4semanas, ya que al suspenderse de forma brusca existe riesgo de síndrome de abstinencia) |
| 6. Antipsicóticos (distintos de quetiapina o clozapina) en pacientes con parkinsonismo o enfermedad demencia por cuerpos de Lewy (riesgo de efectos extrapiramidales graves) |
| 7. Anticolinérgicos/antimuscarínicos para tratar los efectos secundarios extrapiramidales de los neurolépticos (riesgo de toxicidad anticolinérgica) |
| 8. Anticolinérgicos/antimuscarínicos en pacientes con delirium o demencia (riesgo de empeoramiento de la cognición) |
| 9. Neurolépticos en pacientes con síntomas de comportamiento y psicológicos de la demencia, salvo que estos sean graves y no respondan a otros tratamientos no farmacológicos (aumento del riesgo de ictus) |
| 10. Neurolépticos como hipnóticos, salvo que el trastorno del sueño se deba a psicosis o demencia (riesgo de confusión, hipotensión, efectos secundarios extrapiramidales, caídas) |
| 11. Inhibidores de la acetilcolinesterasa con antecedentes de bradicardia persistente (<60lpm), bloqueo cardiaco o síncopes recurrentes de etiología no explicada o tratamiento simultáneo con fármacos que bajan la frecuencia cardiaca como betabloqueantes, digoxina, diltiazem, verapamilo (riesgo de trastornos de la conducción cardiaca, síncope o lesiones) |
| 12. Fenotiazinas como tratamiento de primera línea, ya que existen alternativas más seguras y eficaces (las fenotiazinas son sedantes y producen toxicidad antimuscarínica relevante en los mayores, con la excepción de la proclorperazina para el tratamiento de náuseas/vómitos/vértigo, clorpromazina para el hipo persistente y levomepromazina como antiemético en cuidados paliativos) |
| 13. Levodopa o agonistas dopaminérgicos para el temblor esencial (no hay evidencia de eficacia) |
| 14. Antihistamínicos de primera generación (existen muchos antihistamínicos más seguros y menos tóxicos) |
| Sección E. Sistema renal. Los siguientes medicamentos son potencialmente inapropiados en personas mayores con enfermedad renal aguda o crónica por debajo de determinados umbrales de TFGe (consultar fichas técnicas de los medicamentos y vademeca locales) |
| 1. Digoxina en tratamiento crónico a dosis superiores a 125μg/día con TFGe <30ml/min/1,73m2 (riesgo de intoxicación digitálica si no se monitorizan los niveles plasmáticos) |
| 2. Inhibidores directos de la trombina (p.ej., dabigatrán) con TFGe<30ml/min/1,73m2 (riesgo de sangrado) |
| 3. Inhibidores del factorXa (p.ej., rivaroxabán) con TFGe<15ml/min/1,73m2 (riesgo de sangrado) |
| 4. AINE con TFGe<50ml/min/1,73m2 (riesgo de deterioro de la función renal) |
| 5. Colchicina con TFGe<10ml/min/1,73m2 (riesgo de toxicidad por colchicina) |
| 6. Metformina con TFGe<30ml/min/1,73m2 (riesgo de acidosis láctica) |
| Sección F. Sistema gastrointestinal |
| 1. Proclorperazina o metoclopramida con parkinsonismo (riesgo de empeoramiento de los síntomas parkinsonianos) |
| 2. IBP para la enfermedad ulcerosa péptica no complicada o la esofagitis péptica erosiva a dosis terapéuticas plenas durante >8 semanas (está indicada la disminución previa de la dosis o la retirada) |
| 3. Medicamentos que suelen causar estreñimiento (p.ej., fármacos antimuscarínicos/anticolinérgicos, hierro oral, opiodes, verapamilo, antiácidos con aluminio) en pacientes con estreñimiento crónico cuando existan alternativas que no estriñen (riesgo de exacerbar el estreñimiento) |
| 4. Hierro oral a dosis elementales superiores a 200mg/día (p.ej., hierro fumarato >600mg/día, hierro sulfato >600mg/día, hierro gluconato 1.800mg/día; no hay evidencia de mayor absorción por encima de estas dosis) |
| Sección G. Sistema respiratorio |
| 1. Teofilina como monoterapia para la EPOC (existen alternativas más seguras y efectivas; riesgo de efectos adversos por el estrecho margen terapéutico) |
| 2. Corticosteroides sistémicos en lugar de corticosteroides inhalados para el tratamiento de mantenimiento de la EPOC moderada-grave (exposición innecesaria a los efectos secundarios a largo plazo de los corticosteroides sistémicos; existen alternativas inhaladas más efectivas) |
| 3. Broncodilatadores antimuscarínicos (p.ej., ipratropio, tiotropio) con antecedentes de glaucoma de ángulo estrecho (pueden exacerbar el glaucoma) u obstrucción del tracto urinario inferior (pueden causar retención urinaria) |
| 4. Betabloqueantes no cardioselectivos (orales o tópicos para el glaucoma) con antecedentes de asma que precisa tratamiento (aumenta el riesgo de broncoespasmo) |
| 5. Benzodiazepinas con insuficiencia respiratoria aguda o crónica (p.ej. pO2<8,0kPa±pCO2>6,5kPa; riesgo de exacerbación de la insuficiencia respiratoria) |
| Sección H. Sistema musculoesquelético |
| 1. AINE (exceptuando los inhibidores selectivos de la COX-2) con antecedentes de enfermedad ulcerosa péptica o hemorragia digestiva, salvo con uso simultáneo de un IBP o un antagonista H2 (riesgo de reaparición de enfermedad ulcerosa) |
| 2. AINE con hipertensión grave (riesgo de exacerbación de la hipertensión) o con insuficiencia cardiaca grave (riesgo de exacerbación de la insuficiencia cardiaca) |
| 3. AINE a largo plazo (>3meses) para el tratamiento sintomático de la artrosis cuando no se ha probado el paracetamol (los analgésicos simples son preferibles y normalmente igual de efectivos para el tratamiento del dolor) |
| 4. Corticosteroides a largo plazo (>3meses) como monoterapia para la artritis reumatoide (riesgo de efectos secundarios sistémicos de los corticosteroides) |
| 5. Corticosteroides (salvo inyecciones intraarticulares periódicas para el dolor monoarticular) para la artrosis (riesgo de efectos secundarios sistémicos de los corticosteroides) |
| 6. AINE o colchicina a largo plazo (>3meses) para el tratamiento crónico de la gota cuando no existe contraindicación para los inhibidores de la xantina-oxidasa (p.ej., alopurinol, febuxostat) (los inhibidores de la xantina-oxidasa son los fármacos profilácticos de primera elección en la gota) |
| 7. Inhibidores selectivos de la COX-2 con enfermedad cardiovascular (aumento del riesgo de infarto de miocardio e ictus) |
| 8. AINE con corticosteroides sin IBP a dosis profiláctica (aumenta el riesgo de enfermedad ulcerosa péptica) |
| 9. Bifosfonatos orales en pacientes con enfermedades digestivas altas presentes o previas (p.ej., disfagia, esofagitis, gastritis, duodenitis, enfermedad ulcerosa péptica, o hemorragia digestiva alta) (riesgo de reaparición/exacerbación de esofagitis, úlcera esofágica o estenosis esofágica) |
| Sección I. Sistema urogenital |
| 1. Fármacos antimuscarínicos con demencia o deterioro cognitivo crónico (aumenta el riesgo de confusión, agitación) o glaucoma de ángulo estrecho (riesgo de exacerbación del glaucoma) o prostatismo crónico (riesgo de retención urinaria) |
| 2. Bloqueantes alfa-1-adrenérgicos selectivos en pacientes con hipotensión ortostática sintomática o síncope miccional (riesgo de recurrencia del síncope) |
| Sección J. Sistema endocrino |
| 1. Sulfonilureas de larga duración de acción (p.ej., glibenclamida, clorpropamida, glimepirida) con diabetes mellitus tipo2 (riesgo de hipoglucemia prolongada) |
| 2. Tiazolidindionas (p.ej., rosiglitazona, pioglitazona) en pacientes con insuficiencia cardiaca (riesgo de exacerbación de la insuficiencia cardiaca) |
| 3. Betabloqueantes en la diabetes mellitus con frecuentes episodios de hipoglucemia (riesgo de enmascaramiento de los síntomas de hipoglucemia) |
| 4. Estrógenos con antecedentes de cáncer de mama o tromboembolismo venoso (aumento del riesgo de recurrencia) |
| 5. Estrógenos orales sin progestágenos en mujeres con útero intacto (riesgo de cáncer de endometrio) |
| 6. Andrógenos (hormonas sexuales masculinas) en ausencia de hipogonadismo primario o secundario (riesgo de toxicidad por andrógenos; no han demostrado beneficios fuera de la indicación de hipogonadismo) |
| Sección K. Fármacos que aumentan de forma predecible el riesgo de caídas en personas mayores |
| 1. Benzodiazepinas (sedantes, pueden reducir el nivel de conciencia, deterioran el equilibrio) |
| 2. Neurolépticos (pueden causar dispraxia de la marcha, parkinsonismo) |
| 3. Vasodilatadores (p.ej., bloqueantes alfa-1-adrenérgicos, calcioantagonistas, nitratos de acción prolongada, IECA, ARA-II) con hipotensión postural persistente (descenso recurrente superior a 20mmHg de la presión sistólica; riesgo de síncope, caídas) |
| 4. Hipnóticos-Z (p.ej., zoplicona, zolpidem, zaleplón) (pueden causar sedación diurna prolongada, ataxia) |
| Sección L. Analgésicos |
| 1. Uso de opiodes potentes orales o transdérmicos (morfina, oxicodona, fentanilo, buprenorfina, diamorfina, metadona, tramadol, petidina, pentazocina) como tratamiento de primera línea para el dolor leve (inobservancia de la escala analgésica de la OMS) |
| 2. Uso de opiodes pautados (no a demanda) sin asociar laxantes (riesgo de estreñimiento grave) |
| 3. Opiodes de acción prolongada sin opiodes de acción rápida para el dolor irruptivo (riesgo de persistencia del dolor grave) |
| Sección N. Carga antimuscarínica/anticolinérgica |
| 1. Uso concomitante de 2 o más fármacos con propiedades antimuscarínicas/ anticolinérgicas (p.ej., antiespasmódicos vesicales, antiespasmódicos intestinales, ATC, antihistamínicos de primera generación) (riesgo de toxicidad antimuscarínica/anticolinérgica) |
Versión española de los criterios START (Screening Tool to Action the Right Treatment) 2014
| «Salvo que el paciente esté en situación terminal y por tanto necesite un enfoque farmacoterapéutico paliativo, deberían considerarse los siguientes tratamientos cuando se hayan omitido sin una razón clínica clara. Se asume que el prescriptor observará todas las contraindicaciones específicas de estos fármacos antes de recomendarlos en pacientes mayores.» |
| Sección A. Sistema cardiovascular |
| 1. Antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en presencia de fibrilación auricular crónica |
| 2. AAS (75-160mg/día) en presencia de fibrilación auricular crónica cuando los antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa están contraindicados |
| 3. Antiagregantes (AAS, clorpidogrel, prasugrel o ticagrelor) con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica |
| 4. Antihipertensivos cuando la presión arterial sistólica sea habitualmente >160mmHg y/o la presión arterial diastólica sea habitualmente >90mmHg (>140mmHg y >90mmHg, respectivamente, si el paciente es diabético) |
| 5. Estatinas con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica, salvo que el paciente esté en situación de final de vida o su edad sea >85años |
| 6. IECA en la insuficiencia cardiaca sistólica y/o cardiopatía isquémica bien documentada |
| 7. Betabloqueantes en la cardiopatía isquémica |
| 8. Betabloqueantes apropiados (bisoprolol, nebivolol, metoprolol o carvedilol) en la insuficiencia cardiaca sistólica estable |
| Sección B. Sistema respiratorio |
| 1. Agonista beta-2 o antimuscarínico (p.ej., ipratropio, tiotropio) inhalado pautado en el asma o la EPOC leve a moderada |
| 2. Corticosteroide inhalado pautado en el asma o la EPOC moderada a grave, cuando FEV1<50% del valor predicho y existen frecuentes exacerbaciones que requieren corticosteroides orales |
| 3. Oxigenoterapia domiciliaria continua en la hipoxemia crónica (pO2<8,0kPa, 60mmHg o SatO2<89%) |
| Sección C. Sistema nervioso central y ojos |
| 1. Levodopa o un agonista dopaminérgico en la enfermedad de Parkinson idiopática con deterioro funcional y discapacidad secundarias |
| 2. Antidepresivos no tricíclicos en presencia de síntomas depresivos mayores persistentes |
| 3. Inhibidores de la acetilcolinesterasa (donepezilo, rivastigmina, galantamina) para la enfermedad de Alzheimer leve-moderada o la demencia por cuerpos de Lewy (rivastigmina) |
| 4. Prostaglandinas, prostamida o betabloqueantes tópicos para el glaucoma primario de ángulo abierto |
| 5. ISRS (ISRN o pregabalina si los ISRS está contraindicados) para la ansiedad grave persistente que interfiere con la independencia funcional |
| 6. Agonistas dopaminérgicos (ropinirol, pramipexol o rotigotina) para el síndrome de piernas inquietas una vez se han descartado como causas la deficiencia de hierro y la enfermedad renal grave |
| Sección D. Sistema gastrointestinal |
| 1. IBP en la enfermedad por reflujo gastroesofágico grave o la estenosis péptica que precise dilatación |
| 2. Suplementos de fibra (p.ej., salvado, ispaghula, metilcelulosa, sterculia) en la diverticulosis con antecedentes de estreñimiento |
| Sección E. Sistema musculoesquelético |
| 1. Fármacos antirreumáticos modificadores de la enfermedad en la artritis reumatoide activa incapacitante |
| 2. Bifosfonatos y vitaminaD y calcio en pacientes que reciben corticosteroides orales a largo plazo |
| 3. Suplementos de calcio y vitaminaD en pacientes con osteoporosis conocida y/o fracturas por fragilidad previas y/o densidad mineral ósea con T inferiores a −2,5 en múltiples puntos) |
| 4. Antirresortivos o anabolizantes óseos (p.ej., bifosfonatos, ranelato de estroncio, teriparatida, denosumab) en pacientes con osteoporosis conocida cuando no existan contraindicaciones farmacológicas o clínicas pasa su uso (densidad mineral ósea con T inferiores a −2,5 en múltiples puntos) y/o antecedentes de fracturas por fragilidad |
| 5. Suplementos de vitaminaD en pacientes mayores que no salen de casa, sufren caídas o tienen osteopenia (densidad mineral ósea con T<−1,0 pero no <−2,5 en múltiples puntos) |
| 6. Inhibidores de la xantina oxidasa (p.ej., alopurinol, febuxostat) en pacientes con antecedentes de episodios de gota recurrentes |
| 7. Suplementos de ácido fólico en pacientes que toman metotrexato |
| Sección F. Sistema endocrino |
| 1. IECA (ARA-II si no se toleran los IECA) en la diabetes con evidencia de enfermedad renal (proteinuria en una tira reactiva o microalbuminuria (>30mg/24h) con o sin datos bioquímicos de enfermedad renal |
| Sección G. Sistema genitourinario |
| 1. Bloqueantes alfa-1-adrenérgicos para el prostatismo sintomático cuando no se considera necesaria la prostatectomía |
| 2. Inhibidores de la 5-alfa reductasa para el prostatismo sintomático cuando no se considera necesaria la prostatectomía |
| 3. Estrógenos tópicos vaginales o pesario con estrógenos para la vaginitis atrófica sintomática |
| Sección H. Analgésicos |
| 1. Opiodes potentes en el dolor moderado o severo cuando el paracetamol, los AINE o los opiodes de baja potencia no son apropiados para la gravedad del dolor o se han demostrado ineficaces |
| 2. Laxantes en pacientes que reciben opiodes de forma regular |
| Sección I. Vacunas |
| 1. Vacuna trivalente anual contra la gripe estacional |
| 2. Vacuna antineumocócica cada 5años |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; ARA-II: antagonista del receptor de angiotensinaii; ATC: antidepresivos tricíclicos; eGFR: filtrado glomerular estimado; EPOC: enfermedad pulmonar obstructiva grave; IBP: inhibidor de la bomba de protones; ISRN: inhibidor selectivo de la recaptación de noradrenalina; ISRS: inhibidor selectivo de la recaptación de serotonina.
Los criterios STOPP-START han demostrado ser una buena herramienta de detección de prescripciones potencialmente inapropiadas y de mejora de la calidad de la prescripción en personas mayores en todos los ámbitos asistenciales75. Suponen además un lenguaje común que permite la comparación y la adopción de medidas educativas y correctoras. Esta nueva versión en español supone un avance que busca seguir mejorando el manejo de medicamentos en los mayores, especialmente en los más vulnerables.
FinanciaciónEste trabajo ha sido financiado por la Unión Europea, Séptimo Programa Marco (FP7 / 2007-2013), grant agreement n ¿ 305930 (SENATOR).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.