Editado por: Dra. Núria Torner CIBER Epidemiologia y Salud Publica CIBERESP Unitat de Medicina Preventiva i Salut Pública Departament de Medicina, Universitat de Barcelona
Más datosla vacunación para SARS-CoV-2 permitió disminuir casos graves que requieren de ventilación mecánica invasiva (VMI) y atención en UCI. Sin embargo, no es claro su impacto en la enfermedad grave. El objetivo fue evaluar si los adultos con neumonía grave por SARS-CoV-2 que requirieron ventilación mecánica tuvieron un comportamiento clínico diferente en términos de mortalidad, según su estado de vacunación.
Metodologíaestudio de cohorte retrospectiva, en adultos con neumonía severa por SARS-CoV-2 con requerimiento de VMI y UCI. Se evaluaron desenlaces clínicos según el estado de vacunación, controlando por comorbilidades.
ResultadosSe analizaron 200 pacientes (24% vacunados, edad 61 ± 13 años, hombres 68%). Los vacunados tenían menor PCR al ingreso, presión de distensión y requerimiento de PEEP para VMI. La mortalidad (43,8 vs. 36,8%, p: 0,335), la estancia hospitalaria, la estancia en UCI y el tiempo en VMI fueron similares entre los grupos. La lesión renal aguda y el requerimiento de hemodiálisis (0 vs. 9,2%, p: 0,03) fueron más frecuentes en los no vacunados. No hubo asociación entre la mortalidad y recibir al menos una dosis de vacunación (RR 1,21; IC 95% 0,829–1,774, p: 0,334).
Conclusionesla vacunación no impactó la mortalidad; sin embargo, nuestros datos sugieren que puede reducir el estado de inflamación producido por la enfermedad y la aparición de lesión renal aguda y el requerimiento de hemodiálisis. Se requerirán estudios futuros para evaluar el impacto del tipo de vacuna y/o el número de dosis recibidas.
Vaccination for SARS-CoV-2 made it possible to reduce severe cases that require invasive mechanical ventilation (IMV) and care in the ICU. However, its impact on severe disease is not clear. The objective was to assess whether adults with severe SARS-CoV-2 pneumonia who required mechanical ventilation had a different clinical behavior in terms of mortality, depending on their vaccination status.
MethodologyRetrospective cohort study, in adults with severe pneumonia due to SARS-CoV-2 requiring IMV and ICU. Clinical outcomes were evaluated according to vaccination status, controlling for comorbidities.
ResultsTwo hundred patients (24% vaccinated, age 61 ± 13 years, men 68%) were analyzed. The vaccinated had lower CRP at admission, distension pressure and PEEP requirement for IMV. Mortality (43.8 vs 36.8%, p: 0.335), hospital stay, ICU stay, and time on IMV were similar between groups. Acute kidney injury and hemodialysis requirement (0 vs 9.2%, p: 0.03) were more frequent in the unvaccinated. There was no association between mortality and receiving at least one dose of vaccination (RR 1.21; CI 95% 0.829–1.774, p: 0.335).
ConclusionsVaccination did not impact mortality. However, our data suggest that it may reduce the inflammatory state produced by the disease and the occurrence of acute kidney injury and the requirement for hemodialysis. Future studies will be required to assess the impact of the type of vaccine and/or the number of doses received.
La COVID-19, infección causada por el SARS-CoV-2, fue declarada pandemia por la Organización Mundial de la Salud el 11 de marzo de 20201,2. En el mundo se han reportado más de 600 millones de casos, con más de 6 millones de muertes hasta diciembre de 2022. De forma similar, en Colombia se han reportado más de 5 millones de casos con más de 127.000 decesos3.
La implementación de la vacunación ha permitido controlar el ascenso de los casos de COVID-19 y ha conseguido disminuir en forma importante el número de casos graves que requieren de ventilación mecánica invasiva (VMI) y atención en la Unidad de Cuidados Intensivos (UCI). La efectividad reportada de las vacunas va hasta del 89% para prevenir la hospitalización y hasta el 90% para la evitar el ingreso a UCI con 2 dosis de vacunación de ARN mensajero4. Con la implementación del plan de vacunación desde enero a septiembre de 2021, se calculó que en Italia se evitaron 445.193 nuevos casos, 79.152 hospitalizaciones, 9.839 ingresos a UCI y 22.067 muertes5.
Algunos datos muestran que existe adicionalmente un potencial impacto en el curso de las formas graves de la enfermedad; con menor severidad respecto a los no vacunados, menor tiempo de requerimiento de VMI y menos días de estancia en UCI6.
A pesar de lo mencionado, aún no hay claridad sobre el impacto de la vacunación en la mortalidad de los pacientes que ya evolucionaron a una forma grave y requirieron de VMI. El objetivo de este estudio fue evaluar en los adultos con neumonía grave por SARS-CoV-2 que requirieron VMI, si haber sido vacunados comparado con no haber recibido la vacunación, tuvo impacto en la mortalidad, con base en una cohorte de pacientes manejados en un hospital de referencia en Colombia.
MetodologíaSe realizó un estudio de cohorte retrospectiva, evaluando los pacientes con diagnóstico de infección por SARS-CoV-2 que requirieron VMI y que fueron ingresados a la UCI del Hospital Universitario San Ignacio en Bogotá (Colombia), desde febrero de 2021 hasta junio de 2022. Los criterios de inclusión fueron: pacientes mayores de 18 años de edad, con infección por SARS-CoV-2 confirmada por RT-PCR, antígeno o FilmArray, que hubiesen tenido un curso clínico de neumonía grave, síndrome de dificultad respiratoria aguda (SDRA) y que hubiesen recibido soporte respiratorio con VMI e ingreso a UCI. Los criterios de exclusión fueron pacientes remitidos desde o hacia otras instituciones, coinfección con otros virus como influenza A y/o B, virus sincitial respiratorio o adenovirus, coinfección bacteriana sospechada o confirmada antes de llegar a VMI y el segundo episodio de infección por SARS-CoV-2. El estudio fue aprobado por el comité de ética institucional (código de aprobación 180–2022).
El cálculo de tamaño muestral se realizó según el concepto de «evento de interés por variable» propuesto por Freeman8, buscando incluir 10 eventos de mortalidad por cada una de las 7 variables que se consideraron un potencial factor de confusión y por el estado de vacunación. Asumiendo una mortalidad esperada de 40%, el tamaño de muestra calculado fue de 200 pacientes.
Los datos se obtuvieron a partir de una base de datos de la UCI, en donde se registró de forma sistemática la edad, sexo, peso, talla, tiempo de síntomas, comorbilidades mencionados por el paciente, laboratorios de ingreso para definir la severidad y SOFA de ingreso a UCI. Adicionalmente, aspectos relacionados con la ventilación mecánica como tiempo en VMI, características de la mecánica pulmonar (distensibilidad, presión de distensión, presión meseta, PEEP y volumen corriente), si requirió pronación y número de ciclos, tiempo de estancia hospitalaria y en UCI y mortalidad intrahospitalaria. Finalmente se recolectó información con respecto al estado de vacunación, número de dosis, vacuna recibida y momento de la vacunación con respecto al ingreso. Para garantizar la calidad de los datos se vigiló la tasa de datos perdidos y se verificó la información cuando se encontraron datos extremos.
Se definió neumonía grave según el consenso colombiano para manejo de la infección por SARS-CoV-2 (neumonía con frecuencia respiratoria >30 rpm, dificultad respiratoria o SaO2 < 90% al ambiente)1 y SDRA según los criterios de Berlín, sin tener en cuenta el criterio de la PEEP, dado que el diagnóstico fue considerado por el médico tratante, previo al inicio de la VMI7. Se consideró obesidad cuando el IMC era >30 kg/m2.
Se describieron las variables categóricas mediante datos de frecuencia absoluta y relativa. Para las variables continuas, media y desviación estándar si cumplían con criterios de distribución normal y mediana y rango intercuartílico para aquellas que no cumplieran con dicho criterio. Para evaluar el supuesto de normalidad se utilizó la prueba de Kolmogorov Smirnov. La comparación de la mortalidad entre los grupos exposición (vacunados vs. no vacunados) se realizó utilizando una prueba t, U de Mann Whitney o chi-cuadrado según las características de las variables. Considerando la alta frecuencia de mortalidad en la cohorte se calculó la razón de riesgos (RR) para la mortalidad intrahospitalaria, inicialmente en un análisis crudo y posteriormente en un análisis ajustado controlando por posibles factores de confusión. Para ello se utilizó un modelo lineal generalizado con un link log y distribución binomial8. Se incluyeron como potenciales variables de confusión las que han sido asociadas de forma independiente a mortalidad en estudios previos (edad, sexo, hipertensión arterial, diabetes mellitus tipo 2, obesidad, enfermedad renal crónica, cáncer activo, EPOC) e interacciones biológicamente plausibles con la vacunación (edad y enfermedad renal crónica). La selección de las variables finalmente incluidas en modelo ajustado se hizo mediante el método stepwise backward. Se consideró significativo un valor de p < 0,05. Se utilizó para el análisis el paquete estadístico Stata® versión 16.
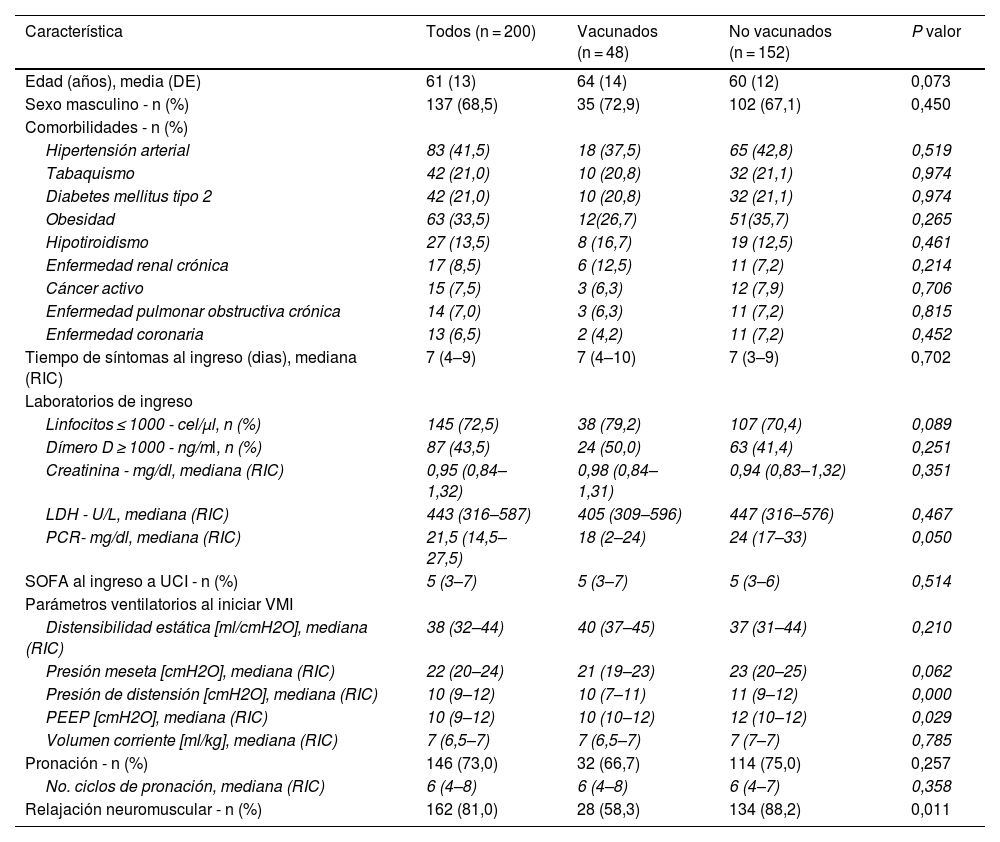
ResultadosSe analizaron un total de 200 pacientes, de los cuales 24% (n = 48) habían sido vacunados. En la tabla 1 se presentan las características clínicas basales de estos pacientes. La edad promedio fue 61 ± 13 años, con predominio del sexo masculino (68%). La mediana del tiempo de síntomas al momento del ingreso fue de 7 días. Las principales comorbilidades fueron hipertensión arterial y diabetes mellitus tipo 2, así como el antecedente de tabaquismo. La mediana del puntaje SOFA al ingreso a UCI fue de 5 puntos. Más del 70% tenían un conteo de linfocitos ≤1000 cel/μl y más del 40% tenían un dímero D ≥ 1.000 ng/ml. 73% requirieron pronación y 81% relajación neuromuscular.
Características clínicas basales de los pacientes según el estado de vacunación
| Característica | Todos (n = 200) | Vacunados (n = 48) | No vacunados (n = 152) | P valor |
|---|---|---|---|---|
| Edad (años), media (DE) | 61 (13) | 64 (14) | 60 (12) | 0,073 |
| Sexo masculino - n (%) | 137 (68,5) | 35 (72,9) | 102 (67,1) | 0,450 |
| Comorbilidades - n (%) | ||||
| Hipertensión arterial | 83 (41,5) | 18 (37,5) | 65 (42,8) | 0,519 |
| Tabaquismo | 42 (21,0) | 10 (20,8) | 32 (21,1) | 0,974 |
| Diabetes mellitus tipo 2 | 42 (21,0) | 10 (20,8) | 32 (21,1) | 0,974 |
| Obesidad | 63 (33,5) | 12(26,7) | 51(35,7) | 0,265 |
| Hipotiroidismo | 27 (13,5) | 8 (16,7) | 19 (12,5) | 0,461 |
| Enfermedad renal crónica | 17 (8,5) | 6 (12,5) | 11 (7,2) | 0,214 |
| Cáncer activo | 15 (7,5) | 3 (6,3) | 12 (7,9) | 0,706 |
| Enfermedad pulmonar obstructiva crónica | 14 (7,0) | 3 (6,3) | 11 (7,2) | 0,815 |
| Enfermedad coronaria | 13 (6,5) | 2 (4,2) | 11 (7,2) | 0,452 |
| Tiempo de síntomas al ingreso (dias), mediana (RIC) | 7 (4–9) | 7 (4–10) | 7 (3–9) | 0,702 |
| Laboratorios de ingreso | ||||
| Linfocitos ≤ 1000 - cel/μl, n (%) | 145 (72,5) | 38 (79,2) | 107 (70,4) | 0,089 |
| Dímero D ≥ 1000 - ng/ml, n (%) | 87 (43,5) | 24 (50,0) | 63 (41,4) | 0,251 |
| Creatinina - mg/dl, mediana (RIC) | 0,95 (0,84–1,32) | 0,98 (0,84–1,31) | 0,94 (0,83–1,32) | 0,351 |
| LDH - U/L, mediana (RIC) | 443 (316–587) | 405 (309–596) | 447 (316–576) | 0,467 |
| PCR- mg/dl, mediana (RIC) | 21,5 (14,5–27,5) | 18 (2–24) | 24 (17–33) | 0,050 |
| SOFA al ingreso a UCI - n (%) | 5 (3–7) | 5 (3–7) | 5 (3–6) | 0,514 |
| Parámetros ventilatorios al iniciar VMI | ||||
| Distensibilidad estática [ml/cmH2O], mediana (RIC) | 38 (32–44) | 40 (37–45) | 37 (31–44) | 0,210 |
| Presión meseta [cmH2O], mediana (RIC) | 22 (20–24) | 21 (19–23) | 23 (20–25) | 0,062 |
| Presión de distensión [cmH2O], mediana (RIC) | 10 (9–12) | 10 (7–11) | 11 (9–12) | 0,000 |
| PEEP [cmH2O], mediana (RIC) | 10 (9–12) | 10 (10–12) | 12 (10–12) | 0,029 |
| Volumen corriente [ml/kg], mediana (RIC) | 7 (6,5–7) | 7 (6,5–7) | 7 (7–7) | 0,785 |
| Pronación - n (%) | 146 (73,0) | 32 (66,7) | 114 (75,0) | 0,257 |
| No. ciclos de pronación, mediana (RIC) | 6 (4–8) | 6 (4–8) | 6 (4–7) | 0,358 |
| Relajación neuromuscular - n (%) | 162 (81,0) | 28 (58,3) | 134 (88,2) | 0,011 |
DE: desviación estándar; LDH: deshidrogenasa láctica RIC: rango intercuartílico; PEEP: presión positiva al final de la espiración; PCR: proteína C reactiva; SOFA: Sequential Organ Failure Assessment Score; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasive.
Al comparar el grupo de vacunados vs. no vacunados, la PCR fue más baja en los vacunados (mediana 18 vs. 24 mg/dl, p: 0,05). Algo similar se observó en los parámetros ventilatorios al iniciar la VMI, donde la distensibilidad, presión meseta y presión de distensión fue mejor para los vacunados, aunque solo significativamente diferente en este último parámetro (tabla 1). Del total de los pacientes vacunados, 11 (22,9%) habían recibido solo una dosis, 29 (60,4%) habían recibido 2 dosis y 8 (16,6%) habían recibido 2 dosis y un refuerzo. Las vacunas recibidas fueron principalmente Sinovac, seguida de Pfizer y finalmente, Astrazeneca (tabla 2).
Estado de vacunación
| Característica | |
|---|---|
| Vacuna recibida - primera dosis (n = 48), n (%) | |
| Sinovac | 28 (58,3) |
| Pfizer | 11 (22,9) |
| Astrazeneca | 9 (18,7) |
| Vacuna recibida - segunda dosis (n = 29), n (%) | |
| Sinovac | 19 (65,5) |
| Pfizer | 5 (17,2) |
| Astrazeneca | 5 (17,2) |
| Vacuna recibida - refuerzo (n = 8), n (%) | |
| Sinovac | 5 (62,5) |
| Pfizer | 3 (37,5) |
| Tiempo inicio síntomas - primera dosis (días), mediana (RIC) | 84 (13–238) |
| Tiempo primera dosis - segunda dosis (días), mediana (RIC) | 71 (32–112) |
| Tiempo segunda dosis - refuerzo (días), mediana (RIC) | 155 (75–198) |
| RIC (rango intercuartílico) | |
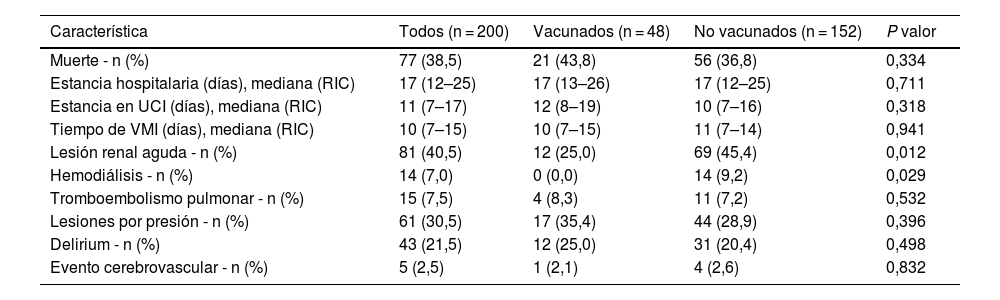
En relación a los desenlaces clínicos de los pacientes, según el estado de vacunación, la muerte no fue estadísticamente diferente entre grupos (43,8 vs. 36,8%, p: 0,334) similar a lo encontrado para otros desenlaces como la estancia hospitalaria, la estancia en UCI, el tiempo de VMI, la aparición de trombo embolismo pulmonar, lesiones por presión, delirium o evento cerebrovascular. Por el contrario, la lesión renal aguda y el requerimiento de hemodiálisis fueron más frecuentes en el grupo de los no vacunados (tabla 3).
Desenlaces clínicos según el estado de vacunación
| Característica | Todos (n = 200) | Vacunados (n = 48) | No vacunados (n = 152) | P valor |
|---|---|---|---|---|
| Muerte - n (%) | 77 (38,5) | 21 (43,8) | 56 (36,8) | 0,334 |
| Estancia hospitalaria (días), mediana (RIC) | 17 (12–25) | 17 (13–26) | 17 (12–25) | 0,711 |
| Estancia en UCI (días), mediana (RIC) | 11 (7–17) | 12 (8–19) | 10 (7–16) | 0,318 |
| Tiempo de VMI (días), mediana (RIC) | 10 (7–15) | 10 (7–15) | 11 (7–14) | 0,941 |
| Lesión renal aguda - n (%) | 81 (40,5) | 12 (25,0) | 69 (45,4) | 0,012 |
| Hemodiálisis - n (%) | 14 (7,0) | 0 (0,0) | 14 (9,2) | 0,029 |
| Tromboembolismo pulmonar - n (%) | 15 (7,5) | 4 (8,3) | 11 (7,2) | 0,532 |
| Lesiones por presión - n (%) | 61 (30,5) | 17 (35,4) | 44 (28,9) | 0,396 |
| Delirium - n (%) | 43 (21,5) | 12 (25,0) | 31 (20,4) | 0,498 |
| Evento cerebrovascular - n (%) | 5 (2,5) | 1 (2,1) | 4 (2,6) | 0,832 |
RIC: rango intercuartílico; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva.
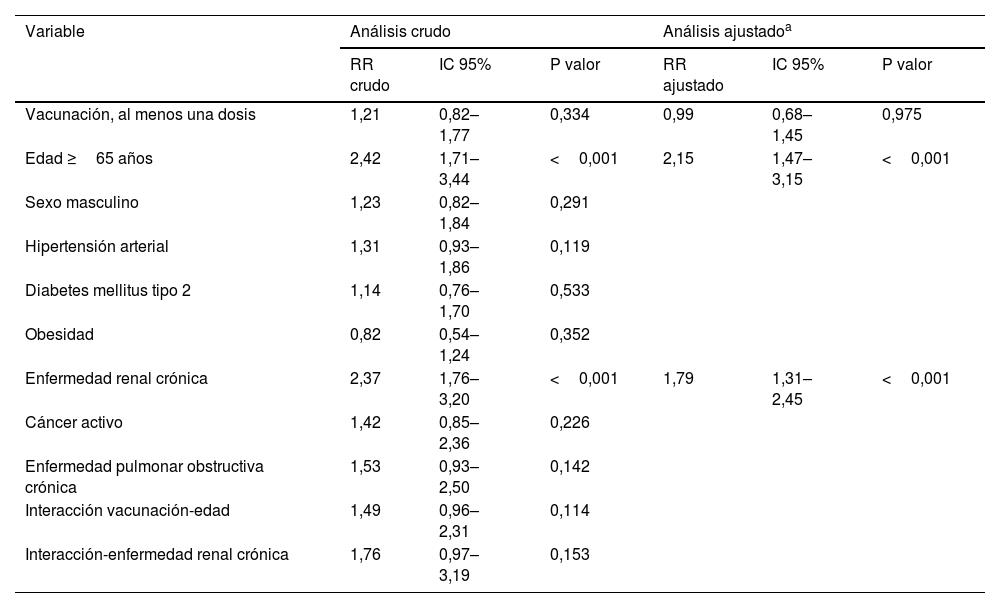
En el análisis crudo no se encontró asociación entre la mortalidad y haber recibido al menos una dosis de vacunación (riesgo relativo 1,21 IC 95% 0,829–1,774, p: 0,334) a diferencia de la edad ≥65 años (RR 2,42 IC 95% 1,71–3,44, p < 0,001) y el antecedente de enfermedad renal crónica (RR 2,37 IC 95%; 1,76–3,20, p < 0,001). En el análisis ajustado, nuevamente no se encontró asociación significativa con el estado de vacunación (RR 0,99 IC 95%; 0,68–1,45, p: 0,975), después de controlar por edad, sexo, comorbilidades e interacciones (tabla 4).
Factores asociados a mortalidad en pacientes con neumonía por SARS- Cov2 y que requirieron ventilación mecánicaa
| Variable | Análisis crudo | Análisis ajustadoa | ||||
|---|---|---|---|---|---|---|
| RR crudo | IC 95% | P valor | RR ajustado | IC 95% | P valor | |
| Vacunación, al menos una dosis | 1,21 | 0,82–1,77 | 0,334 | 0,99 | 0,68–1,45 | 0,975 |
| Edad ≥65 años | 2,42 | 1,71–3,44 | <0,001 | 2,15 | 1,47–3,15 | <0,001 |
| Sexo masculino | 1,23 | 0,82–1,84 | 0,291 | |||
| Hipertensión arterial | 1,31 | 0,93–1,86 | 0,119 | |||
| Diabetes mellitus tipo 2 | 1,14 | 0,76–1,70 | 0,533 | |||
| Obesidad | 0,82 | 0,54–1,24 | 0,352 | |||
| Enfermedad renal crónica | 2,37 | 1,76–3,20 | <0,001 | 1,79 | 1,31–2,45 | <0,001 |
| Cáncer activo | 1,42 | 0,85–2,36 | 0,226 | |||
| Enfermedad pulmonar obstructiva crónica | 1,53 | 0,93–2,50 | 0,142 | |||
| Interacción vacunación-edad | 1,49 | 0,96–2,31 | 0,114 | |||
| Interacción-enfermedad renal crónica | 1,76 | 0,97–3,19 | 0,153 | |||
En el presente studio, encontramos que los adultos colombianos con neumonía grave por SARS-CoV-2, que requirieron VMI e ingreso a UCI, no tuvieron una diferencia significativa en la tasa de mortalidad, estancia en UCI o tiempo en VMI según el estado de vacunación, después de controlar por múltiples comorbilidades.
Nuestros hallazgos son similares a los reportados por Graselli et al.9 quienes demostraron cómo la vacunación para SARS-CoV-2 disminuye la probabilidad de ingresar a UCI, con RR 0,15 (IC 95% 0,13–0,17), pero una vez el paciente llega a requerir ingreso a la unidad, la estancia hospitalaria (mediana 25 días RIQ 17–36), estancia en UCI (mediana 13 días RIQ 7–24) y mortalidad en UCI (25,9% [n = 107] vs. 32,4% [n = 45]; P: 0,14) no fueron diferentes entre vacunados y no vacunados. En cambio, la mortalidad durante el total de la estancia hospitalaria sí fue superior entre los vacunados (29,9% [n = 112/375] vs. 40,2% [n = 55/137], P: 0,03).
Por el contrario, en el estudio de Bruni et al.10 la estancia en UCI fue de 11,4 (±7,1) días, siendo inferior para los vacunados, así como la mortalidad en UCI (38,5% vs. 24,3%; P: 0,014). Este estudio fue realizado en Italia, donde los pacientes habían ingresado a UCI, pero con diferentes dispositivos de oxigenación (no solo VMI); los vacunados tenían mayor edad, estaban más inmunosuprimidos y/o tenían alguna malignidad. Las diferencias en la edad, las comorbilidades de base y la disponibilidad de recursos para el manejo podrían explicar las diferencias.
En nuestra población los vacunados tuvieron la tendencia a presentar mayor edad, pero similar frecuencia de comorbilidades. Esto se puede explicar por la forma en que se dio el proceso de vacunación para SARS-CoV-2 en Colombia, el cual fue diseñado por etapas, incluyendo en la primera etapa a personas >80 años y talento humano en salud y la segunda etapa a personas entre 60 y 79 años11. Este proceso también fue similar en otros países12, como se evidencia en los estudios que comparan el comportamiento clínico de los vacunados, quienes corresponden a una población mayor y con más factores de riesgo para mortalidad8,10.
Los estudios con los cuales se han desarrollado las diferentes vacunas para SARS-CoV-2 han demostrado su efectividad para la prevención de la enfermedad grave13, sin embargo, aquellos que adquieren la enfermedad también pueden llegar a requerir UCI y VMI (aunque en menor proporción)14. Nuestros datos sugieren que los pacientes vacunados cursan con menor inflamación, reflejado en menor lesión renal aguda y/o necesidad de hemodiálisis, niveles de PCR más bajos, así como mejores condiciones en la mecánica respiratoria al iniciar la VMI. Esto puede darse dado que una vez que se adquiere la infección, gracias a la vacunación, el cuerpo tiene la capacidad de reaccionar rápidamente iniciando la actividad inmunitaria y disminuyendo el daño inmune y la severidad de la enfermedad15.
De todas las vacunas estudiadas, la mayor efectividad se ha encontrado en las vacunas ARNm seguidas por las de virus inactivados14, al parecer es por su capacidad de generar una repuesta tanto mediada por anticuerpos como por activación de linfocitos T citotóxicos lo que le permite tener una respuesta inmunológica más rápida16, en nuestro estudio solo el 22,9% de quienes recibieron la primera dosis, 17,2% de la segunda dosis y 37,5% de quienes recibieron refuerzo, tenían vacunación tipo ARNm. Nuestro tamaño de muestra no nos permitió evaluar de forma precisa si el tipo de vacuna puede producir diferencias significativas en los desenlaces clínicos en esta población. Se requerirán nuevos estudios prospectivos y multicéntricos para evaluar esta hipótesis.
Las limitaciones de este estudio están dadas por el carácter retrospectivo del mismo que podría haber limitado la evaluación de las comorbilidades, al ser estas autoreportadas por el paciente, sin embargo, de existir un sesgo de mala clasificación este sería no diferencial dado que afectaría de forma similar a toda la población, por lo que no se desviaría la dirección del efecto pero probablemente si se podría subestimar. De igual forma algunas variables asociadas a mortalidad, como la falla cardiaca o la cirrosis hepática, no pudieron ser evaluadas en nuestro estudio, dado que no fueron evaluadas para todos los pacientes, lo que hace posible que existan sesgos de selección no documentados. Así mismo nuestro tamaño no nos permitió evaluar de forma precisa el potencial impacto del tipo de vacuna utilizada, la combinación de vacunas, las dosis de refuerzo y momento de aplicación de la vacuna en relación al momento de adquirir la enfermedad. Todos estos factores podrían impactar las conclusiones si, por ejemplo, existiesen diferencias en la mortalidad según el tipo de vacuna utilizada. Además, nuestros datos pueden tener una validez externa limitada en poblaciones distintas a la colombiana, en donde se usaron esquemas de vacunación diferentes. Estudios prospectivos y multicéntricos serán necesarios para evaluar el efecto de diferentes esquemas de vacunación en múltiples poblaciones.
ConclusionesLa vacunación no impactó de forma significativa en la tasa mortalidad de los pacientes colombianos que cursaron con COVID-19 grave, con requerimiento de VMI y UCI. Sin embargo, nuestros datos muestran que la vacunación puede reducir el estado de inflamación producido por la enfermedad y la aparición de desenlaces como la lesión renal aguda y el requerimiento de hemodiálisis. Se requerirán estudios con mayor tamaño de muestra para evaluar el impacto del tipo de vacuna y/o número de dosis recibidas en diferentes poblaciones.
Responsabilidades éticasLos procedimientos seguidos se han realizado conforme a las normas éticas del comité de ética institucional y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
AutoríaYina Benítez, Luis Trianab, Oscar Muñoz y Viviana López contribuyeron a la conceptualización de la investigación. Yina Benítez, Laura Niño y Santiago Bottia recogieron la información. Yina Benítez, Oscar Muñoz y Viviana López llevaron a cabo el análisis de datos y escribieron el borrador y el manuscrito final. Todos los autores contribuyeron, leyeron y aprobaron la versión del manuscrito enviado.
FinanciaciónNinguna.