Evaluar la eficacia y seguridad de onabotulinumtoxina A en pacientes con vejiga hiperactiva idiopática (VHI) con falta de eficacia, intolerancia o contraindicación para el uso de anticolinérgicos.
Material y métodosSe realizó un estudio observacional, prospectivo, abierto en un único centro entre 2008 y 2013, en pacientes consecutivos con vejiga hiperactiva idiopática con falta de eficacia o intolerancia a los anticolinérgicos.
ResultadosLas 73 pacientes fueron mujeres con edad de 58,9±12,9 años. Se administraron 100 y 200 unidades de toxina en 89 y 5 casos, respectivamente. Diecinueve pacientes recibieron una segunda inyección, 8 pacientes 3 inyecciones y un paciente 4. Clínicamente se observó que inicialmente un 98% de las pacientes tenían incontinencia urinaria de urgencia y después del tratamiento solo un 42%; el número de absorbentes por día, pasó de 2,8 al inicio a 0,5 después del tratamiento. Respecto a los parámetros urodinámicos, el volumen del primer deseo miccional mejoró de 97±63ml a 139±81ml. Se obtuvieron resultados similares en capacidad cistométrica y el volumen de la primera contracción involuntaria del detrusor. Una paciente tuvo urocultivo positivo, resolviéndose con un régimen de antibiótico oral convencional. El cateterismo intermitente fue necesario en 5 pacientes durante la primera semana.
ConclusionesLas inyecciones de onabotulinumtoxina A mejoraron significativamente no solo los síntomas clínicos, sino también los parámetros urodinámicos en pacientes con vejiga hiperactiva idiopática inadecuadamente manejados con anticolinérgicos. Esta es una técnica simple, con efectos adversos mínimos y generalmente bien tolerada.
To assess the efficacy and safety of onabotulinum toxin A in patients with idiopathic overactive bladder inadequately managed with anticholinergics.
Material and methodsA prospective, open-label, single centre, and interventional study was conducted, from 2008 to 2013, on consecutive patients with idiophatic overactive bladder that showed lack of efficacy or intolerance to anticholinergic agents.
ResultsThe study included 73 female patients aged 58.9±12.9 years. A dose of 100 and 200 units of toxin were administered in 89 and 5 cases, respectively. Nineteen patients received a second injection, 8 patients received 3, and one patient was treated 4 times. Clinically, it was observed that 98% patients had urge urinary incontinence at baseline, as compared with 42% under treatment. Similar results were obtained regarding the number of pads used per day, from 2.8 at baseline to 0.5 after treatment. as regrads the urodynamic parameters, the first desire to void volume improved from ml 97±63 to 139±81ml. Similar results were obtained as regards cystometric capacity and the volume of the first involuntary detrusor contraction. One patient had a positive urine culture resolved using a conventional oral antibiotic regimen. Intermittent catheterisation was required in 5 patients during the first week.
ConclusionsOnabotulinum toxin A injections significantly improved, not only the clinical symptoms, but also the urodynamic parameters in patients with idiopathic overactive bladder inadequately managed with anticholinergic drugs. This is a simple technique with minimal adverse effects and generally well tolerated.
La Sociedad Internacional de Continencia define como vejiga hiperactiva (VH) un síndrome caracterizado por síntomas del tracto urinario inferior tales como urgencia con o sin incontinencia urinaria y usualmente acompañada de frecuencia urinaria y nocturia1.
La VH tiene una prevalencia global entre el 12 y el 19%, generando una enorme carga para el sistema de salud, la sociedad y la calidad de vida de los individuos afectados2. En urología, el uso de onabotulinumtoxina A ha sido ampliamente evaluado en pacientes con VH neurogénica3–9. Además, diferentes estudios apoyan su uso en pacientes con VH y con incontinencia urinaria de urgencia persistente, mostrando una mejoría en la calidad de vida y en algunos parámetros urodinámicos10,11.
Según las guías de la Asociación Europea de Urología y la Asociación Americana de Urología, la terapia de primera línea incluye la rehabilitación y el tratamiento farmacológico con agentes antimuscarínicos y agonistas del receptor β3-adrenérgico12–14. Cuando los pacientes son intolerantes o refractarios al tratamiento farmacológico, tanto la aplicación de toxina botulínica como la neuromodulación sacra son las alternativas recomendadas15. En un estudio retrospectivo Makovey et al.16 reportaron resultados exitosos posteriores a la aplicación de toxina botulínica en 34/57 (60%) pacientes en los que la eficacia de los anticolinérgicos había fallado y en 24/28 (86%) que no toleraban los anticolinérgicos por sus efectos adversos.
Ha aumentado la evidencia que muestra que el tratamiento con toxina botulínica se asocia a menos síntomas urinarios y una mejora en la calidad de vida del paciente17.
En la actualidad existe un nivel de evidencia A para el uso de onabotulinumtoxina A en pacientes con vejiga hiperactiva idiopática (VHI) manejados inadecuadamente con anticolinérgicos18.
El propósito de este estudio fue evaluar los parámetros urodinámicos, clínicos y eventos adversos en pacientes con VHI, tratados de forma inadecuada con anticolinérgicos, que recibieron onabotulinumtoxina A intravesical.
Materiales y métodosSe trata de un estudio observacional, prospectivo, abierto en un único centro público que se llevó a cabo entre 2008 y 2013, en pacientes consecutivas con diagnostico de VHI con falta de eficacia o intolerancia a los fármacos anticolinérgicos. Las pacientes recibieron tratamiento con 100 o 200 unidades de onabotulinumtoxina A (BOTOX® Allergan, Inc., Irvine, CA, EE. UU.) de acuerdo con las necesidades de cada paciente.
Las pacientes con síntomas de VHI que no respondieron al tratamiento anticolinérgico fueron remitidas a la Unidad Especializada en Urología Funcional y Femenina de nuestro hospital en donde se les realizó un amplio estudio. Las participantes cumplían los siguientes criterios de inclusión: edad igual o mayor a 18 años y VHI refractaria o intolerante a anticolinérgicos. Las pacientes con otros diagnósticos que no fueran VHI (es decir, vejiga neurogénica o cistitis intersticial), cualquier condición considerada como una contraindicación para el tratamiento de toxina botulínica (reacción alérgica, enfermedades de la unión neuromuscular, enfermedades neuropáticas periféricas, etc.), neoplasias, cambios anatómicos, y el embarazo o la lactancia fueron excluidos del análisis. El protocolo de estudio fue aprobado por el comité de ética local. Todas las pacientes fueron plenamente informadas sobre los detalles del protocolo de estudio y dieron su consentimiento informado por escrito. Se siguieron los principios éticos establecidos en la Declaración de Helsinki y las buenas prácticas clínicas.
La evaluación inicial incluía la historia clínica, un diario miccional de 3 días, la evaluación de la calidad de vida (OAB-q SF), el residuo posmiccional, cultivo de orina, y los estudios urodinámicos antes y después de la aplicación de onabotulinumtoxina A.
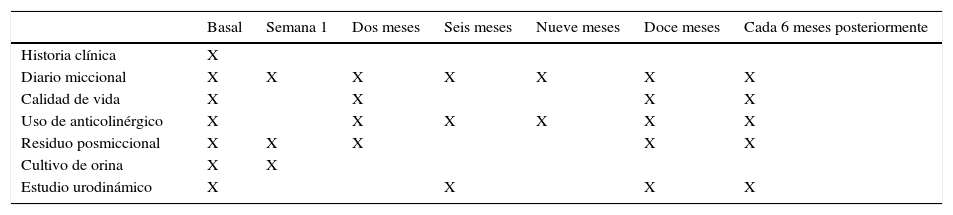
Las visitas de seguimiento se programaron en la semana 1, a los 2, 6, 9 y 12 meses, y a partir de entonces, cada 6 meses (tabla 1).
Esquema de seguimiento y recolección de datos
| Basal | Semana 1 | Dos meses | Seis meses | Nueve meses | Doce meses | Cada 6 meses posteriormente | |
|---|---|---|---|---|---|---|---|
| Historia clínica | X | ||||||
| Diario miccional | X | X | X | X | X | X | X |
| Calidad de vida | X | X | X | X | |||
| Uso de anticolinérgico | X | X | X | X | X | X | |
| Residuo posmiccional | X | X | X | X | X | ||
| Cultivo de orina | X | X | |||||
| Estudio urodinámico | X | X | X | X |
Onabotulinumtoxina A se inyecta en el músculo detrusor en 20 sitios, evitando el trígono, mediante el uso de aguja con tope y con cistoscopio (rígido o flexible); bajo sedación intravenosa en un centro de cirugía ambulatoria. Se utiliza profilaxis antibiótica con cefazolina intravenosa (2g); en aquellos casos con alergia a la cefazolina, se utiliza vancomicina. La inyección de onabotulinumtoxina A de 100 unidades se diluye con 10ml de solución salina al 0,9%. Se inyecta 0,5ml en cada punto con una distancia entre ellos de aproximadamente 1cm. Una vez administrada la toxina y después de comprobar la ausencia efectos adversos, tales como hematuria, y evaluar que la paciente orina correctamente, la paciente es dada de alta sin sonda vesical, pero con un tratamiento antibiótico durante 3-7 días. Una semana después a la aplicación la paciente vuelve al hospital para realizar una evaluación clínica, descartar la presencia de infecciones del tracto urinario y llevar a cabo la medición del residuo posmiccional. La indicación de autocateterismo dependía del volumen del residuo posmiccional y los síntomas, este se suele indicar en aquellos pacientes con residuo posmiccional superior a 200ml y/o con síntomas. Este estudio evaluó el número de pacientes que requieren cateterismo después de la administración de la toxina botulínica y la duración del mismo. Durante el seguimiento de las pacientes, un empeoramiento en cuanto a los parámetros clínicos fueron tenidos en cuenta para la reinyección de la toxina.
Los aspectos relacionados con la calidad de vida y los síntomas fueron evaluados con el cuestionario corto para VH (OAB-q SF) validado en español. Para evaluar los síntomas son 6 ítems y para evaluar calidad de vida son 13 ítems. subdivididos en: afrontamiento (5 ítems), sueño (3 ítems), y emocionales sociales (5 ítems). Los resultados se evaluaron mediante el cálculo de las medias de cada una de las secciones del cuestionario.
Análisis estadístico: Para el análisis se utilizó el programa estadístico SPSS 15.0 (SPSS Inc. Chicago, IL, EE. UU.). Se realizó un análisis estadístico descriptivo (media [desviación estándar]) para las características demográficas y clínicas. Para analizar las variables cuantitativas, previas y posteriores a la inyección de onabotulinumtoxina A, se utilizó la prueba t Student. Las variables categóricas se compararon mediante una prueba de Chi-cuadrado. En caso de que todos los datos de parámetros urodinámicos no se recogieron para una o más pacientes, los valores que faltan se sustituyeron con una media geométrica. Las comparaciones entre los valores previos a la intervención y después de esta se realizaron para incontinencia urinaria de urgencia (presencia o no de incontinencia con la urgencia), frecuencia urinaria nocturna (número de micciones en la noche), frecuencia urinaria diurna (si toleraba o no más de 2h sin orinar) y número de absorbentes al día. También se examinaron los parámetros urodinámicos antes y después a la aplicación (volumen del primer deseo miccional, volumen de la primera contracción involuntaria del detrusor, capacidad cistométrica, presión máxima del detrusor y el residuo posmiccional. Un valor de p<0,05 fue considerado significativo.
ResultadosSetenta y tres pacientes cumplieron con los criterios de inclusión y exclusión. Todas las pacientes fueron mujeres con una edad media de 59,2±12,9 años. Según el sistema de clasificación de riesgos anestésicos de la Sociedad Americana de Anestesiología (ASA), 13 (14%) de los pacientes fueron clasificadas como ASA I, 62 (66%) como ASA II, y 19 (20%) como ASA III, respectivamente (tabla 2).
Características demográficas basales
| Características | Número de pacientes |
|---|---|
| Sexo | Mujeres: 73 (100%) |
| Hombres: 0 (0%) | |
| ASAa | I: 13 (14%) |
| II: 62 (66%) | |
| III: 19 (20%) | |
| Edad (años) | 58,9±12,9 |
| Uso previo de anticolinérgicos | 40 (85%) |
Entre las 73 pacientes incluidas en el estudio, 28 (30%) de ellas requirieron inyecciones adicionales, de las cuales 19 (20%) recibieron 2 dosis de onabotulinumtoxina A, 8 (9%) fueron tratadas 3 veces, y una paciente (1%) fue tratada 4 veces. En cuanto a las dosis de onabotulinumtoxina A administradas en nuestro estudio, se utilizaron 100 unidades en 89 procedimientos y 200 unidades en 5 procedimientos. Entre aquellas pacientes que requirieron retratamientos, el tiempo medio entre las inyecciones fue 22±7 meses entre la primera y la segunda dosis, 17±10 meses entre la segunda y la tercera, y 20±6 meses entre la tercera y la cuarta sesión.
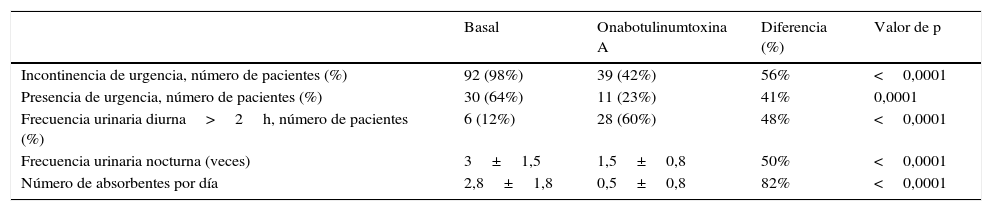
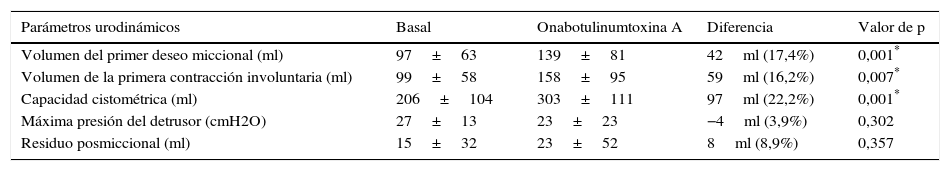
En cuanto a la clínica al inicio del estudio 92 (98%) pacientes tenían incontinencia urinaria de urgencia, en comparación con 39 (42%) posterior al tratamiento, p<0,0001 (tabla 3). Se obtuvieron resultados similares en cuanto al número de absorbentes por día: de 2,8±1,8 al inicio a 0,5±0,8 después del tratamiento, p<0,0001. Además, la frecuencia urinaria nocturna disminuyó significativamente de 3±1,5 al inicio a 1,5±0,8 con la aplicación de onabotulinumtoxina A, p<0,0001 (tabla 3). Respecto a los parámetros urodinámicos, el volumen del primer deseo miccional mejoró significativamente de 97±63ml a 139±81ml con el tratamiento, p=0,001. Se obtuvieron resultados similares con respecto a la capacidad cistométrica y el volumen de la primera contracción involuntaria del detrusor, p=0,001 y p=0,007, respectivamente (tabla 4). Por último, en cuanto a los efectos adversos, una paciente tuvo un urocultivo positivo que se resolvió con éxito con un régimen antibiótico oral convencional. El cateterismo intermitente fue necesario en 5 pacientes durante la primera semana después de la administración de la toxina botulínica, ninguna de ellas necesitó cateterismo intermitente después de 3 meses. En este estudio, ninguna paciente tuvo hematuria o dolor después de la inyección. Aunque el protocolo incluyó la evaluación de la calidad de vida, muchas pacientes no completaron el cuestionario, hecho que ha provocado que la información relativa a la calidad de vida no haya sido incluida en el análisis.
Cambios en las variables clínicas posterior a la aplicación de onabotulinumtoxina A
| Basal | Onabotulinumtoxina A | Diferencia (%) | Valor de p | |
|---|---|---|---|---|
| Incontinencia de urgencia, número de pacientes (%) | 92 (98%) | 39 (42%) | 56% | <0,0001 |
| Presencia de urgencia, número de pacientes (%) | 30 (64%) | 11 (23%) | 41% | 0,0001 |
| Frecuencia urinaria diurna>2h, número de pacientes (%) | 6 (12%) | 28 (60%) | 48% | <0,0001 |
| Frecuencia urinaria nocturna (veces) | 3±1,5 | 1,5±0,8 | 50% | <0,0001 |
| Número de absorbentes por día | 2,8±1,8 | 0,5±0,8 | 82% | <0,0001 |
Comparación de los parámetros urodinámicos antes y después de la aplicación de onabotulinumtoxina A
| Parámetros urodinámicos | Basal | Onabotulinumtoxina A | Diferencia | Valor de p |
|---|---|---|---|---|
| Volumen del primer deseo miccional (ml) | 97±63 | 139±81 | 42ml (17,4%) | 0,001* |
| Volumen de la primera contracción involuntaria (ml) | 99±58 | 158±95 | 59ml (16,2%) | 0,007* |
| Capacidad cistométrica (ml) | 206±104 | 303±111 | 97ml (22,2%) | 0,001* |
| Máxima presión del detrusor (cmH2O) | 27±13 | 23±23 | −4ml (3,9%) | 0,302 |
| Residuo posmiccional (ml) | 15±32 | 23±52 | 8ml (8,9%) | 0,357 |
Los resultados de este estudio muestran que el tratamiento con onabotulinumtoxina A presenta mejoras significativas en los parámetros urodinámicos y clínicos en pacientes con falta de eficacia, intolerancia o contraindicación para el tratamiento con anticolinérgicos. El uso de la toxina botulínica en pacientes con lesión medular y vejiga neurogénica ha sido ampliamente estudiado y fue en los primeros pacientes en los que se usó; en 1988 Dykstra et al. describen por primera vez su uso, aplicándola en el esfínter urinario externo para tratar disinergias detrusor-esfinterianas de pacientes con lesión médular3. Posteriormente, Schurch et al. en 2000, evaluaron el uso de onabotulinumtoxina A para el tratamiento del detrusor hiperactivo neurogénico en 12 pacientes con lesión de la médula espinal7. En el 2004, Giannantoni et al. publican el primer estudio controlado de onabotulinumtoxina A en pacientes con hiperactividad neurogénica del detrusor19. Cruz et al. evaluaron los efectos de onabotulinumtoxina A sobre la incontinencia urinaria, los parámetros urodinámicos y la calidad de vida en pacientes incontinentes con VH neurogénica, encontrando una mejoría significativa en todos ellos20. Nuestro estudio se enfocó en el tratamiento de pacientes con VHI en los cuales se había comprobado la intolerancia o falta de eficacia de los fármacos anticolinérgicos, nuestros resultados coinciden con los publicados por Nitti et al. que evaluaron la eficacia y la seguridad de onabotulinumtoxina A en pacientes con VH e incontinencia urinaria inadecuadamente tratados con anticolinérgicos21. Al analizar los resultados en cuanto a los parámetros urodinámicos de nuestro estudio observamos una mejoría que se asemeja a la de otros estudios publicados hasta la fecha11,22–24. Denys et al. informaron una mejoría significativa del volumen de la primera contracción involuntaria del detrusor después del tratamiento con 100 unidades de onabotulinumtoxina A, que en nuestro caso con 42ml alcanzó una diferencia estadísticamente significativa, p=0,00711. Además, Schmid et al. hablan de un aumento del volumen promedio del primer deseo miccional aumentado de 126-212ml22. Del mismo modo, nosotros encontramos un aumento significativo de este parámetro urodinámico (p=0,001).
En cuanto a la capacidad cistométrica, Dowson et al. informan de un aumento significativo de esta en pacientes con hipersensibilidad vesical tratados con 100 unidades de onabotulinumtoxina A24. De acuerdo con nuestro estudio se encontró un aumento significativo en la capacidad cistométrica de 97±113ml, p<0,001.
Encontramos que el tiempo medio hasta la necesidad de retratamiento fue de 20 meses en las 19 pacientes que requirieron una segunda dosis, 17 meses en 8 que recibieron una tercera sesión y 20 meses en la que necesitó una cuarta dosis. El tiempo medio hasta la necesidad de retratamiento observado en nuestro estudio es ligeramente superior al reportado por Brubaker et al.25, quienes informaron de 370 días. La retención urinaria, que se muestra como uno de los posibles efectos secundarios después de las inyecciones de toxina botulínica intravesical, puede llevar a la necesidad de cateterismo intermitente. Aunque hemos observado un aumento en el promedio de residuo posmiccional desde el inicio hasta la última visita de seguimiento de 8ml, no fue estadísticamente significativo (p=0,357). Nuestros resultados están en línea con los informes anteriores2,10,23. Por otra parte, el cateterismo intermitente fue necesario en 5 (5,3%) de las pacientes durante la primera semana después de la administración de toxina botulínica y ninguna de ellas necesitó cateterismo intermitente después de 3 meses. De acuerdo con la literatura, la necesidad de cateterismo oscila entre el 10 y 43%26. El volumen recomendado para hacer un cateterismo no se define actualmente, aunque a menudo se realiza con un residuo posmiccional mayor de 200ml o cuando es mayor del 40% de la capacidad cistométrica2. En cuanto a la calidad de vida, los resultados de la OAB-q SF que se encuentran en nuestro estudio muestran una mejora significativa de esta pero como se mencionó anteriormente en la sección de resultados, muchas de nuestras pacientes no completaron el cuestionario. No obstante, en aquellas pacientes que lo completaron los resultados coinciden con los publicados anteriormente por Chapple et al.2 quienes reportaron mejoras significativas en la calidad de vida con onabotulinumtoxina A en comparación con el placebo.
Debemos reconocer que hay algunas limitaciones en este estudio, como el sesgo de referencia o su diseño abierto. La falta de características estándar de los ensayos clínicos, tales como controles de placebo, asignación al azar y el cegamiento de los evaluadores son todas las limitaciones inherentes de estudios abiertos. Sin embargo, el hecho de que el análisis de los datos se llevó a cabo en una forma enmascarada puede haber reducido la posibilidad de sesgo. Probablemente, la limitación más importante es la falta de información sobre los parámetros de calidad de vida. Aunque estaba prevista la evaluación de la calidad de vida en el protocolo, muchas pacientes no respondieron al cuestionario. Por lo tanto, no hemos sido capaces de realizar un análisis de la calidad de vida. Otra limitación de este estudio es que es de centro único. Sin embargo, el hecho de incluir un gran número de pacientes minimiza el impacto de dicha limitación.
ConclusiónLa aplicación de onabotulinumtoxina A mejora significativamente no solo los síntomas clínicos, sino también los parámetros urodinámicos en pacientes con VHI quienes han sido tratados inadecuadamente con anticolinérgicos. Esta es una técnica simple, con efectos adversos mínimos y generalmente bien tolerada. Se necesitan más investigaciones para concentrarse en el perfeccionamiento de los parámetros de inyección, como el número, el volumen y la profundidad de las inyecciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Mercedes Cano, enfermera de la Unidad de Urología Funcional del Hospital Universitario 12 de Octubre, por su ayuda en el protocolo y la realización de los estudios urodinámicos.