El schwannoma microquístico reticular (SMR) es una rara variante de schwannoma con predilección por el tracto gastrointestinal; es una neoplasia neural benigna sin potencial significativo de recurrencia. Microscópicamente exhibe un patrón de crecimiento microquístico y reticular de células fusiformes que se anastomosan y entrelazan alrededor de islas de estroma mixoide o colagenoso/hialinizado. La actividad mitótica es baja y no se observan atipia ni necrosis.
Por inmunohistoquímica expresa positividad nuclear y citoplásmica para S-100, con positividad variable para proteína fibrilar glial ácida (PGAF).
Los diagnósticos diferenciales incluyen el tumor del estroma gastrointestinal y el perineuroma, y en casos con morfología más epitelioide se deben considerar las neoplasias epiteliales.
Hasta la fecha los reportes de schwannoma microquístico reticular son pocos, por ello presentamos 2 casos, el primero en el intestino delgado y el segundo en el mesoapéndice.
Reticular microcystic schwannoma (RMS) is a rare variant of schwannoma found most frequently in the gastrointestinal tract; it is a benign neural neoplasm with a low rate of recurrence. Microscopically, it shows a striking microcystic and reticular lesional growth pattern with anastomosing and interlacing strands of spindle cells around islands of myxoid or collagenous/hyalinized stroma. Mitotic activity is low and both atypia and necrosis are absent.
Immunohistochemically, there is a strong nuclear and cytoplasmic positivity for S-100 and a variably strong glial fibrillary acidic protein staining (GFAP).
Differential diagnoses include gastrointestinal stromal tumour, perineurioma and, in cases with epithelioid morphology, epithelial neoplasms should be considered.
There are few reported cases to date. We present 2 cases, one in small bowel and the other in mesoappendix.
El schwannoma es un tumor de la vaina nerviosa, encapsulado, generalmente esporádico, solitario y no recurrente; afecta a todas las edades, pero es más común entre los 20 y los 50 años, sin predilección por ningún sexo1.
Los schwannomas presentan una amplia distribución anatómica, preferentemente por la cabeza, el cuello y las superficies flexoras de las extremidades superiores e inferiores1,2. Los schwannomas del tracto gastrointestinal son infrecuentes, con localización en el estómago y rara vez en el colon y el recto2,3.
Las variantes morfológicas incluyen el schwannoma anciano, el celular, el plexiforme, el melanocítico, el epitelioide y el híbrido (con neurofibroma o perineuroma)1,2,4.
En el año 2008, Liegl et al.2 describieron una variante clinicopatológica e inmunofenotípica de schwannoma con una morfología predominantemente microquística/reticular en el tracto gastrointestinal, el tracto respiratorio superior, la glándula adrenal, el brazo y la espalda, en una serie de casos en los que lo denominaron schwannoma microquístico reticular (SMR).
Desde entonces hubo pocos reportes de casos de localización visceral4–7, por cuya razón presentamos los siguientes casos.
Caso clínico 1Paciente varón de 67 años, presentó un cuadro de suboclusión intestinal, por lo que fue sometido a laparotomía exploratoria. Los hallazgos operatorios fueron 2 lesiones tumorales, una en el recto, que resultó ser un lipoma, y otra en el intestino delgado.
La lesión del intestino delgado correspondió a un tumor polipoide, submucoso, indurado, pardo blanquecino, y midió 1,6×1,3×1,0cm.
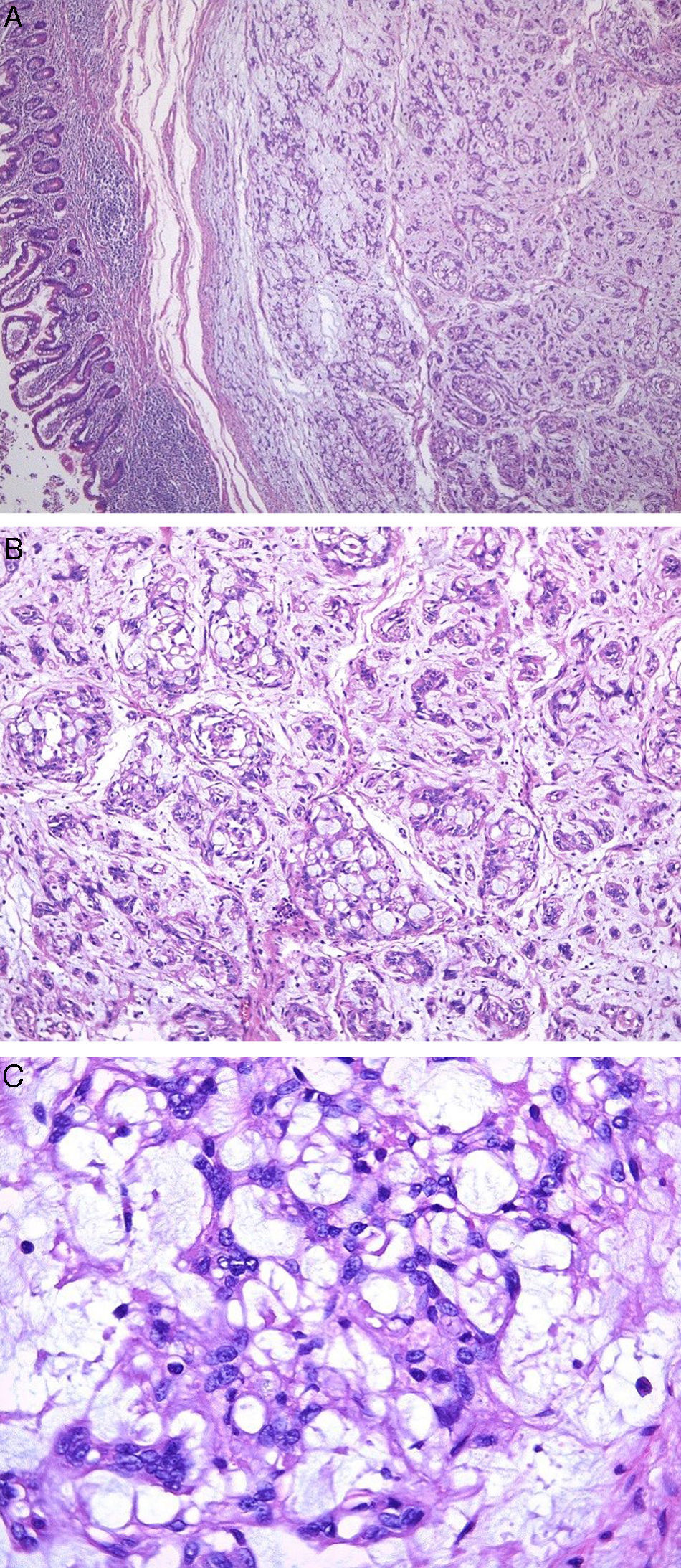
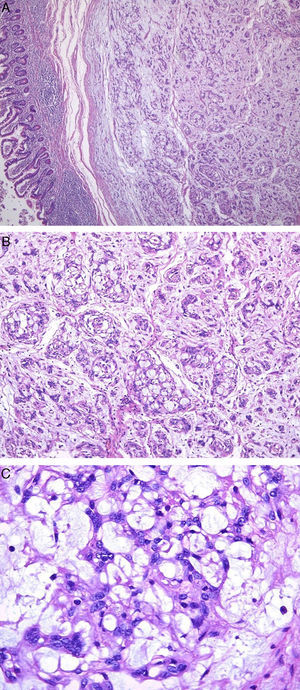
Microscópicamente se observó un nódulo submucoso, bien circunscrito, no encapsulado, con un llamativo patrón de crecimiento microquístico y reticular con filas de células fusiformes que se anastomosaban y entrecruzaban unas con otras, en un estroma mixoide y colagenoso, con predominio del primero.
Las células neoplásicas se caracterizaban por presentar bordes mal definidos, con citoplasma eosinófilo. Los núcleos eran redondos a ovales con nucléolos pequeños. No se observó atipia, mitosis ni necrosis (fig. 1).
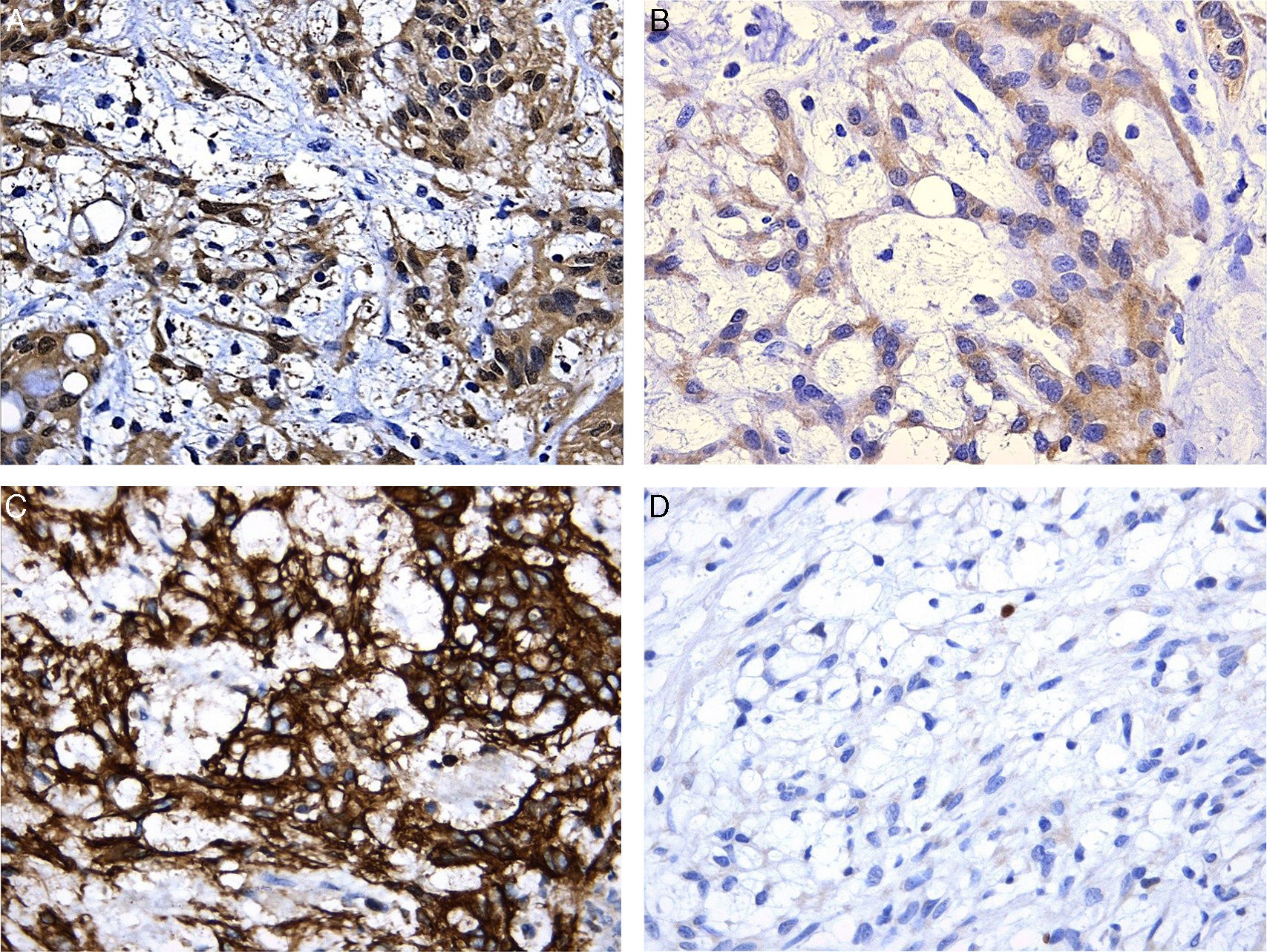
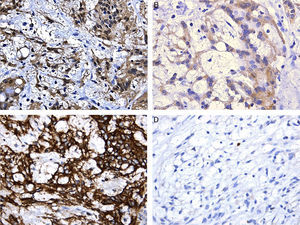
Los estudios complementarios de inmunohistoquímica revelaron expresión nuclear y citoplásmica para la proteína S-100 y tinción citoplásmica para proteína fibrilar glial ácida (PGAF), así como también para CD56; fueron negativos para panqueratina, CD117 y alfa-actina, y el índice proliferativo evaluado con Ki67 fue bajo, menor al 1% (fig. 2).
Caso clínico 2Varón de 63 años, quien presentó un cuadro clínico de 2 días de evolución caracterizado por dolor abdominal en fosa iliaca derecha tipo cólico, fiebre, vómitos e hiporexia; en el examen clínico preferencial fueron positivos el punto de McBurney y el signo de Blumberg; con el diagnóstico de apendicitis aguda complicada fue sometido a laparotomía exploratoria. Dentro de los hallazgos operatorios se evidenció una masa sólida bien circunscrita en la región distal del mesoapéndice. Los hallazgos macroscópicos correspondieron a una tumoración sólida, que midió 2,3×2,0×1,8cm, de consistencia gelatinosa y color pardo claro; el apéndice cecal midió 6,0cm de longitud y 3,5cm de diámetro, con serosa irregular, color gris y áreas hemorrágicas; ambos tenían adherencias fibrinoides en toda su extensión.
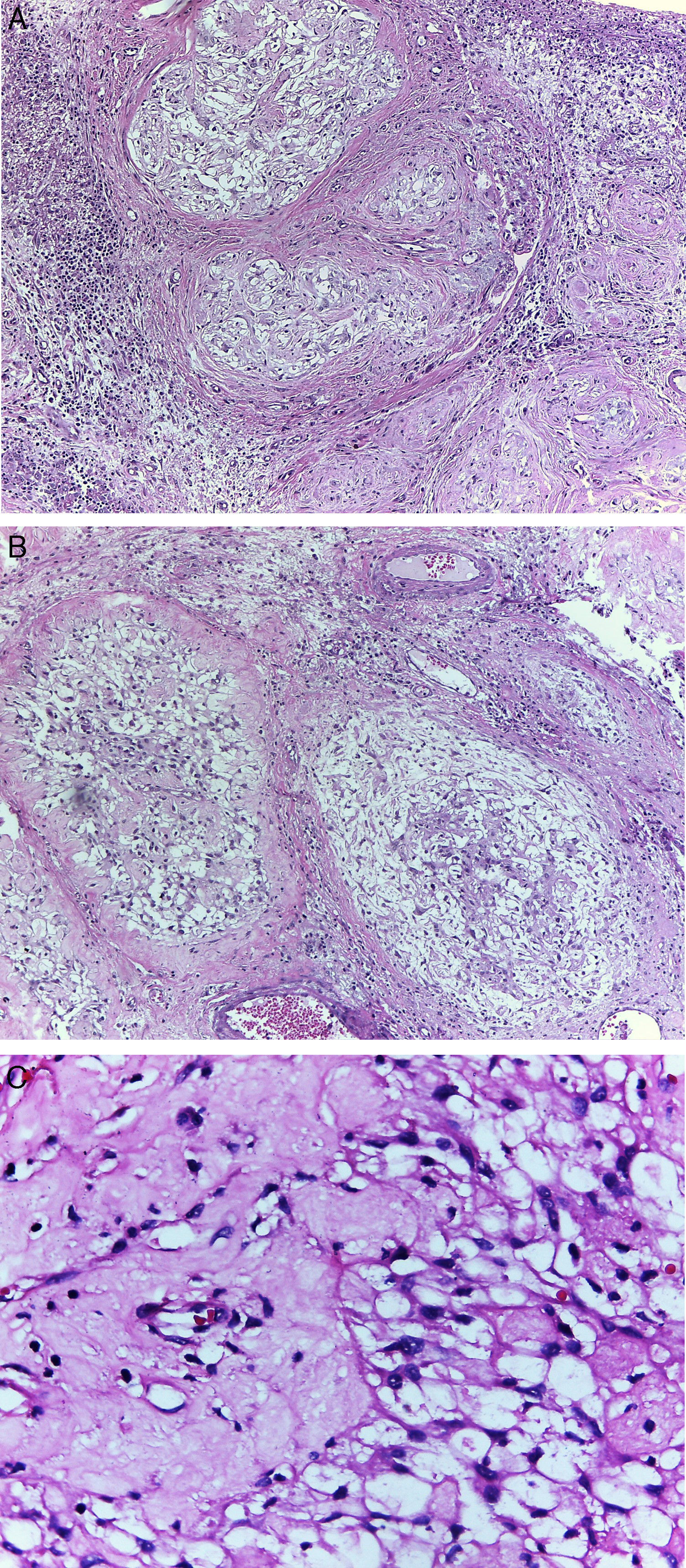
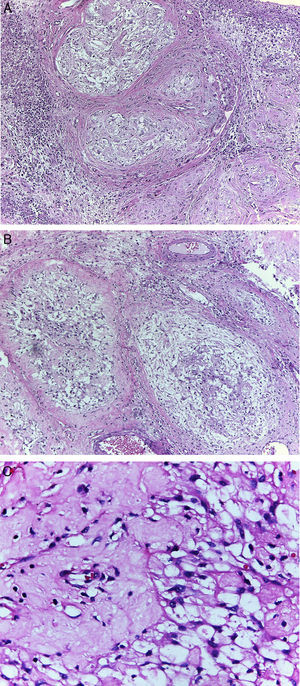
Microscópicamente, el tumor presentó un patrón multinodular, bien circunscrito, no encapsulado, constituido por células fusiformes que en algunas áreas se entrelazan, inmersas en un estroma colagenoso/hialinizado, dando el aspecto de encaje, y otras, con áreas mixoides. Dichas células tumorales presentaron un amplio citoplasma eosinófilo y núcleos redondos a ovales, con nucléolos inconspicuos. Los nódulos estaban rodeados por infiltrado inflamatorio agudo y crónico; además, se evidenció una periapendicitis aguda (fig. 3).
Caso clínico 2. A: tumor multinodular, con patrón de crecimiento reticular, rodeado por infiltrado inflamatorio (H-E, ×100). B: patrón de crecimiento reticular y áreas de aspecto mixoide (H-E, ×100). C: células fusiformes con núcleos redondos a ovales y amplio citoplasma eosinófilo, inmersos en abundante estroma colagenoso (H-E, ×400).
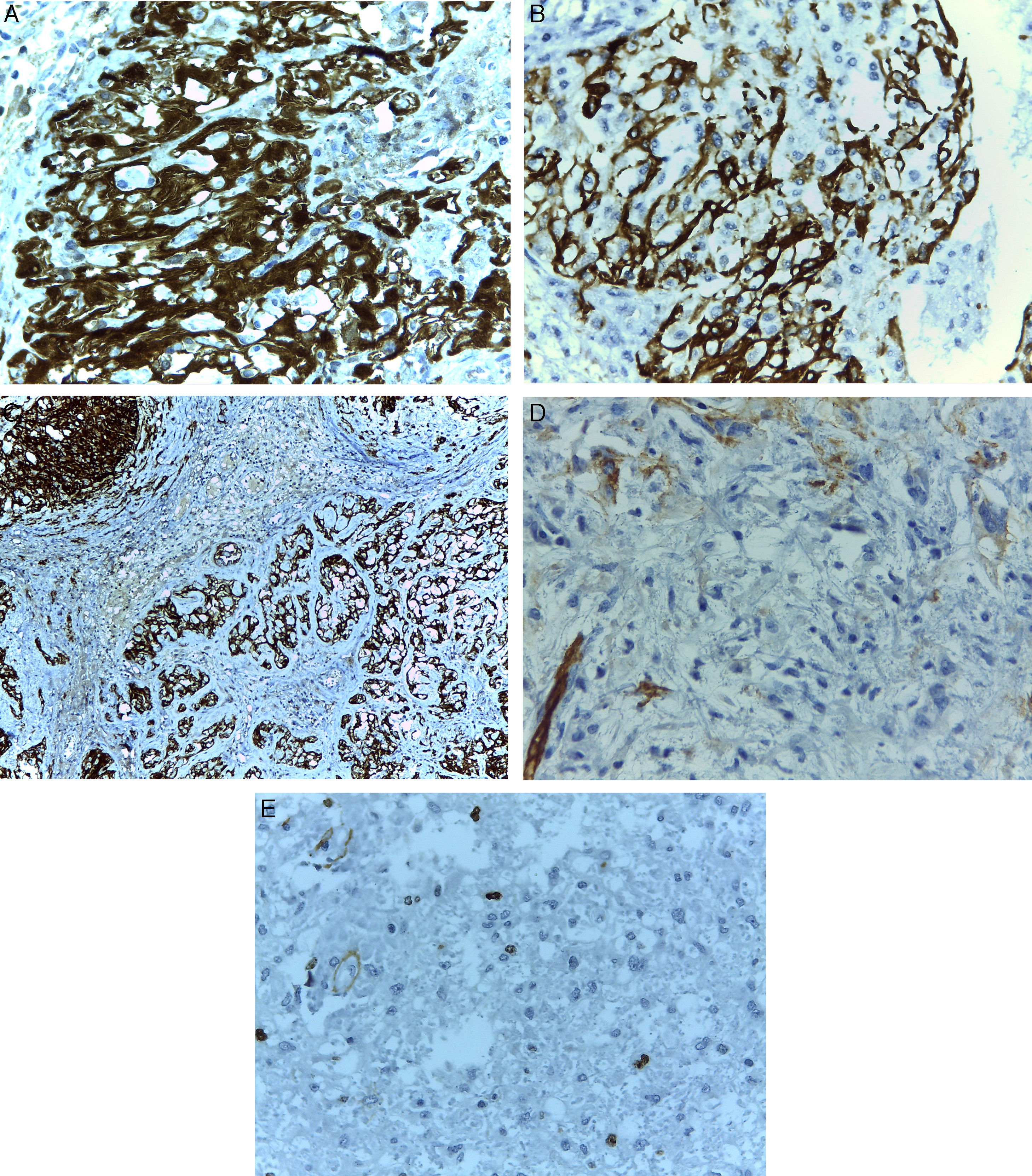
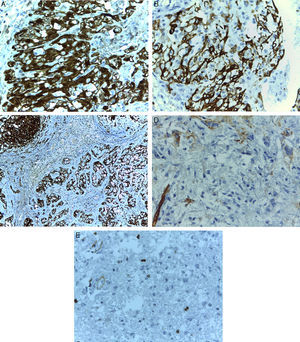
Las células tumorales mostraron positividad para PGAF y CD56, tinción nuclear y citoplásmica intensa para proteína S-100, expresión parcial para CD34 y negatividad para CD117, alfa-actina y panqueratina. El índice proliferativo evaluado con Ki 67 fue del 8% (fig. 4).
DiscusiónLos SMR son tumores benignos, no recurrentes, asintomáticos y con un tamaño promedio de 4,3cm, usualmente de localización submucosa en el tracto gastrointestinal2. Para Trivedi y Ligato3, esta variante es más común en el intestino que en el estómago.
En el año 2008, Liegl et al.2 describieron por primera vez estas lesiones con un característico patrón de crecimiento reticular y microquístico, con filas de células fusiformes que se anastomosan y entrecruzan en un estroma mixoide a colagenoso con células inflamatorias escasas. Las células neoplásicas son poco definidas, con citoplasma eosinófilo y núcleo redondo u ovalado, con nucléolo inconspicuo. Los SMR presentan buena circunscripción, pero pueden atrapar a las glándulas o criptas existentes con infiltración focal de la muscular de la mucosa.
Estos tumores muestran positividad intensa nuclear y citoplásmica para proteína S-100 y expresión variable para PGAF2,5.
Los casos que presentamos corresponden a 2 pacientes del sexo masculino cuyas edades son 67 y 63 años, con tumores localizados en el intestino delgado y el mesoapéndice, respectivamente, mientras que los casos presentados por Liegl et al.2 corresponden en su mayoría a pacientes del sexo femenino, con una edad media de 63 años; de los 10 casos reportados, 5 se localizaban en el tracto gastrointestinal: fondo gástrico (uno), yeyuno/intestino delgado (2), ciego (uno) y recto (uno).
Por lo general, estos tumores han sido descritos como asintomáticos, pero los 2 casos que reportamos fueron catalogados como abdomen agudo quirúrgico.
Las características macroscópicas, histológicas e inmunofenotípicas son similares a las descritas en la literatura; adicionalmente, y a diferencia de lo reportado uno de nuestros casos, tuvo expresión parcial de CD34. Han transcurrido más de 4 y 3 años, respectivamente, y hasta la fecha no hay recurrencia de la enfermedad.
Los diagnósticos diferenciales que se deben tener presente son: schwannoma «clásico» gastro/colorrectal, tumor del estroma gastrointestinal, perineuroma intestinal y tumor mioepitelial, entre otros.
Los schwannomas gástricos y colorrectales son infrecuentes en nuestra institución; corresponden a neoplasias fusocelulares no encapsuladas, que carecen de las características zonas Antoni A, Antoni B y cuerpos de Verocay. La mayoría de estos tumores están rodeados por un prominente infiltrado linfoplasmocitario, incluyendo la formación de centros germinales.
Los tumores del estroma gastrointestinal son las neoplasias mesenquimales más frecuentes a nivel gastrointestinal; están compuestos de células fusiformes, epitelioides, o de tipo mixto; la arquitectura excepcionalmente puede ser microquística. El diagnóstico se confirma con estudios de inmunohistoquímica, siendo positivos para DOG1 y/o CD117; la mayoría expresa CD34, siendo negativo en los schwannomas del tracto gastrointestinal3. Sin embargo, hasta un 4% de los tumores del estroma gastrointestinal no muestran expresión para CD1172,8. La positividad intensa y difusa para S-100 en los schwannomas ayuda en el diagnóstico diferencial.
Los perineuromas intestinales son neoplasias infrecuentes, están constituidos por una población de células fusiformes y monomorfas, con abundante citoplasma eosinófilo y núcleo ovoide o elongado, dispuestas en un fondo de estroma colagenoso3. Por inmunohistoquímica estos tumores expresan EMA, Claudina 1 y transportador de glucosa 1, y son negativos para S-100 y PGAF8.
Los tumores mioepiteliales microscópicamente están constituidos por células fusiformes, plasmocitoides y/o epitelioides que forman nidos, cordones y raramente pueden tener un patrón microquístico, reticular y glandular, inmersos en un estroma condromixoide/colagenoso/hialino. Los tumores con leve atipia son de bajo grado (mioepitelioma o tumor mixto), mientras que los tumores con moderada a severa atipia son de alto grado (carcinoma mioepitelial o tumor mixto maligno). Por inmunohistoquímica todos son reactivos para marcadores epiteliales (queratina y/o EMA); también son positivos para S-100 (87%), calponina (86%) y PGAF (46%)9. La proteína S-100 y PGAF en estas circunstancias no distinguen entre los SMR y los tumores mioepiteliales10.
En las biopsias obtenidas del tracto gastrointestinal, la matriz mixoide en combinación con estructuras microquísticas pueden simular pequeñas estructuras tubulares infiltrantes, o células en anillo de sello, pudiendo, por lo tanto, causar confusión con un carcinoma mucinoso. La ausencia de atipia nuclear y la negatividad para citoqueratina permite su distinción3. Además de las enfermedades mencionadas se debe tener en cuenta el pólipo fibroso inflamatorio, tumor localizado con mayor frecuencia en el estómago, pero que también se presenta en el intestino delgado, dando lugar esporádicamente a invaginaciones intestinales. Al igual que su homólogo gástrico, está compuesto por células fusiformes, uniformes, con rica vascularización, que si llega a tener una matriz edematosa puede semejar un liposarcoma, pero a diferencia de este, presenta numerosos eosinófilos y carece de lipoblastos11.
En resumen, describimos 2 casos de SMR en intestino delgado y mesoapéndice, con cursos clínicos aparentemente benignos en pacientes de 67 y 63 años, respectivamente, como una variante morfológica de schwannoma con predilección por localizaciones viscerales poco frecuentes.
La observación de un patrón de crecimiento microquístico/reticular de células fusiformes anastomosadas y entrelazadas entre sí, inmersas en un estroma mixoide/colagenoso, asociado a una expresión intensa de proteína S-100, expresión variable para PGAF, con negatividad para DOG1, EMA, queratinas y marcadores musculares, nos debería orientar al diagnóstico de esta entidad, sobre todo en las muestras obtenidas de biopsias quirúrgicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.