El tumor miofibroblástico angiomixoide plexiforme o fibromixoma plexiforme es una neoplasia mesenquimal benigna, rara, recientemente descrita, que afecta al antro gástrico. Histológicamente presenta crecimiento plexiforme y está compuesta por células fibro/miofibroblásticas en un estroma mixoide, variable, con marcada trama capilar. En el presente artículo llevamos a cabo una revisión de la literatura y aportamos 2 casos adicionales en pacientes jóvenes (36 y 46 años) que consultaron por molestias gástricas inespecíficas y hemorragia digestiva alta. Ambas lesiones estaban situadas en la submucosa y en la capa muscular propia y presentaban un patrón de crecimiento plexiforme. Las células tumorales eran fusiformes y se disponían en el seno de una matriz mixoide abundante. La vascularización estaba constituida por numerosos vasos de pared fina y pequeño calibre. Con las técnicas de inmunohistoquímica, las células tumorales fueron positivas para actina de músculo liso, vimentina, caldesmón y desmina (un caso) y negativas para CD117, DOG1, EMA, S100, β-catenina y CD34. El estudio molecular no detectó mutaciones en los genes KIT y PDGFRA, en ninguno de los 2 casos. Hasta la fecha (4 años y 8 meses), ninguno de los pacientes ha desarrollado recidivas ni metástasis.
El diagnóstico diferencial incluye una gran variedad de lesiones mixoides que pueden asentar o invadir la pared del estómago (GIST, tumor desmoide intraabdominal, pólipo fibroide inflamatorio, leiomioma-leiomiosarcoma, perineuroma, schwannoma y neurofibroma), pero solo el neurofibroma plexiforme comparte su característico patrón de crecimiento.
Aunque en la revisión de la literatura hemos encontrado un total de 23 casos bajo la denominación de tumor gástrico miofibroblástico angiomixoide plexiforme o fibromixoma plexiforme, también hemos advertido que antes de la introducción de estos términos se habían descrito lesiones gástricas mixoides semejantes, no muy bien caracterizadas, que comparten mayoritariamente la localización antral gástrica, por lo que cabría especular sobre la posible existencia de una misma entidad con variable grado de diferenciación fibro/miofibroblástica y de patrón plexiforme, desarrollada probablemente en una población celular limitada exclusivamente al estómago.
Plexiform, angiomyxoid myofibrobastic tumour, or plexiform fibromyoma, is a rare, recently described, benign neoplasm that affects the gastric antrum. Histologically the tumour has a plexiform growth pattern and is composed of fibro/myofibroblastic cells in a variable mixed stroma with a prominent capillary network. We have reviewed the literature and present 2 further cases occurring in young patients (36 and 46 years of age) who presented with gastric discomfort and upper gastrointestinal bleeding. Both lesions were located in the submucosa and muscularis and showed a plexiform growth pattern. Fusiform cells were found in an abundant myxoid extracellular matrix. Numerous small fine-walled blood vessels were present. Immunohistochemistry revealed positivity for smooth muscle actin, vimentin, h-caldesmon and desmin (in one case) and negativity for CD117, DOG1, EMA, S100, β-catenin and CD34. Molecular studies showed no mutations in the KIT and PDGFRA genes in either case. To date, neither of the patients has recurrences or metastases, 4 years and 8 months after diagnosis.
Differential diagnosis includes a wide variety of myxoid lesions that may arise in or invade the stomach wall (GIST, intraabdominal desmoid tumour, inflammatory fibroid polyp, leiomyoma-leiomyosarcoma, perineuroma, schwannoma and neurofibroma), among these, plexiform neurofibroma is the only one showing the characteristic growth pattern.
In our review of the literature, we found 23 cases described as gastric plexiform angiomyxoid myofibroblastic tumour, or gastric plexiform fibromyxoma. However, before the introduction of these terms, similar, if not completely characterized, gastric myxoid lesions had been described in the gastric antrum, suggesting that a single entity with a variable degree of fibro/myofibroblastic differentiation and a plexiform growth pattern might exist, perhaps developing in cells found only in the stomach.
Aunque la mayoría (95%) de las neoplasias mesenquimales gastrointestinales corresponden a tumores del estroma gastrointestinal (GIST) y de músculo liso, también se han descrito una gran variedad de otros tipos tumorales con muy baja incidencia, tales como schwannoma, tumor desmoide, tumor fibroso solitario, pólipo fibroide inflamatorio, tumor miofibroblástico inflamatorio, etc.1–3. El principal problema diagnóstico que presentan estas lesiones inusuales es su fácil confusión con determinados cuadros morfológicos de GIST, y especialmente con los GIST CD117-negativos y sin mutaciones en los genes KIT o PDGFRA (wtKIT/PDGFRA).
Recientemente se ha llamado la atención sobre una forma peculiar de neoplasia gástrica mesenquimal, de curso clínico benigno, diferenciación fibro/miofibroblástica y patrón de crecimiento plexiforme, que ha sido denominada con los términos descriptivos de tumor miofibroblástico angiomixoide plexiforme4 y fibromixoma plexiforme5. En el presente artículo describimos 2 nuevos casos de esta entidad y llevamos a cabo una revisión de la literatura sobre neoplasias mesenquimales mixoides del estómago.
Material y métodoCaso 1Varón de 36 años que consultó por pirosis. En la endoscopia gástrica se identificó una neoplasia submucosa situada en el antro que no ulceraba la superficie. En la TAC la tumoración se situaba en el espesor de la pared gástrica antral, tenía 6cm de diámetro máximo y protruía hacia la luz del estómago. El paciente fue intervenido con el diagnóstico de sospecha de GIST y se llevó a cabo una gastrectomía parcial. En la pieza quirúrgica la tumoración medía 6×3,5cm de diámetro, estaba recubierta por mucosa gástrica intacta y, al corte, tenía coloración blanquecina y consistencia firme.
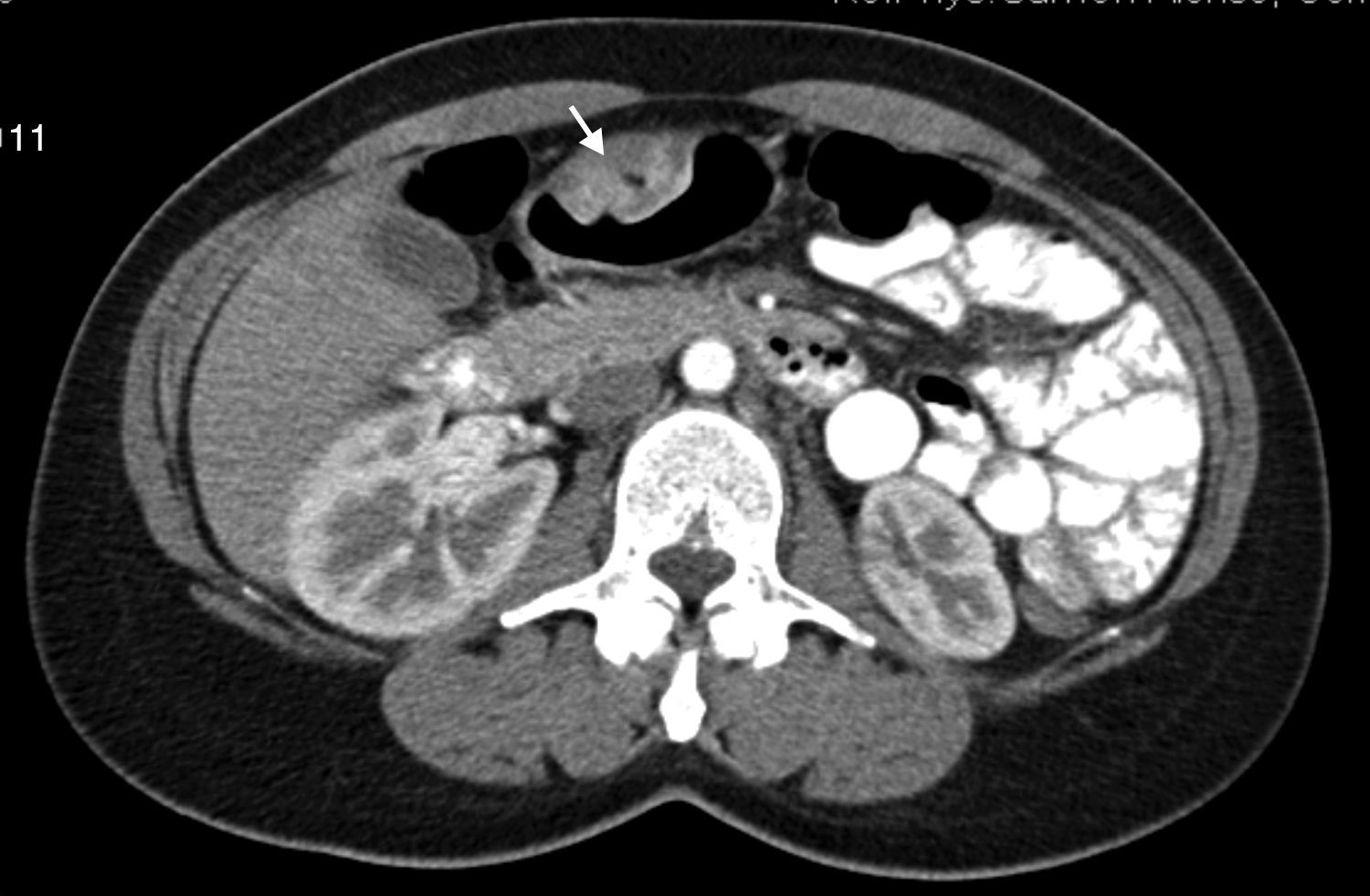
Caso 2Mujer de 46 años con hemorragia digestiva asociada a toma de AINE. En la gastroscopia se observaron 2 ulceraciones sobre una posible lesión submucosa antral. En el estudio de la TAC se confirmó la presencia de una masa neoplásica gástrica ulcerada (fig. 1). Se procedió a su extirpación mediante antrectomía. En la pieza quirúrgica se observó una zona ligeramente sobreelevada, con pequeñas ulceraciones de bordes netos, que, al corte, mostró un nódulo de 2,5×2cm, mal delimitado y de aspecto mixoide, situado en la submucosa.
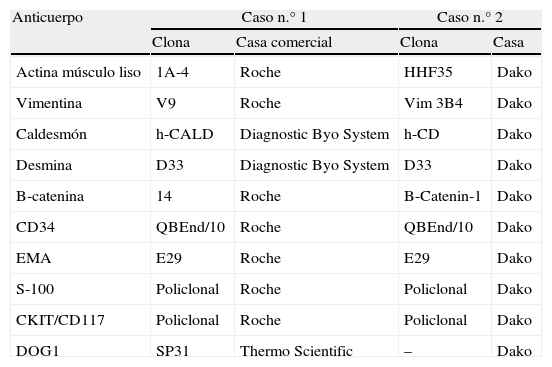
Las piezas quirúrgicas fueron rutinariamente fijadas en formol e incluidas en parafina. Se realizaron cortes de 4μm que fueron teñidos con hematoxilina-eosina, azul alcián y se empleó la técnica de inmunohistoquímica con el sistema automatizado de tinción Ventana BenchMark XT (Roche) y EnVision™ (DAKO). En la tabla 1 aparecen recogidos los anticuerpos primarios utilizados, con sus clones y casas suministradoras correspondientes.
Anticuerpos primarios utilizados, clones y casas suministradoras
| Anticuerpo | Caso n.° 1 | Caso n.° 2 | ||
| Clona | Casa comercial | Clona | Casa | |
| Actina músculo liso | 1A-4 | Roche | HHF35 | Dako |
| Vimentina | V9 | Roche | Vim 3B4 | Dako |
| Caldesmón | h-CALD | Diagnostic Byo System | h-CD | Dako |
| Desmina | D33 | Diagnostic Byo System | D33 | Dako |
| B-catenina | 14 | Roche | B-Catenin-1 | Dako |
| CD34 | QBEnd/10 | Roche | QBEnd/10 | Dako |
| EMA | E29 | Roche | E29 | Dako |
| S-100 | Policlonal | Roche | Policlonal | Dako |
| CKIT/CD117 | Policlonal | Roche | Policlonal | Dako |
| DOG1 | SP31 | Thermo Scientific | – | Dako |
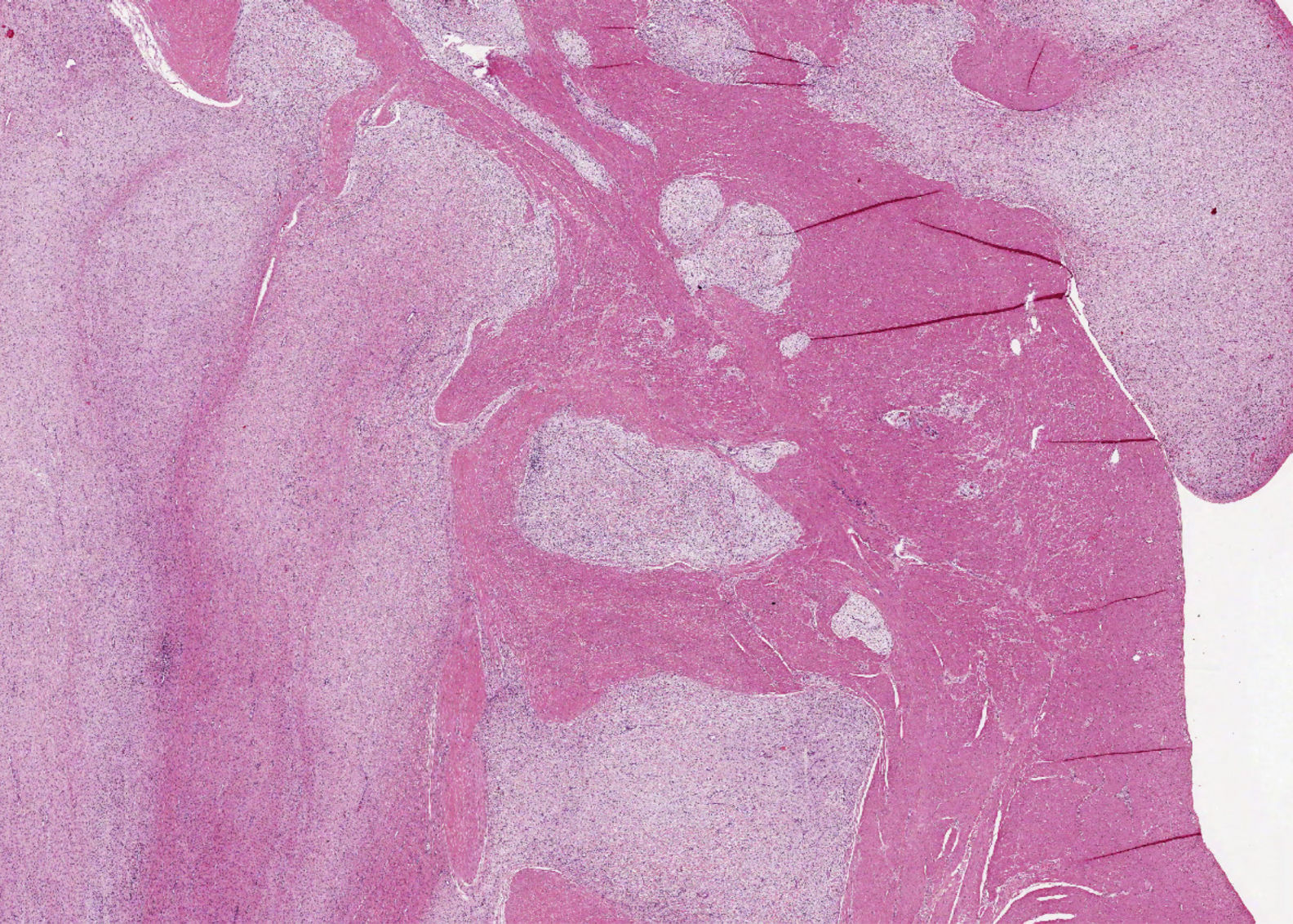
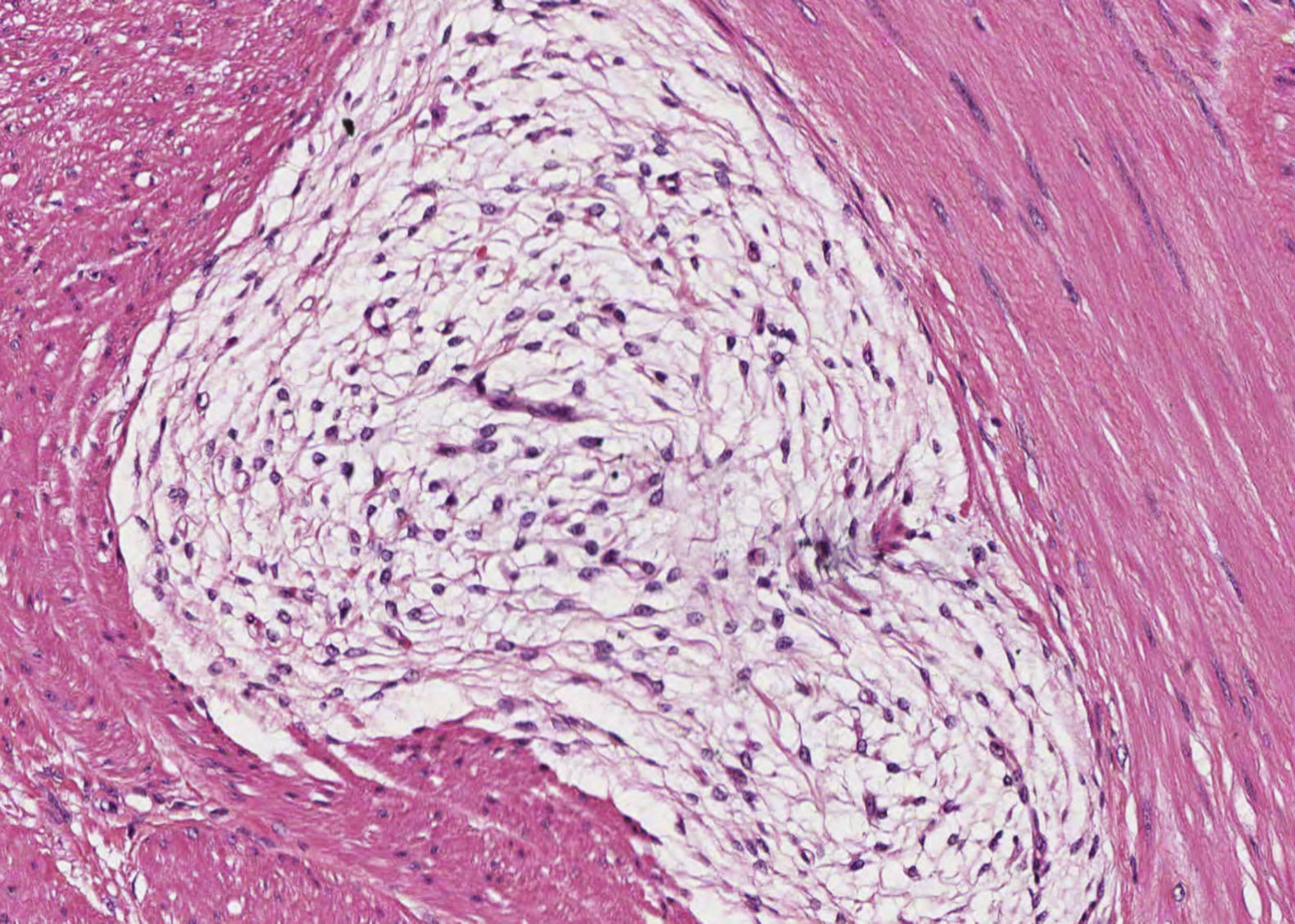
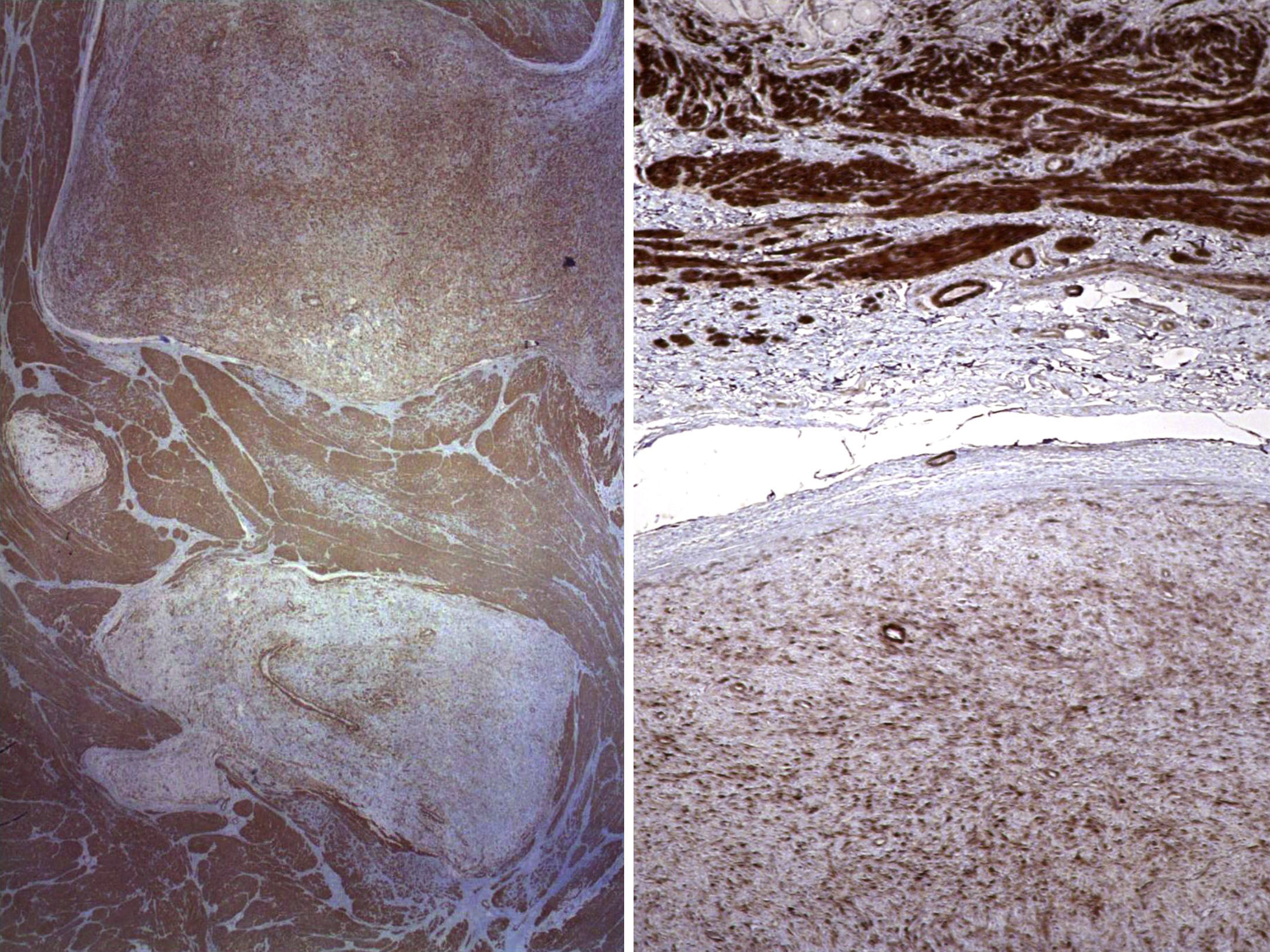
En ambos casos el cuadro histológico fue totalmente superponible. Se trataba de una lesión mesenquimal plexiforme con marcada tendencia a crecer entre los haces musculares (fig. 2). Las células proliferantes eran fusiformes, con escaso citoplasma eosinófilo y núcleo oval, y se encontraban inmersas en un estroma rico en matriz mixoide azul alcian-positivo (fig. 3). No se identificó atipia nuclear manifiesta, focos de necrosis ni actividad mitótica significativa. La vascularización estaba constituida por pequeños vasos capilares. En algunos territorios existían discretas variaciones de este patrón fundamental, incluyendo aumento de matriz colágena, celularidad poligonal e, incluso, discreta hipercelularidad. Con las técnicas de inmunohistoquímica, las células presentaban inmunorreacción positiva a la actina de músculo liso, vimentina, caldesmón y desmina (focal, en el segundo caso) y negativa a CD117, DOG1, CD34, EMA, S100 y β-catenina (fig. 4). La inmunorreacción al CD34 puso de manifiesto exclusivamente la trama capilar vascular. Se emitió el diagnóstico de fibromixoma plexiforme (tumor miofibroblástico plexiforme angiomixoide). El estudio molecular realizado en ambas lesiones no mostró alteración en los exones 9, 11, 13,17 del gen KIT ni en los exones 12 y 18 del gen PDGFRA. Tras la intervención ambos pacientes se encuentran libres de enfermedad (4 años y 8 meses, respectivamente).
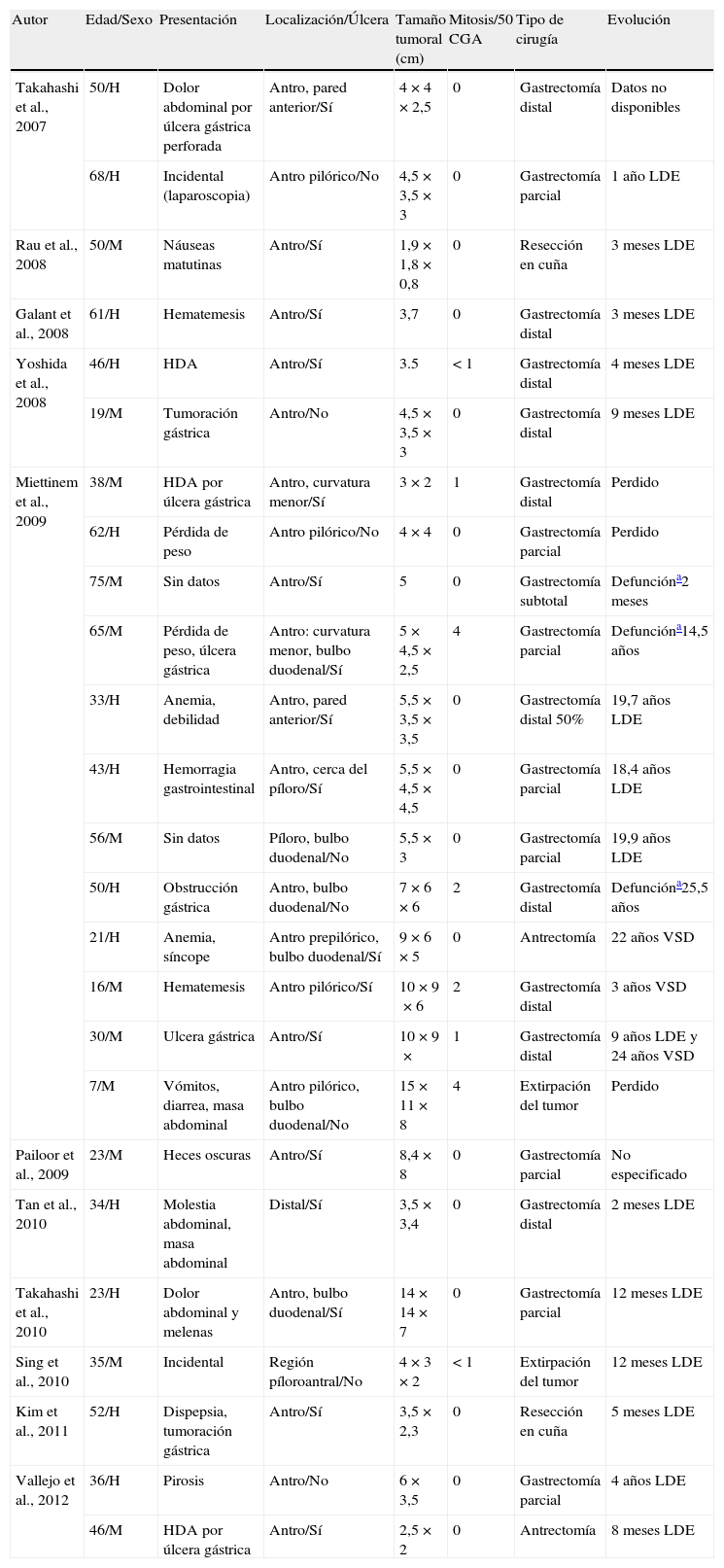
En 2007, Takahashi et al.4 introdujeron el término descriptivo de tumor miofibroblástico plexiforme angiomixoide para señalar una lesión mesenquimal gástrica benigna, situada en el antro y con posible extensión al bulbo duodenal, que presentaba como hallazgos fundamentales las características histológicas referidas. A partir de esta descripción inicial de 2 casos comenzaron a aparecer en la literatura publicaciones de lesiones morfológicamente superponibles6–13. En la tabla 2 se recogen las características clínicas y morfológicas más significativas de todos los casos publicados hasta la fecha. Son neoplasias propias de adultos de edad media (42,7 años; rango 7-75 años), sin distinción sexual, que asientan en el antro. Aunque la presentación clínica es muy heterogénea, la mayoría consultaron por hematemesis. Dos casos fueron hallazgos incidentales, uno de ellos a propósito de una colecistectomía. Todas las lesiones se localizaban en la submucosa y muscular propia con diámetro máximo medio de 5,9cm (1,9-15cm). Aunque en algunas lesiones5,6,11 se describen nódulos únicos o múltiples en la serosa, en ninguna se señala extensión o diseminación al peritoneo o epiplón. Es de señalar que hasta la fecha no se han descrito tumores de similares características en ninguna otra localización del tracto gastrointestinal, por lo que se ha sugerido un posible origen en una población celular limitada exclusivamente al estómago5. La mucosa gástrica adyacente a la tumoración estaba ulcerada en 17 casos. Morfológicamente, en todos los casos había buena delimitación, aunque con bordes imprecisos, y estaba compuesta por múltiples nódulos dispuestos en un patrón plexiforme. Es de destacar que los nódulos subserosos carecen de patrón plexiforme y muestran bordes con crecimiento expansivo. Los nódulos eran irregulares en tamaño y forma, y contenían escasas células fusiformes, abundante matriz mixoide y trama capilar prominente. En 4 casos se observó invasión intravascular, lo que sugiere que el tumor puede utilizar los vasos como una vía de diseminación dentro de la pared gástrica5. Las células proliferantes eran fusiformes con citoplasma eosinófilo y núcleo oval con discreta hipercromasia. Las figuras de mitosis estaban ausentes o eran muy poco frecuentes (<4/50CGA) y no existían focos de necrosis. Con las técnicas inmunohistoquímicas, las células expresaban actina de músculo liso (18/20, 90%), actina muscular específica (6/6, 100%), vimentina (1/1, 100%), y de modo focal caldesmón (4/4, 100%), calponina (2/2, 100%), desmina (14/17, 82.3%), CD10 (1/5, 20%) y receptor de progesterona (1/2, 50%)11. En todos los casos en que se estudió la expresión de CD117, CD34, DOG-1, S-100, PDGFRA, antígeno de membrana epitelial, β-catenina, ALK, neurofilamentos, NSE, citoqueratina, citoqueratina AE1-AE3, BCL-2, colágeno tipoIV, laminina y receptor de estrógenos, la inmunorreacción fue negativa. El índice de proliferación con el anticuerpo Ki-67 fue inferior al 2%. En algunos tumores se describen hallazgos adicionales, tales como depósitos de colágeno, especialmente en el centro de lo nódulos; mastocitos dispersos en el estroma; escasa infiltración de linfocitos, células plasmáticas y eosinófilos y células de bordes despuntados, con delgadas extensiones citoplásmicas eosinófilas, que recuerdan a las células de músculo liso.
Características clínicas y morfológicas
| Autor | Edad/Sexo | Presentación | Localización/Úlcera | Tamaño tumoral (cm) | Mitosis/50 CGA | Tipo de cirugía | Evolución |
| Takahashi et al., 2007 | 50/H | Dolor abdominal por úlcera gástrica perforada | Antro, pared anterior/Sí | 4×4×2,5 | 0 | Gastrectomía distal | Datos no disponibles |
| 68/H | Incidental (laparoscopia) | Antro pilórico/No | 4,5×3,5×3 | 0 | Gastrectomía parcial | 1 año LDE | |
| Rau et al., 2008 | 50/M | Náuseas matutinas | Antro/Sí | 1,9×1,8×0,8 | 0 | Resección en cuña | 3 meses LDE |
| Galant et al., 2008 | 61/H | Hematemesis | Antro/Sí | 3,7 | 0 | Gastrectomía distal | 3 meses LDE |
| Yoshida et al., 2008 | 46/H | HDA | Antro/Sí | 3.5 | < 1 | Gastrectomía distal | 4 meses LDE |
| 19/M | Tumoración gástrica | Antro/No | 4,5×3,5×3 | 0 | Gastrectomía distal | 9 meses LDE | |
| Miettinem et al., 2009 | 38/M | HDA por úlcera gástrica | Antro, curvatura menor/Sí | 3×2 | 1 | Gastrectomía distal | Perdido |
| 62/H | Pérdida de peso | Antro pilórico/No | 4×4 | 0 | Gastrectomía parcial | Perdido | |
| 75/M | Sin datos | Antro/Sí | 5 | 0 | Gastrectomía subtotal | Defuncióna2 meses | |
| 65/M | Pérdida de peso, úlcera gástrica | Antro: curvatura menor, bulbo duodenal/Sí | 5×4,5×2,5 | 4 | Gastrectomía parcial | Defuncióna14,5 años | |
| 33/H | Anemia, debilidad | Antro, pared anterior/Sí | 5,5×3,5×3,5 | 0 | Gastrectomía distal 50% | 19,7 años LDE | |
| 43/H | Hemorragia gastrointestinal | Antro, cerca del píloro/Sí | 5,5×4,5×4,5 | 0 | Gastrectomía parcial | 18,4 años LDE | |
| 56/M | Sin datos | Píloro, bulbo duodenal/No | 5,5×3 | 0 | Gastrectomía parcial | 19,9 años LDE | |
| 50/H | Obstrucción gástrica | Antro, bulbo duodenal/No | 7×6×6 | 2 | Gastrectomía distal | Defuncióna25,5 años | |
| 21/H | Anemia, síncope | Antro prepilórico, bulbo duodenal/Sí | 9×6×5 | 0 | Antrectomía | 22 años VSD | |
| 16/M | Hematemesis | Antro pilórico/Sí | 10×9×6 | 2 | Gastrectomía distal | 3 años VSD | |
| 30/M | Ulcera gástrica | Antro/Sí | 10×9× | 1 | Gastrectomía distal | 9 años LDE y 24 años VSD | |
| 7/M | Vómitos, diarrea, masa abdominal | Antro pilórico, bulbo duodenal/No | 15×11×8 | 4 | Extirpación del tumor | Perdido | |
| Pailoor et al., 2009 | 23/M | Heces oscuras | Antro/Sí | 8,4×8 | 0 | Gastrectomía parcial | No especificado |
| Tan et al., 2010 | 34/H | Molestia abdominal, masa abdominal | Distal/Sí | 3,5×3,4 | 0 | Gastrectomía distal | 2 meses LDE |
| Takahashi et al., 2010 | 23/H | Dolor abdominal y melenas | Antro, bulbo duodenal/Sí | 14×14×7 | 0 | Gastrectomía parcial | 12 meses LDE |
| Sing et al., 2010 | 35/M | Incidental | Región píloroantral/No | 4×3×2 | < 1 | Extirpación del tumor | 12 meses LDE |
| Kim et al., 2011 | 52/H | Dispepsia, tumoración gástrica | Antro/Sí | 3,5×2,3 | 0 | Resección en cuña | 5 meses LDE |
| Vallejo et al., 2012 | 36/H | Pirosis | Antro/No | 6×3,5 | 0 | Gastrectomía parcial | 4 años LDE |
| 46/M | HDA por úlcera gástrica | Antro/Sí | 2,5×2 | 0 | Antrectomía | 8 meses LDE |
LDE: libre de enfermedad; HDA: hemorragia digestiva alta; VSD: vive, status de la enfermedad desconocido.
Teniendo en cuenta estas características morfológicas y biológicas, esta lesión se ha considerado como una neoplasia benigna de estirpe fibro/miofibroblástica, pero existen discrepancias acerca del término más apropiado para su denominación. Miettinen et al.5, teniendo en cuenta la variabilidad en el contenido de matriz mixoide, prefieren el término alternativo de fibromixoma plexiforme. En nuestros casos, aunque predominaban las áreas mixoides, también encontramos nódulos con depósito de cantidades notables de colágeno, por lo que consideramos esta última denominación como más idónea.
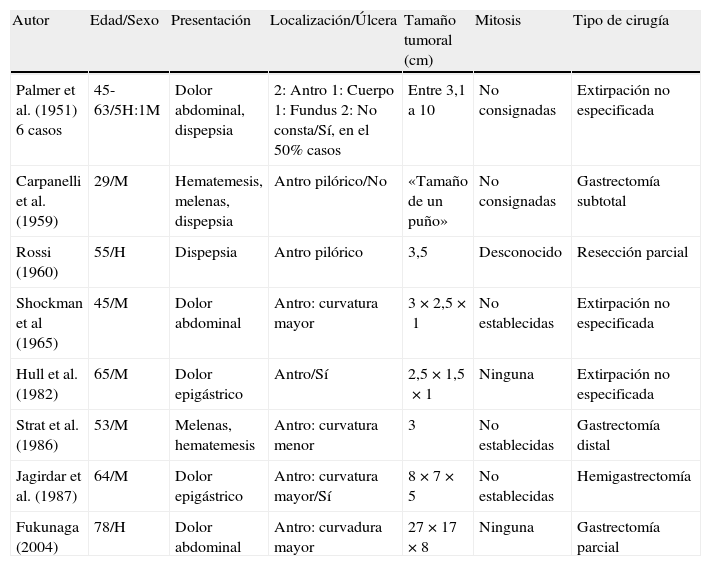
En la literatura previa a la publicación de Takahashi et al.4 hemos encontrado varias publicaciones14–21 y comentarios22 sobre la existencia de mixomas, fibromixomas y fibroangiomixomas en la pared del estómago, con comportamiento biológico benigno, sin que se especifique un patrón de crecimiento plexiforme. No obstante, la escasa precisión en las descripciones histológicas, conjuntamente con la ausencia de estudios inmunohistoquímicos o ultraestructurales completos y moleculares, no permiten descartar definitivamente un GIST mixoide ni afirmar que estemos ante el mismo tipo lesional; no obstante, es de destacar que la gran mayoría de estas lesiones mixoides compartían la misma localización gástrica antral (tabla 3), por lo que se podría especular que se podría tratar de la misma entidad con variable grado de diferenciación fibro/miofibroblástica y patrón plexiforme. La serie de lesiones mixoides más extensa es la aportada por Palmer17, que describe 6 lesiones gástricas, pero dada la escasez de datos histológicos, no podemos confirmar que estemos ante casos semejantes a la entidad que nos estamos refiriendo.
Lesiones mixoides
| Autor | Edad/Sexo | Presentación | Localización/Úlcera | Tamaño tumoral (cm) | Mitosis | Tipo de cirugía |
| Palmer et al. (1951) 6 casos | 45-63/5H:1M | Dolor abdominal, dispepsia | 2: Antro 1: Cuerpo 1: Fundus 2: No consta/Sí, en el 50% casos | Entre 3,1 a 10 | No consignadas | Extirpación no especificada |
| Carpanelli et al. (1959) | 29/M | Hematemesis, melenas, dispepsia | Antro pilórico/No | «Tamaño de un puño» | No consignadas | Gastrectomía subtotal |
| Rossi (1960) | 55/H | Dispepsia | Antro pilórico | 3,5 | Desconocido | Resección parcial |
| Shockman et al (1965) | 45/M | Dolor abdominal | Antro: curvatura mayor | 3×2,5×1 | No establecidas | Extirpación no especificada |
| Hull et al. (1982) | 65/M | Dolor epigástrico | Antro/Sí | 2,5×1,5×1 | Ninguna | Extirpación no especificada |
| Strat et al. (1986) | 53/M | Melenas, hematemesis | Antro: curvatura menor | 3 | No establecidas | Gastrectomía distal |
| Jagirdar et al. (1987) | 64/M | Dolor epigástrico | Antro: curvatura mayor/Sí | 8×7×5 | No establecidas | Hemigastrectomía |
| Fukunaga (2004) | 78/H | Dolor abdominal | Antro: curvadura mayor | 27×17×8 | Ninguna | Gastrectomía parcial |
El diagnóstico diferencial del fibromixoma plexiforme hay que establecerlo principalmente con otras lesiones mesenquimales primarias de la pared gástrica que puedan contener matriz mixoide, tales como: GIST, tumor desmoide intraabdominal, pólipo fibroide inflamatorio, leiomioma-leiomiosarcoma, perineuroma, schwannoma y neurofibroma2,3. En la diferenciación de estas lesiones hay que tener en consideración 3 aspectos: patrón de crecimiento plexiforme, celularidad e inmunofenotipo. En la pared del estómago, el patrón de crecimiento plexiforme se describe también en el tumor glómico y en el neurofibroma plexiforme. El tumor glómico se diferencia del fibromixoma plexiforme por carecer de matriz mixoide y estar compuesto por células poligonales, dispuestas en grupos, que expresan actina de músculo liso23. Los neurofibromas plexiformes en el tubo digestivo generalmente se observan en el contexto de una neurofibromatosis tipo I y están compuestos por células de Schwann (S100-positivas), fibroblastos (CD34-positivas) y, en menor medida, por células perineurales (EMA-positivas) en el seno de una matriz abundante mixoide o mixo-colágena24. Las otras neoplasias señaladas pueden presentar matriz mixoide pero carecen de patrón plexiforme propiamente dicho, y su perfil inmunohistoquímico es diferente. Los GIST pueden presentar crecimiento multinodular, estar compuestos por células fusiformes, poligonales o de ambos tipos, y expresan inmunorreacción al CD117 y/o DOG-1 o bien presentan mutaciones en el gen KIT o PDGFRA1. El pólipo fibroide inflamatorio está compuesto por células fusiformes que tienden a disponerse concéntricamente alrededor de los vasos que muestran inmunorreacción positiva al CD34 y mutaciones en los exones 12 y 18 del gen PDGFRA25; además contienen abundante infiltrado inflamatorio linfocitario y eosinofílico. Los leiomiomas y leiomiosarcomas mixoides en el tubo digestivo son excepcionales y, a diferencia de los fibromixomas plexiformes, las células se disponen en fascículos, tienen núcleos elongados con extremos romos y citoplasma eosinófilo y fibrilar, y expresan actina de músculo liso y desmina26,27. El tumor desmoide abdominal se desarrolla en el mesenterio y secundariamente infiltra la pared del tubo digestivo, y aunque estas lesiones pueden tener matriz mixoide, presentan crecimiento infiltrativo, marcada tendencia a la recidiva y las células expresan actina de músculo liso y β-catenina28,29. Por último, el tumor miofibroblástico inflamatorio también se desarrolla en la cavidad abdominal y secundariamente afecta la pared del tubo digestivo. Aunque en algunas lesiones la matriz mixoide puede ser acusada y las células tumorales presentan inmunorreacción positiva a la actina de músculo liso, tienen mayor grado de atipia nuclear y con frecuencia expresan inmunorreacción positiva al ALK30; además, generalmente se presentan en gente joven.
En resumen, aunque en los casos que presentamos predominan las áreas mixoides, también existen territorios con mayor depósito de colágeno, por lo que consideramos que el término más apropiado es el de fibromixoma plexiforme. Con independencia del término utilizado, estas lesiones se caracterizan por asentar en el antro gástrico, presentar crecimiento plexiforme y estar compuestas por células fibro/miofibroblásticas con estroma mixoide variable y marcada trama capilar. Probablemente, algunas de las lesiones previamente descritas bajo los términos de mixoma, fibromixoma y angiomixoma gástricos representan la misma entidad, ya que tienen preferencia por el antro gástrico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.