Estudiar la correlación entre una imagen PET estática del primer minuto (FMF) adquirida con radiotrazadores de amiloide marcados con flúor-18 y la PET cerebral con [18F]FDG en pacientes con afasia primaria progresiva (APP).
Material y métodosLa cohorte de estudio incluyó a 17 pacientes diagnosticados de APP con la siguiente distribución: 9APP variante no fluente, 4APP variante logopénica, 1APP variante semántica, 3APP inclasificables. Se extrajeron los SUVR regionales de las FMF y sus correspondientes imágenes PET con [18F]FDG y se calcularon los coeficientes de correlación de Pearson.
ResultadosLos SUVR de ambas imágenes mostraron patrones similares de alteración cerebral regional. Los análisis de correlación intrapaciente dieron como resultado un coeficiente medio de r=0,94 ±0,06. Los coeficientes de correlación regional entre pacientes de la cohorte del estudio fueron superiores a 0,81. Las subcohortes específicas según el radiotrazador y la variante de APP no mostraron diferencias en la similitud de las imágenes.
ConclusionesLa FMF estática podría ser una alternativa válida a la PET dinámica de amiloide en fase inicial propuesta en la literatura, así como un biomarcador de neurodegeneración para el diagnóstico y la clasificación de la APP en los estudios de PET amiloide.
To study the correlation between a static PET image of the first-minute-frame (FMF) acquired with 18F-labeled amyloid-binding radiotracers and brain [18F]FDG PET in patients with primary progressive aphasia (PPA).
Material and methodsThe study cohort includes 17 patients diagnosed with PPA with the following distribution: 9nonfluent variant PPA, 4logopenic variant PPA, 1semantic variant PPA, 3unclassifiable PPA. Regional SUVRs are extracted from FMFs and their corresponding [18F]FDG PET images and Pearson's correlation coefficients are calculated.
ResultsSUVRs of both images show similar patterns of regional cerebral alterations. Intrapatient correlation analyses result in a mean coefficient of r=.94 ±.06. Regional interpatient correlation coefficients of the study cohort are greater than 0.81. Radiotracer-specific and variant-specific subcohorts show no difference in the similarity between the images.
ConclusionsThe static FMF could be a valid alternative to dynamic early-phase amyloid PET proposed in the literature, and a neurodegeneration biomarker for the diagnosis and classification of PPA in amyloid PET studies.
La afasia primaria progresiva (APP) es un síndrome neurológico caracterizado por el deterioro parcial o total de las funciones relacionadas con el lenguaje de forma secundaria a procesos neurodegenerativos1,2. Se trata de un síndrome heterogéneo, con diferentes causas neuropatológicas implicadas, y las características específicas del habla y el lenguaje definen el diagnóstico y la clasificación de dicho trastorno en las variantes no fluente/agramática (APPvnf), semántica (APPvs) y logopénica (APPvl), respectivamente3. En cuanto al tipo de neuropatología subyacente, la APPvnf suele estar relacionada con la degeneración lobar frontotemporal (DLFT) positiva para tau o para TDP-43, la APPvs se relaciona con la DLFT-TDP y la APPvl suele ser una presentación atípica de la enfermedad de Alzheimer (EA)3,4.
Debido a las alteraciones regionales específicas del metabolismo cerebral en este síndrome y al tipo de neuropatología subyacente, tanto los biomarcadores de imagen de neurodegeneración ([18F]fluorodesoxiglucosa PET [FDG]) como los biomarcadores de imagen de los procesos fisiopatológicos (PET con amiloide y tau) desempeñan un papel importante en su diagnóstico y clasificación5-8. En cuanto a los patrones de hipometabolismo, se ha demostrado que la APPvnf presenta alteraciones frontales, la APPvs en la región temporal anterior y la APPvl en la región témporoparietal4,5,9-11.
Las imágenes de PET amiloide adquiridas en fase precoz con un radiotrazador de unión a amiloide como son [18F]florbetapir (FBP), [18F]flutemetamol (FMM) o [18F]florbetaben (FBB) han demostrado su similitud con la PET con [18F]FDG12-20. Además, el protocolo en doble fase permite obtener a la vez información sobre la neurodegeneración y la carga amiloide, lo que también puede apoyar el diagnóstico diferencial de las variantes de la APP6. Si bien la principal aplicación de las imágenes de PET amiloide en fase precoz ha sido en el diagnóstico de la EA, también se ha evaluado su utilización en pacientes con demencia frontotemporal (DFT)14 o APP21.
En un estudio anterior hemos presentado la imagen del primer minuto (FMF) de la PET amiloide, una imagen estática similar a la perfusión adquirida durante el primer minuto tras de la inyección de un radiotrazador de unión a amiloide marcado con [18F]22. Se ha demostrado cuantitativamente su similitud con el patrón de referencia en la práctica clínica rutinaria, la PET con [18F]FDG, mostrando unos coeficientes de correlación elevados. La ventaja de la imagen propuesta estriba en el uso de una ventana temporal común para la imagen en fase precoz con tres radiotrazadores de unión a amiloide marcados con 18F, y en la aplicación de un protocolo de adquisición estática, lo que facilita la interpretación por parte de los especialistas en medicina nuclear en la práctica clínica habitual. En este estudio se comparó específicamente la FMF y la PET con [18F]FDG en una cohorte de pacientes con APP.
Material y métodosPacientesLa base de datos inicial retrospectivamente seleccionada consistió en una cohorte de pacientes con imágenes disponibles de PET con amiloide en doble fase y con [18F]FDG, adquiridas entre febrero de 2016 y julio de 2019 en el Servicio de Medicina Nuclear del Hospital Universitario 12 de Octubre, en Madrid, España. Se excluyeron aquellos pacientes sin diagnóstico de APP. La clasificación de la APP se realizó previamente a la obtención de imágenes de la PET con [18F]FDG, de acuerdo con la evaluación neuropsicológica, la neuroimagen estructural y el criterio clínico de neurólogos y neuropsicólogos en base a los criterios diagnósticos definidos por Gorno-Tempini et al.3. Aquellos pacientes que no se ajustaron a los criterios de APPvnf, APPvl o APPvs se definieron como no clasificables (APPnc).
Estudio PETImagen FMFLa FMF se adquirió utilizando [18F]FBP o [18F]FMM en un tomógrafo Siemens Biograph 6 True Point PET/CT (Siemens Healthcare, Erlangen, Alemania). Las imágenes se adquirieron tras la inyección intravenosa de una dosis del radiotrazador de 410±13MBq y 193±17MBq, respectivamente. Se realizó adquisición de imágenes estáticas de 1minuto durante un total de 10minutos inmediatamente después de la inyección (p.i.) y se registró la FMF. Las imágenes se reconstruyeron utilizando un algoritmo de reconstrucción del tipo de función de dispersión de puntos (point spread function [PSF]) (3iteraciones, 21subconjuntos, filtro all-pass) y se realizó corrección de la atenuación con una TC de dosis baja, así como también se aplicó corrección de la dispersión y la aleatorización. Las imágenes reconstruidas tuvieron un tamaño de matriz de 168×168 y un tamaño de vóxel de 4,0728×4,0728×5mm3.
PET con [18F]FDGLas imágenes de la PET con [18F]FDG se adquirieron en un tomógrafo Siemens Biograph 6 True Point PET/CT (Siemens Healthcare, Erlangen, Alemania). Se inyectó por vía intravenosa una dosis de 275±103MBq de [18F]FDG, y las imágenes se registraron a los 30-68minutos p.i. Se utilizó un algoritmo de reconstrucción PSF (6iteraciones, 16subconjuntos; filtro gaussiano: 3mm). Para la corrección de la atenuación se utilizó una TC de dosis baja, y se aplicó corrección de aleatorización y dispersión. Las imágenes reconstruidas tuvieron un tamaño de matriz de 336×336 y un tamaño de vóxel de 1,0182×1,0812×3mm3.
Análisis de las imágenesPara el pre-procesado de todas las imágenes se utilizó el Statistical Parametric Mapping12 (SPM12) (Wellcome Centre for Human Neuroimaging, University College London, Londres, Reino Unido)23. Para tener en cuenta las diferencias anatómicas entre pacientes, se empleó el algoritmo de segmentación unificada del SPM12, normalizando espacialmente las imágenes según el espacio estándar definido por el Instituto Neurológico de Montreal (MNI). Como referencia anatómica se utilizaron las imágenes de TC correspondientes a los protocolos de adquisición de la PET/TC tanto de amiloide como de [18F]FDG, tal y como se describe en Presotto et al.24. Las imágenes resultantes presentaron un tamaño de matriz de 91×109×91 y un tamaño de vóxel de 2×2×2mm3. A continuación se segmentaron un total de 68 regiones cerebrales en localización cortical y subcortical, utilizando el atlas Automatic Anatomical Labelling (AAL2)25,26. A partir de estas 68 regiones determinadas, se definieron 8 volúmenes de interés (VOI) que correspondieron a los lóbulos frontal, occipital, parietal y temporal, las cortezas cinguladas anterior y posterior (CCA y CCP, respectivamente), el precúneo y el cuerpo estriado. La captación regional del radiotrazador se cuantificó calculando los cocientes del valor de captación estandarizada (SUVR), utilizando la parte de materia gris del cerebelo.
Análisis estadísticoLas variables cuantitativas se representaron como media ±desviación estándar (DE). La normalidad de las distribuciones se estudió mediante la prueba de Shapiro-Wilk. Se compararon los SUVR regionales de las FMF y de las imágenes de [18F]FDG de la cohorte del estudio, así como en subgrupos según el radiotrazador y según la variante de APP, calculando los coeficientes de correlación promedio intraclase (r) mixto y bilateral, y la prueba t-test para datos apareados o la prueba del orden con signo de Wilcoxon. Teniendo en cuenta la reducida cohorte del estudio con 17pacientes, no se calcularon las correlaciones en subgrupos según el estado amiloide así como tampoco en los subgrupos en función de la variante de la APP divididos según el radiotrazador empleado. En el análisis agrupado, el único caso disponible con APPvs se agrupó con los casos de APPnc bajo el epígrafe de «Otras APP». Todo el análisis estadístico se llevó a cabo con los programas informáticos MATLAB R2019a (The MathWorks, Inc., Natick, MA, EE.UU.) y el SPSS versión 26.00 (IBM Corp., Armonk, NY, EE.UU.), y se consideró estadísticamente significativo un valor de p<0,05.
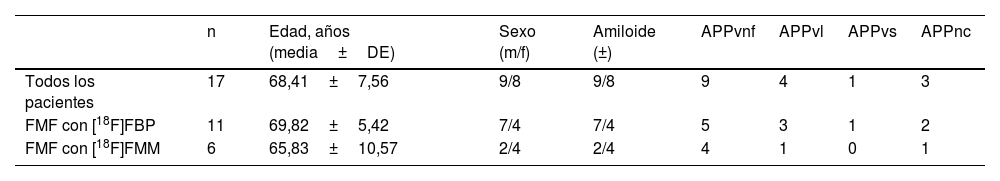
ResultadosDatos demográficos y de imagenEn la cohorte del estudio retrospectivo se incluyeron un total de 17 pacientes (edad 68,41 ±7,56años, 8mujeres) con imágenes PET FMF y [18F]FDG disponibles. El estudio de PET amiloide en fase dual se realizó 48,72 ±50,71días después de la adquisición de la PET/TC con [18F]FDG. Todos los pacientes fueron diagnosticados de sospecha de APP. La cohorte del estudio estuvo compuesta por 9pacientes con APPvnf, 4con APPvl, 1con APPvs y 3con ucAP. La PET amiloide fue positiva en el análisis visual en 2/9 (22,22%) casos de APPvnf, 4/4 (100%) casos de APPvl, 0/1 (0,00%) casos de APPvs y 3/3 (100%) casos de APPnc. La tabla 1 resume los datos demográficos de la cohorte del estudio.
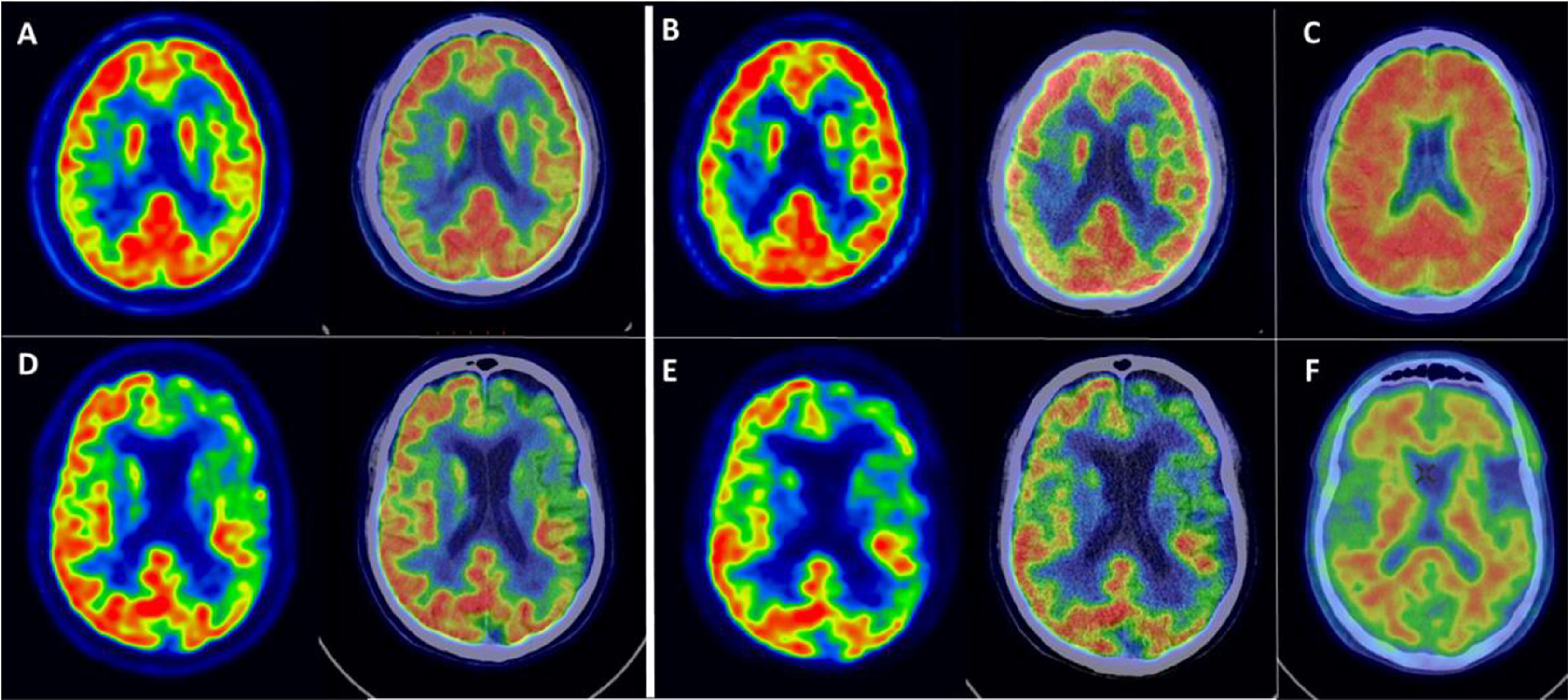
La figura 1 muestra ejemplos de FMF y de las imágenes correspondientes con [18F]FDG. Comparando la FMF con la [18F]FDG, puede observarse un patrón de perfusión/metabolismo similar para ambas, apreciándose una reducción de la actividad en las mismas regiones corticales.
Ejemplos de FMF, su imagen PET correspondiente con [18F]FDG, y de la PET amiloide.
Fila superior: mujer de 52 años con sospecha de APPvl. A)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo parietotemporal derecho asimétrico. B)Cortes axiales de la imagen PET con [18F]FMM del primer minuto (FMF) y de fusión con la TC, mostrando una hipoperfusión parietotemporal derecha asimétrica con una distribución similar a la imagen PET con [18F]FDG correspondiente. C)Corte axial de PET con [18F]FMM en fase tardía, positivo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvl como forma de presentación de una EA con el respaldo de los biomarcadores.
Fila inferior: varón de 65años con deterioro cognitivo leve a moderado de aparición focal y de tipo APP. D)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo predominantemente lobar frontal y temporal izquierdos. E)Cortes axiales de la PET con [18F]FMM de primer minuto (FMF) y de fusión con TC, que muestran una hipoperfusión frontal y temporal de distribución similar a la PET con [18F]FDG. F)Corte axial de la PET con [18F]FMM en fase tardía, negativo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvnf en un contexto de DFT con el respaldo de los biomarcadores.
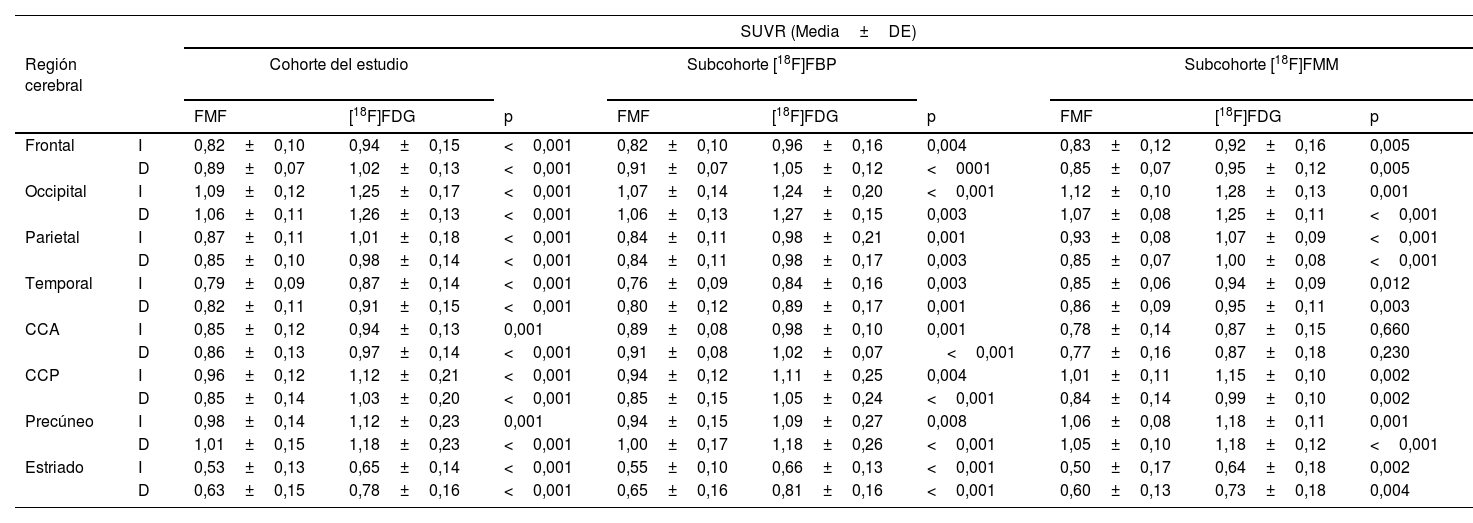
La tabla 2 resume los SUVR regionales de las FMF y de sus correspondientes imágenes PET con [18F]FDG. Pueden observarse SUVR regionales mayores en las imágenes PET con [18F]FDG, pero la tendencia regional baja/alta es la misma para ambas imágenes. De forma global, los valores más bajos en todas las subcohortes específicas según el radiotrazador se detectaron en el cuerpo estriado, siendo los valores corticales más bajos los de la región temporal. Por otra parte, debido a la actividad visual del paciente durante la adquisición de imágenes, la región occipital es la que muestra los SUVR más elevados.
SUVR regionales de la FMF y de la PET con [18F]FDG agrupados según el radiotrazador de la FMF
| SUVR (Media±DE) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Región cerebral | Cohorte del estudio | Subcohorte [18F]FBP | Subcohorte [18F]FMM | |||||||
| FMF | [18F]FDG | p | FMF | [18F]FDG | p | FMF | [18F]FDG | p | ||
| Frontal | I | 0,82±0,10 | 0,94±0,15 | <0,001 | 0,82±0,10 | 0,96±0,16 | 0,004 | 0,83±0,12 | 0,92±0,16 | 0,005 |
| D | 0,89±0,07 | 1,02±0,13 | <0,001 | 0,91±0,07 | 1,05±0,12 | <0001 | 0,85±0,07 | 0,95±0,12 | 0,005 | |
| Occipital | I | 1,09±0,12 | 1,25±0,17 | <0,001 | 1,07±0,14 | 1,24±0,20 | <0,001 | 1,12±0,10 | 1,28±0,13 | 0,001 |
| D | 1,06±0,11 | 1,26±0,13 | <0,001 | 1,06±0,13 | 1,27±0,15 | 0,003 | 1,07±0,08 | 1,25±0,11 | <0,001 | |
| Parietal | I | 0,87±0,11 | 1,01±0,18 | <0,001 | 0,84±0,11 | 0,98±0,21 | 0,001 | 0,93±0,08 | 1,07±0,09 | <0,001 |
| D | 0,85±0,10 | 0,98±0,14 | <0,001 | 0,84±0,11 | 0,98±0,17 | 0,003 | 0,85±0,07 | 1,00±0,08 | <0,001 | |
| Temporal | I | 0,79±0,09 | 0,87±0,14 | <0,001 | 0,76±0,09 | 0,84±0,16 | 0,003 | 0,85±0,06 | 0,94±0,09 | 0,012 |
| D | 0,82±0,11 | 0,91±0,15 | <0,001 | 0,80±0,12 | 0,89±0,17 | 0,001 | 0,86±0,09 | 0,95±0,11 | 0,003 | |
| CCA | I | 0,85±0,12 | 0,94±0,13 | 0,001 | 0,89±0,08 | 0,98±0,10 | 0,001 | 0,78±0,14 | 0,87±0,15 | 0,660 |
| D | 0,86±0,13 | 0,97±0,14 | <0,001 | 0,91±0,08 | 1,02±0,07 | <0,001 | 0,77±0,16 | 0,87±0,18 | 0,230 | |
| CCP | I | 0,96±0,12 | 1,12±0,21 | <0,001 | 0,94±0,12 | 1,11±0,25 | 0,004 | 1,01±0,11 | 1,15±0,10 | 0,002 |
| D | 0,85±0,14 | 1,03±0,20 | <0,001 | 0,85±0,15 | 1,05±0,24 | <0,001 | 0,84±0,14 | 0,99±0,10 | 0,002 | |
| Precúneo | I | 0,98±0,14 | 1,12±0,23 | 0,001 | 0,94±0,15 | 1,09±0,27 | 0,008 | 1,06±0,08 | 1,18±0,11 | 0,001 |
| D | 1,01±0,15 | 1,18±0,23 | <0,001 | 1,00±0,17 | 1,18±0,26 | <0,001 | 1,05±0,10 | 1,18±0,12 | <0,001 | |
| Estriado | I | 0,53±0,13 | 0,65±0,14 | <0,001 | 0,55±0,10 | 0,66±0,13 | <0,001 | 0,50±0,17 | 0,64±0,18 | 0,002 |
| D | 0,63±0,15 | 0,78±0,16 | <0,001 | 0,65±0,16 | 0,81±0,16 | <0,001 | 0,60±0,13 | 0,73±0,18 | 0,004 | |
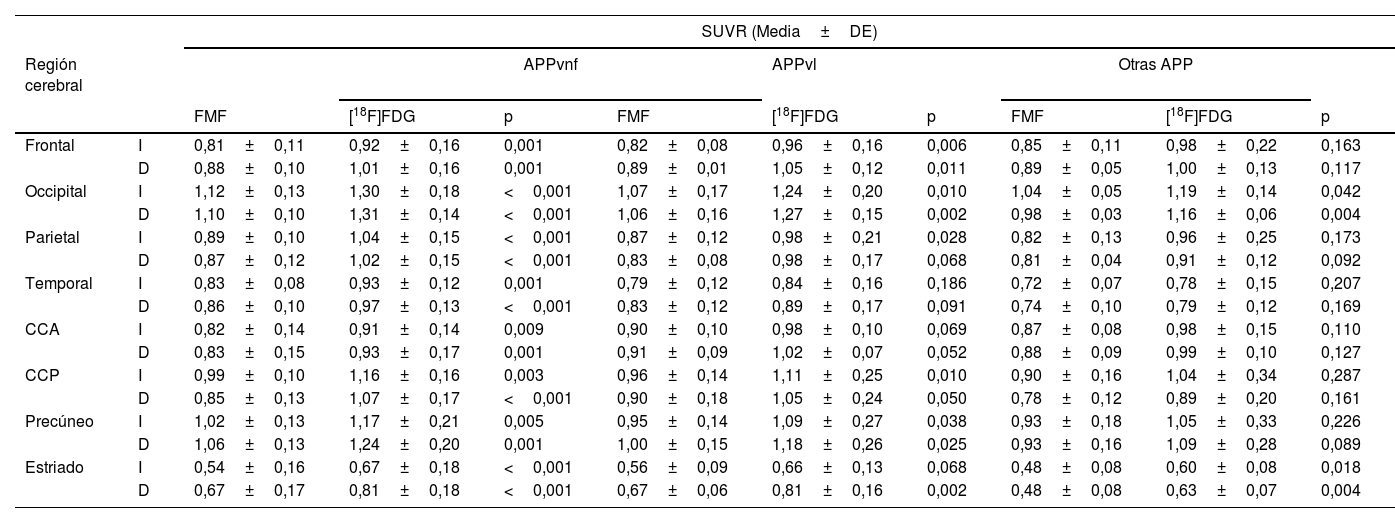
La tabla 3 muestra los SUVR regionales para cada variante. Se observa nuevamente que las FMF y la PET con [18F]FDG muestran un SUVR regional similar, si bien es ligeramente superior de forma global en la segunda imagen. En todos los grupos puede observarse una disminución del metabolismo temporal. Además, los SUVR están más reducidos en el CCA del grupo con APPvnf respecto a los otros dos.
SUVR regionales de las FMF y la PET con [18F]FDG agrupados según la variante de APP
| SUVR (Media±DE) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Región cerebral | APPvnf | APPvl | Otras APP | |||||||
| FMF | [18F]FDG | p | FMF | [18F]FDG | p | FMF | [18F]FDG | p | ||
| Frontal | I | 0,81±0,11 | 0,92±0,16 | 0,001 | 0,82±0,08 | 0,96±0,16 | 0,006 | 0,85±0,11 | 0,98±0,22 | 0,163 |
| D | 0,88±0,10 | 1,01±0,16 | 0,001 | 0,89±0,01 | 1,05±0,12 | 0,011 | 0,89±0,05 | 1,00±0,13 | 0,117 | |
| Occipital | I | 1,12±0,13 | 1,30±0,18 | <0,001 | 1,07±0,17 | 1,24±0,20 | 0,010 | 1,04±0,05 | 1,19±0,14 | 0,042 |
| D | 1,10±0,10 | 1,31±0,14 | <0,001 | 1,06±0,16 | 1,27±0,15 | 0,002 | 0,98±0,03 | 1,16±0,06 | 0,004 | |
| Parietal | I | 0,89±0,10 | 1,04±0,15 | <0,001 | 0,87±0,12 | 0,98±0,21 | 0,028 | 0,82±0,13 | 0,96±0,25 | 0,173 |
| D | 0,87±0,12 | 1,02±0,15 | <0,001 | 0,83±0,08 | 0,98±0,17 | 0,068 | 0,81±0,04 | 0,91±0,12 | 0,092 | |
| Temporal | I | 0,83±0,08 | 0,93±0,12 | 0,001 | 0,79±0,12 | 0,84±0,16 | 0,186 | 0,72±0,07 | 0,78±0,15 | 0,207 |
| D | 0,86±0,10 | 0,97±0,13 | <0,001 | 0,83±0,12 | 0,89±0,17 | 0,091 | 0,74±0,10 | 0,79±0,12 | 0,169 | |
| CCA | I | 0,82±0,14 | 0,91±0,14 | 0,009 | 0,90±0,10 | 0,98±0,10 | 0,069 | 0,87±0,08 | 0,98±0,15 | 0,110 |
| D | 0,83±0,15 | 0,93±0,17 | 0,001 | 0,91±0,09 | 1,02±0,07 | 0,052 | 0,88±0,09 | 0,99±0,10 | 0,127 | |
| CCP | I | 0,99±0,10 | 1,16±0,16 | 0,003 | 0,96±0,14 | 1,11±0,25 | 0,010 | 0,90±0,16 | 1,04±0,34 | 0,287 |
| D | 0,85±0,13 | 1,07±0,17 | <0,001 | 0,90±0,18 | 1,05±0,24 | 0,050 | 0,78±0,12 | 0,89±0,20 | 0,161 | |
| Precúneo | I | 1,02±0,13 | 1,17±0,21 | 0,005 | 0,95±0,14 | 1,09±0,27 | 0,038 | 0,93±0,18 | 1,05±0,33 | 0,226 |
| D | 1,06±0,13 | 1,24±0,20 | 0,001 | 1,00±0,15 | 1,18±0,26 | 0,025 | 0,93±0,16 | 1,09±0,28 | 0,089 | |
| Estriado | I | 0,54±0,16 | 0,67±0,18 | <0,001 | 0,56±0,09 | 0,66±0,13 | 0,068 | 0,48±0,08 | 0,60±0,08 | 0,018 |
| D | 0,67±0,17 | 0,81±0,18 | <0,001 | 0,67±0,06 | 0,81±0,16 | 0,002 | 0,48±0,08 | 0,63±0,07 | 0,004 | |
En primer lugar se obtuvieron las correlaciones intrapaciente entre los SUVR regionales de las FMF y de las imágenes PET correspondientes con [18F]FDG, obteniéndose una correlación media de r=0,95 ±0,04. Al dividir según el radiotrazador, los coeficientes de correlación intrapaciente medios fueron r=0,94 ±0,05 y r=0,97 ±0,02 para [18F]FBP y [18F]FMM, respectivamente. En cuanto a los subgrupos según la variante, las correlaciones intrapaciente medias fueron r=0,96 ±0,03 (APPvnf), r=0,93 ±0,07 (APPvl) y r=0,97 ±0,02 (Otras APP).
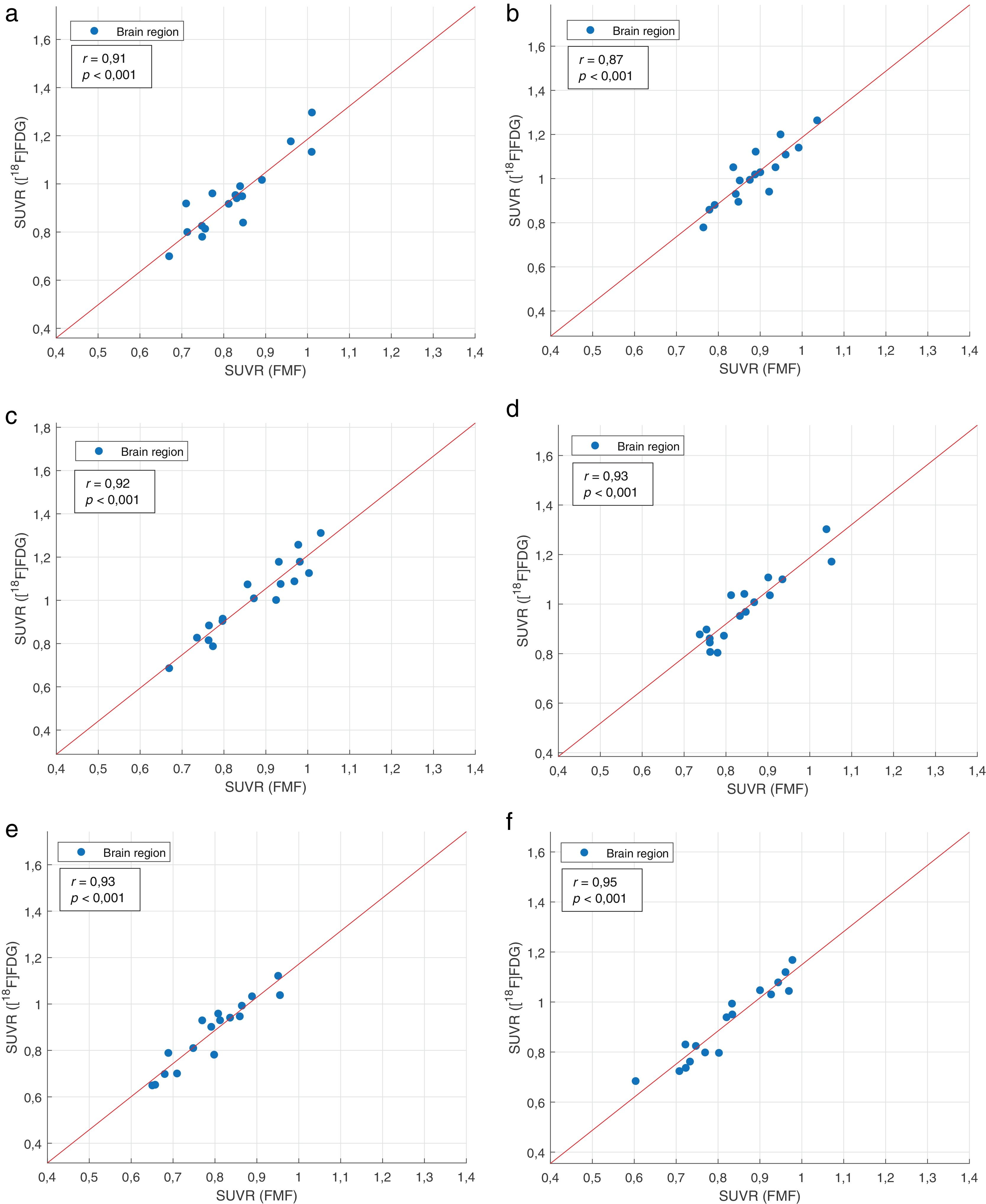
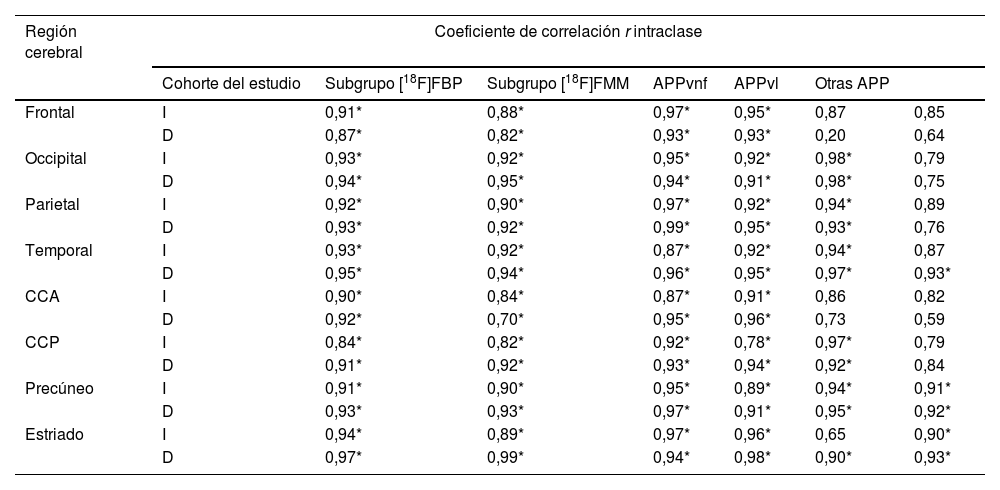
La tabla 4 resume los coeficientes de correlación regional interpaciente entre los SUVR de las FMF y las correspondientes imágenes PET con [18F]FDG. Se obtuvieron fuertes correlaciones positivas significativas >0,84 en todas las regiones de la cohorte de estudio. Lo mismo ocurrió para los subgrupos según el radiotrazador. Al dividir según la variante de APP, los mejores resultados globales se obtuvieron con el subgrupo APPvnf. Sin embargo, también hubo fuertes correlaciones positivas, aunque no siempre fue estadísticamente significativa, en los otros dos subgrupos de la variante de APP. La figura 2 muestra gráficas de correlación representativas para las regiones frontal, parietal y temporal de toda la cohorte del estudio.
Coeficientes de correlación regional interpaciente de la FMF y la PET con [18F]FDG
| Región cerebral | Coeficiente de correlación r intraclase | ||||||
|---|---|---|---|---|---|---|---|
| Cohorte del estudio | Subgrupo [18F]FBP | Subgrupo [18F]FMM | APPvnf | APPvl | Otras APP | ||
| Frontal | I | 0,91* | 0,88* | 0,97* | 0,95* | 0,87 | 0,85 |
| D | 0,87* | 0,82* | 0,93* | 0,93* | 0,20 | 0,64 | |
| Occipital | I | 0,93* | 0,92* | 0,95* | 0,92* | 0,98* | 0,79 |
| D | 0,94* | 0,95* | 0,94* | 0,91* | 0,98* | 0,75 | |
| Parietal | I | 0,92* | 0,90* | 0,97* | 0,92* | 0,94* | 0,89 |
| D | 0,93* | 0,92* | 0,99* | 0,95* | 0,93* | 0,76 | |
| Temporal | I | 0,93* | 0,92* | 0,87* | 0,92* | 0,94* | 0,87 |
| D | 0,95* | 0,94* | 0,96* | 0,95* | 0,97* | 0,93* | |
| CCA | I | 0,90* | 0,84* | 0,87* | 0,91* | 0,86 | 0,82 |
| D | 0,92* | 0,70* | 0,95* | 0,96* | 0,73 | 0,59 | |
| CCP | I | 0,84* | 0,82* | 0,92* | 0,78* | 0,97* | 0,79 |
| D | 0,91* | 0,92* | 0,93* | 0,94* | 0,92* | 0,84 | |
| Precúneo | I | 0,91* | 0,90* | 0,95* | 0,89* | 0,94* | 0,91* |
| D | 0,93* | 0,93* | 0,97* | 0,91* | 0,95* | 0,92* | |
| Estriado | I | 0,94* | 0,89* | 0,97* | 0,96* | 0,65 | 0,90* |
| D | 0,97* | 0,99* | 0,94* | 0,98* | 0,90* | 0,93* | |
La FMF es una imagen de tipo perfusión sencilla de adquirir y que permite obtener información sobre la neurodegeneración y el depósito de Aβ (junto con la imagen PET de Aβ en fase tardía) en la misma sesión. En este estudio se evaluó la similitud de la FMF con el patrón de referencia clínico para la neurodegeneración de la PET con [18F]FDG, en una cohorte de pacientes con APP. En estudios anteriores las imágenes de PET amiloide precoz se adquirieron durante varios minutos, teniendo que seleccionar ventanas de tiempo específicas para cada radiotrazador durante la adquisición o en la reconstrucción de los datos dinámicos adquiridos en modo «lista»12,19. La FMF, por el contrario, constituye una alternativa ampliamente disponible y con una ventana temporal común para los tres radiotrazadores PET amiloide marcados con 18F.
Como se observa en los análisis SUVR, las imágenes de [18F]FDG presentaron, en general, valores más elevados que las FMF, pero este desfase es coherente y estadísticamente significativo para todas las regiones. Este mismo patrón se observa en estudios previos que evalúan imágenes de PET amiloide en fase precoz y adquiridas con [18F]FBP12-15 y [18F]FBB19,20. Además, las alteraciones regionales de SUVR también fueron coherentes dentro de los subgrupos. Al dividir según la variante de APP, los SUVR también siguieron patrones concordantes con los descritos en la literatura3-5,9. Sin embargo, no se encontraron diferencias estadísticamente significativas entre los grupos nfAPP y APPvl (el grupo Otras APP se excluyó de este análisis debido a su composición heterogénea).
En cuanto a los análisis de correlación, los análisis intrapaciente mostraron valores de r muy altos. Estos índices también son comparables o superiores a los coeficientes de correlación intrasujeto obtenidos por Hsiao et al.12 y Asghar et al.14, ambos utilizando [18F]FBP y ventanas temporales de 0-2 y 2-5minutos, respectivamente. La similitud entre las imágenes mostrada por los análisis intrapaciente también es independiente del radiotrazador utilizado y de la variante de la APP donde se obtuvieron correlaciones fuertes.
Los coeficientes de correlación regional interpaciente fueron ligeramente inferiores a los valores intrapaciente, aunque siguen siendo fuertes entre las regiones del estudio (r=0,92 ±0,03). Con algunas excepciones, los coeficientes de correlación regional interpaciente resultaron igualmente elevados tanto en los subgrupos específicos del radiotrazador como según el tipo de variante de APP. Los coeficientes de correlación regional más bajos se obtuvieron para la región frontal derecha (r=0,20, subgrupo APPvl) y el CCA (r=0,59, r=0,70 o r=0,73 para el subgrupo Otras APP, [18F]FBP y APPvl, respectivamente), que, aunque no suele estar afectada en la EA, al ser una región relativamente pequeña, puede considerarse alterada por artefactos secundarios a movimientos del paciente durante la adquisición de las imágenes. Además, se ha demostrado que presenta un metabolismo reducido en la PET con [18F]FDG y que se ve afectada por la atrofia27-29. Aunque algunos coeficientes de correlación regional siguen siendo fuertes, no resultaron ser estadísticamente significativos, lo que puede explicarse por el reducido número de pacientes una vez divididos según la variante de APP. En comparación con estudios anteriores, los coeficientes de correlación regional fueron comparables o superiores12,13,15-20, a pesar de que los grupos de estudio investigados no estuvieron centrados en pacientes con APP en estos casos. Por ejemplo, en la PET precoz con [18F]FBP, Hsiao et al.12 obtuvieron valores de r entre r=0,41 (región frontal orbitaria) y r=0,93 (región temporal superior) para una ventana temporal de 0-2minutos. Del mismo modo, los coeficientes de correlación descritos por Myoraku et al.15 oscilaron entre 0,61 y 0,94. Utilizando [18F]FMM, para las primeras adquisiciones (0-10minutos), Schmitt et al.16 obtuvieron valores de correlación con [18F]FDG PET en regiones corticales comprendidas entre r=0,76 y r=0,924. Boccalini et al.17 también mostraron unos elevados coeficientes de correlación (r>0,72) independientemente del radiotrazador PET amiloide utilizado, [18F]FBP y [18F]FMM. En el caso del [18F]FBP en fase inicial, Daerr et al.19 obtuvieron valores de r entre 0,59 (regiones frontal izquierda y sensitivo-motora derecha) y 0,86 (CCP derecho) utilizando una ventana temporal de 0-5minutos. En nuestro estudio no se adquirieron FMF con [18F]FBB, pero los coeficientes de correlación regional en el grupo de estudio fueron globalmente más altos y oscilan entre r=0,84 (CCP izquierdo) y r=0,97 (cuerpo estriado derecho).
Además de la imagen de perfusión FMF, este protocolo permitió adquirir la imagen PET amiloide estándar en fase tardía del paciente. En el caso de la APP se ha demostrado que la positividad del amiloide puede ayudar en la clasificación y la identificación de la neuropatología subyacente. En una revisión sistemática realizada por Villarejo-Galende et al.6, los autores descubrieron que el amiloide positivo se relacionaba más comúnmente con la APPvl (84,9%), mientras que los pacientes con nfAPP o APPvs raramente mostraban un aumento de la carga amiloide. Del mismo modo, Bergeron et al.7 hallaron una prevalencia de positividad amiloide en el 86% de los casos con APPvl y solo en el 20% y el 16% de los casos con APPvnf y APPvs, respectivamente. En el presente grupo de estudio también pudo observarse esta distribución, con un 100% de positividad amiloide en los pacientes con APPvl y APPnc, mientras que el resto fue mayoritariamente amiloide negativo. Por lo tanto, la combinación de las imágenes de perfusión cerebral y de depósito de amiloide en un único protocolo de adquisición puede mejorar el rendimiento diagnóstico de la prueba. De este modo, si bien una PET amiloide positiva no implica un diagnóstico de EA, en combinación con un patrón de hiperperfusión parietotemporal en la FMF puede apoyar el diagnóstico de EA probable en los pacientes con APPvl o APPvs. Del mismo modo, un resultado negativo para amiloide en combinación con un patrón de hipoperfusión frontal en el caso de un paciente con APPvnf puede apoyar el diagnóstico de DFT. Esto también ha sido demostrado previamente por Kuo et al.21, donde la combinación de PET amiloide en fase precoz y tardía fue capaz de diferenciar entre controles sanos y pacientes con EA y APP.
Una de las principales limitaciones de nuestro estudio ha sido la reducida cohorte de pacientes para poder comparar las dos imágenes, aunque los resultados están en consonancia con estudios previos de cohortes exclusivas de APP4,6,21. Además, solo hubo un paciente diagnosticado de APPvs, y para los análisis de grupos se incluyó en el de los pacientes con APPnc. En este estudio no se adquirieron FMF con [18F]FBB y tampoco hubo disponible un grupo de controles sanos, que debería incluirse en futuros estudios con una población de mayor tamaño. Además, en futuros estudios se pretende analizar la comparación visual entre FMF y [18F]FDG. Por último, si bien los cambios producidos en el metabolismo/perfusión cerebrales secundarios a las enfermedades neurodegenerativas son de desarrollo lento (años), el intervalo de tiempo transcurrido entre la adquisición de imágenes FMF y [18F]FDG no fue la misma en todos los casos (hasta 166días), y ello puede haber reducido ligeramente las correlaciones.
ConclusionesEn este estudio hemos demostrado la semejanza entre la FMF y la [18F]FDG en una cohorte de estudio de pacientes diagnosticados con diferentes variantes de APP. Las medidas cuantitativas y los análisis de correlación revelan la utilidad de la FMF, y que esta imagen estática del primer minuto, independiente del radiotrazador amiloide empleado, constituye una alternativa viable a la adquisición dinámica de la PET amiloide precoz y a la PET con [18F]FDG. En combinación con la imagen PET amiloide simultánea podría constituir un biomarcador de imagen para el diagnóstico y la clasificación de la APP.
Declaración éticaEste estudio se ajusta a los principios de la Declaración de Helsinki y fue autorizado por el Comité de Ética e Investigación del hospital.
Consentimiento informadoSe obtuvo el consentimiento informado por escrito de los pacientes antes de la adquisición de las imágenes.
FinanciaciónEsta investigación no recibió ninguna subvención específica procedente de organismos de financiación de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Ejemplos de FMF, su imagen PET correspondiente con [18F]FDG, y de la PET amiloide. Fila superior: mujer de 52 años con sospecha de APPvl. A)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo parietotemporal derecho asimétrico. B)Cortes axiales de la imagen PET con [18F]FMM del primer minuto (FMF) y de fusión con la TC, mostrando una hipoperfusión parietotemporal derecha asimétrica con una distribución similar a la imagen PET con [18F]FDG correspondiente. C)Corte axial de PET con [18F]FMM en fase tardía, positivo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvl como forma de presentación de una EA con el respaldo de los biomarcadores. Fila inferior: varón de 65años con deterioro cognitivo leve a moderado de aparición focal y de tipo APP. D)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo predominantemente lobar frontal y temporal izquierdos. E)Cortes axiales de la PET con [18F]FMM de primer minuto (FMF) y de fusión con TC, que muestran una hipoperfusión frontal y temporal de distribución similar a la PET con [18F]FDG. F)Corte axial de la PET con [18F]FMM en fase tardía, negativo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvnf en un contexto de DFT con el respaldo de los biomarcadores. Ejemplos de FMF, su imagen PET correspondiente con [18F]FDG, y de la PET amiloide. Fila superior: mujer de 52 años con sospecha de APPvl. A)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo parietotemporal derecho asimétrico. B)Cortes axiales de la imagen PET con [18F]FMM del primer minuto (FMF) y de fusión con la TC, mostrando una hipoperfusión parietotemporal derecha asimétrica con una distribución similar a la imagen PET con [18F]FDG correspondiente. C)Corte axial de PET con [18F]FMM en fase tardía, positivo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvl como forma de presentación de una EA con el respaldo de los biomarcadores. Fila inferior: varón de 65años con deterioro cognitivo leve a moderado de aparición focal y de tipo APP. D)Cortes axiales de la PET con [18F]FDG y de fusión con TC, mostrando un hipometabolismo predominantemente lobar frontal y temporal izquierdos. E)Cortes axiales de la PET con [18F]FMM de primer minuto (FMF) y de fusión con TC, que muestran una hipoperfusión frontal y temporal de distribución similar a la PET con [18F]FDG. F)Corte axial de la PET con [18F]FMM en fase tardía, negativo para depósitos patológicos de amiloide en la corteza cerebral. Los hallazgos apoyan el diagnóstico de APPvnf en un contexto de DFT con el respaldo de los biomarcadores.](https://static.elsevier.es/multimedia/2253654X/0000004200000004/v2_202311010733/S2253654X22001391/v2_202311010733/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Gráficos de correlación con la línea de los mínimos cuadrados del SUVR de la FMF y la [18F]FDG de las regiones frontal (a: izquierda; b: derecha), parietal (c: izquierda; d: derecha) y temporal (e: izquierda; f: derecha) de pacientes con afasia primaria progresiva. Gráficos de correlación con la línea de los mínimos cuadrados del SUVR de la FMF y la [18F]FDG de las regiones frontal (a: izquierda; b: derecha), parietal (c: izquierda; d: derecha) y temporal (e: izquierda; f: derecha) de pacientes con afasia primaria progresiva.](https://static.elsevier.es/multimedia/2253654X/0000004200000004/v2_202311010733/S2253654X22001391/v2_202311010733/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
