Las metástasis vertebrales son una causa común de dolor en el paciente oncológico, lo cual puede generar limitación funcional, además de complicaciones derivadas de una posible compresión medular, radicular y fracturas. Se requiere de un abordaje complejo de estas metástasis por el riesgo de secuelas permanentes. Con el aumento de las supervivencia gracias a los nuevos tratamientos emergentes, las posibilidades de presentar metástasis vertebrales son cada vez mayores, por ende, el manejo de estas lesiones debe ir encaminado al alivio del dolor y el mantenimiento de la deambulación. La radioterapia juega un papel fundamental en el manejo de estas lesiones, y disponemos de avances tecnológicos en los últimos años que han permitido mejorar la calidad e intencionalidad de los tratamientos, pasando de ser meramente paliativos a proponer tratamientos que mejoren el control local. En este articulo hacemos una descripción de como la técnica de SBRT (stereotactic body radiotherapy), en pacientes seleccionados puede mejorar el control local de forma más duradera, y el valor que tiene en paciente oligometastásico y tras cirugía.
Spine metastases are a common cause of pain in the oncologic patient which can generate functional limitation, in addition to complications derived from spinal cord compression, radicular compression and fractures. A complex approach to these metastases is required due to the risk of permanent sequelae. With the increase in survival rates due to new emerging treatments, the possibilities of presenting vertebral metastases are increasing, therefore, the management of these lesions should be aimed at pain relief and maintenance of ambulation. Radiotherapy has a fundamental role in the management of these lesions, and technological advances in recent years have made it possible to improve the quality and intentionality of the treatments, going from having a palliative intent to proposing treatments that improve local control. In this article we describe how the stereotactic body radiotherapy (SBRT) technique, in selected patients, can improve local control and its value in oligometastatic patients and after surgery.
Las metástasis vertebrales pueden llegar a presentarse hasta en un 70% de los pacientes diagnosticados con cáncer1.
Al igual que las metástasis óseas en cualquier localización, las lesiones a nivel vertebral pueden generar dolor importante, con limitación funcional, que resulta del propio dolor, así como de complicaciones por fracturas, y compresiones radiculares o mielopatía por afectación epidural1,2. Se considera que hasta el 10% de los pacientes con metástasis vertebrales van a desarrollar compresión medular, por lo que el abordaje de tratamiento es mucho más complejo que las metástasis óseas de otra localización, ya que el riesgo de generar secuelas incapacitantes de forma permanente es mayor1,2.
Con el avance en los tratamientos sistémicos, quimioterapia, inmunoterapia, hormonoterapia y radioterapia, las supervivencias de los pacientes son cada vez mayores, lo que conlleva mayor posibilidad de desarrollar metástasis a lo largo de la evolución de su enfermedad y la necesidad de ofrecer tratamientos que ayuden a mantener una buena calidad de vida.
El objetivo principal del tratamiento en las metástasis vertebrales es el control local de la enfermedad, el alivio del dolor y el mantenimiento de la funcionalidad3.
De forma general, estas metástasis se han tratado mediante técnicas quirúrgicas invasivas, con radioterapia externa a dosis paliativas o una combinación de ambas.
El tratamiento de las metástasis vertebrales requiere un manejo multidisciplinar que incluye oncólogos radioterápicos, cirujanos de columna, radiólogos y oncólogos médicos.
Históricamente la radioterapia externa a dosis convencionales, en el tratamiento de las metástasis vertebrales, ha demostrado mejoría de control de dolor en un 60-85% de los casos, con una durabilidad variable de acuerdo con la histología, siendo mejor la respuesta en los tumores de mama, próstata y mielomas4.
Con el aumento en la supervivencia de pacientes con tumores metastásicos, aumenta la necesidad de alcanzar una mejoría de los síntomas y la funcionalidad y al mismo tiempo minimizar el riesgo de efectos adversos.
Radioterapia en metástasis vertebralesTradicionalmente las metástasis vertebrales han sido tratadas con radioterapia externa a dosis y fraccionamientos que se consideran seguros para la tolerancia de la médula espinal. La dosis habitualmente empleada con la intención de lograr mejoría del dolor y control tumoral local suele ser fraccionada en 10 sesiones de 3Gy, 5 de 4Gy o 1 de 8Gy.
En la actualidad se ha avanzado hacia la posibilidad de administrar dosis altas, biológicamente efectivas y consideradas como radicales, gracias a la capacidad de conformar la dosis y limitar la dosis tóxica a nivel medular (fig. 1).
Esta técnica es conocida como SBRT (stereotactic body radiotherapy) y se administra entre 1 y 5 fracciones de>6Gy por fracción.
Una de las ventajas de la SBRT es mejorar el control local de la enfermedad, además de lograr una mejoría de los síntomas. En la columna vertebral, la progresión puede estar asociada con morbilidad neurológica, dolor y opciones limitadas de tratamientos adicionales, por lo que es una localización ideal para el tratamiento con SBRT.
La SBRT se ha definido como la administración precisa de radioterapia externa a dosis altas, altamente conformadas y guiadas por imagen, administrada en una sola o pocas fracciones, en una localización extracraneal, con una dosis biológicamente equivalente a un curso de tratamiento con intención radical administrado a un fraccionamiento convencional (1,8-3,0Gy/fracción).
La SBRT ha demostrado ser eficaz para proporcionar un control local adecuado de la enfermedad en combinación con cirugía o como tratamiento único en casos seleccionados. Por lo tanto, se ha convertido en el tratamiento de elección cuando está indicada la ablación local completa de una lesión metastásica, sobre todo en pacientes con enfermedad oligometastásica5.
Para definir si un paciente es candidato a tratamiento con SBRT, es importante determinar el grado de afectación de la médula espinal, ya que esto condiciona la posibilidad o no de poder utilizar las dosis ablativas que se pueden prescribir sin generar toxicidad.
Cuando nos encontramos ante un paciente con metástasis vertebrales, debemos considerar varios factores que nos van a ayudar a decidir el tratamiento más adecuado en cada situación.
Para la toma de decisiones es importante tener en cuenta:
- 1.
Características del paciente: dolor, déficit neurológico, edad, comorbilidades, estado general, expectativa de vida y preferencias del paciente.
- 2.
Factores relacionados con el tumor: histología, perfil molecular, enfermedad sistémica y las opciones terapéuticas.
- 3.
Factores relacionados con la columna: localización vertebral, presencia y grado de afectación epidural, tratamientos previos (radioterapia o cirugía) y estabilidad de la columna5.
Las situaciones en las que la SBRT puede ser útil son: pacientes con enfermedad oligometastásica, enfermedad epidural limitada o nula, columna estable, pacientes que han recibido previamente radioterapia y de forma seleccionada de manera postoperatoria.
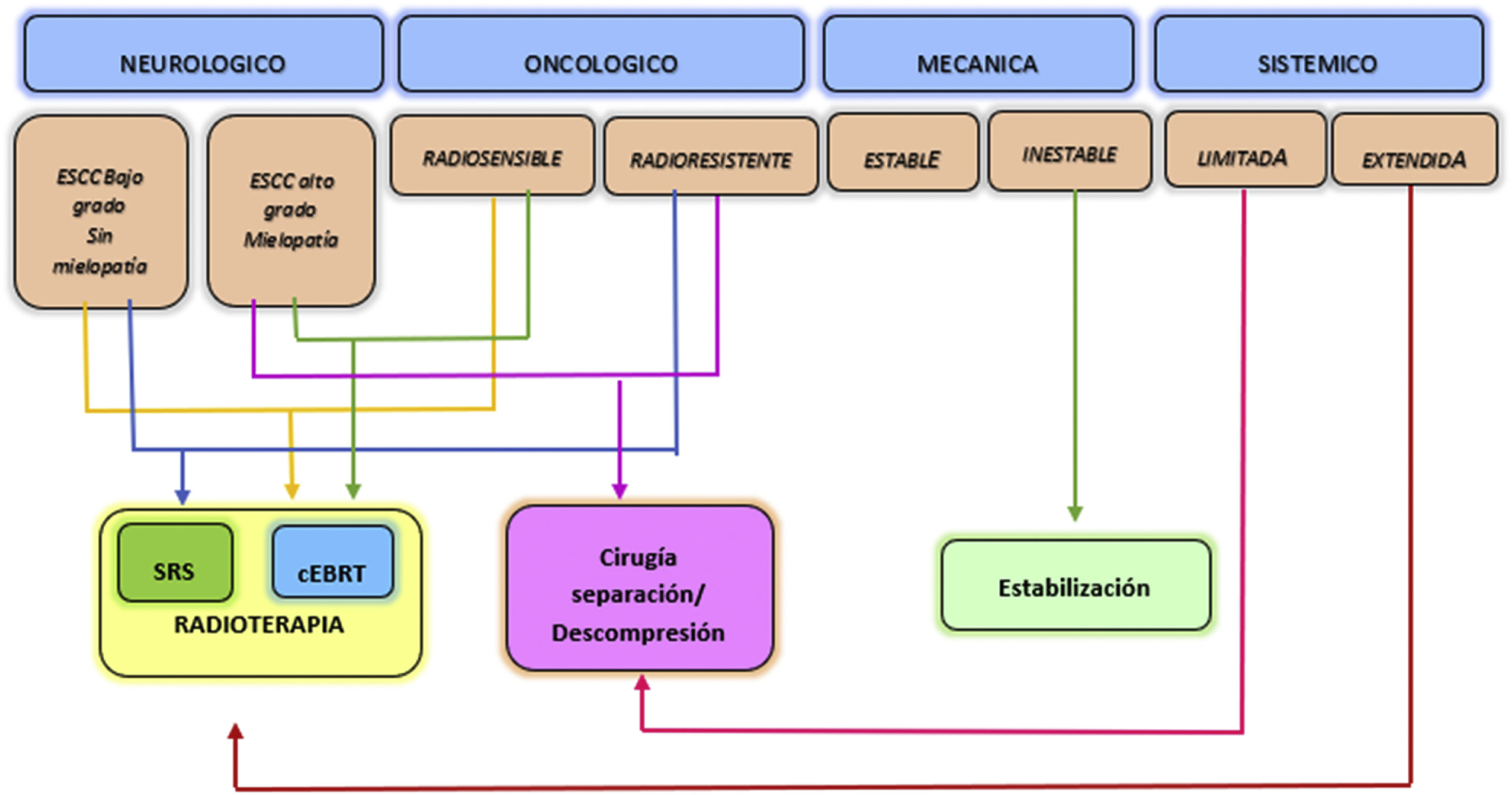
El marco de decisión NOMS tiene en consideración las características neurológicas, oncológicas, mecánicas y sistémicas de los pacientes e incorpora el uso de la radioterapia, la cirugía mínimamente invasiva y en general el tratamiento multimodal para el manejo de las metástasis vertebrales, lo cual ha demostrado mejora de control local, alivio del dolor, y la restauración o preservación de la funcionalidad neurológica, minimizando la morbilidad de los pacientes6 (fig. 2).
Marco de decisión NOMS. Adaptada de Laufer et al.6.
La herramienta desarrollada por el Spine Oncology Study Group (SOSG) permite determinar la estabilidad de la columna, por medio de la puntuación SINS (Spine Instability Neoplastic Score), que incluye 6 parámetros, que predicen la necesidad o no de estabilización quirúrgica6,7 (tabla 1).
Escala SINS (Spine Instability Neoplastic Score)
| Puntuación | |
|---|---|
| Localización | |
| Unión occipito-C2, C7-T2, T11-L1, L5-S1 | 3 |
| Columna móvil C3-C6, L2-L4 | 2 |
| Columna semirrígida T3-T10 | 1 |
| Columna rígida S2-S5 | 0 |
| Dolor | |
| Sí | 3 |
| Ocasional pero no mecánico | 1 |
| No dolor | 0 |
| Lesión ósea | |
| Lítica | 2 |
| Mixta (lítica/blástica) | 1 |
| Blástica | 0 |
| Alineación vertebral | |
| Subluxación/traslación presente | 4 |
| Deformidad nueva (cifosis escoliosis) | 2 |
| Alineación normal | 0 |
| Aplastamiento cuerpo vertebral | |
| >50% | 3 |
| <50% | 2 |
| Sin aplastamiento, pero afectación 50% vertebral | 1 |
| Ninguno de las anteriores | 0 |
| Afectación de elementos posterolaterales | |
| Bilateral | 3 |
| Unilateral | 1 |
| Ninguno | 0 |
| Total | |
| Estable | 0-6 |
| Indeterminada | 7-12 |
| Inestable | 13-18 |
Adaptada de: Fisher et al.7.
En general los pacientes con columna inestable o indeterminada (puntuación SINS>7) deben ser valorados por un equipo quirúrgico6.
Otra herramienta útil en la toma de decisiones para el manejo de las metástasis vertebrales es la valoración del grado de compresión medular por medio de resonancia magnética.
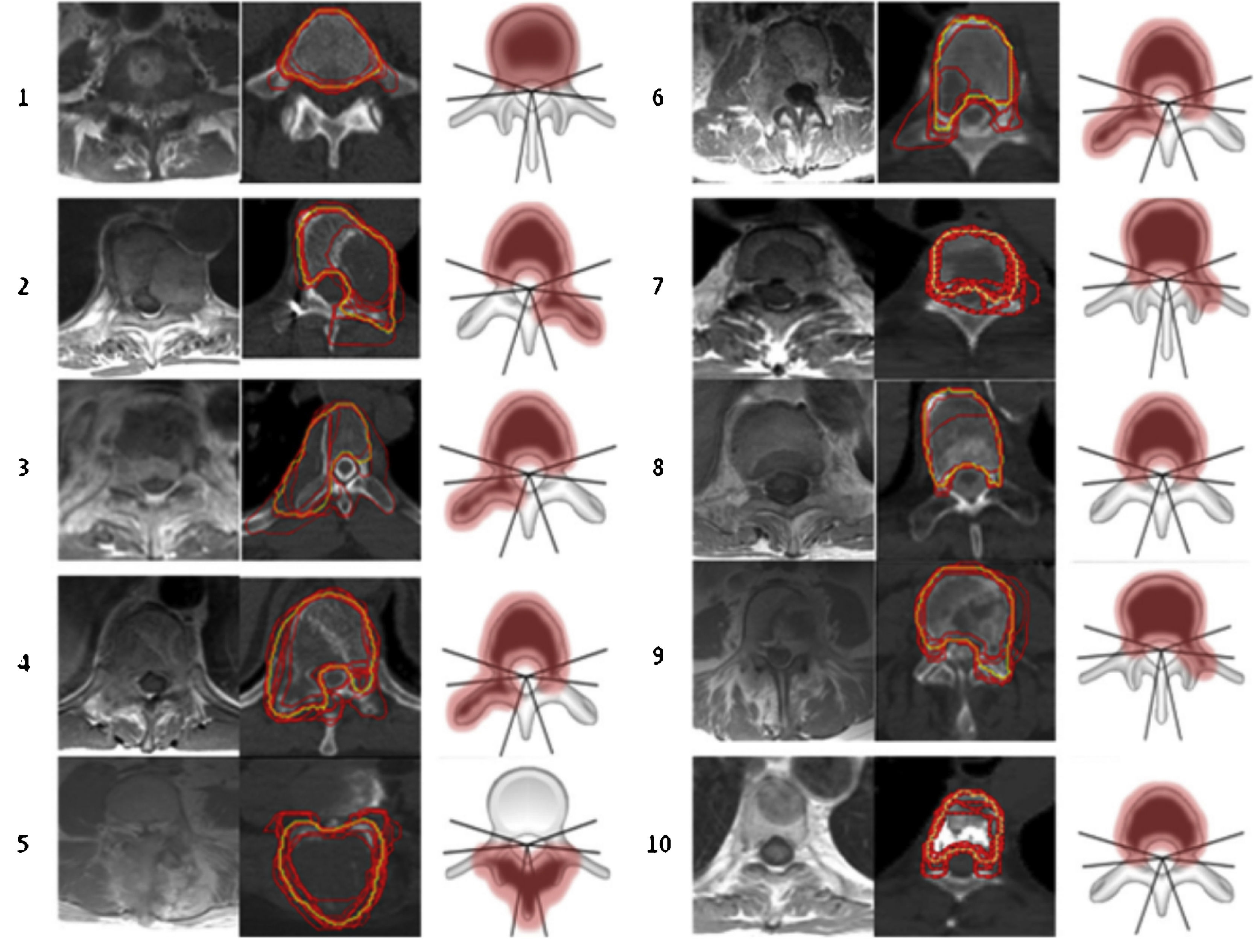
Bilsky et al. clasificaron el grado de compresión medular ESCC (epidural spinal cord compression) en 4 puntos8 (fig. 3):
Representación esquemática del grado de compresión medular. Fuente: Tseng et al.5.
Grado 0: tumor confinado al hueso.
Grado 1a: tumor con extensión epidural, sin desplazamiento del saco tecal.
Grado 1b: tumor con extensión epidural y desplazamiento del saco tecal, pero sin contacto con la médula.
Grado 1c: tumor con extensión epidural y abultamiento de la médula, pero sin desplazarla.
Grado 2: tumor con desplazamiento o compresión de la médula, sin extensión circunferencial, con líquido cefalorraquídeo visible alrededor de la médula.
Grado 3: tumor con extensión circunferencial y/o que causa compresión medular sin líquido cefalorraquídeo visibles alrededor de la médula8.
Teniendo en cuenta las herramientas descritas previamente, las indicaciones para valorar realizar un tratamiento con SBRT se encuentran resumidas en la tabla 2.
Indicaciones de tratamiento con SBRT
| Factores | Indicado | Precaución | Contraindicado |
|---|---|---|---|
| Estado general | ECOG 0-2 | ECOG>3 | |
| Expectativa de vida | Mayor a 3 meses | ||
| Dolor | Intratable | ||
| Síntomas neurológicos | Compresión medular o cauda equina sintomática | ||
| Estadio enfermedad | Enfermedad oligometastásica | Enfermedad metastásica o rápidamente progresiva | |
| Histología | Diagnóstico histológico | Tumores radiosensibles | |
| Tratamiento sistémico | Opciones de tratamiento sistémico | ||
| Imagen | ESCC (Bilsky) grado 0-1 | ESCC (Bilsky) grado 2 | ESCC (Bilsky)grado 3 o compresión cauda equina o>3 niveles no contiguos afectos |
| Estabilidad | SINS 0-6 | SINS 7-12 | SINS 13-18 |
| Radioterapia previa | Radioterapia previa a dosis convencional en el mismo nivel | SBRT previa en el mismo nivel | Radioterapia externa convencional 90 días previos |
| Posicionamiento | Imposibilidad para mantener la inmovilización |
ECOG: Eastern Cooperative Oncology Group; ESCC: epidural spinal cord compression; SBRT: stereotactic body radiotherapy; SINS: Spinal Instability Neoplasic Score.
Adaptada de: Tseng et al.5.
Una consideración a tener en cuenta es que los pacientes con un grado de compresión Bilsky 2-3 en un único nivel y con una expectativa de vida de por lo menos 3 meses, podrían ser manejados con una descompresión quirúrgica y posterior SBRT siempre y cuando haya por lo menos 2mm de separación con la médula y el instrumental utilizado en la cirugía no interfiera con las imágenes para planificar el tratamiento de radioterapia9.
Planificación de la SBRTPara una adecuada realización de una SBRT vertebral se requiere de una inmovilización adecuada del paciente que permita la reproducibilidad interfracción, minimizando la incertidumbre y las posibles toxicidades. En general se usan sistemas de inmovilización rígidos, pero a la vez cómodos, como pueden ser los colchones de vacío. Si la localización es en columna cervical, se usan máscaras termoplásticas.
Para la delimitación de las diferentes estructuras, especialmente la médula espinal, y el contorneo del volumen diana, es imperativo la realización y fusión de imágenes de una resonancia magnética con secuencias T1-T2 que incluyan por lo menos un cuerpo vertebral por encima y por debajo de la zona que se quiere tratar.
Para la delimitación de los volúmenes de tratamiento de SBRT se emplea la guía del «International Spine Radiosurgery Consortium»(fig. 4)10.
Delimitación de los volúmenes de radioterapia empleados en SBRT espinal. Fuente: Cox et al.10.
Según este consenso internacional, se delimitan 3 tipos de volúmenes: GTV (Gross Tumor Volume) incluye la lesión tumoral visible tanto en el tac como en la fusión con la imagen de resonancia. El CTV (Clinical Target Volumen) abarca áreas de potencial extensión microscópica y un PTV (Planning Target Volume) es el margen del CTV que habitualmente es menor de 3mm, según localización de la lesión y la cercanía con la médula espinal. Adicionalmente, para evitar las incertidumbres tanto de posicionamiento como de movimiento intrafracción se contornea un volumen de seguridad de 2-3mm alrededor de la médula espinal (fig. 5).
Evidencia a favor de la SBRTGrandes estudios retrospectivos han demostrado la eficacia de la SBRT vertebral con control local duradero, supervivencia libre de progresión y tasas de paliación en aproximadamente un 70-95% de pacientes que reciben tratamiento por primera vez, en reirradiaciones o como tratamiento adyuvante después de la resección quirúrgica10.
Existen diferentes esquemas de tratamiento con SBRT que incluyen 18-24Gy en una sola fracción, 24Gy en 2 fracciones, 24-30Gy en 3 fracciones, 30Gy en 4 fracciones y 30-40Gy en 5 fracciones. La dosis viene determinada por localización, el tamaño tumoral, el riesgo de fractura vertebral (puede llegar al 39% en sesión única)11, la cercanía o no de la médula al volumen a tratar, además de la experiencia o las preferencias de cada centro para garantizar la reproducibilidad del tratamiento inter fracción.
Se ha descrito el mecanismo por el que la SBRT influye en el control local de la enfermedad. La exposición tumoral a una dosis por fracción de 8Gy o superior puede activar nuevas vías radiobiológicas que conducen a muerte celular a través de mecanismos que incluyen la respuesta inmune específica del antígeno tumoral inducida por radiación, lesión endotelial/vascular o simplemente aumento de la destrucción celular secundaria a una dosis administrada más alta10.
Como efecto asociado a la SBRT está descrito el «pain flare». Este consiste en un aumento transitorio del dolor, durante y al finalizar el tratamiento. Su incidencia es del 14-68%, y puede ser controlable administrando dexametasona de forma preventiva. Las fracturas por compresión vertebral pueden aparecer en un 11-39% de los casos. En análisis retrospectivos se han identificado como factores de riesgo las lesiones líticas, el compromiso>50% del cuerpo vertebral, tener una fractura de base y una columna mal alineada11. En general, un SINS intermedio/alto tiene mayor riesgo, por lo que estos pacientes se podrían beneficiar de técnicas quirúrgicas mínimamente invasivas para estabilización de la columna previa al tratamiento con SBRT11.
La mielopatía asociada a la SBRT es una complicación rara que se puede presentar en un 0,4% de los casos, y está condicionada por la dosis máxima que recibe la médula, según el esquema de tratamiento utilizado12.
La tolerancia de la médula espinal a 1, 3 o 5 fracciones está perfectamente descrita en la literatura. Las dosis establecidas como seguras para la médula en un tratamiento con SBRT son de 12,4Gy, 20,3Gy y 25,3Gy respectivamente, con un riesgo de mielopatía menor del 1%12.
Para reirradiaciones también hay información que nos permite tomar decisiones terapéuticas evitando el daño medular relacionado con la SBRT. Pero hay que tener en cuenta varios factores, la dosis inicial recibida y el fraccionamiento, el volumen a tratar en el segundo tratamiento, la dosis máxima acumulada en la médula y el tiempo transcurrido desde el primer tratamiento; con esto es posible definir si la reirradiación se debe realizar con fraccionamiento convencional o si es posible hacerla con SBRT.
Recientemente se ha publicado un estudio fase ii-iii (SC24) aleatorizado, realizado en Australia y Canadá en el que se compara el uso de SBRT (2 sesiones de 12Gy) con radioterapia externa a dosis convencionales paliativas (20Gy en 5 fracciones), para el control del dolor en metástasis vertebrales13. En este estudio participaron pacientes con metástasis vertebrales dolorosas confirmadas por resonancia magnética, con un máximo de 3 vértebras consecutivas afectadas, y sin inestabilidad de columna ni compresión medular. A los 3 meses del tratamiento el 35% de los pacientes tratados con SBRT tuvieron una respuesta completa al dolor, frente al 14% de los pacientes tratados con radioterapia convencional. Como efectos adversos se presentó dolor grado 3 en el 4% de pacientes y fractura vertebral grado 1 en el 11% tratado con SBRT, frente al 5% y al17% de los pacientes tratados con radioterapia convencional, sin llegar a producirse ningún fallecimiento. Por lo tanto, estos resultados indican que el uso de SBRT tiene mejores resultados en contexto paliativo, sin producir efectos adversos de relevancia13.
En una revisión sistemática realizada en 2020, se concluye que con la SBRT vertebral se consiguen tasas de control local al año del tratamiento del 90% en metástasis vertebrales de novo, superiores al 80% en el contexto de adyuvancia con radioterapia tras cirugía y superiores al 65% en casos de reirradiaciones. Como efecto adverso más común se observaron fracturas vertebrales en el 10-15% de los pacientes14.
Un ensayo aleatorizado fase 2/3 (RTOG0631) valoró el control del dolor a los 3 meses, con esquema de tratamiento 16Gy en una fracción en comparación con 8Gy en una fracción y aunque la fase 2 del estudio encontró que la fracción única de 16Gy/1 era segura, los resultados preliminares de la fase 3 informados en ASTRO 2019 (Sociedad Americana de Oncología Radioterápica) no evidenciaron ninguna mejora en el control del dolor en 3 o 6 meses después del tratamiento. Aunque se considera que el control del dolor a los 3 meses es un objetivo importante, las series de datos mencionados anteriormente indican que es más probable que la SBRT proporcione control del dolor y local a lo largo del tiempo15.
En 2018 se publicó los resultados de un estudio fase ii, aleatorizando a 55 pacientes con metástasis vertebrales de novo a recibir 30Gy en 10 fracciones versus 24Gy en una fracción de SBRT. Los resultados mostraron tasas de respuesta completa del dolor a los 3 meses en un 43,5% con SBRT vs. 17,4% con fraccionamiento convencional, siendo aun mayor a los 6 meses (52.6 vs. 10%) sin toxicidad G3 en el grupo de SBRT, ni casos de mielopatía en ninguno de los grupos16.
SBRT postoperatoriaEl valor de la cirugía en las metástasis vertebrales tiene potenciales ventajas, ya que puede proporcionar descompresión de estructuras neurales, estabilidad de columna y es útil para proporcionar diagnóstico con alivio sintomático neurológico17.
Para tratar metástasis vertebrales se usan diferentes abordajes quirúrgicos, y el objetivo principal es resecar el mayor volumen tumoral posible. Sin embargo, la cirugía sola no puede eliminar por completo la enfermedad, requiriendo de forma habitual un tratamiento complementario con radioterapia17.
Un concepto reciente de manejo de las metástasis vertebrales es la «cirugía de separación», que tiene como concepto el restaurar la distancia anatómica entre el tumor y la médula, por medio de técnicas microquirúrgicas que permiten descomprimir el canal medular, y lograr una distancia entre el tumor y la médula de por lo menos 2-3mm, lo que permite administrar dosis altas de radiación, minimizando la posible toxicidad medular17.
Varios estudios han demostrado el valor de la radioterapia tras la cirugía en paciente con compresión medular. Más recientemente, el estudio multicéntrico norteamericano AOSpine, confirmo que, en pacientes con compresión medular sintomática, la intervención quirúrgica proporcionó una mejoría inmediata y sostenida en el estado ambulatorio postoperatorio, la calidad de vida y la escala de dolor18.
La cirugía también está indicada para la inestabilidad mecánica, ya que el dolor causado por la inestabilidad no se palia eficazmente solo con la radioterapia.
Una revisión sistemática publicada en 2021 ha encontrado una tasa de control local a un año del 70-95%18. Algunos de estos estudios describen factores predictivos de respuesta, como son la enfermedad epidural residual tras la cirugía, el grado de compresión (Bilsky) al diagnóstico, la dosis de SBRT (18-26Gy en sesión única vs. 18-40 en 3-5 fracciones), determinadas histologías como sarcomas y alto volumen tumoral, el control del dolor a los 3-6 meses, el índice de Karnofsky y la posibilidad de recibir tratamiento sistémico. Los resultados muestran un perfil de toxicidad bajo, con riesgo de fractura por compresión vertebral del 5,6%18.
Como indicaciones para SBRT postoperatoria están:
- •
Pacientes con enfermedad oligometastásica y/o con largas supervivencias.
- •
Pacientes con gran volumen tumoral con histologías radiorresistentes como sarcomas, carcinoma renal, de colon y melanoma.
- •
Pacientes con radioterapia externa previa, susceptibles de resección.
Las dosis de SBRT pueden ser variables, pero se ha visto que dosis más altas logran mejor control local: 18-26Gy en 1-2 fracciones o 27Gy en 3 fracciones alcanzan más control local de la enfermedad con respecto a 24-30Gy en 5 fracciones. Las tasas de control local son del 84-95% en diferentes series5.
El material utilizado en la cirugía es importante para la planificación del tratamiento y la delimitación de volúmenes: los materiales con fibra de carbono reducen el artefacto y disminuyen la incertidumbre en las dosimetrías18.
Los tiempos recomendados para administrar el tratamiento no deben sobrepasar las 4 semanas tras la cirugía. Se recomienda una semana para procedimientos mínimamente invasivos y 2 semanas tras cirugía abierta18.
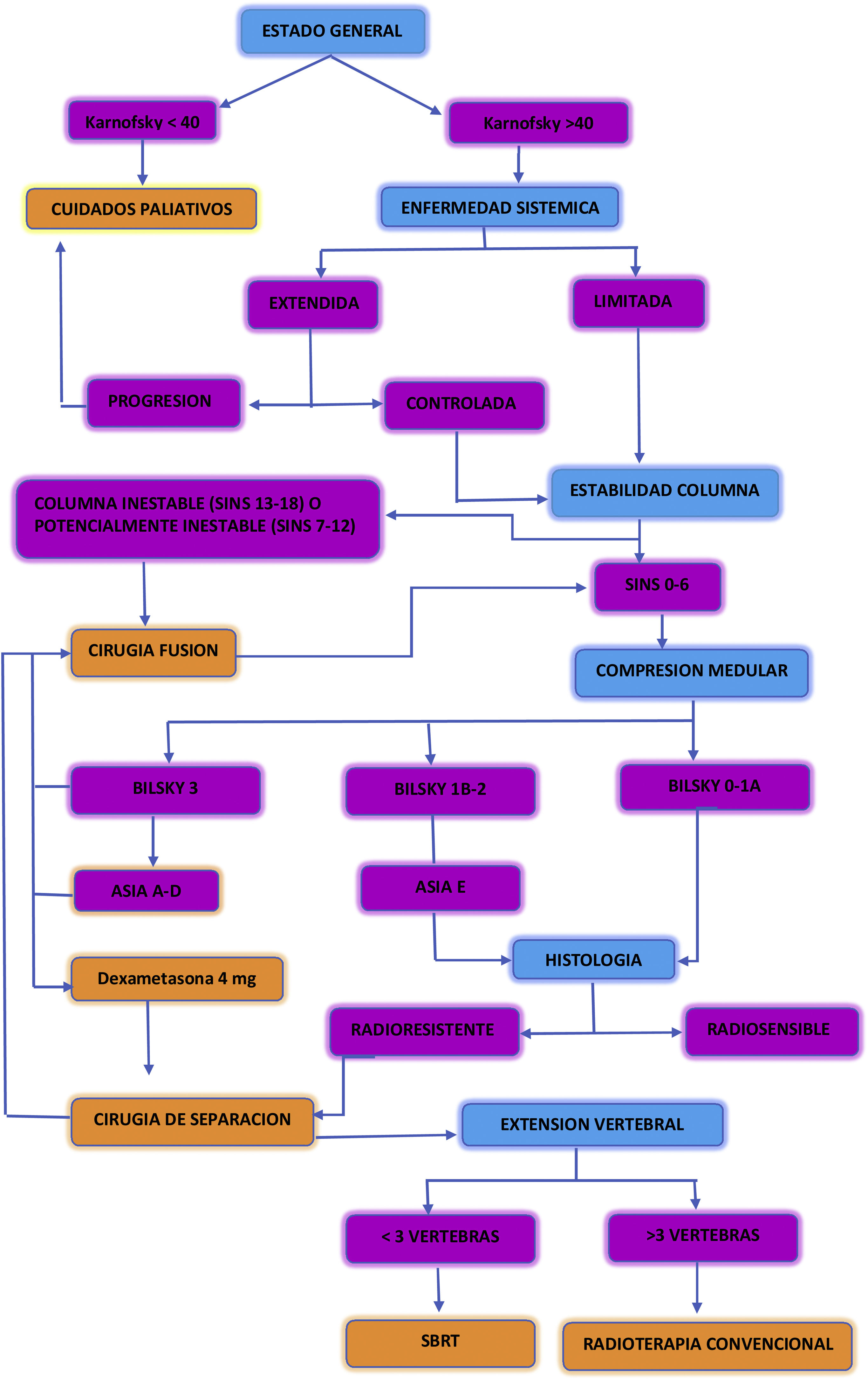
En la figura 6 se describe un algoritmo de decisiones propuesto en el manejo de los pacientes con metástasis vertebrales17.
Algoritmo de decisiones propuesto en el manejo de los pacientes con metástasis vertebrales. Adaptada de: Conti et al.17.
La principal ventaja de la terapia de protones sobre la radioterapia basada en fotones es una mejor distribución de dosis, con alta conformidad y gradiente de dosis, disminuyendo al mismo tiempo la dosis integral a los tejidos sanos, gracias a las propiedades físicas de los protones19.
Por lo general, se recomienda la protonterapia para disminuir los posibles efectos secundarios relacionados con la radioterapia, en tumores con buen pronóstico o para escalar la dosis con el objetivo de aumentar el control local. En el cordoma y condrosarcoma espinal, la terapia de protones se considera como un estándar en el entorno postoperatorio o para enfermedad irresecable. Los ensayos clínicos han demostrado que la protonterapia permite aumentar la dosis de tratamiento sin complicaciones, a pesar de la proximidad con órganos en riesgo como la médula20–22.
Por sus propiedades físicas y la experiencia clínica obtenida en el tratamiento de los sarcomas espinales, la protonterapia podría tener beneficio también para el tratamiento de las metástasis vertebrales.
No existen ensayos clínicos que consideren el tratamiento de las metástasis vertebrales, más que en un escenario paliativo. Teniendo en cuenta el contexto actual, de acceso limitado a la terapia de protones, las metástasis vertebrales no se consideran dentro de las indicaciones actuales. Pero a pesar de la falta de datos clínicos, la terapia de protones podría valorarse en pacientes seleccionados con enfermedad oligometastásica de buen pronóstico, o en pacientes que hayan recibido tratamientos previos de radioterapia cerca del tumor primario.
En comparación con la técnica basada en fotones, con protones se usan esquemas hipofraccionados. En un estudio comparativo de planificación entre SBRT con IMRT (Intensity Modulated Radiation Therapy) versus terapia de partículas (Carbon Ion Therapy y protones), Rief et al. demostraron un beneficio de la terapia de partículas en la preservación de la médula espinal, sin diferencias significativas en la cobertura del volumen a tratar. Para otros órganos como el pulmón o el intestino, la dosis también se redujo, pero la ventaja fue menor, teniendo en cuenta que la dosis administrada con IMRT ya estaba dentro de la tolerancia de los tejidos normales23.
En los casos de tratamiento postoperatorio, hay que tener precaución en el caso de los materiales de fijación. La presencia de material metálico cerca del tumor puede afectar la precisión de la planificación debido a los artefactos en el tac de planificación y la dosimetría24.
Debido a estas incertidumbres, la radioterapia preoperatoria con protones es preferible, siempre que sea posible. Si la cirugía se realiza en primer lugar, se recomienda el uso de algoritmos comunes de reducción de artefactos metálicos, uso de tac con energía dual, que permitan mejorar la calidad de la imagen, facilitar el contorneo, y reducir las incertidumbres de cálculo de dosis. También se requiere la integración de la composición de los implantes en el cálculo de dosis. Se prefieren las trayectorias balísticas que eviten el paso del haz de radiación a través del material metálico25. Los implantes no metálicos como polieteretercetona reforzada con fibra de carbono son un material prometedor para superar esas dificultades26.
ConclusionesEl tratamiento de las metástasis vertebrales es complejo y requiere de un abordaje multidisciplinar, teniendo en cuenta los diferentes factores, para lograr el mejor resultado clínico para el paciente.
La SBRT es un tratamiento efectivo y seguro para pacientes con metástasis vertebrales, con la capacidad de administrar dosis ablativas evitando órganos sanos, en pocos días de tratamiento. El desafío principal es el criterio de selección de los pacientes, ya que no todos son candidatos a SBRT. Pero está claramente demostrado el beneficio en pacientes oligometastásicos, con enfermedad localizada y columna estable, tanto para control sintomático del dolor, como local de enfermedad.
Los cirujanos de columna desempeñan un papel fundamental en muchos de estos pacientes, ya que por medio de técnicas quirúrgicas mínimamente invasivas se pueden realizar tratamiento combinados que mejoren los resultados oncológicos de estos pacientes.
Nivel de evidenciaNivel de evidencia i.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.