Analizar el efecto de las plaquetas sobre el crecimiento de cartílago en los defectos articulares provocados en la rodilla ovina.
Material y métodoSe provocó un defecto de 4mm de diámetro y 3mm de profundidad en la tróclea femoral de ambas rodillas en corderos macho de 6 meses de edad. La distribución de los grupos fue: grupo A (n=6): el defecto de la rodilla derecha se rellenó con concentrado de plaquetas 5min después de ser activado con ClCa. Grupo B (n=6): el defecto se rellenó con colágeno y plaquetas.
Las plaquetas se obtuvieron por centrifugación de 10ml de sangre arterial obtenida de cada animal antes de la cirugía. En los defectos de la rodilla izquierda no se administraron plaquetas. Las ovejas fueron sacrificadas 10 semanas después de la cirugía. Se realizaron estudios macro y microscópicos.
ResultadosEn el grupo A, se observó cartílago hialino en 4 de los defectos de la rodilla derecha a las 10 semanas de la cirugía. Ninguno de los defectos de la rodilla izquierda mostró crecimiento de cartílago hialino. En el grupo B, no se observó cartílago hialino en nigún defecto. No obstante, todos los defectos presentaron mejor celularidad condral y menor fibrosis en los defectos tratados con plaquetas que en los no tratados.
ConclusionesEsta técnica para la reconstrucción con plaquetas de defectos articulares de oveja ha mostrado en nuestro estudio resultados esperanzadores que empeoran combinadas con un andamiaje de colágeno.
To study the influence of platelets on cartilage growth in articular defects in the sheep knee.
Material and methodsMale Rasa Aragonesa sheep (6 months) were operated under general anaesthesia. A 4mm diameter and 3mm deep defect was made in the femoral trochlea in both knees. The right knee defect was filled with platelet concentrate 5min after being activated with ClCa in group A (n=6), and similarly activated platelets + collagen scaffold in group B (n=6). Platelets were obtained by centrifuging 10ml arterial blood from the sheep prior to the surgical procedure. The left knee defect was not filled. The sheep were sacrificed 10 weeks after surgery. Macroscopic and microscopic studies were performed.
ResultsIn group A, hyaline cartilage was observed in the right knee defect at the end of the experiment in four cases. None of the defects of the left knees showed hyaline cartilage growth. In group B, hyaline cartilage was not observed in any right knee defect. However, in group B, all sheep showed better chondral cellularity and regeneration and lower fibrosis in the defects treated with platelets than in non-treated ones.
ConclusionsThis technique for articular defect reconstruction with platelets has shown satisfactory results in our study. However, collagen scaffolds may decrease this positive effect.
El cartílago articular posee escasa capacidad para la autorreparación, por lo que las lesiones no tratadas suelen degenerar en artrosis1–5. De hecho, después de lesionarse la superficie articular se suele formar fibrocartílago, el cual posee características biomecánicas inferiores a las del cartílago hialino6. Por eso, las lesiones del cartílago articular tienen un mal pronóstico.
Las plaquetas son ricas en factores de crecimiento y han mostrado efectos positivos sobre la diferenciación y proliferación del cartílago in vitro7–10. El factor BB de crecimiento derivado de las plaquetas (PDGF-BB) promueve la proliferación de condrocitos en matrices de poliglicólico8. El factor 2 de crecimiento fibrobástico (FGF2) fomenta la formación de cartílago in vitro en partículas de hidroxiapatita con células estromales de la médula ósea humana9. Kaps et al10 vieron que el sobrenadante plaquetario humano estimulaba el crecimiento de condrocitos articulares y del tabique nasal. También se han demostrado efectos positivos sobre la reconstrucción de defectos articulares en algunos modelos experimentales con conejos11,12.
Entre las técnicas para la reparación de defectos articulares destaca la implantación de células autólogas en suspensión o con una gran variedad de matrices como soporte celular. Las matrices aportan una estructura tridimensional que puede ayudar para la reconstrucción articular. Varios autores han empleado matrices de colágeno en los defectos articulares13–18. El colágeno tipo i se emplea en la clínica humana y es considerado como un material cito-compatible con sitios de reconocimiento para las integrinas19. Pound et al20 observaron la síntesis significativa de matriz celular en bioreactores con médula ósea y colágeno tipo i a la vez que un aumento de la proliferación celular. El colágeno activa a las plaquetas y puede generar un ambiente positivo para la reparación del cartílago. Por todo ello, se planteó como hipótesis de trabajo que el concentrado de plaquetas podría favorecer la reparación de los defectos cartilaginosos creados en la rodilla del cordero. También se consideró la posibilidad de que una matriz de colágeno asociado a las plaquetas pudiera servir de soporte de las mismas.
Material y métodoSe emplearon corderos macho (raza aragonesa) de 6 meses de edad. Esta edad corresponde en el cordero a la madurez esquelética. El experimento consistió en crear defectos condrales en ambas rodillas. Las ovejas fueron sacrificadas 10 semanas después de la cirugía. Se realizaron estudios macro y microscópicos.
Todos los experimentos animales fueron aprobados por el Comité Ético de la Universidad de Zaragoza.
Muestras de sangreLas plaquetas se obtuvieron por centrifugación (1.500rpm) de 10ml de sangre arterial (citratada al 10%) obtenida de cada animal, 10min antes de la cirugía. El número de plaquetas se midió antes y después del centrifugado mediante impedanciometría (ABBOTT® CellDyn 3500R). La media del número de plaquetas previo al centrifugado fue de 84×109/l, y tras la centrifugación fue de 260×109/l, viendo que mediante este procedimiento la concentración de plaquetas se incrementó tres veces. Se obtuvo el sobrenadante plaquetario (3ml) al que se añadió 1ml de cloruro cálcico (ClCa 9mg/ml).
Procedimiento quirúrgicoSe administró 1 gramo de amoxicilina y ácido clavulánico antes de la cirugía y 12h después. Bajo anestesia general (intramuscular: xilacina 0,1mg/kg, ketamina 5mg/kg, buprenorfina 0,01mg/kg y propofol 6mg/kg) mediante una incisión de 4cm parapatelar medial, se provocó un defecto, hasta llegar a hueso subcondral, de 4mm de diámetro y 3mm de profundidad en la tróclea femoral de ambas rodillas con un dispositivo metálico especialmente diseñado para el experimento. En el grupo A (n=6) el defecto de la rodilla derecha se rellenó con concentrado de plaquetas 5min después de ser activado con ClCa; en el grupo B (n=6) el defecto se rellenó con colágeno tipo i bovino (Hemotese®, Symatese biomatériaux, Chaponost, Francia) que fue mezclado con plaquetas procesadas (estas se inyectaron sobre el colágeno que rellenaba el defecto condral) al igual que en el grupo A.
Los defectos de las rodillas izquierdas no fueron tratados con plaquetas, y sirvieron como control.
La cápsula articular y el tejido subcutáneo fueron suturados con ácido poliglicólico 3/0 y la piel con seda del 0. La libre deambulación se permitió tras la cirugía. Las ovejas fueron sacrificadas 10 semanas tras la cirugía mediante una dosis letal de pentobarbital endovenoso (Dolethal®, Vetoquinol S.A., Lure Cedex, Francia).
Estudio histológicoTras el sacrificio se extrajeron las rodillas y fueron incluidas en formaldehido al 10% durante una semana por lo menos, y decalcificadas con 0,5M EDTA (pH 7,4) durante dos semanas. Las piezas fueron pasadas por decrecientes gradaciones de etanol, lavadas en solución salina tamponada con fosfato, e incluidas en parafina a 60°C. Se realizaron cortes con el microtomo de 7mm de espesor y se almacenaron a 4°C. Después, fueron teñidas con hematoxilina-eosina. Las preparaciones se estudiaron al microscopio con ópticas de 10 y 20 aumentos. Las preparaciones fueron evaluadas independientemente por dos de los investigadores. Se aplicó una escala semicuantitativa para la gradación del daño y de los cambios degenerativos21 puntuando de 0 a 3. Una puntuación de 0 correspondía a graves daños o cambios degenerativos sin diferenciación de cartílago ni signos proliferativos; 1 punto: cambios degenerativos moderados, ligeros signos de diferenciación y proliferación; 2 puntos: diferenciación cartilaginosa y signos proliferativos sin cartílago hialino; 3 puntos: tejido similar al cartílago normal hialino.
EstadísticaLa prueba de la U de Mann-Whitney fue empleada para comparar grupos no pareados. La prueba de Wilcoxon se empleó para los grupos pareados. Se consideraron como significativos los valores p<0,05.
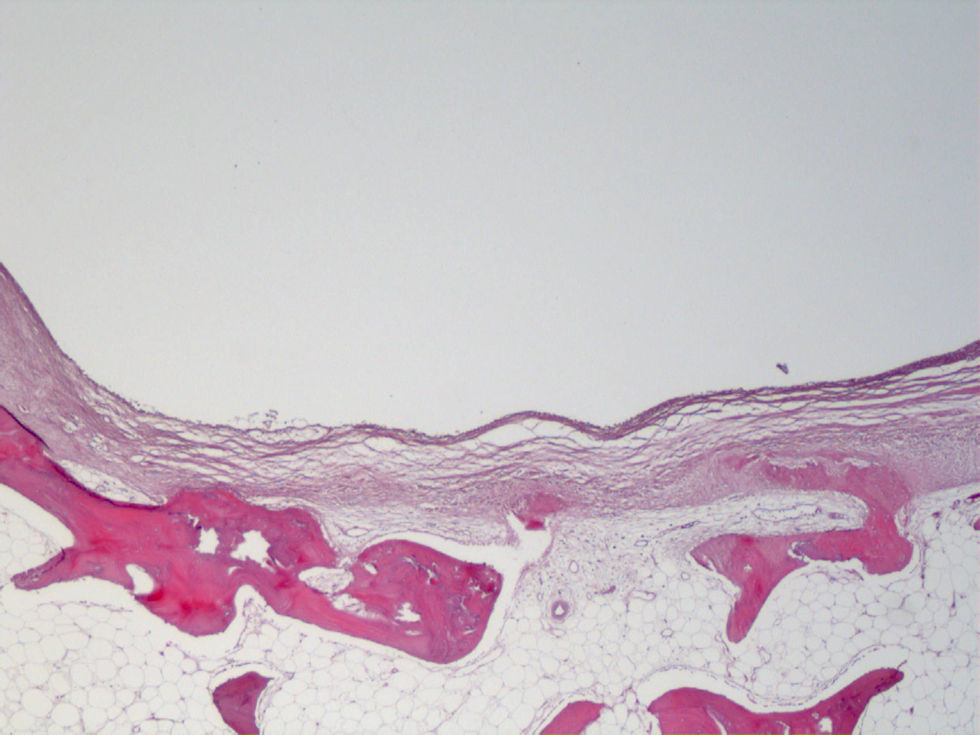
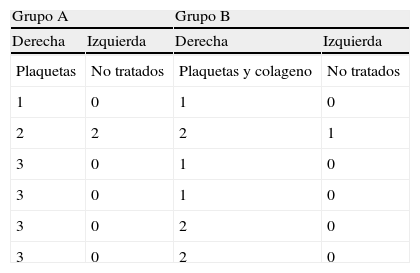
ResultadosEn el grupo A se observó cartílago hialino rellenando el defecto de la rodilla derecha a las 10 semanas de la cirugía (fig. 1) en cuatro casos. Las puntuaciones de la escala semicuantitativa de gradación histológica se presentan en la tabla 1. En dos casos los defectos tratados aparecieron completamente rellenos del nuevo tejido, en dos casos la reconstrucción fue irregular cubriendo solo el 75% de la superficie del defecto, en un caso el nuevo tejido resultaba ligeramente excrecente, y en otro caso el nuevo tejido rellenó solo el 50% del defecto. En las rodillas izquierdas (defectos no tratados) (fig. 2) los resultados histológicos fueron peores. Las diferencias entre las puntuaciones de las rodillas derechas y las izquierdas fueron significativas (p=0,034). Tres de los defectos no tratados presentaron un relleno completo del defecto, uno de los defectos no tratados presentó un relleno cercano al 75%, y dos defectos aparecieron rellenos con menos del 50%. No hubo correlación entre la escala semicuantitativa de daño y el mayor o menor relleno del defecto con nuevo tejido en las rodillas derechas o izquierdas.
Resultados de la gradación histologica de los defectos condrales a las 10 semanas de la cirugía, según una escala semicuantitativa
| Grupo A | Grupo B | ||
| Derecha | Izquierda | Derecha | Izquierda |
| Plaquetas | No tratados | Plaquetas y colageno | No tratados |
| 1 | 0 | 1 | 0 |
| 2 | 2 | 2 | 1 |
| 3 | 0 | 1 | 0 |
| 3 | 0 | 1 | 0 |
| 3 | 0 | 2 | 0 |
| 3 | 0 | 2 | 0 |
(0 corresponde a graves daños; 1 punto: cambios degenerativos moderados, ligeros signos de diferenciación y proliferación; 2 puntos: diferenciación cartilaginosa y signos proliferativos sin cartílago hialino; 3 puntos: tejido similar al cartílago normal hialino).
En el grupo B no encontramos cartílago hialino en los defectos creados. Si bien, los defectos tratados en este grupo presentaron mejores resultados que los controles no tratados. En este grupo todos los defectos tratados con plaquetas y colágeno (fig. 3) presentaron mayor celularidad condral y regeneración y menos fibrosis que los no tratados con plaquetas. Las diferencias entre las puntuaciones de la escala semicuantitativa de gradación histológica (tabla 1) de los defectos tratados y no tratados fueron significativas (grupo B: p=0,039). Encontramos diferencias significativas entre las rodillas derechas del grupo A y el B (U-Mann-Whitney p 0,042). En el grupo B dos de los defectos tratados presentaron un rellenado completo del defecto, dos defectos presentaron cerca del 75%, y dos defectos se rellenaron menos del 50%. Tres de los defectos no tratados presentaron un rellenado completo del defecto, un defecto presentó cerca del 75%, y dos defectos se rellenaron menos del 50%. No encontramos diferencias interobservador con respecto a la gradación histológica.
DiscusiónEn anteriores trabajos11,12 publicamos los efectos positivos de los concentrados plaquetarios sobre la reconstrucción de los defectos articulares en un modelo experimental en conejo. No encontramos en la bibliografía estudios similares en animales no pequeños, por lo que se planteó el presente trabajo con corderos, siendo este un modelo más próximo al humano. En este trabajo hemos observado que el efecto positivo de los concentrados plaquetarios se presenta también en la reconstrucción de defectos cartilaginosos articulares en los corderos. Esto creemos que se debe al efecto positivo de los factores plaquetarios, ya comentados en la introducción, sobre las células de la médula ósea estimulando la formación de tejido condral en el entorno articular.
No se emplearon medios para fijar las plaquetas en el defecto. Las plaquetas activadas con el calcio tienden a formar una masa que queda confinada en la lesión. Es cierto que al no haber un medio de sujeción específico parte puede perderse, pero a pesar de eso el experimento muestra un efecto positivo sobre los defectos tratados con plaquetas. Tras revisar la bibliografía pensamos que el empleo de soportes de colágeno i conjuntamente con los concentrados plaquetarios podría ayudar en la reconstrucción de los defectos articulares. Funayama et al17 inyectaron condrocitos incluidos en un gel de colágeno ii en defectos cartilaginosos en conejos, encontrando que el gel de colágeno ii se comportaba como un andamiaje adecuado para el trasplante de condrocitos. Chajra et al18 compararon el comportamiento de condrocitos bovinos cultivados en matrices de colágeno, uno de ellos fue Hemotese®, el mismo que el empleado en nuestro caso, conteniendo o no hidroxiapatita y glutaraldehido o EDC/NHS, obteniendo un resultado similar de las células en los cuatro tipos de andamiaje empleados. Yates et al13 señalaron que las esponjas porosas de colágeno mantienen la viabilidad, forma y actividad de los condrocitos articulares bovinos. Lubiatowski et al14 observaron en conejos la presencia de cartílago similar al hialino en defectos penetrantes en la estructura subcondral y rellenos con andamiaje de colágeno a las 4 y a las 12 semanas. Por el contrario, Dorotka et al22 encontraron que la implantación de una matriz de colágeno aislada no mejoraba la reparación de los defectos condrales producidos en el cóndilo medial femoral de la oveja. Estos autores21 encontraron también que los defectos que no penetraban en el hueso subcondral presentaron la menor cantidad de rellenado del defecto, y que la técnica de microfracturas aumentaba la respuesta curativa. Malicev et al15 emplearon matrices de colágeno tipo i equino con condrocitos articulares humanos. Los preparados con gel de fibrina o plasma humano mostraron mejores resultados que los preparados sin el gel. Los condrocitos implantados directamente en un andamiaje de colágeno presentaron una forma fibroblástica, mientras que aquellos encapsulados en un gel de fibrina se mostraron esféricos. Esto indicaría que el empleo directo de un andamiaje de colágeno no es útil sin un procesado previo de los condrocitos con factores adicionales. La ausencia de procesado celular previo puede haber influido en el resultado negativo del grupo de colágeno en nuestro trabajo. Además, el trabajo de Malicev et al15 mostraría la compatibilidad de los condrocitos humanos con matrices de colágeno procedentes de otra especie animal. Cook et al23 encontraron tejido fibroso y fibrocartílago rellenando los defectos osteocondrales provocados en los cóndilos femorales de perros adultos y tratados con 100mg de implantes de colágeno bovino tipo i derivado de hueso. A pesar de la compatibilidad interespecies en estos trabajos, en nuestro trabajo el uso de un colágeno tipo i bovino en un modelo ovino, podría haber contribuido al resultado negativo del grupo de colágeno.
Se ha demostrado el efecto positivo de las plaquetas para el crecimiento de los condrocitos implantados subcutáneamente en conejos24. Es posible que la presencia del colágeno actúe de barrera entre los factores plaquetarios y las células a estimular.
Nuestro estudio tiene algunas deficiencias. No hemos estudiado otras matrices que pudieran colaborar con el resultado positivo de las plaquetas sobre la reconstrucción de defectos articulares. Realizamos un estudio de los resultados a las 10 semanas, lo cual ha resultado útil para valorar los efectos a medio plazo, sin embargo, creemos que deberían realizarse estudios en periodos más largos de tiempo. Para el presente estudio hemos empleado un modelo experimental en oveja, no siendo por ello extrapolables todas las conclusiones a los humanos.
El concentrado de plaquetas mostró un efecto beneficioso sobre el crecimiento de condrocitos en los defectos articulares en corderos. Sin embargo, los resultados empeoraron cuando empleamos matrices de colágeno tipo i asociados a las plaquetas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.