Evaluar con un modelo animal de osteoartrosis (conejos de raza Nueva Zelanda) la eficacia del tratamiento con viscosuplementos activos (ácido hialurónico [AH]) cargado con nanopartículas (NP) que encapsulan compuestos o fármacos antiinflamatorios.
Material y métodosEstudio experimental compuesto de cinco grupos de conejos a los que se realizó la sección del ligamento cruzado anterior (LCA) y resección del menisco interno para desencadenar cambios degenerativos y usarlo como modelo de osteoartrosis. Los grupos se dividieron en osteoartrosis sin tratamiento (I), tratamiento con AH comercial (II), tratamiento con AH con NP vacías (III), tratamiento con AH con NP que encapsulan dexametasona (IV) y tratamiento con AH con NP que encapsulan cúrcuma (V). En los grupos II a V se realizó la infiltración del compuesto correspondiente espaciándolas una semana.
Se realizó un análisis histológico macroscópico mediante una escala basada en la clasificación de Outerbridge para la artrosis.
ResultadosObservamos que dicho modelo de osteoartrosis es reproducible y se aprecian cambios degenerativos similares a los que se encuentran en el ser humano.
Los grupos a los que se infiltró AH con NP cargadas con curcumina (V), seguido del grupo de dexametasona (IV) presentaron macroscópicamente menos fibrilación, exposición de hueso subcondral y esclerosis (mejor puntuación en la escala) que los grupos de control (I) (osteoartrosis sin tratamiento), el grupo (II) tratado con AH comercial y el de AH con NP sin fármaco (III).
ConclusionesEl uso de viscosuplementos activos podría tener un efecto adicional al tratamiento convencional de AH por su efecto antioxidante y antiinflamatorio, siendo el grupo más prometedor el de las NP que encapsulan curcumina y en segundo lugar el de dexametasona.
To evaluate with an animal model of osteoarthritis (New Zealand rabbits) the effectiveness of treatment with active viscosupplements (hyaluronic acid loaded with nanoparticles (NPs) that encapsulate anti-inflammatory compounds or drugs.
Material and methodsExperimental study composed of 5 groups of rabbits in which section of the anterior cruciate ligament and resection of the internal meniscus were performed to trigger degenerative changes and use it as a model of osteoarthritis. The groups were divided into osteoarthrosis without treatment (I), treatment with commercial hyaluronic acid (HA) (II), treatment with HA with empty nanoparticles (III), treatment with HA with nanoparticles encapsulating dexamethasone (IV) and treatment with HA with nanoparticles that encapsulate curcumin (V). In groups II to V, the infiltration of the corresponding compound was carried out spaced one week apart.
Macroscopic histological analysis was performed using a scale based on the Outerbridge classification for osteoarthritis.
ResultsWe observed that this osteoarthritis model is reproducible and degenerative changes similar to those found in humans are observed.
The groups that were infiltrated with hyaluronic acid with curcumin-loaded nanoparticles (V), followed by the dexamethasone group (IV) presented macroscopically less fibrillation, exposure of subchondral bone and sclerosis (better score on the scale) than the control groups (I) (osteoarthritis without treatment), group (II) treated with commercial hyaluronic acid and hyaluronic acid with nanoparticles without drug (III).
ConclusionsThe use of active viscosupplements could have an additional effect to conventional hyaluronic acid treatment due to its antioxidant and anti-inflammatory effect. The most promising group was hyaluronic acid with nanoparticles that encapsulate curcumin and the second group was the one that encapsulates dexamethasone.
La artrosis es la enfermedad crónica articular más frecuente y actualmente existen pocos tratamientos efectivos, de los cuales ninguno ha demostrado retrasar la progresión de la enfermedad.
Puede afectar tanto a pequeñas como a grandes articulaciones, siendo la rodilla en términos de sintomatología y confirmación radiológica la articulación más afectada, con más del 10% de los hombres y 13% de las mujeres afectados por encima de los 60 años1.
Es una patología que produce dolor y repercute directamente en la movilidad y autonomía de los pacientes, además de vincularse indirectamente con otras comorbilidades como las enfermedades cardiovasculares o la hipertensión.
Supone la primera causa de incapacidad permanente y la tercera de incapacidad laboral temporal, eso sin mencionar el coste que supone al sistema sanitario anualmente2.
El tratamiento de la osteoartrosis incluye medidas terapéuticas generales, médicas y quirúrgicas en función de la evolución y progresión de la enfermedad:
Entre las medidas generales se encuentran la modificación de estilo de vida, fisioterapia, fármacos de acción sintomática lenta (SYSADOA), antiinflamatorios no esteroideos (AINE) vía oral y tópica, inyecciones intraarticulares con corticoides, ácido hialurónico (AH), plasma rico en plaquetas y células madre mesenquimales1,2.
Si los tratamientos previos fracasan, se opta por el tratamiento quirúrgico: lavado articular, perforaciones subcondrales, osteotomías, injertos de cartílago o artroplastias.
Uno de los tratamientos más utilizados antes del recambio protésico son las inyecciones exógenas de AH con el objetivo de restaurar las propiedades viscoelásticas del líquido sinovial que están comprometidas1.
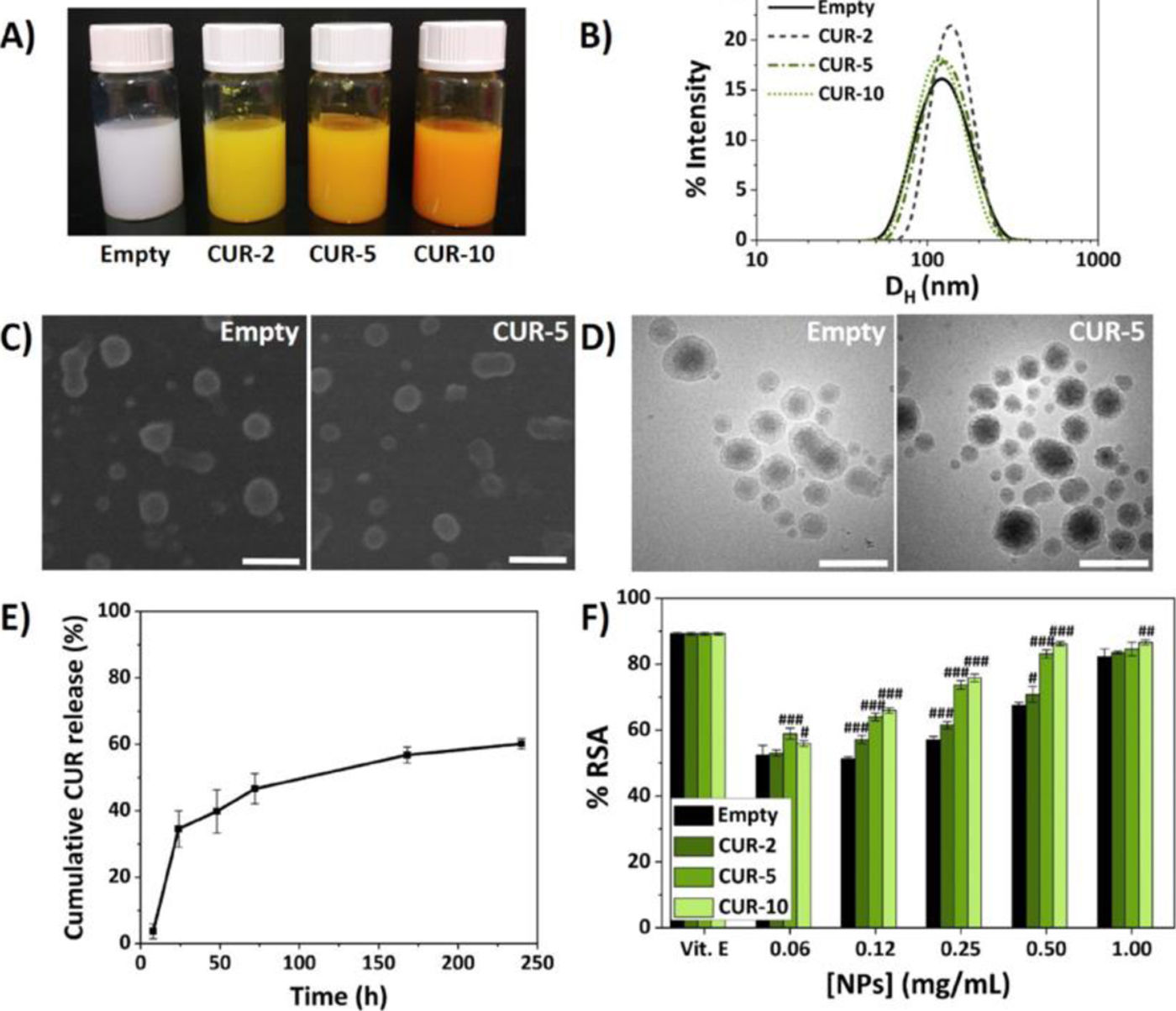
Con el fin de aportar un beneficio adicional al efecto de viscosuplementación que se aplica actualmente en clínica, se propone la utilización de un viscosuplemento que además contenga nanopartículas (NP) poliméricas basadas en la vitamina E que encapsulan diferentes compuestos o fármacos antiinflamatorios (curcumina, celecoxib o dexametasona)3.
Material y métodosPreparación de los materiales: viscosuplementos activos y NPLas NP son polímeros derivados de la vitamina E, desarrolladas en el Instituto de Ciencia y Tecnología de Polímeros - Consejo Superior de Investigaciones Científicas (ICTP-CSIC) de Madrid, que tienen la capacidad de encapsular diferentes fármacos.
Previamente a nuestro modelo in vivo se han realizado estudios in vitro para la caracterización de los viscosuplementos activos, valoración de la toxicidad celular sobre cultivos celulares con macrófagos y condrocitos y por último la inyectabilidad de las NP sobre tejido subcutáneo de la rata3.
El grupo ICTP-CSIC desarrolla biomateriales para el sector biomédico, en especial polímeros con aplicación en ingeniería tisular, sistemas de liberación controlada de compuestos bioactivos y medicamentos poliméricos.
Uno de los trabajos se centró en la adición de NP poliméricas basadas en la vitamina E y cargadas con diferentes antiinflamatorios, con el objetivo de proporcionar un beneficio adicional al efecto del viscosuplemento (AH), como son el efecto antioxidante y antiinflamatorio3–5.
In vitro se sintetizaron y caracterizaron las propiedades fisicoquímicas de las NP para determinar las formulaciones con sus tamaños hidrodinámicos (Dh), índices de polidispersidad (PDI) y eficiencias de encapsulación.
En la figura 1 se muestran los estudios de biocompatibilidad de las NP que encapsulan curcumina.
Caracterización de las NP5.
Se realizaron además ensayos de citotoxicidad utilizando la línea celular de macrófagos de ratón RAW 264.7 (Sigma-Aldrich) y condrocitos humanos CH-a (INNOPROT) y ensayos para la medición del efecto antioxidante por 2,2-difenil-1-picrilhidracilo (DPPH) y antiinflamatorio por medición de óxido nítrico (NO) en macrófagos3–5.
Una vez caracterizadas las NP se diseñaron formulaciones poliméricas inyectables mediante la disolución del AH de alto peso molecular en las dispersiones de NPs preparadas anteriormente y se entrecruzaron con divinil sulfona (DVS), consiguiendo propiedades reológicias en términos de viscosidad (Ǵ y Ǵ́) muy parecidas o superiores a dos viscosuplementos comerciales (Adant® y Hyalone®)3–5.
Modelo animalSe eligió el modelo animal en conejos por la semejanza anatómica de la rodilla con la del ser humano, la disponibilidad y tamaño de la articulación.
Se siguieron las directrices Animal research reporting In Vivo experiments (ARRIVE), así como las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia (R.D 53/2013), además de las recomendaciones para el punto final humanitario (Directiva 63/2010/UE). Dado que se trata de un proyecto en animales se aplicaron los métodos de reemplazo, reducción y refinamiento.
Antes del inicio del proyecto se realizaron los cursos de formación y procedimientos necesarios para conseguir la capacitación requerida (A, B, C y D) según R. D. 53/2013 (BOE 8 de febrero de 2013) y O. ECC 566/2015 (BOE 1 de abril de 2015).
Además, el proyecto fue valorado por el comité de ética animal del hospital y recibió la aprobación de la dirección general de agricultura, ganadería y alimentación (consejería de medio ambiente, ordenación del territorio y sostenibilidad) con código de registro ES280790000092.
La realización del estudio con un modelo animal es fundamental para valorar los cambios que se producen macro y microscópicamente con el uso de esta nueva herramienta terapéutica para la artrosis.
Por otro lado, se usó la escala para el dolor Rabbit Grimace Scale (RbtGs) basada en cinco acciones: cierre orbitario (0-2), aplanamiento de mejillas (0-2), forma de la nariz (0-2), cambio y posición del bigote (0-2), posición y forma de orejas (0-2) durante cada uno de los procedimientos6.
El objetivo del estudio fue valorar y caracterizar la respuesta de estos nuevos viscosuplementos y sus beneficios en sistemas «in vivo» (conejos de raza Nueva Zelanda), después de inducir osteoartrosis en los mismos mediante el modelo denominado seccionar el ligamento cruzado anterior (LCA)7–9.
Se incluyeron cinco grupos de animales: grupo I Osteoartritis sin tratamiento (grupo control de dos conejos), grupo II (n=5) AH entrecruzado comercial (Adant®), grupo III (n=5) AH entrecruzado cargado con NP sin fármaco (grupo control), grupo IV (n=5) AH entrecruzado cargado con NP que encapsulan dexametasona y grupo V (n=5) AH entrecruzado cargado con NP que encapsulan curcumina.
Procedimiento quirúrgicoLos conejos utilizados fueron todas hembras de la raza Nueva Zelanda (granja de San Bernardo. Navarra. España) de 16 semanas de 3,5kg, aproximadamente. Tras un periodo de aclimatación de una semana, se les realizó de forma unilateral aleatorizada la sección del LCA, asociada a meniscectomía interna a través de un abordaje parapatelar medial.
Se comprobó la inestabilidad creada con la maniobra del cajón anterior.
El procedimiento fue llevado a cabo en los quirófanos del animalario del Hospital Ramón y Cajal, después de un ayuno previo de dos horas, bajo medidas de asepsia y antisepsia, antibioterapia intraoperatoria, analgesia y sedación anestésica, así como monitorización de constantes.
InfiltracionesA partir de la cuarta semana, tras la intervención quirúrgica, se realizó semanalmente la infiltración de viscosuplementación intraarticular en cada uno de los grupos correspondientes (grupos II a V) hasta completar dos infiltraciones.
En los grupos III a V que se infiltró AH con NP (vacías, con dexametasona y curcumina), se procedió previamente a la mezcla de ambos componentes en una proporción de 75% de AH y 25% NP con un sistema de llaves de paso y jeringas Luer lock.
Las infiltraciones se realizaron bajo medidas asépticas con aguja 21 o 23G a nivel intraarticular, acceso anteroexterno tras estudiar las referencias anatómicas. Se permitió a los animales movilidad libre en jaula y alimentación ad libitum.
Se realizó la eutanasia a las 10 semanas, vía intravenosa con lidocaína, Propofol y ClK.
Análisis macroscópicoSe valoraron los cuatro compartimentos de cada rodilla medial y lateral de cóndilos femorales y platillos tibiales. Los especímenes fueron fotografiados con una cámara de alta resolución digital. Aunque existen medios cuantitativos, estos sistemas no son frecuentemente usados por requerir tecnología específica y consumir mucho tiempo. Los resultados fueron valorados acorde a la siguiente clasificación, adaptación de la de Outerbridge9, que se muestra en la tabla 1.
Clasificación macroscópica9
| Grado | Macroscópico (sin tinta) |
|---|---|
| 0 | Superficie intacta |
| 1 | Afectación superficial focal |
| 2 | Irregularidad superficial generalizada |
| 3 | Fibrilación superficial incipiente |
| 4 | Fibrilación superficial severa |
| 5 | Erosión incipiente |
| 6 | Erosión severa |
| 7 | Ulceración leve |
| 8 | Ulceración severa |
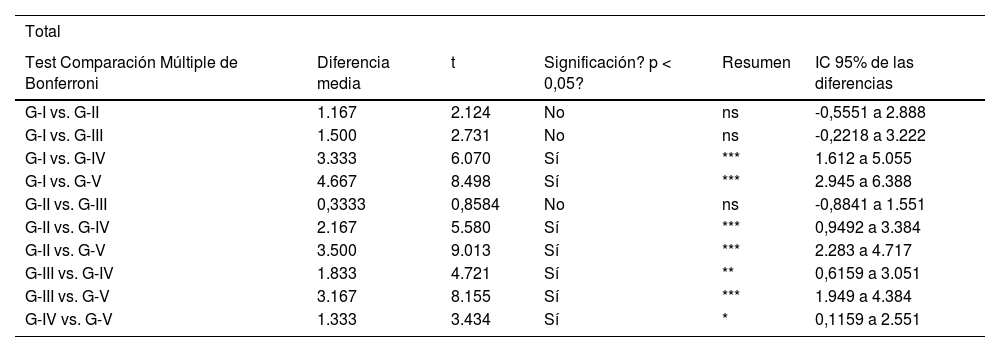
Los análisis estadísticos se realizaron con el programa GraphPad Prism® v6.0 (GraphPad, Inc., San Diego, CA, EE. UU.) y se aplicó una prueba de comparación múltiple de Bonferroni para comparar entre ambos grupos. Los resultados se expresaron como media ± DE. Se establecieron valores significativos como p <0,05 (comparación entre grupo IV y V), p <0,01 (comparación entre grupo III y IV) y p <0,001 (comparación entre cada grupo con los restantes).
ResultadosEvaluación clínicaLos animales no evidenciaron signos clínicos de mal control del dolor durante el estudio. Valoramos el dolor mediante la escala Grimace de la universidad de Newcastle.
Uno de los conejos falleció durante el procedimiento anestésico antes de proceder a las infiltraciones (grupo IV), otro presentó una artritis séptica (grupo II) y tuvo que realizarse una eutanasia. Tras el episodio se extremaron las medidas asépticas y de esterilización del material quirúrgico durante el procedimiento.
Resultados macroscópicosLa valoración se hizo de forma independiente a la persona que realizó las cirugías e infiltraciones, de forma que los grupos y muestras únicamente estaban numerados y referenciados (rodilla intervenida en cada animal) para evitar sesgar el análisis.
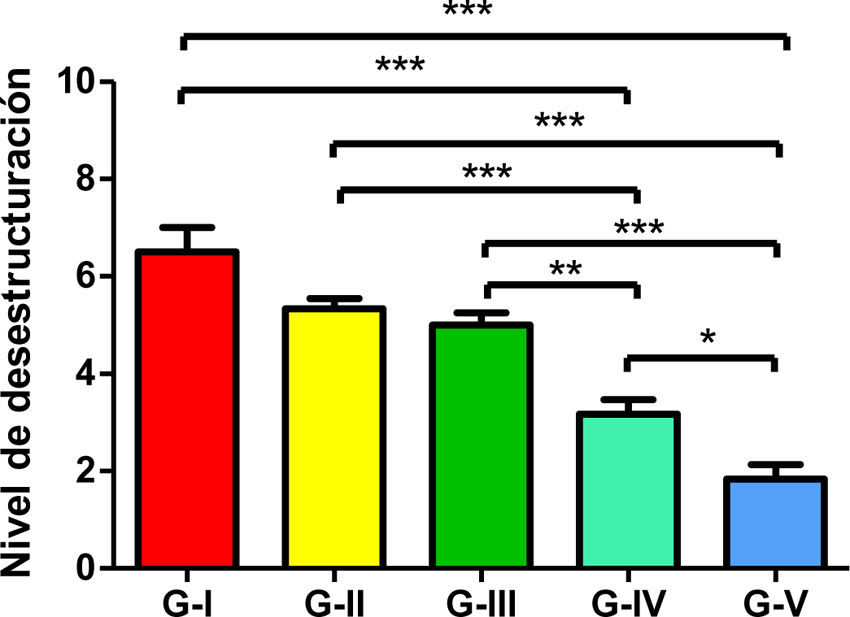
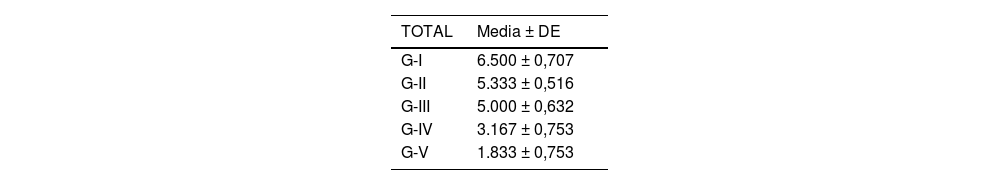
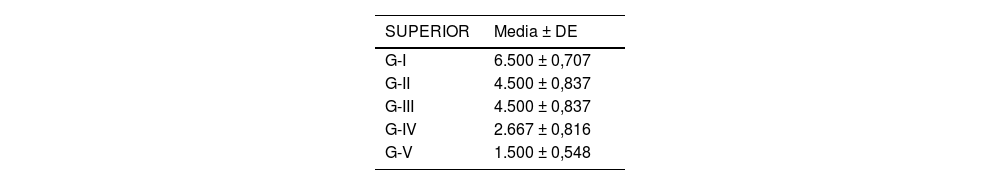
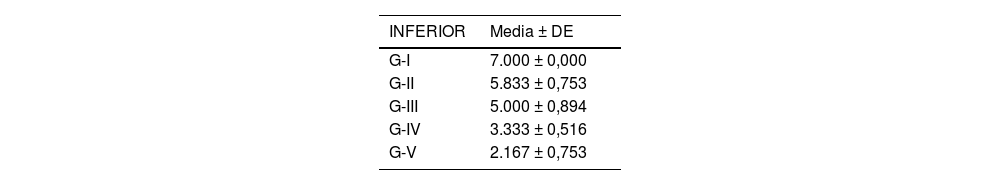
Se analizó el nivel de desestructuración articular en las diferentes zonas (superior, media e inferior) y de forma general.
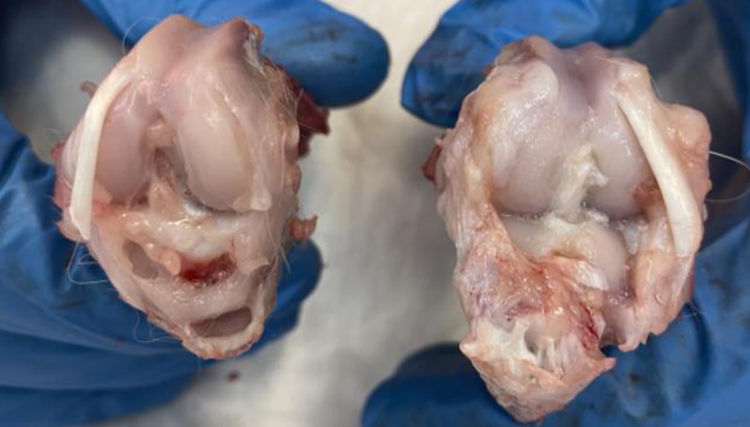
Acorde a la clasificación macroscópica adaptada de Outerbridge, se observó mayor afectación articular en los cuatro compartimentos del grupo de osteoartrosis sin tratamiento (I: control) y en el grupo de osteoartrosis tratada con AH con NP vacías (grupo III) de forma similar que en el grupo de osteoartrosis tratada con AH comercial (grupo II) (fig. 2).
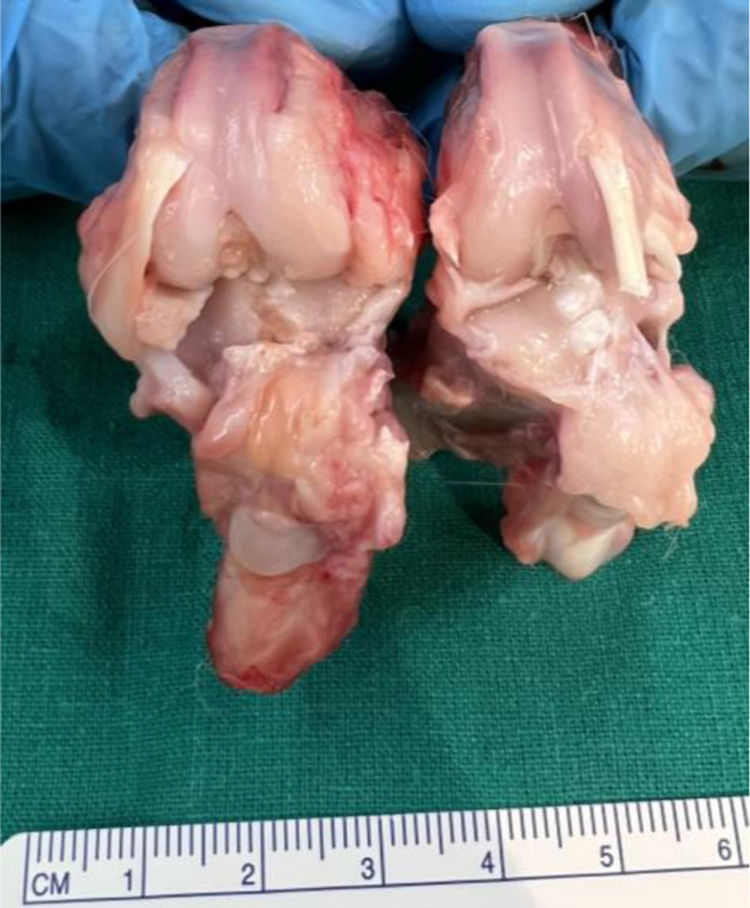
Las rodillas tratadas con AH con NP que contenían curcumina y dexametasona presentaron menores cambios degenerativos, siendo menor la afectación en el grupo V (curcumina) (fig. 3) respecto al grupo IV (dexametasona).
Por otro lado, no hubo diferencias estadísticamente significativas entre el grupo tratado con AH comercial y AH con NP vacías (fig. 4).
Los resultados de estos estudios se muestran en las tablas 2-6, así como en la figura 5.
Resultados estadísticos comparación múltiple Bonferroni
| Total | |||||
|---|---|---|---|---|---|
| Test Comparación Múltiple de Bonferroni | Diferencia media | t | Significación? p < 0,05? | Resumen | IC 95% de las diferencias |
| G-I vs. G-II | 1.167 | 2.124 | No | ns | -0,5551 a 2.888 |
| G-I vs. G-III | 1.500 | 2.731 | No | ns | -0,2218 a 3.222 |
| G-I vs. G-IV | 3.333 | 6.070 | Sí | *** | 1.612 a 5.055 |
| G-I vs. G-V | 4.667 | 8.498 | Sí | *** | 2.945 a 6.388 |
| G-II vs. G-III | 0,3333 | 0,8584 | No | ns | -0,8841 a 1.551 |
| G-II vs. G-IV | 2.167 | 5.580 | Sí | *** | 0,9492 a 3.384 |
| G-II vs. G-V | 3.500 | 9.013 | Sí | *** | 2.283 a 4.717 |
| G-III vs. G-IV | 1.833 | 4.721 | Sí | ** | 0,6159 a 3.051 |
| G-III vs. G-V | 3.167 | 8.155 | Sí | *** | 1.949 a 4.384 |
| G-IV vs. G-V | 1.333 | 3.434 | Sí | * | 0,1159 a 2.551 |
IC: intervalo de confianza.
Nivel de desestructuración total.
Los asteriscos se refieren a las comparaciones realizadas entre los grupos correspondientes en cuanto al nivel de desestructuración total (dado que se realizó un análisis múltiple de Bonferroni).
* Comparación entre grupo IV y V. Aplicado nivel de significación p <0,05.
** Entre grupo III y IV. Aplicado nivel de significación p<0,01.
*** Entre cada grupo con los restantes. Nivel de significación p <0,001 (más exigente).
Los modelos experimentales in vitro para la osteoartrosis son mucho más controlables que los modelos animales y son utilizados para investigar eventos biológicos a corto plazo, para deducir el mecanismo de acción, ya que se producen menos variables y los resultados pueden ser más discernibles. En cambio, estos modelos no pueden reproducir los cambios estructurales que se producen en los tejidos a mediano y largo plazo10.
Los modelos experimentales nos permiten realizar un estudio secuencial de la enfermedad, en este caso la artrosis, determinar con precisión el comienzo y duración de la enfermedad, así como su gravedad y progresión en el tiempo. Se reproduce de un modo controlable la escala y la progresión, se pueden cuantificar y categorizar con rigor los cambios patológicos encontrados, para poder desarrollar nuevas terapias11.
Una alternativa usada en la experimentación es el modelo de osteoartrosis en las ratas, pero no poseen una superficie articular amplia y dificultan las técnicas a realizar10,11:
Otros métodos alternativos de inducción de artrosis en animales son la inducción por agentes químicos (papaína, tripsina, colagenasa) o la manipulación mecánica o quirúrgica: lesión directa del cartílago, osteotomía desalineadora o inmovilización.
La meniscectomía para la inducción de osteoartrosis es un procedimiento quirúrgico que fue descrito por Moskowitz et al. (1979) en conejos inicialmente, posteriormente se ha asociado a la sección de ligamentos por otros autores como Kamekura (2005), Brandt KD (2002) o Bendele AM porque los cambios artrósicos son más rápidos y extensos (cuatro a seis semanas)12–14.
Varias revisiones sistemáticas han demostrado el efecto positivo de la viscosuplementación como tratamiento analgésico, aunque la eficacia de las terapias con AH continúa siendo controvertida debido a la inconsistencia de las guías de tratamiento y la bibliografía actual15,16.
Tanto estudios in vitro como in vivo han demostrado efectos fisiológicos del AH exógeno, como son la condroprotección y supresión de la degradación de los agrecanos, que pueden contrarrestar los mecanismos implicados en la patogénesis de la osteoartrosis. Además, pueden reducir la producción de mediadores proinflamatorios y metaloproteinasas de la matriz extracelular (MMP)17,18.
La interacción del AH con los receptores celulares CD44 inhibe la expresión de IL-1β y por consecuencia la producción de MMP, desintegrina y metaloproteasa, zinc y calcio dependiente (disintegrin and metalloproteinase with thrombospondin motifs, ADAMTS) y NO, responsables de la destrucción articular19,20. También se han publicado efectos sobre la síntesis de proteoglicanos, glucosaminoglicanos, antiinflamatorio, analgésico y acciones sobre el hueso subcondral19.
La inyección intraarticular de los viscosuplementos es la mejor vía de administración por actuar localmente sobre la articulación afectada. De forma que se pretende conseguir la máxima concentración del fármaco en el tejido requerido21. Por otro lado, la acción analgésica del AH debe poseer alta durabilidad para reducir el número de infiltraciones requeridas y disminuir el malestar. Clínicamente los viscosuplementos de AH con altos pesos moleculares y entrecruzados, parece que presentan mejores capacidades que los simples y de bajo peso molecular15. Existe en el mercado diferentes formulaciones comerciales de AH para su administración intraarticular que se diferencian en su peso molecular, grado de reticulación y origen, aunque actualmente no existe una clara recomendación de uno sobre otro.
Uno de los mayores problemas de la vía de administración intraarticular es la velocidad de distribución y aclarado del fármaco en la articulación, debido al sistema linfático21. Una solución al problema podría ser que los viscosuplementos tengan una función de vehículo o transportador del fármaco para la liberación progresiva y a la vez ejercer su función inherente para restablecer las propiedades viscoelásticas del líquido sinovial3,22.
Se han estudiado y desarrollado en los últimos años sistemas de liberación de fármacos para incrementar la biodisponibilidad del fármaco y reducir los efectos sistémicos, como pueden ser los liposomas, las micropartículas y las micelas22.
Estudios previos sobre modelos animales han valorado el uso de polímeros como sistema de liberación de fármacos unidos al AH, entre ellos el chitosán, el ácido poliláctico-glicólico y ciclodextrano, ofreciendo unos resultados favorables en cuanto a protección articular tras el tratamiento23–25.
Existe evidencia en el efecto positivo de la curcumina en modelos animales (ratón) de osteoartrosis, en cuanto a la mediación con los factores inflamatorios y condroprotector26.
En este estudio demostramos que el modelo de osteoartrosis empleado, consistente en la sección del LCA asociado a resección del menisco interno, reproduce los cambios degenerativos de una forma similar a la que ocurre en el ser humano.
Es un modelo in vivo que provoca una inestabilidad y consiguiente artrosis en un tiempo mucho menor del que haría falta en el ser humano, por lo tanto, tiene una gran utilidad de cara a poder influir en el proceso mediante tratamientos como en nuestro caso las infiltraciones de viscosuplementos activos.
Con nuestro modelo animal de osteoartrosis pudimos comparar el efecto de las infiltraciones entre los diferentes grupos de tratamiento.
Interpretamos, a raíz de los resultados obtenidos, que existe un efecto favorable en los grupos de tratamiento con el AH cargado con NP que encapsulan curcumina y dexametasona, siendo mayor la protección articular en el grupo de curcumina (p < 0,05).
El efecto de la viscosuplementación del AH sería aditivo al efecto antiinflamatorio de los fármacos, que mediante este sistema se liberaría intraarticularmente de forma progresiva según los modelos in vitro previos.
Una limitación del estudio es el número de animales que dificulta el extraer conclusiones, a pesar de que el número de animales fue calculado acorde a series anteriores de otros estudios similares.
Por último, hay que mencionar que la extrapolación de los resultados al ser humano es limitada y deben ser tomados con precaución.
Las líneas futuras de investigación se centran en la aplicación de la nanotecnología, con el fin de disminuir las dosis necesarias de fármaco y usar la terapia celular dirigida en los estadios precoces de la osteoartrosis.
La ingeniería tisular y medicina regenerativa es un campo en auge y esperanzador en el tratamiento de la enfermedad articular27,28.
Terapias como los hidrogeles, que poseen propiedades físicas y químicas excepcionales, la capacidad de transportar y liberar agentes bioactivos, se sitúan como posibles tratamientos específicos. La combinación con terapias mediante factores de crecimiento y terapia génica, así como hidrogeles basados en la respuesta a señales fisiológicas pueden ofrecer soluciones más efectivas29.
ConclusionesEl uso de viscosuplementos activos podría tener un efecto adicional al tratamiento convencional de AH por su efecto antioxidante y antiinflamatorio, siendo el grupo más prometedor el de las NP que encapsulan cúrcuma y en segundo lugar el de dexametasona.
Nivel de evidenciaNivel de evidencia I.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Fundación SECOT por la beca de investigación concedida 2020.
Síntesis de hidrogeles entrecruzados de AH en ICTP-CSIC (Instituto de Ciencia y Tecnología de Polímeros. Consejo Superior de Investigaciones Científicas), con la colaboración de los investigadores Pontes, Aguilar, San Román y Vázquez.
Veterinarios y personal del animalario (técnicos y celadores) del Hospital Universitario Ramón y Cajal Universidad de Alcalá de Henares.
Residentes de Cirugía Ortopédica y Traumatología Hospital Ramón y Cajal por su contribución y ayuda durante el proyecto. En especial a Victor Casas, Salvador Álvarez y Hector Toribio.