Determinar qué modelo farmacocinético para propofol proporciona una mayor estabilidad hemodinámica durante la inducción anestésica.
Material y métodosEnsayo clínico prospectivo, aleatorizado, no ciego y por intención de tratar donde se incluyeron 280 pacientes ASA I-III, 18-80 años de edad y 45-100kg de peso, programados para cirugía bajo anestesia general. Los pacientes se distribuyeron aleatoriamente en 2 grupos, dependiendo del modelo farmacodinámico para propofol empleado (Marsh Modificado o Schnider), para analizar el comportamiento hemodinámico durante la inducción y la intubación. Se administró una infusión controlada por objetivo de propofol para mantener un índice biespectral de 35-55. En el minuto 6 se realizó la intubación orotraqueal, finalizando el estudio a los 11min del comienzo.
Fueron recogidos cada minuto la frecuencia cardiaca, la tensión arterial media, las dosis, las concentraciones de propofol y la aparición de hipotensión. El producto de la frecuencia cardiaca y la tensión arterial media (FC×TAM) fue calculado cada minuto y analizado pormenorizadamente, determinando, entre otros, el valor mínimo antes de la intubación, el máximo tras ella, y la relación entre estos 2 valores (GRADIENTE [MÍN, MÁX], variable principal del estudio).
ResultadosNo hubo diferencias significativas en el comportamiento hemodinámico entre los grupos del estudio. GRADIENTE (MÍN, MÁX): 77,41 vs. 84,86% (p=0,821); hipotensión: 17,3 vs. 12,8% (p=0,292); Marsh Modificado y Schnider, respectivamente.
ConclusiónNo se han podido demostrar diferencias en el comportamiento hemodinámico, a pesar de que el grupo del Marsh Modificado recibió una dosis mayor de propofol.
Determine the best propofol pharmacokinetic model that meets patient requirements and is devoid of major haemodynamic side effects.
Material and methodsProspective, randomised, open-label, clinical trial was performed on an intention to treat basis. It included 280 patients with ASA physical status i-iii, aged 18 to 80 years and weight range between 45 to 100kg, scheduled for surgery under general anaesthesia. They were randomized into 2 groups according to the pharmacokinetic model: Modified Marsh group and Schnider group. The haemodynamic changes that occurred during the induction and intubation were analysed. A propofol target controlled infusion was started to achieve and maintain a bispectral index value between 35 and 55. At minute 6, orotracheal intubation was performed and the study finished at minute 11.
Heart rate, mean arterial pressure and their product (HR×MAP) were measured and recorded every minute throughout the study. Every HR×MAP value was compared to its baseline value to determine the minimum value before intubation, the maximum value after intubation, the maximum variation after intubation, and its final value. The GRADIENTE (MIN, MAX) variable (primary endpoint of this study) analyses the difference between maximal and minimal values related to intubation. Propofol doses and calculated concentrations and any hypotensive events were also recorded.
ResultsNo differences were found between groups regarding haemodynamic performance. GRADIENTE (MIN, MAX) values and the percentage of hypotensive events were: Modified Marsh group median 77.41% vs. Schnider group 84.86% (p= 0.821) and 17.3% vs. 12.8% (p = 0.292), respectively.
ConclusionThe study failed to demonstrate any haemodynamic difference between the 2 groups, even though the Modified Marsh group received a larger dose of propofol.
Los cambios hemodinámicos durante la anestesia general tienen implicaciones pronósticas negativas, por lo que deben ser evitados. Las mayores variaciones hemodinámicas son debidas a la inducción anestésica y a la intubación orotraqueal (IOT)1,2.
El descenso de la frecuencia cardiaca (FC) y de la tensión arterial durante la inducción anestésica depende de factores como son las dosis de los fármacos empleados, el ASA elevado (clasificación del estado físico según la American Society of Anaesthesia), y determinadas enfermedades (anemia, hipovolemia o disfunción ventricular)3–7. Durante la IOT, sin embargo, se produce un aumento de estos parámetros hemodinámicos3,8,9. Una adecuada administración de analgésicos podría llegar a minimizar esta respuesta.
La disminución de la tensión arterial durante la inducción anestésica con propofol se debe a un descenso de las resistencias vasculares sistémicas10,11 o del gasto cardiaco, y puede potenciarse con la asociación de otros fármacos como el fentanilo12,13. Sin embargo, la respuesta hemodinámica a la intubación es más atenuada que con otros hipnóticos8,14. Una adecuada administración de analgésicos podría llegar a minimizar esta respuesta.
Las infusiones controladas por objetivo (TCI, por target controlled infusion) y la medición de su efecto hipnótico mediante parámetros como el índice biespectral (BIS) pueden ayudar a ajustar la dosificación a las necesidades de cada paciente y en cada momento, consiguiendo un mejor control de las variaciones hemodinámicas15.
Los distintos modelos de TCI para propofol han sido previamente comparados para evaluar aspectos farmacológicos como la exactitud en los cálculos de las concentraciones, las propiedades farmacocinéticas y farmacodinámicas o su seguridad16,17. También se han comparado con variadas formas de administración (infusiones manuales) con diferentes tipos de anestesia general18–21 e incluso distintos tipos de TCI controladas por objetivo de concentración en el sitio de efecto (Ce)22. En todos estos estudios, el efecto secundario más predominante fue el compromiso hemodinámico.
Actualmente, los modelos más extendidos con objetivo de Ce para propofol son: Marsh Modificado17,23 y Schnider24,25.
El modelo de Marsh Modificado, al administrar una mayor dosis que el de Schnider26, puede originar unos mayores cambios en las variables hemodinámicas (descenso de la FC y la tensión arterial media [TAM]) durante la inducción, y una mayor estabilidad de las mismas durante la IOT.
En nuestro estudio, estos 2 modelos de TCI para Ce de propofol guiados por BIS fueron comparados durante la inducción anestésica y la IOT para identificar el modelo que proporciona una mayor estabilidad hemodinámica.
Material y métodosTras la aprobación por el Comité Ético de Investigaciones Científicas del Hospital Universitario Severo Ochoa de Leganés en junio de 2009 y la obtención del consentimiento informado de cada paciente, se realizó un estudio prospectivo aleatorizado no ciego en el que fueron incluidos 280 pacientes. Todos ellos estaban programados para cirugía bajo anestesia general con IOT, ASA I-III, con peso entre 45 y 100kg y edad entre 18 y 80 años. Los pacientes fueron incluidos de manera aleatorizada en uno de los grupos del estudio, grupo MM o grupo S, dependiendo del modelo matemático empleado para la infusión de propofol en TCI: Marsh Modificado17,23 o Schnider24,25. Se decidió no realizar un estudio ciego porque las diferencias entre los modelos son tan evidentes que pueden identificarse con suma facilidad. La aleatorización se realizó gracias a una tabla descargada de la web: http://www.random.org (Mads Haahr School of Computer Science and Statistics, Trinity College, Dublín, Irlanda).
Los pacientes que presentaron alguna de las siguientes situaciones fueron excluidos del estudio: alergia a algún fármaco del estudio, gestantes, tratamiento con opiáceos, adicción a drogas, enfermedades sistémicas no controladas (como por ejemplo: hipertensión, diabetes mellitus o enfermedad renal), enfermedad cardiaca, inestabilidad hemodinámica, enfermedades neurológicas, tratamientos que pudieran afectar al trazado electroencefalográfico, dificultad de intubación, premedicación o ansiolisis previa inadecuada (consideramos que era adecuada si se obtenía un 2 es la Escala de Ramsay y un 4 en la Escala de Sedación-Agitación de Riker) y los que no alcanzaron niveles de hipnosis adecuados (valores de BIS fuera del rango 35-55 en 3 o más mediciones entre los minutos 6 y 11). Además, los pacientes ASA III no debían presentar un grado mayor de ii en la clasificación funcional de la New York Heart Association.
Todos los pacientes recibieron como premedicación 10mg de diazepam 2h antes del procedimiento, se les canalizó un catéter venoso periférico y fueron monitorizados con electrocardiograma, oximetría de pulso, tensión arterial no invasiva y monitor de BIS (XP®, versión 2.01; Aspect Medical Systems, Natick, MA, EE. UU.). Antes de la inducción anestésica todos recibieron una preoxigenación con oxígeno al 100% mediante mascarilla facial durante 2min. Durante todo el estudio solo se infundieron los fluidos necesarios para la administración de fármacos.
El estudio comenzó con la inducción anestésica, se realizó la IOT a los 6min y finalizó en el minuto 11.
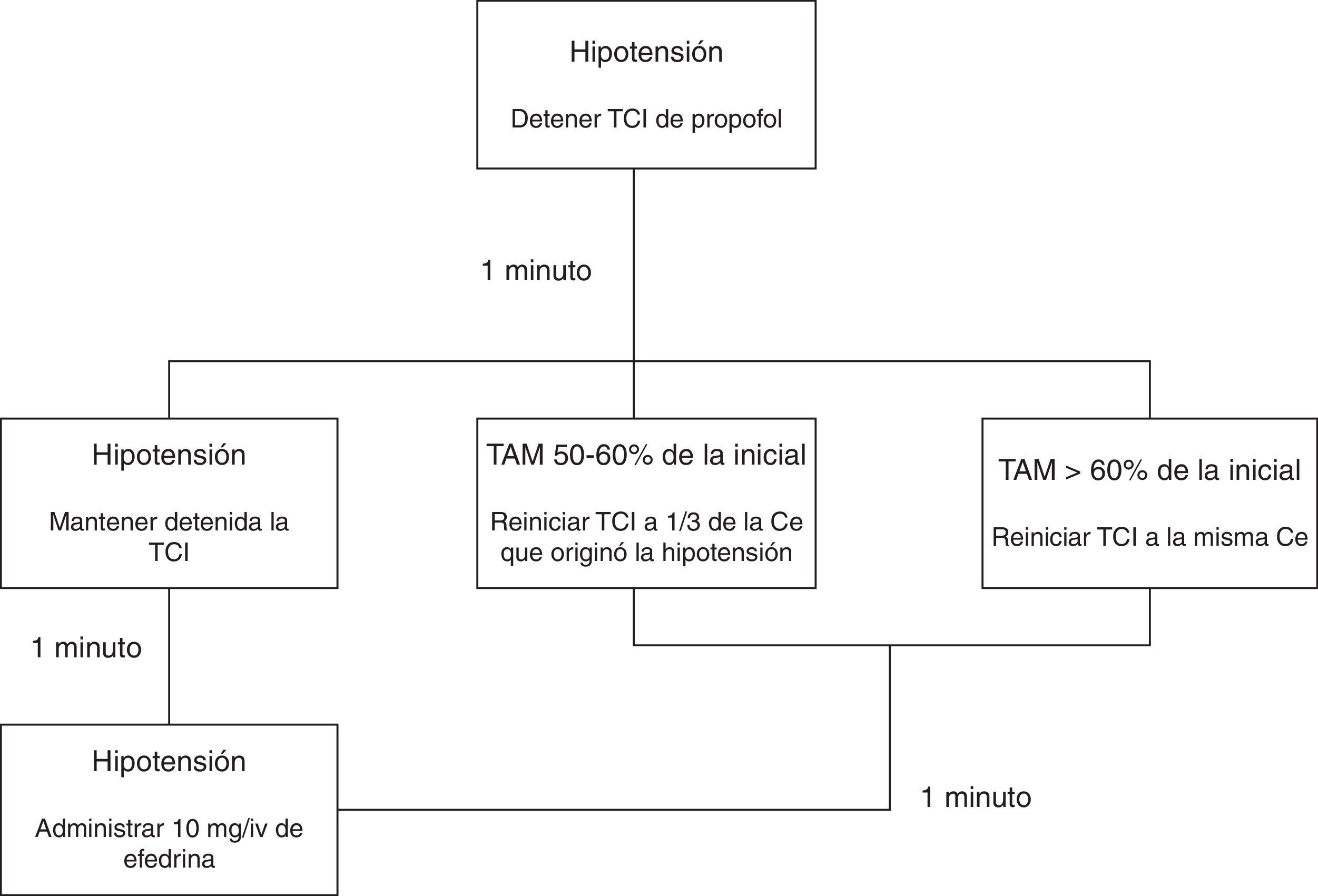
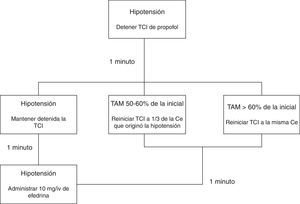
La inducción (minuto 0) se realizó con 3μg kg−1 de fentanilo y propofol. La bomba de TCI para propofol empleada fue la Base Primea de Orchestra® (Fresenius-Kabi, Brezins, Francia), y dependiendo del grupo al que pertenecía el paciente, fue programada con uno de los modelos farmacocinéticos con Ce como objetivo Marsh Modificado17,23 (grupo MM) o Schnider24,25 (grupo S). En ambos casos se comenzó con un objetivo de 6μg mL−1 de Ce, modificándose posteriormente para conseguir y mantener un nivel de hipnosis medida por BIS de 35-55, salvo que apareciese hipotensión. Si la TAM descendía por debajo del 50% de su valor inicial, la infusión de propofol se modificaba siguiendo el algoritmo que muestra la figura 1.
Algoritmo en caso de hipotensión.
Algoritmo a seguir en caso de hipotensión (TAM<50% de su valor inicial). En caso de hipotensión la infusión de propofol fue detenida. La situación fue reevaluada tras pasar un minuto: en caso de que la TAM remontase hasta un valor>60% de la TAM inicial, se reinició la TCI a una Ce igual a la previa; en caso de que estuviera entre el 50 y el 60% de la TAM inicial, se reinició la TCI con una Ce igual a un tercio de la previa; y en caso de hipotensión mantenida, se mantuvo detenida la infusión durante un minuto más. Tras el paso de este segundo minuto la situación fue nuevamente valorada: en caso de recuperación se procedió como se menciona anteriormente, y en caso de continuar con la hipotensión se mantuvo la infusión detenida y se administraron 10mg de efedrina intravenosa, reevaluándose la situación minuto a minuto hasta la resolución del cuadro.
La IOT fue facilitada con 0,15mg kg−1 de cisatracurio administrados una vez obtenido un nivel de hipnosis adecuado (BIS<60).
Se recogieron las siguientes variables: edad, sexo, peso, altura, índice de masa corporal, índice de masa magra, superficie corporal y estado físico según la clasificación de la ASA. El nivel de hipnosis fue estudiado mediante el valor del BIS en cada minuto, el tiempo necesario para alcanzar el objetivo de hipnosis (BIS 35-55) y el valor de BIS en el momento de la IOT. También se recogió el tiempo empleado en las maniobras de IOT. La dosis, la concentración en plasma y la Ce del propofol fueron estudiadas en 3 momentos del estudio: al conseguirse el nivel de hipnosis objetivo, durante la IOT (minuto 6) y al final del estudio (minuto 11).
Las variaciones hemodinámicas fueron evaluadas gracias a la FC, la TAM y su producto (FC×TAM) de cada minuto del estudio, realizándose las mediciones de manera no invasiva. El FC×TAM fue calculado multiplicando la FC por la TAM y dividiendo entre 100.
Se calculó la media aritmética de la diferencia entre el valor en cada minuto del FC×TAM y su valor inicial (MD FC×TAM), y la media aritmética del valor absoluto de la diferencia entre el valor en cada minuto del FC×TAM y su valor inicial (MDA FC×TAM).
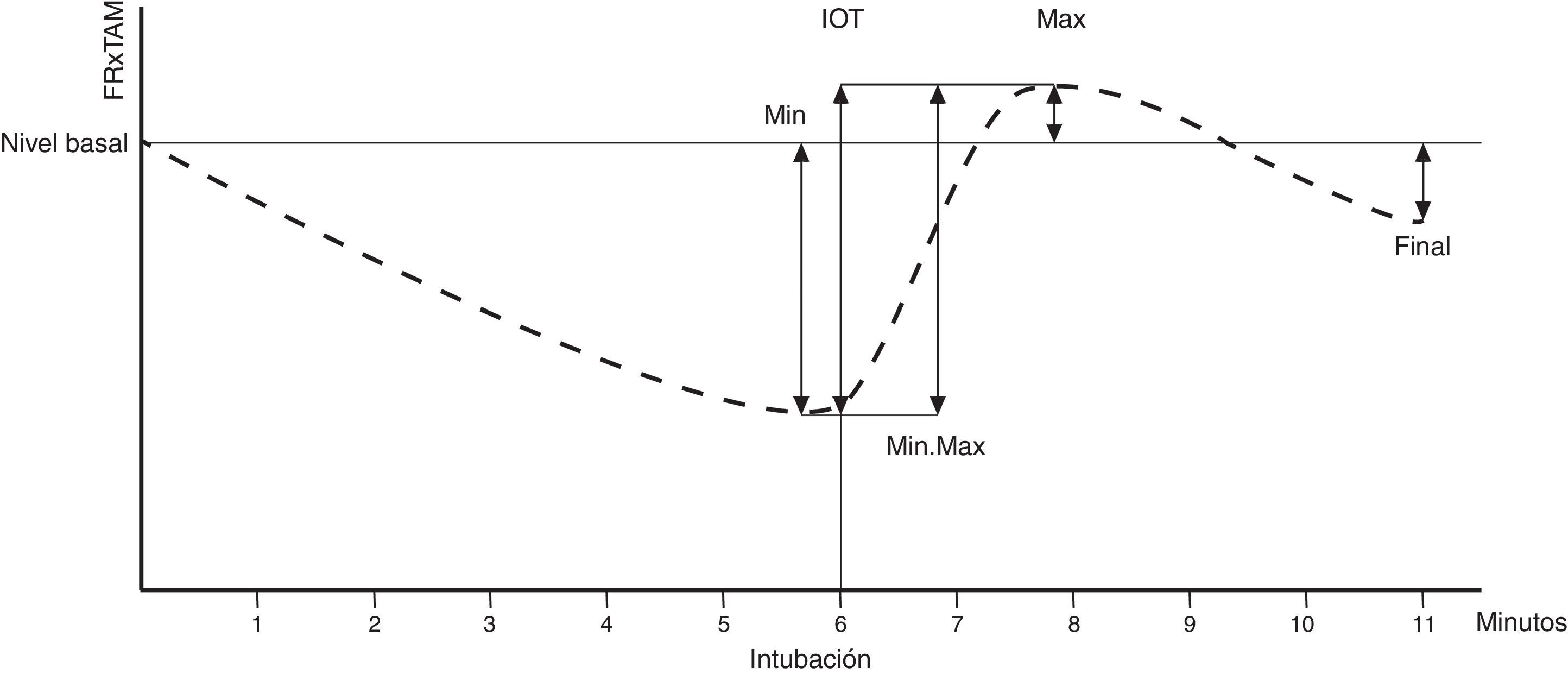
Las variables MÍN, MÁX, GRADIENTE (MÍN, MÁX), INTUBACIÓN y FINAL se definieron a través del análisis de las variaciones porcentuales del FC×TAM con respecto a su valor inicial en varios momentos: antes y después de la intubación, y al final del estudio (ver fig. 2).
Esquema de las variables hemodinámicas.
Eje de abscisas: tiempo en minutos. Eje de ordenadas: valor del FC×TAM (producto de la frecuencia cardiaca [FC] por la tensión arterial media [TAM]). Línea delgada horizontal: valor basal del FC×TAM. Línea delgada vertical: momento de la intubación orotraqueal (IOT), que se produjo en el minuto 6. Línea discontinua: evolución del FC×TAM a lo largo del estudio. Flechas: representan los valores de FC×TAM comparados para calcular cada variable. MÍN: valor mínimo alcanzado antes de la IOT. MÁX: valor máximo alcanzado tras la IOT. FINAL: valor alcanzado al final del estudio (minuto 11). MÍN.MÁX: diferencia porcentual entre el valor más bajo antes de la IOT y el más alto tras la misma. INTUBACIÓN: diferencia porcentual entre el valor alcanzado justo antes de la IOT (minuto 6) y el más alto tras la misma.
Las variables que representan la evolución hemodinámica a lo largo de todas las fases del estudio fueron agrupadas en una sola (variable SUM) mediante la siguiente fórmula:
Además, se determinó el porcentaje de pacientes en los que se obtenían unos valores mayores del 150% en las variables GRADIENTE (MÍN, MÁX) (variable principal del estudio) e INTUBACIÓN, o por debajo del −50% en la variable FINAL.
Se recogieron cuadros de hipotensión (definida como TAM por debajo de 50mmHg y/o descenso de más del 50% de su valor basal).
Análisis estadísticoEl tamaño muestral (al menos 137 pacientes por grupo) fue determinado gracias a un estudio piloto en el que se incluyeron 65 pacientes distribuidos en 2 grupos paralelos de manera aleatoria para conseguir un nivel de confianza del 95% y una potencia estadística del 80%.
Los datos fueron presentados como media±desviación estándar o mediana y rango intercuartílico. La distribución normal de las variables continuas fue comprobada con el test de Kolmogorov-Smirnov-Lilliefors. Para comparar las variables cuantitativas se empleó el test de la t de Student, y para las variables cualitativas, el chi cuadrado. La variable GRADIENTE (MÍN, MÁX) presentó unas varianzas diferentes en cada grupo, por lo que para su estudio se utilizó el test de la U de Mann-Whitney. Los valores de p menores de 0,05 fueron considerados estadísticamente significativos. El análisis se realizó utilizando el programa SPSS® versión 15.0 (SPSS Inc. Chicago, IL, EE. UU.).
ResultadosFueron incluidos un total de 280 pacientes: 139 en el grupo S, 137 en el grupo MM, y 4 se perdieron (2 antes de la aleatorización y un caso en cada grupo tras la misma).
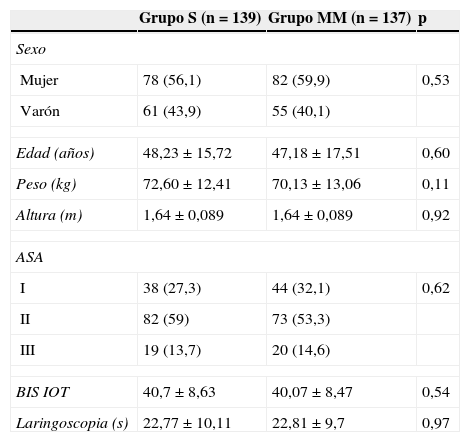
Ambos grupos fueron comparables en cuanto a los datos demográficos, al ASA, la duración de la maniobra de IOT y el nivel de hipnosis en ese momento, estas 2 últimas relacionadas con la intensidad nociceptiva de la IOT (tabla 1). El nivel objetivo de hipnosis (valor de BIS 35-55) fue conseguido antes en el grupo MM que en el S (1,92±0,6 frente a 2,39±0,96min; p<0,001).
Características de la población estudiada y de la intubación
| Grupo S (n=139) | Grupo MM (n=137) | p | |
|---|---|---|---|
| Sexo | |||
| Mujer | 78 (56,1) | 82 (59,9) | 0,53 |
| Varón | 61 (43,9) | 55 (40,1) | |
| Edad (años) | 48,23±15,72 | 47,18±17,51 | 0,60 |
| Peso (kg) | 72,60±12,41 | 70,13±13,06 | 0,11 |
| Altura (m) | 1,64±0,089 | 1,64±0,089 | 0,92 |
| ASA | |||
| I | 38 (27,3) | 44 (32,1) | 0,62 |
| II | 82 (59) | 73 (53,3) | |
| III | 19 (13,7) | 20 (14,6) | |
| BIS IOT | 40,7±8,63 | 40,07±8,47 | 0,54 |
| Laringoscopia (s) | 22,77±10,11 | 22,81±9,7 | 0,97 |
ASA: American Society of Anaesthesia; BIS IOT: valor del índice biespectral justo antes de proceder a la intubación orotraqueal; Laringoscopia: duración en segundos de las maniobras de intubación; MM: Marsh Modificado; S: Schnider.
Los valores se presentan como media±desviación estándar o n (porcentaje). Los valores de p no muestran diferencias estadísticamente significativas entre los grupos en ninguna de las variables.
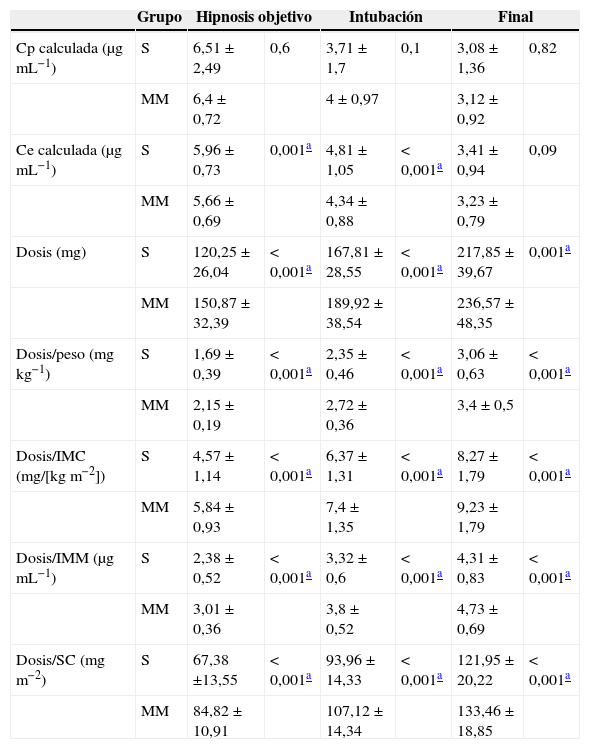
Las dosis de propofol fueron significativamente mayores en el grupo MM en el momento de alcanzar el objetivo de hipnosis, durante la IOT y al final del estudio. Las Ce calculadas fueron significativamente mayores en el momento de alcanzar el objetivo de hipnosis y durante la IOT en el grupo S (tabla 2).
Dosis y concentraciones de propofol
| Grupo | Hipnosis objetivo | Intubación | Final | ||||
|---|---|---|---|---|---|---|---|
| Cp calculada (μg mL−1) | S | 6,51±2,49 | 0,6 | 3,71±1,7 | 0,1 | 3,08±1,36 | 0,82 |
| MM | 6,4±0,72 | 4±0,97 | 3,12±0,92 | ||||
| Ce calculada (μg mL−1) | S | 5,96±0,73 | 0,001a | 4,81±1,05 | <0,001a | 3,41±0,94 | 0,09 |
| MM | 5,66±0,69 | 4,34±0,88 | 3,23±0,79 | ||||
| Dosis (mg) | S | 120,25±26,04 | <0,001a | 167,81±28,55 | <0,001a | 217,85±39,67 | 0,001a |
| MM | 150,87±32,39 | 189,92±38,54 | 236,57±48,35 | ||||
| Dosis/peso (mg kg−1) | S | 1,69±0,39 | <0,001a | 2,35±0,46 | <0,001a | 3,06±0,63 | <0,001a |
| MM | 2,15±0,19 | 2,72±0,36 | 3,4±0,5 | ||||
| Dosis/IMC (mg/[kg m−2]) | S | 4,57±1,14 | <0,001a | 6,37±1,31 | <0,001a | 8,27±1,79 | <0,001a |
| MM | 5,84±0,93 | 7,4±1,35 | 9,23±1,79 | ||||
| Dosis/IMM (μg mL−1) | S | 2,38±0,52 | <0,001a | 3,32±0,6 | <0,001a | 4,31±0,83 | <0,001a |
| MM | 3,01±0,36 | 3,8±0,52 | 4,73±0,69 | ||||
| Dosis/SC (mg m−2) | S | 67,38 ±13,55 | <0,001a | 93,96±14,33 | <0,001a | 121,95±20,22 | <0,001a |
| MM | 84,82±10,91 | 107,12±14,34 | 133,46±18,85 | ||||
MM: Marsh Modificado; S: Schnider.
Dosis y concentraciones calculadas de propofol en 3 momentos clave del estudio: al alcanzar la hipnosis unos valores de índice biespectral 35-55 (Hipnosis objetivo), a la intubación (Intubación) y al final del estudio (Final). Los valores se presentan como media±desviación estándar.
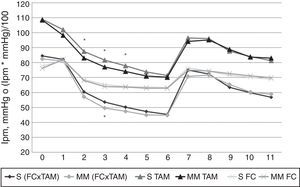
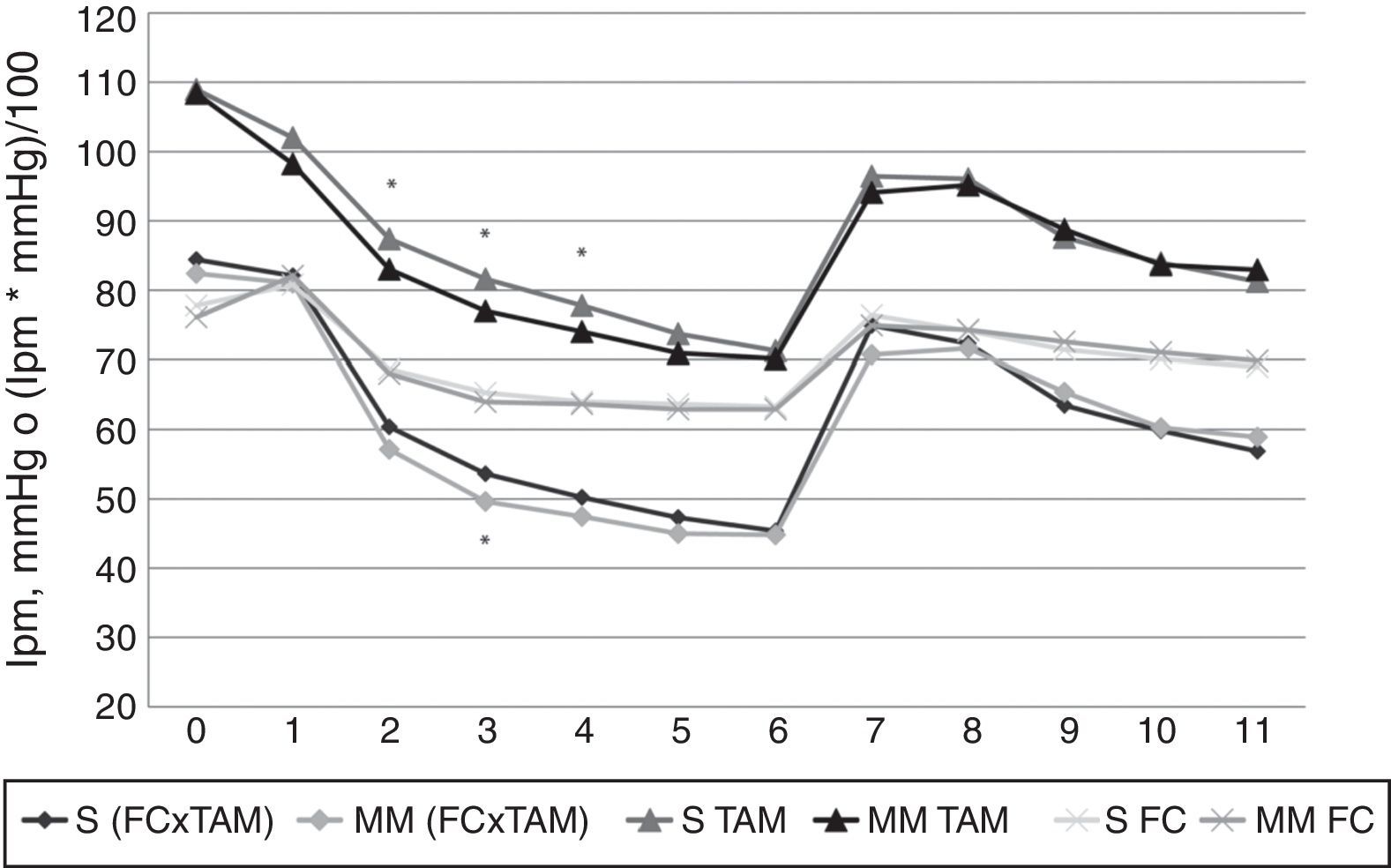
Solo se encontraron diferencias significativas en el comportamiento hemodinámico en la TAM en los minutos 2, 3 y 4, y en el FC×TAM del minuto 3, donde fueron significativamente menores en el grupo MM (figs. 3 y 4). Los cuadros de hipotensión fueron más frecuentes también en este grupo, pero sin alcanzar significación estadística (17,3 frente a 12,8%, respectivamente).
Resultados de la frecuencia cardiaca, la tensión arterial media y su producto (FC×TAM).
Eje de abscisas: tiempo en minutos. Eje de ordenadas: frecuencia cardiaca (FC) en latidos por minuto (lpm), tensión arterial media (TAM) en mmHg o producto de la FC por la TAM (FC×TAM) en lpm por mmHg dividido por 100. S: valores en el grupo Schnider. MM: valores en el grupo Marsh Modificado. Los valores representados corresponden a la media aritmética. Se encontraron diferencias estadísticamente significativas, marcadas en la figura por medio de asteriscos, en el minuto 3 del FC×TAM (p=0,022), y en los minutos 2, 3 y 4 de la TAM (los valores de p fueron, respectivamente, 0,02, 0,01 y 0,025); en todos los casos el grupo MM presentó valores inferiores al grupo S.
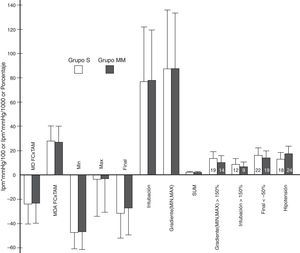
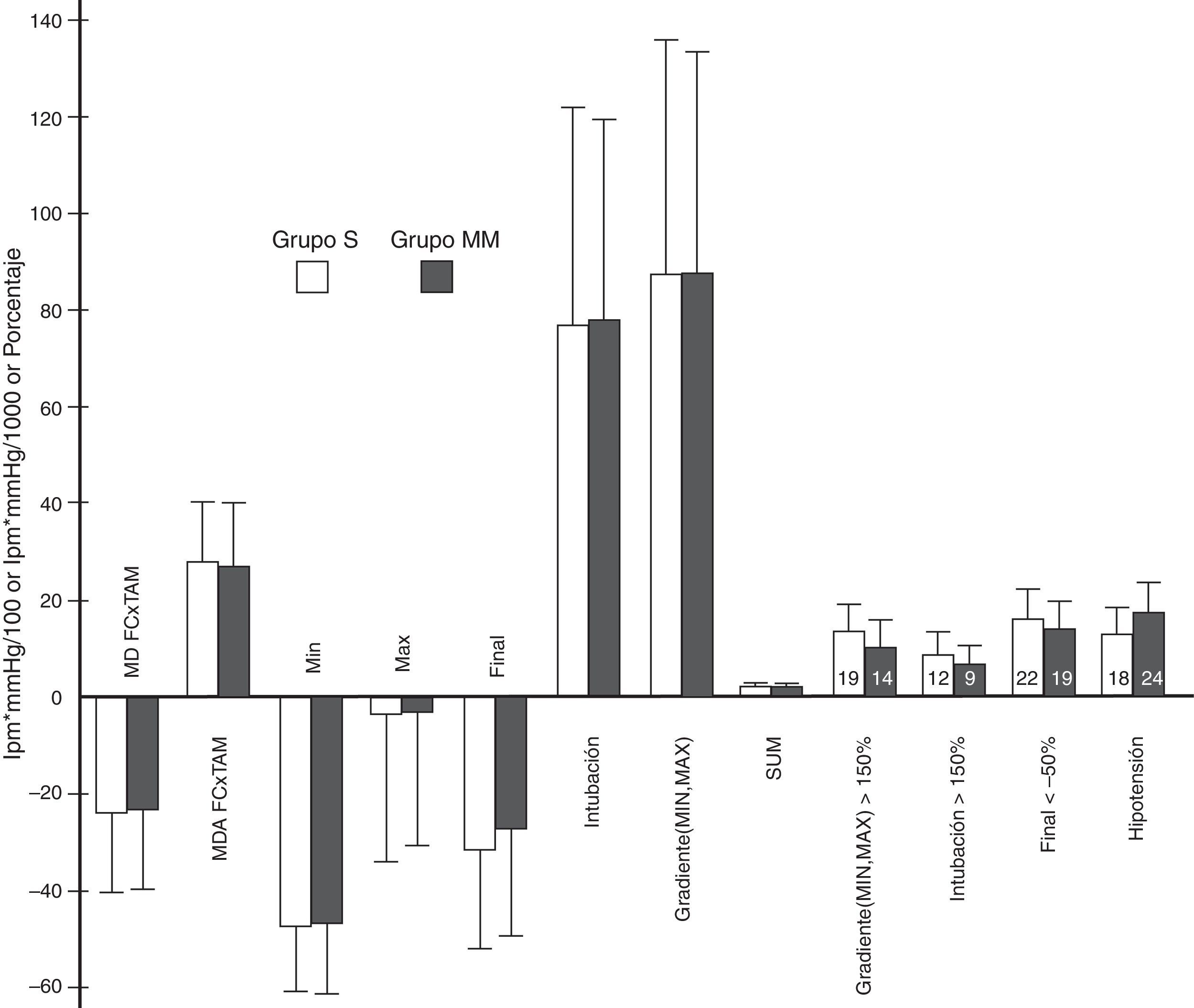
Variables derivadas del producto de la frecuencia cardiaca por la tensión arterial media.
Variables derivadas del FC×TAM. El eje de ordenadas: frecuencia cardiaca en latidos por minuto (lpm) por la tensión arterial media en mmHg dividido por 100 o por 1.000 en el caso de la variable SUM o porcentaje. La altura de los rectángulos representa la media o el porcentaje, y las barras de error, la desviación estándar o el intervalo de confianza del 95%. El número en el interior de cada rectángulo es el número de pacientes. MD FC×TAM: media de las diferencias entre el valor del FC×TAM en cada minuto y su valor inicial. MDA FC×TAM: media del valor absoluto de las diferencias entre el valor del FC×TAM en cada minuto y su valor inicial. MÍN: diferencia entre el valor de FC×TAM más bajo antes de la intubación y su valor inicial. MÁX: diferencia entre el valor de FC×TAM más alto tras la intubación y su valor inicial. FINAL: diferencia entre el valor de FC×TAM al final del estudio (minuto 11) y su valor inicial. INTUBACIÓN: diferencia entre el valor alcanzado justo antes la maniobra de intubación y el máximo valor tras la misma. MÍN.MÁX: diferencia porcentual entre el valor más bajo antes del intubación y el máximo valor alcanzado tras la misma. SUM: sumatorio de los valores absolutos de las variables MÍN, MÁX, MÍN.MÁX y FINAL, dividido por 100. Las variables GRADIENTE (MÍN, MÁX)>150%, INTUBACIÓN>150% y FINAL<−50% son el porcentaje de pacientes que presentaban un valor por encima de 150% en las 2 primeras y uno por debajo de −50% en la última. La variable HIPOTENSIÓN representa el porcentaje de pacientes que presentaron hipotensión en cada grupo. No se encontró ninguna diferencia significativa entre los grupos en estas variables. Los valores de p fueron, respectivamente: 0,72, 0,54, 0,7, 0,91, 0,91, 0,84, 0,96, 0,54, 0,46; 0,65, 0,75 y 0,29.
Nuestro objetivo principal era demostrar que el comportamiento hemodinámico durante la inducción anestésica y la intubación dependería del modelo de TCI para propofol en Ce utilizado. Pero no hemos hallado diferencias relevantes entre los 2 grupos de nuestro estudio.
Los modelos de TCI para propofol en Ce empleados en el estudio difieren en que los cálculos en que se basa el modelo de Schnider24,25 tienen en cuenta el peso, la altura, el índice de masa magra y la edad del paciente, mientras que el modelo de Marsh Modificado17,23 (derivado del modelo de Marsh27) solo tiene en cuenta el peso. Las dosis, la velocidad de administración (sobre todo al inicio de la infusión) y las concentraciones calculadas también difieren entre ambos: el modelo de Marsh Modificado17,23 proporciona una dosis mayor y de manera más rápida, pero con unas Ce calculadas menores.
Las únicas diferencias estadísticamente significativas entre los grupos del estudio fueron en la TAM (minutos 2, 3 y 4) y en el FC×TAM (minuto 3), presentando un descenso mayor en el grupo MM. Pero no son diferencias clínicamente relevantes, ya que los mayores descensos se produjeron en el minuto 6 (justo antes de la IOT). Y en ese momento ambos modelos tienden a converger, solapándose las curvas de FC, TAM y FC×TAM (fig. 3).
A lo largo del estudio la FC, la TAM y el FC×TAM siguieron un mismo patrón: desde el comienzo de la infusión hasta la IOT descendían, justo después de la IOT se producía un aumento rápido hasta alcanzar valores ligeramente inferiores a los iniciales, y a continuación volvían a descender, quedando al final del estudio en valores ligeramente superiores a los de antes de la IOT.
Las variables derivadas del FC×TAM no mostraron ninguna diferencia significativa (fig. 4). Ni siquiera las variables GRADIENTE (MÍN, MÁX) y SUM tuvieron un comportamiento distinto, siendo estas de gran importancia puesto que el GRADIENTE (MÍN, MÁX) mide la máxima variación en los valores del FC×TAM (compara el valor más alto tras la IOT con el más bajo antes de la IOT), y SUM sirve de resumen del comportamiento durante todo el proceso, al tener en cuenta momentos clave del estudio (antes y después de la IOT, y al final del mismo).
En general, la frecuencia global de hipotensión fue cercana al 15%, siendo una cifra similar a las encontradas en otros estudios9. Aunque la frecuencia de cuadros de hipotensión fue algo mayor en el grupo MM, no se alcanzó significación estadística (fig. 4).
La ausencia de diferencias en el comportamiento hemodinámico entre ambos modelos coincide con los resultados publicados por Viterbo et al.22, pero en nuestro estudio se mantienen las diferencias teóricas en las dosis administradas en los trabajos que desarrollaron estos modelos de TCI para el propofol17,23–25. Probablemente esto es debido a que Viterbo et al. emplearon una Ce objetivo inicial de solo 1,5μg mL−1, que fueron aumentando secuencialmente hasta alcanzar un valor de BIS de 50, dando tiempo con esto a que las diferencias entre los modelos se minimicen.
Las dosis, las concentraciones calculadas y la velocidad de administración siguieron un patrón semejante al ya descrito en la literatura26, disminuyendo las diferencias entre los modelos al final del estudio. Probablemente esto fue debido a que nos acercábamos al periodo de mantenimiento anestésico, donde las diferencias entre los modelos no son tan evidentes.
También hemos observado que las variaciones necesarias en la Ce objetivo para mantener el nivel de hipnosis marcado fueron diferentes entre los grupos. En el grupo MM lo más habitual fue que se requiriesen Ce menores que la inicial, mientras que en el grupo S se debió mantener durante más tiempo esa Ce inicial de 6μg mL−1, o incluso hubo de ser aumentada. Es decir, el modelo de Schnider necesita más tiempo para proporcionar la dosis requerida para alcanzar ese determinado nivel de hipnosis. Pero a pesar de que el grupo MM recibió una dosis mayor y de manera más rápida que el grupo S, no tuvo diferencias importantes en el comportamiento hemodinámico.
Decidimos utilizar el producto de la TAM y de la FC para representar los cambios hemodinámicos, y además, con este producto, definimos una serie de variables que valoraban determinados momentos clave para estudiarlos en mayor profundidad.
El hecho de no ser un estudio ciego y el no haber utilizado una monitorización hemodinámica invasiva son limitaciones de nuestro estudio. El método necesario para cegarlo sería complejo y podría no ser adecuado por motivos de seguridad. En el caso de las mediciones invasivas, no fueron realizadas por no estar justificadas ni por el estado del paciente ni por el tipo de cirugía.
Otro problema de nuestro estudio es el no haber podido ajustar la dosis de opiáceo a las necesidades concretas de cada paciente, con lo que en algún caso el comportamiento hemodinámico ha podido verse comprometido. Esperamos que en un futuro podamos disponer de monitores de analgesia validados. Aun así, creemos que nuestros resultados pueden ser extrapolados a la clínica habitual por el amplio tamaño muestral y por la variedad de pacientes y cirugías.
Concluimos que no podemos recomendar ninguno de los modelos como el más adecuado para disminuir las variaciones hemodinámicas durante la inducción anestésica y la intubación al no haberse demostrado diferencias en el comportamiento hemodinámico entre los modelos de TCI para propofol estudiados. Sin embargo, el modelo de Marsh Modificado podría ser más apropiado para obtener una inducción más rápida y confortable. Creemos que nuestro estudio puede ser interesante para futuras investigaciones encaminadas al desarrollo de circuitos cerrados anestésicos, como las que están surgiendo recientemente28–30.
FinanciaciónEsta investigación no recibió ningún tipo de soporte o ayuda económica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.






![Esquema de las variables hemodinámicas. Eje de abscisas: tiempo en minutos. Eje de ordenadas: valor del FC×TAM (producto de la frecuencia cardiaca [FC] por la tensión arterial media [TAM]). Línea delgada horizontal: valor basal del FC×TAM. Línea delgada vertical: momento de la intubación orotraqueal (IOT), que se produjo en el minuto 6. Línea discontinua: evolución del FC×TAM a lo largo del estudio. Flechas: representan los valores de FC×TAM comparados para calcular cada variable. MÍN: valor mínimo alcanzado antes de la IOT. MÁX: valor máximo alcanzado tras la IOT. FINAL: valor alcanzado al final del estudio (minuto 11). MÍN.MÁX: diferencia porcentual entre el valor más bajo antes de la IOT y el más alto tras la misma. INTUBACIÓN: diferencia porcentual entre el valor alcanzado justo antes de la IOT (minuto 6) y el más alto tras la misma. Esquema de las variables hemodinámicas. Eje de abscisas: tiempo en minutos. Eje de ordenadas: valor del FC×TAM (producto de la frecuencia cardiaca [FC] por la tensión arterial media [TAM]). Línea delgada horizontal: valor basal del FC×TAM. Línea delgada vertical: momento de la intubación orotraqueal (IOT), que se produjo en el minuto 6. Línea discontinua: evolución del FC×TAM a lo largo del estudio. Flechas: representan los valores de FC×TAM comparados para calcular cada variable. MÍN: valor mínimo alcanzado antes de la IOT. MÁX: valor máximo alcanzado tras la IOT. FINAL: valor alcanzado al final del estudio (minuto 11). MÍN.MÁX: diferencia porcentual entre el valor más bajo antes de la IOT y el más alto tras la misma. INTUBACIÓN: diferencia porcentual entre el valor alcanzado justo antes de la IOT (minuto 6) y el más alto tras la misma.](https://static.elsevier.es/multimedia/00349356/0000006200000009/v1_201510132143/S0034935614003375/v1_201510132143/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)