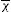La nefropatía lúpica (NL) es un proceso inflamatorio crónico caracterizado por la activación de célulasT y niveles elevados de diversas citocinas, como la MCP-1 a nivel del glomérulo renal y el túbulo intersticial. La MCP-1 es un quimioatractante de monocitos y linfocitos, responsable de la infiltración de leucocitos en el riñón, razón por la cual niveles de MCP-1 en orina de pacientes con NL se correlacionan con la forma activa de la enfermedad.
ObjetivoEl presente estudio tiene como objetivo evaluar los niveles de expresión de la MCP-1 en pacientes con NL y correlacionar sus niveles urinarios con marcadores séricos de autoinmunidad.
Materiales y métodosNuestro estudio es tipo caso-control; los grupos estuvieron conformados por 112 pacientes diagnosticados con LES o NL y 28 personas aparentemente sanas, sin antecedentes clínicos, y familiares para enfermedades autoinmunes, respectivamente. Los niveles de expresión de la MCP-1 fueron estimados mediante qRT-PCR. Además, se evaluaron los parámetros clínicos y los niveles séricos (anticuerpos anti-ds-DNA, anti-nucleosoma, anti-C1q, niveles de β2-microglobulina y fracción del complemento C3 y C4). Finalmente, los datos moleculares y clínicos fueron correlacionados.
ResultadosEn nuestro estudio participaron 39 pacientes con LES activo (mediana 36años), 32 con NL activo (mediana 32,5años), 28 con LES inactivo (mediana 41,5años), 13 con NL inactivo (mediana 38años) y 28 pacientes control (mediana 28,5años). La comparación de niveles de expresión de la MCP-1 entre pacientes con NL activa y LES activo no presentaron valores estadísticamente significativos (p>0,05). Asimismo, se observó una correlación estadísticamente significativa entre los niveles de expresión de MCP-1 y los niveles de anti-C1q (r=0,255; p<0,025); sin embargo, no se encontró ninguna correlación con los restantes marcadores.
ConclusionesEl uso de los niveles de expresión de la MCP-1 en población boliviana no llegaría a ser un biomarcador útil para evaluar la NL. Sin embargo, se sugiere al biomarcador anti-C1q como un marcador serológico para el seguimiento de la enfermedad.
Lupus nephropathy (LN) is a chronic inflammatory process, characterized by the activation of Tcells and high levels of various cytokines, such as MCP-1 at the level of the renal glomerulus and the interstitial tubule. MCP-1 is a chemoattractant of monocytes and lymphocytes, it is responsible for the infiltration of leukocytes in the kidney, which is why MCP-1 levels in urine of patients with LN correlate with the active form of the disease.
ObjectiveThe present study aims to evaluate the expression levels of MCP-1 in patients with LN and to correlate their urinary levels with serum autoimmunity markers.
Material and methodsOur study is of the case-control type, where the groups were made up of 112 patients diagnosed with SLE or LN, and 28 apparently healthy people with no clinical or family history of autoimmune diseases, respectively. MCP-1 expression levels were estimated using qRT-PCR. In addition, clinical parameters and serum levels were evaluated (anti-ds-DNA, anti-nucleosome, anti-C1q antibodies, β2-microglobulin levels, and C3 and C4 complement fraction). Finally, clinical, and molecular data were correlated.
ResultsOur study included 39 patients with active SLE (median 36years), 32 with active LN (median 32.5years), 28 with inactive SLE (median 41.5years), 13 with inactive LN (median 38years), and 28 control patients (median 28.5years). The comparison of MCP-1 expression levels between patients with active LN and active SLE did not show statistically significant values (P>.05). Likewise, a statistically significant correlation was observed between the expression levels of MCP-1 with the levels of anti-C1q (r=.255; P<.025); however, no correlation was found with the other markers.
ConclusionThe use of MCP-1 expression levels in the Bolivian population would not be a useful biomarker to evaluate lupus nephropathy. However, the anti-C1q biomarker is suggested as a serological marker for monitoring the disease.
La nefropatía lúpica (NL) es una de las manifestaciones clínicas más severas del lupus eritematoso sistémico (LES)1, y se observa aproximadamente en el 50% de los pacientes2. Su patogénesis es un proceso complejo que involucra el depósito de inmunocomplejos en el glomérulo, la activación del complemento, la activación de los macrófagos, la proliferación celular y la producción de citocinas y quimiocinas proinflamatorias, que luego se interrelacionan por medio de múltiples mecanismos para causar daño glomerular, tubular, inflamación tubulointersticial y fibrosis3.
La NL continúa siendo una de las manifestaciones más severas del LES. Los parámetros de laboratorio de uso convencional, como la elevación de la creatinina, la proteinuria, los anticuerpos anti-ds-DNA y los niveles bajos del complemento no son lo suficientemente sensibles o específicos para detectar actividad de la enfermedad4. Pueden producirse daños significativos en los riñones antes de que se evidencie clínicamente que la función renal esté deteriorada2.
La MCP-1 es un potente quimioatractante de monocitos, células Ty células asesinas naturales, responsable de inducir daño renal tubular o glomerular. Se sabe que las células del parénquima renal, en particular las células mesangiales y las células epiteliales tubulares, producen MCP-1 en respuesta al estímulo producido por IL-1, TNF-α, IFN-γ e inmunocomplejos de IgG circulante5. Investigaciones previas han demostrado que los niveles de MCP-1 en la orina de pacientes con NL se correlacionan con la actividad de la enfermedad. Se propone medir los niveles excreción del MCP-1 en orina, los cuales serían un excelente indicador de su producción y secreción local, y por lo tanto podrían ser considerados un biomarcador que refleja la actividad inflamatoria en el riñón2,6-8.
La identificación de biomarcadores confiables ayudará a evaluar la actividad de la NL9,10, identificar a los pacientes en riesgo para daño renal y facilitar el diagnóstico temprano. Por consiguiente, el presente estudio tiene como objetivo evaluar los niveles de expresión de la quimiocina MCP-1 en pacientes con NL.
Materiales y métodosPoblación en estudioLos participantes fueron seleccionados mediante la aplicación de los criterios del Colegio Americano de Reumatología11-14, de acuerdo con los cuales los pacientes con LES o NL deben cumplir como mínimo con 4 requisitos para así poder ser incluidos en el grupo de casos. Para la selección de los controles se seleccionaron personas aparentemente sanas, sin antecedentes clínicos ni familiares de enfermedades autoinmunes o enfermedad renal.
En el presente estudio se incluyeron 112 pacientes con LES o NL, los cuales fueron reclutados en el Instituto de Servicios de Laboratorios de Diagnóstico e Investigación en Salud (Seladis). Como grupo control se seleccionaron 28personas sanas.
Diseño del estudioEl presente estudio es de tipo caso-control. El grupo caso fue subdividido en 4 subgrupos en función de la actividad de la enfermedad, los cuales fueron: pacientes con LES activo sin antecedentes de NL; pacientes con NL activa; pacientes con LES inactivo sin antecedentes de NL, y pacientes con NL inactiva. La actividad de la enfermedad fue evaluada mediante el análisis de los datos clínicos, los niveles de anti-ds-DNA, anti-nucleosoma, anti-C1q, β2-microglobulina y complemento C3 y C4. Para evaluar los niveles de expresión de la quimiocina MCP-1 se empleó la prueba de qRT-PCR en la primera muestra de orina de la mañana; estas muestras fueron remitidas por los pacientes de los diferentes grupos de estudio, incluidos los participantes del grupo control. Los niveles urinarios de MCP-1 se asociaron con los valores séricos de los marcadores serológicos anteriormente mencionados.
qRT-PCREl RNA total fue aislado empleando el reactivo Trizol; la síntesis de DNAc se realizó a partir de 30μg de RNA total extraído, utilizando el kit comercial Super ScriptIII Reverse Transcriptase (Invitrogen, EE.UU.), de acuerdo con el protocolo especificado por el fabricante. Las reacciones de PCR en tiempo real se desarrollaron en el termociclador Step One Plus (Applied Biosystems). Para la reacción de PCR se emplearon cebadores específicos basados en las secuencias del gen MCP-1 humano 5’-AACACTCACTCCACAACCCAAG-3’ (forward), 5’-TGTGGTTCAAGAGGAAAAGCAAT-3’ (reverse); como control endógeno se emplearon cebadores del gen de la β-actina humana 5’-GCTCCTCCTGAGCGCAAG-3’ (forward) y 5’- CATCTGCTGGAAGGTGGACA-3’ (reverse).
La mix de PCR estuvo diseñada para un volumen final de 20μl, cumpliendo las especificaciones del fabricante: 4μl de DNAc (30μg/ml), 10μl de SYBR Green Supermix (mezcla optimizada de iTaqTM), 0,4μl de cebador específico directo (2μM), 0,4μl de cebador específico reverso (2μM) y agua libre de nucleasas.
Finalmente, el mix de PCR, con las muestras de DNAc, se llevó al termociclador, donde la muestra fue amplificada de la siguiente manera: un primer paso de desnaturalización inicial de 10min a 95°C, seguida de 40 ciclos (15s a 95°C de desnaturalización, 60s a 60°C de alineamiento y extensión).
Cuantificación relativa de la expresión génicaPara la cuantificación relativa del producto amplificado se empleó el valor del ciclo umbral (Ct) registrado en el software Applied Biosystems, con base en el modelo Delta Delta Ct (ΔΔCt), desarrollado por PE Applied Biosystems (Perkin Elmer, Forster City, CA, EE.UU.). Los valores obtenidos para cada gen diana fueron normalizados con los niveles de Ct obtenidos de un gen calibrador (pacientes control). El gen calibrador es considerado un control interno para las variaciones interanálisis. Para el cálculo se utilizó la fórmula 2−ΔΔCt15:
La interpretación del nivel de expresión del gen en estudio se basa en el valor de la expresión normalizada a un valor constante de1, lo cual significa que un valor igual a1 corresponde a una expresión idéntica entre el gen diana y el calibrador, valores menores a1 corresponden a una expresión menor del gen diana frente al calibrador y valores mayores a1 corresponden a una expresión mayor del gen diana frente al calibrador.
Ensayos inmunoenzimáticosA todos los pacientes en estudio se les hicieron las siguientes pruebas de laboratorio: anticuerpos anti-ds-DNA (Trinity, USA, Cod. 2327670), β2-microglobulina (ORGENTEC, Alemania, Cod. ORG 5BM), anticuerpos anti-nucleosoma (ORGENTEC, Alemania, Cod. ORG 528) y anticuerpos anti-C1q (ORGENTEC, Alemania, Cod. ORG 549). Todos los ensayos de las pruebas de inmunoserología se realizaron empleando las instrucciones de los fabricantes de los kits comerciales.
Análisis estadísticoLos datos se analizaron con el paquete estadístico PSPP1.6.2 (Licencia Pública General de GNU), en tanto que las variables cuantitativas se describieron empleando mediana y percentiles 25 y 75, y los datos categóricos se presentaron como frecuencia y porcentaje; para las pruebas no paramétricas el análisis se realizó mediante la prueba U de Mann-Whitney. En el caso de muestras independientes (niveles de biomarcadores urinarios) entre grupos de estudio se utilizó el test de Kruskal-Wallis. La prueba de Rho de Spearman se utilizó para correlacionar los biomarcadores urinarios con otras variables (marcadores serológicos). Las diferencias se consideraron significativas con un valor de p<0,05.
La expresión génica se evaluó por el método 2−ΔΔCt, que proporciona información sobre el nivel de expresión de un gen en valores relativos. Los valores obtenidos representan el número de veces que se expresa el gen diana con respecto al nivel de expresión del gen calibrador.
Consideraciones éticasEl protocolo del presente estudio fue revisado y aprobado por el Comité de Ética de Investigación de la Universidad Mayor de San Andrés, La Paz, Bolivia, mediante el aval CEI-UMSA 0416 del 2016. Todos los participantes fueron informados de manera verbal y escrita acerca del objetivo y el alcance del presente estudio; asimismo, se explicaron los beneficios y las implicaciones de su participación. El consentimiento informado fue firmado por todos los participantes sin que mediara ningún mecanismo de presión.
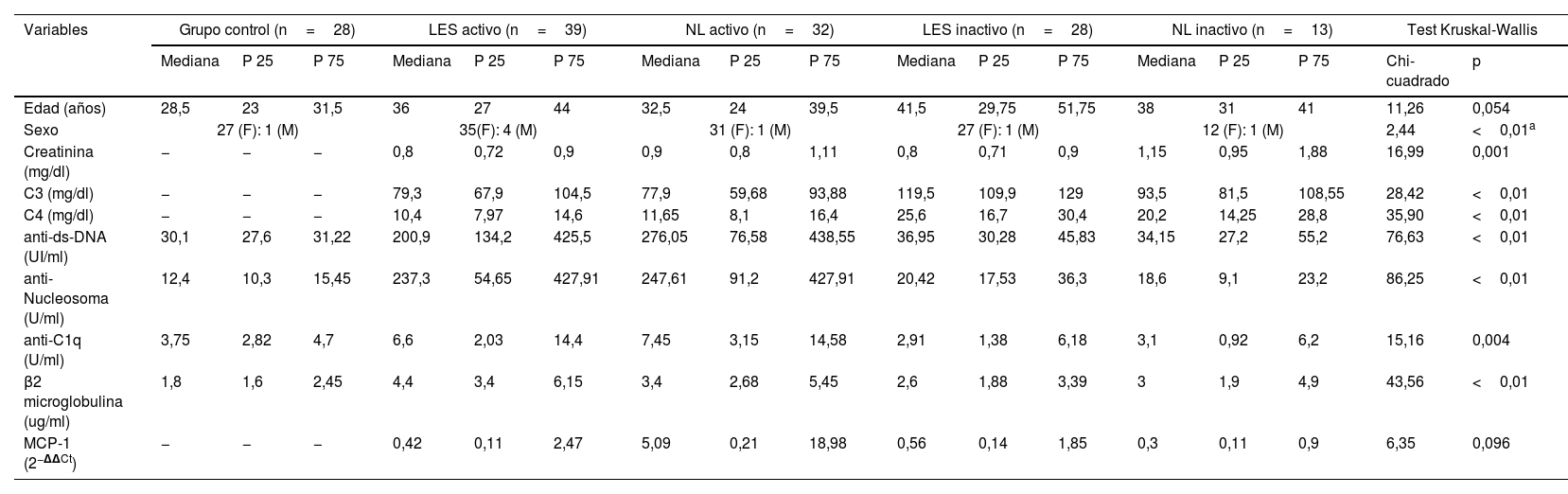
ResultadosEntre los resultados iniciales que se detectaron en nuestro estudio, observamos que la población de estudio estuvo conformada por personas cuyas edades estaban dentro del rango de 17 a 76años, con diferentes rangos de edad entre los diferentes grupos que conformaron esta investigación, hecho que se muestra en la tabla 1; para esta variable no se observaron diferencias significativas entre los diferentes grupos. Del mismo modo, al ser la NL y el LES enfermedades más frecuentes en mujeres, nuestra población mayoritaria fue de sexo femenino, dato que también es visible en la tabla 1.
Comparación de las características demográficas, hallazgos clínicos y datos de laboratorio entre pacientes control-caso
| Variables | Grupo control (n=28) | LES activo (n=39) | NL activo (n=32) | LES inactivo (n=28) | NL inactivo (n=13) | Test Kruskal-Wallis | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mediana | P 25 | P 75 | Mediana | P 25 | P 75 | Mediana | P 25 | P 75 | Mediana | P 25 | P 75 | Mediana | P 25 | P 75 | Chi-cuadrado | p | |
| Edad (años) | 28,5 | 23 | 31,5 | 36 | 27 | 44 | 32,5 | 24 | 39,5 | 41,5 | 29,75 | 51,75 | 38 | 31 | 41 | 11,26 | 0,054 |
| Sexo | 27 (F): 1 (M) | 35(F): 4 (M) | 31 (F): 1 (M) | 27 (F): 1 (M) | 12 (F): 1 (M) | 2,44 | <0,01a | ||||||||||
| Creatinina (mg/dl) | − | − | − | 0,8 | 0,72 | 0,9 | 0,9 | 0,8 | 1,11 | 0,8 | 0,71 | 0,9 | 1,15 | 0,95 | 1,88 | 16,99 | 0,001 |
| C3 (mg/dl) | − | − | − | 79,3 | 67,9 | 104,5 | 77,9 | 59,68 | 93,88 | 119,5 | 109,9 | 129 | 93,5 | 81,5 | 108,55 | 28,42 | <0,01 |
| C4 (mg/dl) | − | − | − | 10,4 | 7,97 | 14,6 | 11,65 | 8,1 | 16,4 | 25,6 | 16,7 | 30,4 | 20,2 | 14,25 | 28,8 | 35,90 | <0,01 |
| anti-ds-DNA (UI/ml) | 30,1 | 27,6 | 31,22 | 200,9 | 134,2 | 425,5 | 276,05 | 76,58 | 438,55 | 36,95 | 30,28 | 45,83 | 34,15 | 27,2 | 55,2 | 76,63 | <0,01 |
| anti-Nucleosoma (U/ml) | 12,4 | 10,3 | 15,45 | 237,3 | 54,65 | 427,91 | 247,61 | 91,2 | 427,91 | 20,42 | 17,53 | 36,3 | 18,6 | 9,1 | 23,2 | 86,25 | <0,01 |
| anti-C1q (U/ml) | 3,75 | 2,82 | 4,7 | 6,6 | 2,03 | 14,4 | 7,45 | 3,15 | 14,58 | 2,91 | 1,38 | 6,18 | 3,1 | 0,92 | 6,2 | 15,16 | 0,004 |
| β2 microglobulina (ug/ml) | 1,8 | 1,6 | 2,45 | 4,4 | 3,4 | 6,15 | 3,4 | 2,68 | 5,45 | 2,6 | 1,88 | 3,39 | 3 | 1,9 | 4,9 | 43,56 | <0,01 |
| MCP-1 (2−ΔΔCt) | − | − | − | 0,42 | 0,11 | 2,47 | 5,09 | 0,21 | 18,98 | 0,56 | 0,14 | 1,85 | 0,3 | 0,11 | 0,9 | 6,35 | 0,096 |
Con respecto a los resultados para los marcadores asociados a la NL y el LES, todos los participantes del grupo control dieron resultados no reactivos a las pruebas de anticuerpos anti-ds-DNA, anticuerpos anti-nucleosoma, anticuerpos anti-C1q y β2-microglobulina, situación que era previsible, lo que confirma que se trataba de personas que no tienen ningún tipo de enfermedad autoinmune (tabla 1). En contraposición, los pacientes del grupo caso presentaron resultados con diferencias significativas, con respecto al grupo control, en las siguientes pruebas serológicas: niveles séricos de anticuerpos anti-ds-DNA, anti-nucleosoma, niveles de β2-microglobulina y niveles de complemento C3 y C4 (p<0,001). Otro resultado que también fue observado es la existencia de diferencias significativas en los niveles séricos de creatinina y en los niveles de anti-C1q (p<0,05) entre los pacientes que presentaban la enfermedad activa y aquellos que la presentaban en remisión (tabla 1).
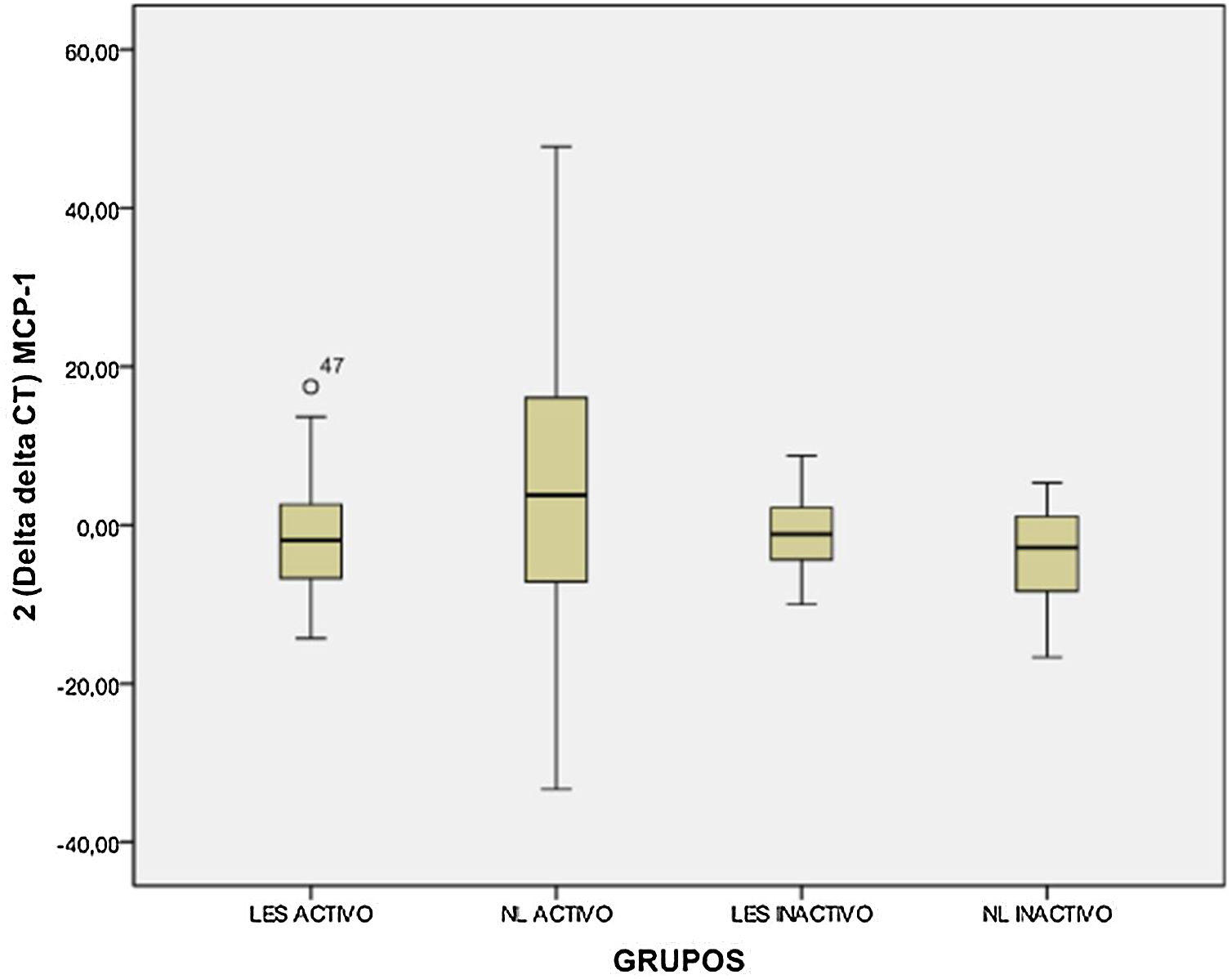
En la figura 1 se presentan los resultados de la comparación realizada para los niveles de expresión de MCP-1 entre los diferentes subgrupos que conformaban el grupo de casos; se observa que no existe una diferencia significativa entre estos subgrupos (p>0,05), como también que los niveles de expresión para el subgrupoII (NL activa) presentaban un rango amplio, y asimismo entre los subgruposI, II yIV; como se muestra en la figura 1, se visualiza que estas presentaban niveles de expresión similares.
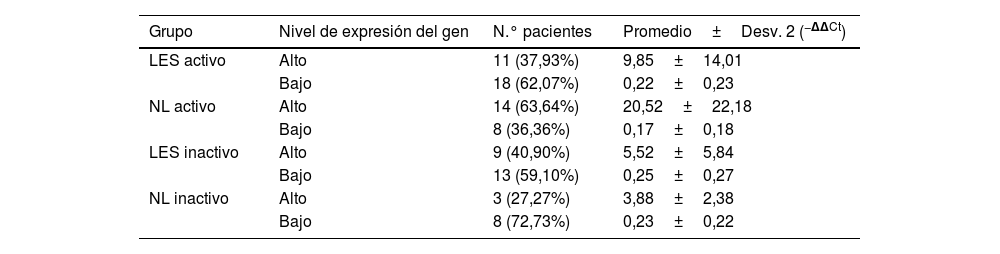
En la tabla 2 se presentan los valores de los niveles de expresión de la quimiocina MCP-1 en los diferentes subgrupos que conforman el grupo de casos. Los pacientes que presentan NL activa (subgrupoII) muestran que tienen niveles elevados de expresión de este marcador, que llegan a ser 20,52±22,18 veces superiores a los niveles del grupo control; estos niveles de expresión se encuentran elevados en un 63,64% de los casos que conforman este subgrupo.
Cuantificación relativa normalizada de la expresión del gen MCP-1 evaluada mediante RT-qPCR en muestras de orina
| Grupo | Nivel de expresión del gen | N.° pacientes | Promedio±Desv. 2 (−ΔΔCt) |
|---|---|---|---|
| LES activo | Alto | 11 (37,93%) | 9,85±14,01 |
| Bajo | 18 (62,07%) | 0,22±0,23 | |
| NL activo | Alto | 14 (63,64%) | 20,52±22,18 |
| Bajo | 8 (36,36%) | 0,17±0,18 | |
| LES inactivo | Alto | 9 (40,90%) | 5,52±5,84 |
| Bajo | 13 (59,10%) | 0,25±0,27 | |
| NL inactivo | Alto | 3 (27,27%) | 3,88±2,38 |
| Bajo | 8 (72,73%) | 0,23±0,22 |
Se observó también un comportamiento elevado de los niveles de expresión de la quimiocina MCP-1 en aquellos pacientes que formaban parte del subgrupoI (LES activo), con un nivel de expresión 9,85±14,01 veces superior a los niveles del grupo control, presente en el 37,93% (tabla 2).
En el caso de los pacientes con enfermedades inactivas, se observaron valores de expresión de la quimiocina MCP-1 inferiores a los que presentaron los pacientes con las enfermedades activas, siendo estos valores de 5,52±5,84 y 3,88±2,38 para los subgruposIII (LES inactivo) yIV (NL inactivo), respectivamente; estos niveles de expresión se presentaron en un porcentaje minoritario del subgrupo (tabla 2); el porcentaje mayoritario fue el nivel bajo de expresión, con valores de 0,25±0,27 (59,1%) y 0,23±0,22 (72,73%) para los subgruposIII (LES inactivo) yIV (NL inactivo), respectivamente.
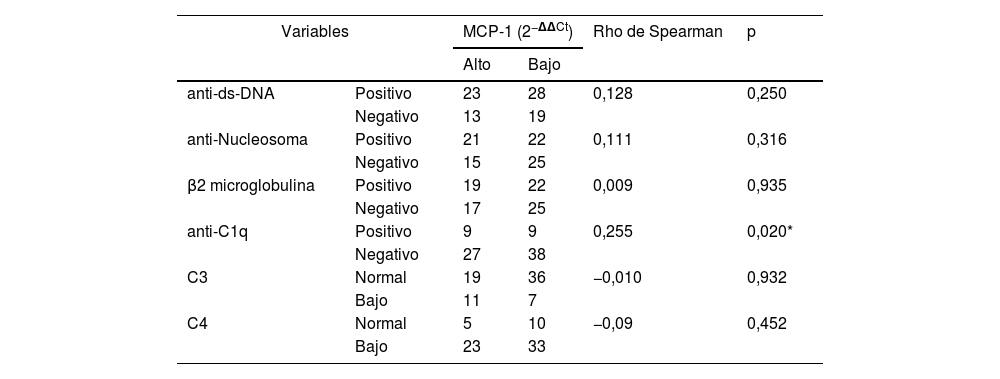
En la tabla 3 se presenta la correlación existente entre los niveles de expresión de la quimiocina MCP-1 y los valores de los marcadores: anti-ds-DNA, anticuerpos anti-nucleosoma, anticuerpos anti-C1q, C3, C4 y β2-microglobulina; para esta correlación se realizó el test de Rho de Spearman. Un resultado llamativo observado en nuestro estudio fue que no se evidenció una respuesta significativa en la correlación de la expresión de la quimiocina MCP-1 y los marcadores anti-ds-DNA, anticuerpos anti-nucleosoma, C3, C4 y β2-microglobulina, que en todos los casos presentó una p>0,05. En contraste, se hizo un interesante hallazgo de correlación positiva entre los niveles de MCP-1 en orina y el marcador serológico anticuerpos anti-C1q (p<0,05), lo cual sugiere que este marcador puede ser empleado para evaluar la actividad de la enfermedad.
Resumen del análisis de correlación de los niveles de expresión urinarios de la quimiocina MCP-1 con los marcadores serológicos evaluados
| Variables | MCP-1 (2−ΔΔCt) | Rho de Spearman | p | ||
|---|---|---|---|---|---|
| Alto | Bajo | ||||
| anti-ds-DNA | Positivo | 23 | 28 | 0,128 | 0,250 |
| Negativo | 13 | 19 | |||
| anti-Nucleosoma | Positivo | 21 | 22 | 0,111 | 0,316 |
| Negativo | 15 | 25 | |||
| β2 microglobulina | Positivo | 19 | 22 | 0,009 | 0,935 |
| Negativo | 17 | 25 | |||
| anti-C1q | Positivo | 9 | 9 | 0,255 | 0,020* |
| Negativo | 27 | 38 | |||
| C3 | Normal | 19 | 36 | −0,010 | 0,932 |
| Bajo | 11 | 7 | |||
| C4 | Normal | 5 | 10 | −0,09 | 0,452 |
| Bajo | 23 | 33 | |||
El control de la actividad de la NL es esencial para evitar una pérdida irreversible de la función renal, y se requiere un tratamiento rápido y oportuno. En la práctica clínica, ninguna prueba de laboratorio es lo suficientemente sensible o específica para detectar actividad de la enfermedad precozmente16. En consecuencia, la identificación de biomarcadores no invasivos, de fácil medición y buena precisión, sería útil en el seguimiento de la enfermedad.
Las células renales (endoteliales, mesangiales, epitelio tubular, células intersticiales y podocitos) pueden expresar quimiocinas tras estimulación16. Los estímulos proinflamatorios inducen la expresión de MCP-1, que en última instancia conduce a una lesión tisular. La MCP-1 desempeña un papel importante en la patogenia de la progresión de la enfermedad renal6. Recientemente, se llevaron a cabo varios estudios relacionados con evaluar la actividad clínica del MCP-1, entre ellos los metaanálisis de Lee et al.6 y Wang et al.17, realizados en poblaciones con distinta distribución demográfica; en ambos casos se sugiere que el MCP-1 puede ser un biomarcador útil para evaluar la actividad de NL, siendo un potencial biomarcador para diferenciar entre NL activa e inactiva, debido a que se encontraron niveles elevados de la quimiocina MCP-1 en pacientes con NL activa en muestras de orina, así como en muestras de suero.
En el año 2018, El Shehaby et al.18 y Dong et al.19 evaluaron la correlación entre los niveles de expresión de la quimiocina MCP-1 y diversos marcadores, entre los cuales se encuentran el anti-ds-DNA, antinuclesomas, anti-C1q, niveles de creatinina, niveles de complemento (C3, C4) y β2M, y encontraron una significancia estadística (p<0,05) en relación con los marcadores C3, C4 y anti-ds-DNA. Este hecho difiere con nuestra investigación, ya que en nuestro caso no se observó una correlación estadísticamente significativa con estos marcadores; sin embargo, a diferencia de este estudio, nuestros participantes fueron pacientes ambulatorios, lo cual dificultó el control de las variables.
En nuestro estudio se compararon los niveles de expresión de la quimiocina MCP-1 entre casos y controles, y no encontramos ninguna diferencia entre los grupos de NL activo (mediana: 5,09 P25 0,21 y P75 18,98), LES activo (mediana; 0,42 P25 0,11 y P75 2,47) y los grupos NL inactivo (mediana: 0,30 P25 0,11 y P75 0,90) y LES inactivo (mediana: 0,56 P25 0,14 y P75 1,85) (p=0,096). En estudios similares en población egipcia y asiática5,20 se observaron resultados similares al presente estudio; sin embargo, existen otros estudios en población caucásica16,19,21,22 que reportan diferencias de los niveles de MCP-1, los cuales fueron significativamente más altos en los pacientes lúpicos con daño renal en comparación con el grupo control.
Akhter et al.23 sugieren al anti-C1q como un marcador para detectar la actividad de la enfermedad de NL; en el presente estudio se obtuvo que la MCP-1 tiene una correlación positiva con los niveles de anticuerpos anti-C1q (r=0,255; p=0,02). Dichos anticuerpos, fuertemente relacionados con la NL, se encuentran en el 30-48%24. Los anticuerpos anti-C1q en forma soluble no activan la cascada del complemento; sin embargo, su unión a C1q previamente fijado a la membrana basal glomerular puede alterar su configuración y, de esta manera, amplificar la activación del complemento. Diferentes investigadores observaron la presencia de anticuerpos anti-C1q que se correlacionan con la actividad de la NL25-28.
En el presente estudio determinamos que no existe correlación de la MCP-1 con los demás marcadores serológicos, ni con los niveles de complemento (C4, C3), posiblemente porque no son específicos de la patología; Ferreira et al.29 reportaron resultados similares.
En el 63,64% de los pacientes con NL activa se evidenció un incremento de la expresión de la quimiocina MCP-1 en comparación con los demás grupos; sin embargo, los datos no son estadísticamente significativos. Si bien muchos estudios demostraron niveles significativos de MCP-1 en pacientes con NL activa, en el presente estudio no se reportaron resultados similares, lo que posiblemente corresponda a factores como la heterogeneidad de la población en estudio, o a que el genotipo MCP-1 expresado en la población en estudio es diferente a las otras poblaciones.
ConclusiónLos resultados obtenidos en el presente estudio sugieren que la quimiocina MCP-1 no es un biomarcador útil para evaluar la actividad de la NL, hecho que puede estar influenciado por el tamaño muestral. Sin embargo, se sugiere al biomarcador anti-C1q como un marcador serológico para el seguimiento de la enfermedad, y se propone una ampliación y una continuación del estudio con un mayor tamaño muestral.
FinanciaciónEste estudio fue financiado con recursos concursables IDH de la Universidad Mayor de San Andrés en la gestión 2014-2015.
Conflicto de interesesLos autores del presente artículo declaran no tener conflicto de intereses.