Las malformaciones vasculares periféricas (MVP) son la consecuencia del desarrollo anormal de las estructuras vasculares durante el período embrionario, manifestándose clínicamente de una forma amplia, desde simples máculas en el momento del nacimiento hasta insuficiencia cardíaca congestiva1. Mulliken clasificó las MVP en dos categorías principales: hemangiomas inmaduros del lactante y malformaciones vasculares propiamente dichas2-4. El último grupo se clasifica en malformaciones vasculares hemodinámicamente activas (MVHA) o de alto flujo y malformaciones vasculares hemodinámicamente inactivas (MVHI) o de bajo flujo. Las primeras presentan comunicaciones patológicas arteriovenosas y nidus, hallazgo que no se presenta en las MVHI. Estas últimas se subdividen en capilares, venulares, venosas y linfáticas (tabla 1).
Las manifestaciones clínicas más frecuentes incluyen trastornos estéticos, dolor y limitación funcional de la zona anatómica en que asienta la MVP; esta última es intensa en las localizaciones intramusculares. Es frecuente observar asimetrías osteomusculares, hipertrofia o atrofia5. En niños son particularmente graves las localizaciones periocular o peribucal, dando lugar a ambliopía y transtornos de la deglución6.
La sospecha clínica se establece mediante exploración física, con los datos de la radiología convencional y con ecografía Doppler. El diagnóstico de certeza se obtiene con la resonancia magnética (RM), arteriografía selectiva y angiografía por punción directa7. La RM ofrece datos en cuanto al tipo de MVP, extensión y afectación de las estructuras anatómicas próximas. Las MVHA presentan imágenes serpenteantes con ausencia de señal en T2, que son características de alta velocidad de flujo. Las MVHI tienen aspecto polilobular y son hiperintensas en T2. La arteriografía selectiva y la angiografía por punción directa son necesarias para objetivar la anatomía de las aferencias arteriolares, nidus y eferencias venosas.
El manejo terapéutico clásico de las MVP ha sido quirúrgico -exéresis completa- siempre que fuese posible8, circunstancia que raramente se produce; cada vez es más aceptado el tratamiento percutáneo mediante embolización con diversas sustancias como primera opción9-11.
El acceso y embolización de las MVP es factible desde las aferencias en las MVHA o por punción directa en caso de las MVHI.
En este artículo reflejamos nuestra experiencia en el tratamiento de 18 pacientes portadores de los dos tipos principales de MVP propiamente dichas: MVHA y MVHI, con una sustancia de embolización obtenida mediante la mezcla de polidocanol y CO212. Hemos incluido en este estudio solamente las MVP; las malformaciones vasculares del sistema nervioso central, pulmón, hígado y aparato digestivo han sido excluidas de este trabajo.
Material y métodos
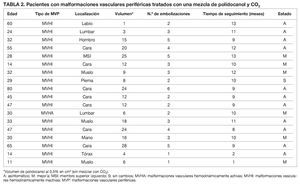
Desde abril de 2005 hasta diciembre de 2006 se realizó una serie de casos en la que fueron tratados 18 pacientes, 11 mujeres y 7 hombres de edades comprendidas entre los 11 y los 80 años (media 38 años). Un paciente (5%) era portador de una MVHA y 17 (95%) presentaban MVHI. Se realizaron en total 56 embolizaciones (rango 1-7; media 3) con una mezcla de polidocanol y CO2 (rango 1-28 cc; media 8 cc).
Los pacientes con MVHI se estudiaron con radiografía simple, ecografía doppler, RM y angiografía por punción directa. Los pacientes con sospecha de MVHA se estudiaron con radiografía simple, ecografía doppler, RM y arteriografías no selectivas y selectivas, con compresión y sin ella.
La indicación terapéutica fue establecida de forma multidisciplinaria, valorando en cada caso la edad del paciente, la clínica, el déficit funcional, la localización anatómica, el trastorno estético, etc. Todos los pacientes presentaron dolor y trastornos funcionales o estéticos. El punto de acceso para la embolización de la MVHA fue arterial femoral, cateterizando selectivamente la rama o ramas aferentes a la MVP.
En la evaluación angiográfica, previa al tratamiento, se emplearon un introductor de 5 French (Cordis Co. Miami. Fl. USA), catéteres angiográficos convencionales de 4 y 5 French (Cordis Co. Miami. Fl. USA) y guías hidrofílicas 0,035" (Terumo Co. Tokyo. Japón). Los estudios supraselectivos se hicieron con microcatéteres 2,4 French (Boston Scientific. 47900 Bayside Parwway. Fremont Ca. USA) y unas guías 0,010-0,014" (Cordis. Johnson&Jonson Co. 9300 AR Rodeen.The Nederlands). Una vez cateterizada la aferencia de la MVHA se inyectó la sustancia de embolización para producir la trombosis del nidus y de las aferencias. Las inyecciones se repitieron el número de veces necesario para provocar la trombosis.
En el tratamiento de las MVHI se rasuró y se lavó la piel con una sustancia antiséptica. El lugar de punción se escogió en función de la información anatómica proporcionada por la ecografía doppler y la RM. La punción se realizó con una aguja de 19 Gauge (BD infusión therapy. Helsingborg. Sweden). Una vez obtenido reflujo de sangre se inyectó medio de contraste realizando series angiográficas.
Las agujas empleadas para la embolización por punción directa se dejaron implantadas durante unos minutos, con el fin de evitar reflujo de material de embolización por el tracto de punción antes de la formación del trombo. Durante la embolización se administró hidrocortisona sodio fosfato 100 mg intravenosos y cefazolina 1 g intravenoso. Durante los 7 días siguientes a la embolización se administraron antiinflamatorios no esteroideos por vía oral (Neobrufen® 400 mg vía oral/6 horas), omeprazol 20 mg vía oral/24 horas y medidas de compresión local.
Todos los pacientes fueron citados al mes y cada 6 meses con el fin de valorar la mejoría sintomática, y en caso negativo repetir la embolización. Se realizaron controles clínicos y mediante ecografía doppler.
En todos ellos se utilizó como sustancia de embolización una mezcla de polidocanol y CO2 siempre en la misma proporción, 2 cm3 de polidocanol y 8 cm3 de CO2. Estas cantidades se alojaban en dos jeringas de 10 cm3 cada una, que se comunicaban entre sí con una llave de dos o tres vías de forma hermética. Tras agitar el contenido de ambas jeringas quedaba alojado en una de ellas, procediéndose a su inyección en la malformación previamente cateterizada12. El proceso de formación de la mezcla dura menos de 10 minutos y se realiza por personal con experiencia en la propia sala en los momentos previos a la embolización después de haber cateterizado la zona a tratar.
El procedimiento de embolización puede plantearse a través de una punción única o múltiple, cuando nos referimos a punción directa. Nuestro planteamiento es que siempre que sea posible se deben realizar varias punciones, con el objetivo de abarcar el mayor área posible de la MVP y, por tanto, hacer llegar la sustancia de embolización a la mayor parte o a la totalidad de la MVP. Además, con varias punciones se produce un efecto "descompresivo" que evita la embolización distal de material esclerosante.
Es difícil medir los resultados obtenidos cuando hablamos de trastornos estéticos o percepciones del estado del propio paciente, pero en general en este trabajo los hemos agrupado en: asintomáticos cuando pacientes con síntomas previos, estéticos o funcionales cuando no los perciben tras el procedimiento y los resultados del seguimiento por imagen lo corroboran, mejoría respecto a la situación previa cuando es así manifestada por los pacientes y las pruebas por imagen demuestran la esclerosis total de la MVP, y sin cambios cuando a pesar de la esclerosis de la MVP el paciente no experimenta una mejoría subjetiva.
Resultados
Se produjo un éxito técnico en el 100% de los casos, entendiendo como tal la posibilidad de embolizar la malformación. No hubo complicaciones técnicas durante el procedimiento. El período medio de seguimiento fue de 9 meses 1-13. Sólo un caso se realizó con punción única; los demás se llevaron a cabo con multipunción. El tamaño externo de las MVP osciló entre 1 y 12 cm.
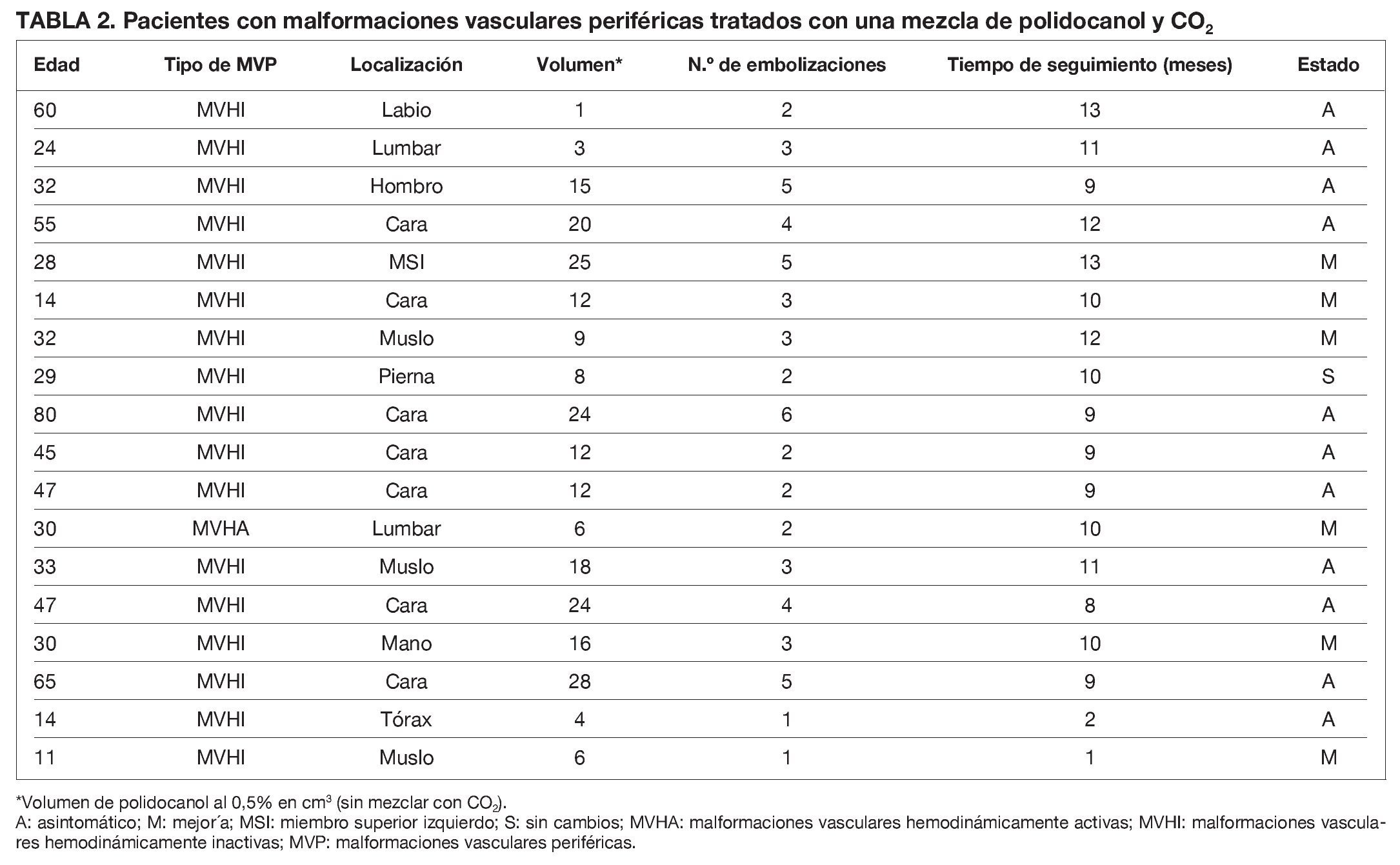
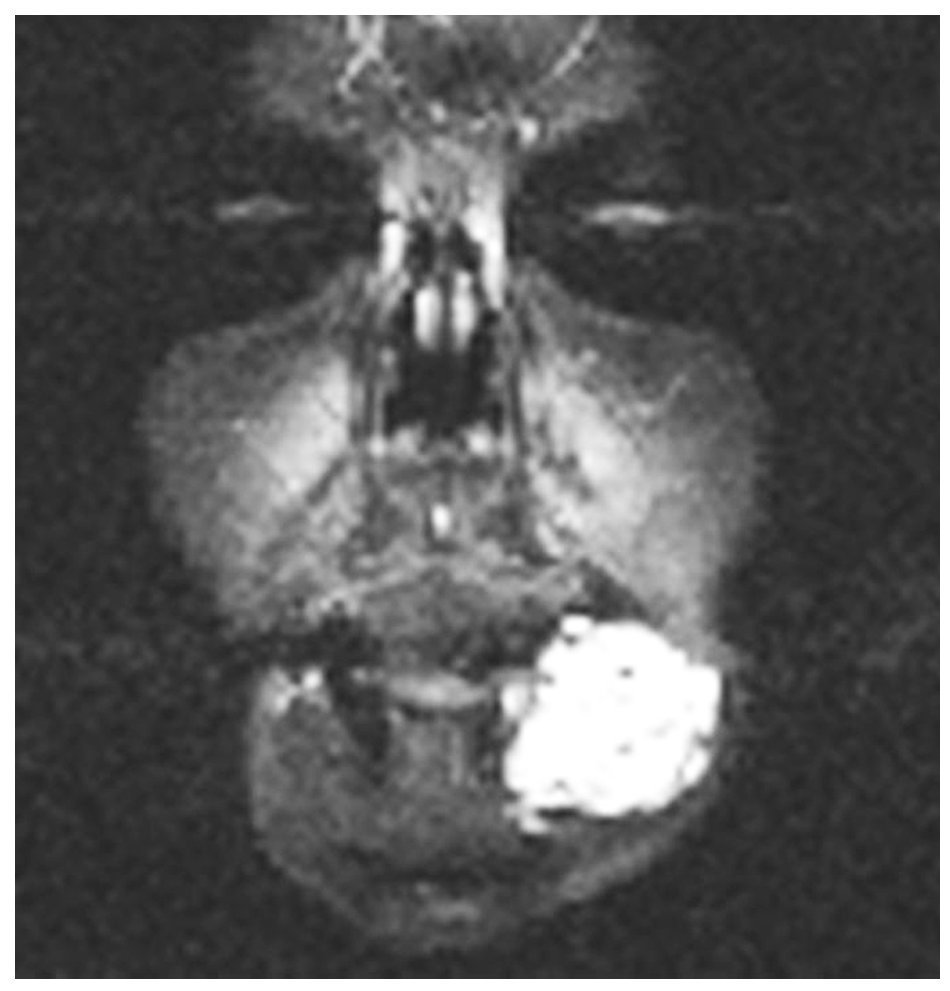
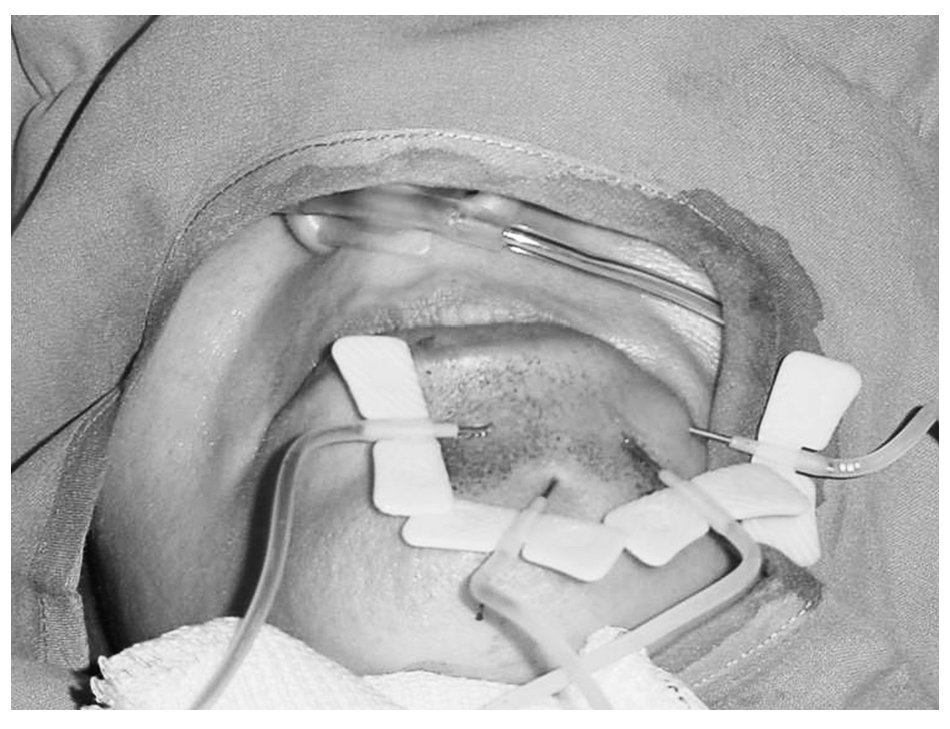
Diecisiete pacientes mejoraron objetiva y subjetivamente (tabla 2; figs. 1-4) recuperando las actividades diarias normales. Todos los pacientes presentaron edema, dolor e incremento de la impotencia funcional en los días siguientes a la embolización, que cedieron con tratamiento médico. Una paciente permaneció sin cambios (tabla 2) debido al rechazo a continuar el tratamiento tras la primera embolización.
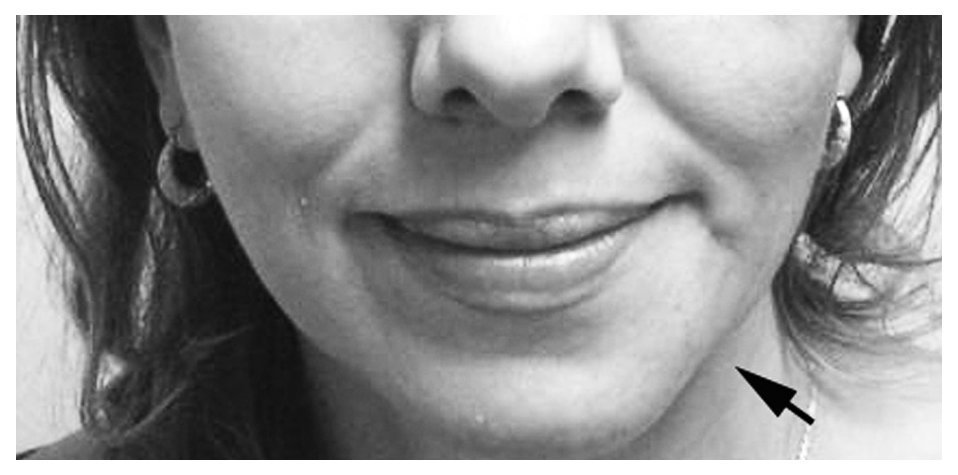
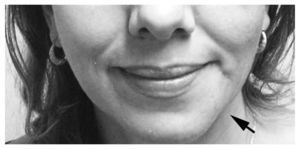
Fig. 1. Malformación vascular hemodinámicamente inactiva que provoca una "deformidad", señalada con cabezas de flecha, en la cara de una paciente.
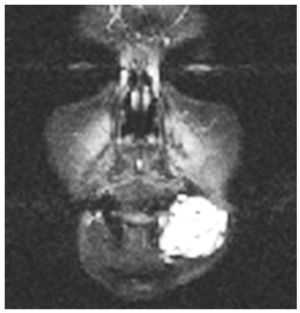
Fig. 2. Resonancia magnética en corte coronal. Se aprecia una hiperintensidad de señal en T2 que delimita perfectamente los límites de esta malformación vascular hemodinámicamente inactiva.
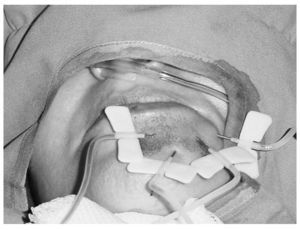
Fig. 3. Punción directa con varios venosistemas en la luz de la malformación, con los que podemos inyectar la sustancia esclerosante.
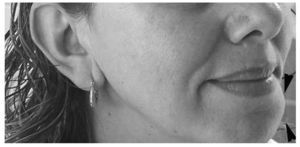
Fig. 4. Control evolutivo, tras tres embolizaciones, en el que no se aprecia la deformidad (flecha negra) que producía la malformación vascular hemodinámicamene inactiva.
No se produjeron complicaciones tras el procedimiento ni durante el seguimiento.
Discusión
Aunque las MVP son entidades patológicas poco frecuentes, constituyen uno de los retos terapéuticos más complicados en el campo de la Medicina10, debido a la dificultad o imposibilidad de tratamiento curativo, a la confusión en la nomenclatura, a la dispersión de pacientes y al hecho de ser responsabilidad inicial de múltiples especialidades.
La baja incidencia global hace que la experiencia acumulada por la mayoría de los profesionales sea escasa, y frecuentes los errores de diagnóstico, pronóstico y manejo.
La decisión en cuanto al momento de tratar al paciente es quizá más problemática que el tratamiento en sí mismo. Es conocido que tratamientos inadecuados pueden convertir una MVP en fase quiescente en una rápidamente evolutiva4,11. Desde un punto de vista general podemos decir que los hemangiomas del lactante no deben tratarse, ya que involucionan en su gran mayoría; sólo en aquellas localizaciones que impidan la alimentación -periorales- o la correcta visión -perioculares- está indicado el tratamiento con corticoterapia sistémica6,13. El resto de MVP serán tratadas si existe dolor, impotencia funcional, trastornos estéticos o psicológicos, valorando en cada paciente la relación riesgo-beneficio14-18.
La primera aproximación terapéutica ha sido la exéresis quirúrgica. Sin embargo, los resultados son decepcionantes, bien por su imposibilidad debido a la zona anatómica en que asienta la MVP, bien por las propias características de la patología, que hacen imposible su extirpación en bloque. En muchas ocasiones la única terapéutica quirúrgica consiste en la amputación o ligaduras proximales. Éstas van seguidas de recidivas prácticamente en el 100% de los casos19.
El abordaje arterial es el habitual para el tratamiento percutáneo de la MVHA, embolizando el nidus desde las aferencias, pero también es posible la embolización de este tipo de malformaciones retrógradamente a través de las eferencias venosas20. Esta aproximación cumple dos objetivos: embolizar la mayor parte del nidus a través del abordaje venoso y poder tratar a pacientes en que la tortuosidad de las aferencias arteriolares impida su cateterización. En circunstancias en las que no es posible cateterizar selectivamente las aferencias y se descarta el abordaje venoso, es posible puncionar directamente el nidus de la MVHA21.
La única vía de acceso a la embolización de una MVHI es la punción directa, ya que todos los territorios vasculares, arteria, arteriola y capilar están íntegros. Una embolización a través de las aferencias arteriolares produciría una necrosis tisular extensa. Es particularmente importante la observación de posibles eferencias a estructuras venosas normales que pudieran verse afectadas durante la embolización. En estos casos se realizaron series angiográficas con compresión manual o con torniquetes con el fin de evitar esta circunstancia.
Existen un gran número de sustancias de embolización22, el alcohol absoluto, polivinil alcohol (Ivalon. Nycomed. París. Francia), espirales de Gianturco (Cook Co. Bjaeverskov. Denmark), Gelfoam (Spongostan Film. Ferrosan. Söborg. Denmark), colas cianoacrílicas (Hystoacril. Braun. Melsungen. Germany) y ethibloc (Ethnor labs. Paris. France). De las sustancias mencionadas algunas actúan mediante una oclusión de la luz vascular, como las espirales de Gianturco, el polivinil alcohol o el Gelfoam, mientras que otras afectan directamente a la pared endotelial produciendo una lesión inflamatoria y una esclerosis que acaba provocando la oclusión del vaso. El alcohol, solo o unido a otros agentes de embolización que refuerzan o complementan su acción como el Gelfoam, Ivalón y espirales de Gianturco, es una sustancia frecuentemente utilizada aunque muy agresiva; produce su acción de forma inmediata, induciendo la trombosis del vaso por la producción de una deshidratación y precipitación brusca de las proteínas del endotelio vascular, poniendo en marcha la "cascada" de la coagulación. La trombosis y posterior organización fibrosa es definitiva y permanente. El riesgo fundamental de la utilización del alcohol consiste en la migración inadvertida e involuntaria a territorios normales provocando necrosis tisular.
En la literatura se han descrito una parada cardíaca y reacciones alérgicas23,24 como únicas complicaciones mayores.
En este trabajo hemos utilizado una mezcla de polidocanol y CO2 como material de embolización12. El polidocanol se comercializó en 1966 e inicialmente se utilizó como anestésico local. El tratamiento de MVP con sustancias esclerosantes presenta ciertas limitaciones debido a que debemos conocer la concentración intravascular del esclerosante y el tiempo que está en contacto con el endotelio vascular. Las sustancias esclerosantes líquidas se diluyen en la sangre, por lo que es difícil controlar la dosis que actúa sobre el endotelio. El polidocanol produce una lesión aguda en el endotelio vascular, desencadenando la "cascada" de la coagulación. Mezclar estas sustancias con gases que faciliten el contacto del esclerosante con la pared vascular es una idea atractiva25-27. Estas mezclas esclerosantes en forma de espuma presentan grandes ventajas respecto a los esclerosantes líquidos, ya que facilitan el contacto de la sustancia con el endotelio vascular, de forma que con una dosis baja se obtiene un contacto con el endotelio vascular28. En la sustancia utilizada en este trabajo hemos usado CO2 como único gas, y la espuma se obtiene mezclando polidocanol con CO2 una vez cateterizada la zona a esclerosar mediante agitación con dos jeringas. El proceso de obtención de la espuma dura unos minutos y se realiza en la sala inmediatamente antes de inyectarla. El CO2 facilita una espuma estable durante unos minutos, tiempo suficiente, en nuestra experiencia, para lograr la lesión endotelial y la subsiguiente trombosis de la zona malformada. La facilidad en la obtención de la mezcla nos permite obtener la cantidad que precisemos en sucesivas operaciones realizadas durante el tratamiento. El CO2 no presenta riesgo de reacciones alérgicas ni nefrotoxicidad; se elimina con rapidez del torrente sanguíneo, hecho éste que nos permite usar dosis generosas sin riesgo de efectos secundarios. En los días siguientes a la embolización todos los pacientes presentaron edema, dolor e incremento de la impotencia funcional que cedieron con tratamiento médico, sintomatología ya descrita en otras series.
Al utilizar un solo gas, la mezcla usada en este trabajo es de muy fácil obtención y la espuma resultante es de manejo sencillo. Los resultados iniciales muestran una baja tasa de complicaciones, con buena eficacia terapéutica.
La embolización percutánea de malformaciones vasculares con una mezcla de polidocanol y CO2 es un método eficaz y con baja incidencia de complicaciones. Nuestros resultados son esperanzadores, aunque se precisan estudios más extensos para extraer conclusiones definitivas.
Declaración de conflicto de intereses. Declaro no tener ningún conflicto de intereses.
Correspondencia:
JOSÉ MARTÍN CARREIRA.
Facultad de Medicina. Departamento de Radiología. C/ San Francisco, 1. 15782 Santiago de Compostela. A Coruña. España.
mrjoseca@usc.es
Recibido: 18-V-2007
Aceptado: 15-X-2007