Presentar nuestra experiencia a 2 años con el uso de microesferas precargadas de adriamicina (DC Bead®) en la quimioembolización (TACE) de hepatocarcinoma, en un estudio prospectivo, consecutivo y multidisciplinar, valorando la eficacia, seguridad y tolerancia de este procedimiento.
Material y métodosDesde mayo 2007 hasta enero 2010 se han realizado 30 procedimientos de TACE en 17 pacientes (media de procedimientos:1,76), 3 mujeres/14 varones, con una edad media de 68 años (56–85 años) mediante el protocolo TACE de precisión, valorando los resultados con los criterios RECIST-EASL, controles TC/RM y clinicoanalíticos al mes, 3 y 6 meses, y luego al año.
ResultadosÉxito técnico inicial en todos los casos. Se empleó la dosis total en 7 casos, y en el resto no se llegó a esta, con una media de 80mg. Se obtuvo una respuesta completa en el 29,41% de los pacientes, una respuesta parcial en el 35,29%, estabilización de la enfermedad en el 23,52% y progresión de la enfermedad en el 11,76%; con una respuesta objetiva de 64,7%. Hemos recogido 2 casos de absceso/necrosis, una colecistitis isquémica y ningún fallecimiento ni fallo hepático relacionado con el procedimiento.
ConclusionesLa TACE con microesferas precargadas de adriamicina (DC Bead®) es un procedimiento seguro y efectivo, dada la baja tasa de complicaciones, buena tolerancia de los pacientes y aumento de la tasa de respuesta tumoral.
To present our experience in the use of microspheres preloaded with adriamycin (DC Bead®) in the transcatheter arterial chemoembolization (TACE) of hepatocellular carcinoma, in a two-year prospective multidisciplinary study in consecutive patients to evaluate the efficacy, safety, and tolerance of this procedure.
Material and methodsFrom May 2007 to January 2010, we performed 30 TACE procedures in 17 patients (3 women and 14 men; mean age, 68 years; age range, 56–85 years). We performed a mean of 1.76 procedures per patient using the precision TACE protocol. Outcomes were evaluated using the RECIST-EASL criteria by clinical, laboratory, CT, and MRI follow-up at 1, 3, 6, and 12 months.
ResultsThe procedure was considered an initial technical success in all cases. The total dose was delivered in seven cases; in the remaining cases, the total dose was not reached (mean dose, 80mg). An objective response was observed in 64.7% of patients: a complete response was observed in 29.41% and a partial response in 35.29%. Disease was stabilized in 23.52% and progressed in 11.76%. We observed two cases of abscess/necrosis and one of ischemic cholecystitis. There were no deaths or cases of liver failure related with the procedure.
ConclusionsTACE using microspheres preloaded with adriamycin (DC Beads®) is safe and effective, given the low rate of complications, good tolerance in patients, and increased tumor response.
El carcinoma hepatocelular (CHC) supone aproximadamente el 90% de todas las neoplasias primarias del hígado y en un 80% de los casos asienta sobre hígados cirróticos. En nuestro medio se asocia principalmente a la infección por virus de la hepatitis B (VHB) o C (VHC).
La historia natural del CHC se ve condicionada no solo por la extensión tumoral, sino también, y de forma determinante, por el grado de insuficiencia hepatocelular en el momento de su diagnóstico1.
El 60% de los CHC se diagnostican en estadios intermedioavanzados donde no es posible la aplicación de terapias curativas2, por lo que la quimioembolización es el tratamiento paliativo que más frecuentemente se utiliza. Estudios controlados y un metaanálisis demuestran que la TACE convencional mejora la supervivencia de los pacientes con CHC en estadio intermedio3,4.
El protocolo clásico realiza la quimioembolización con adriamicina emulsionada en lipiodol. Sin embargo, desde hace 3 años diversos grupos usan un nuevo protocolo de quimioembolización, llamado TACE precisión o DEB-TACE, usando partículas precargadas con citostáticos2. Las microesferas DC Bead® (Biocompatibles, Surrey, UK) constituyen un nuevo material de embolización en el que las partículas embolizantes están constituidas por un hidrogel de alcohol polivinilo (PVA) que ha sido modificado con grupos sulfonados. Las microesferas DC Bead se pueden cargar con doxorrubicina, un agente quimioterápico ampliamente aceptado para el tratamiento de CHC. La liberación de las partículas cargadas en los vasos nutrientes del tumor conllevan la oclusión e isquemia de los vasos tumorales, mientras que la doxorrubicina es gradualmente liberada durante aproximadamente 15 días, de forma local, lo que conlleva mayor necrosis del tumor y menores efectos sistémicos secundarios, por menor paso de drogas al torrente sistémico2,5. Se han realizado estudios de experimentación animal e in vitro que confirman los buenos resultados farmacocinéticos de dichas partículas6,7.
El objetivo de nuestro trabajo es presentar nuestra experiencia a 2 años con el uso de microesferas precargadas de adriamicina (DC Bead®) en la quimioembolización de hepatocarcinoma, en un estudio prospectivo, multidisciplinar y multicéntrico.
Material y métodosDiseño de estudioDesde mayo 2007 hasta enero 2010 se han realizado 30 procedimientos de TACE en 17 pacientes (media de procedimientos: 1,76) de los cuales 3 son mujeres y 14 varones, con una edad media de 68 (rango de 56–85 años) mediante protocolo TACE precisión (microesferas tipo DC Bead® cargadas de adriamicina).
El protocolo se ha realizado mediante consenso multidisciplinar. Dos pacientes provienen del Hospital Mancha Centro, Alcazar de San Juan (Ciudad Real) y los 15 restantes del Hospital Virgen de la Salud, Toledo, de los cuales uno proviene del servicio de oncología y 16 del servicio de aparato digestivo.
Las características epidemiológicas y clinicopatológicas de los pacientes de nuestro estudio se resumen en la tabla 1.
Características epidemiológicas y clinicopatológicas de los pacientes del estudio
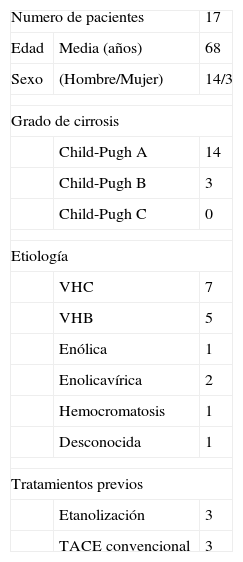
| Numero de pacientes | 17 | |
| Edad | Media (años) | 68 |
| Sexo | (Hombre/Mujer) | 14/3 |
| Grado de cirrosis | ||
| Child-Pugh A | 14 | |
| Child-Pugh B | 3 | |
| Child-Pugh C | 0 | |
| Etiología | ||
| VHC | 7 | |
| VHB | 5 | |
| Enólica | 1 | |
| Enolicavírica | 2 | |
| Hemocromatosis | 1 | |
| Desconocida | 1 | |
| Tratamientos previos | ||
| Etanolización | 3 | |
| TACE convencional | 3 | |
Ocho de los CHC eran masas únicas mayores de 3cm y nueve eran CHC multinodulares, de los cuales 8 eran bilobares.
La media del tamaño tumoral ha sido de 5,09cm (rango de 3–10cm).
Criterios de inclusión/exclusiónLos criterios de inclusión de nuestro estudio corresponden a pacientes asintomáticos con CHC únicos mayores de 3cm, que aunque fuesen candidatos a radiofrecuencia (RF) eran considerados de alto riesgo por su localización (próximo a la vesícula, hilio hepático, cápsula hepática, diafragma o pericardio) y CHC multinodulares, sin invasión vascular ni extensión extrahepática, y con una función hepática conservada (Child-Pugh A o B) o estadio B de la clasificación del Barcelona Clinic Liver Cancer (BCLC)2.
Los pacientes con enfermedad hepática avanzada, entendiendo como tal pacientes en estadio Child-Pugh C o con una cifra de bilirrubina sérica >3mg/dl, aquellos que presentaban invasión vascular o extensión extrahepática, trombosis portal o flujo hepatópeto muy disminuido, shunt portosistémico o flujo hepatófugo fueron excluidos de nuestro estudio.
Estos criterios, no obstante, no impiden la realización de procedimientos supraselectivos en casos individualizados.
Técnica de embolizaciónEl procedimiento terapéutico se lleva a cabo bajo sedación y analgesia, así como profilaxis antibiótica (cefalosporina y metronidazol, el día anterior a la TACE y 3 días posprocedimiento), y antieméticos (ondansetrón).
Tras haber comprobado la permeabilidad portal, realizamos una cateterización supraselectiva de las arterias nutricias del tumor usando un microcatéter de 2,7 Fr (Progreat®, Terumo, Japón).
Aproximadamente 60min antes de realizar la exploración se prepara la suspensión de las partículas con 37,5mg of doxorubicina/ml, hasta un máximo de 150mg de dosis total dividida a partes iguales de 75mg por vial de 2ml cada uno (4ml total). Utilizamos 2 viales de DC Bead® (Biocompatibles, Surrey, UK), uno con particulas de 300–500μm y otro con partículas de 500–700μm. Siempre se intenta usar la mayor cantidad posible, sin tener en cuenta la superficie corporal u otros criterios hasta que no se llegue a una concentración de dosis de 450mg/m2 por superficie corporal, que podría producir cardiotoxicidad. En caso necesario se termina la oclusión tumoral con partículas de PVA o con Embozenes (Celanova Biosciences Inc®, Hague, Netherlands).
Seguimiento post-TACESe realizó hemograma y bioquímica a las 2 semanas de la TACE para valorar el daño hepático y los efectos secundarios del agente quimioterápico, analizando enzimas hepáticas, bilirrubina, albúmina y parámetros hematológicos.
Nuestro protocolo incluye un TC abdominal trifásico de control a las 4–6 semanas para valorar la eficacia del tratamiento y las posibles complicaciones. Asimismo, se han realizado controles clinicoanalíticos al mes, 3 y 6 meses y luego al año.
En cuanto a la programación de las nuevas sesiones, aunque el intervalo que se propone es aproximadamente de 2–3 meses entre sesiones sucesivas, estas dependerán del estado inicial de la tumoración, de los resultados de la TC a las 4–6 semanas, de la evolución clínica del paciente y de la evolución de los marcadores tumorales.
En todos aquellos casos de CHC multinodulares bilobares se realizó una única sesión de TACE.
Eficacia del tratamientoLa respuesta se ha valorado con los criterios RECIST (Response Evaluation Criteria in Solid Tumors) – EASL (European Association for the Study of the Liver)1, que incluyen la valoración del diámetro de la lesión residual viable (área de realce en TC) y de la necrosis tumoral.
ResultadosEn nuestra serie se objetivó un éxito técnico inicial con TACE selectivo en todos los casos.
Se empleó la dosis total (2 viales de 300–500 y 500–700μm repartiendo la dosis total de 150mg por igual en cada vial) en 7 de los pacientes, y en el resto no se llegó a esta dosis completa. La media de dosis usada es de 80mg. En 3 casos hubo de completarse la embolización con otras sustancias embolizantes, en 2 de los casos con partículas de PVA y en el otro caso con Embozenes (Celanova®).
Se obtuvo una respuesta objetiva en 11 pacientes (64,7%). Se obtuvo una respuesta completa (CR) en el 29,41% (n=5) (fig. 1), una respuesta parcial (PR) en el 35,29% (n=6) (fig. 2), estabilidad de la enfermedad (SD) en el 23,52% (n=4) y una progresión de la enfermedad (PD) en el 11,76% (n=2). Las complicaciones que presentaron los pacientes de nuestro estudio incluyen 2 síndromes postembolización (SPE) (6,66%), 2 abscesos (6,66%) y una colecistitis isquémica (3,33%). No hubo ninguna muerte relacionada con el procedimiento.
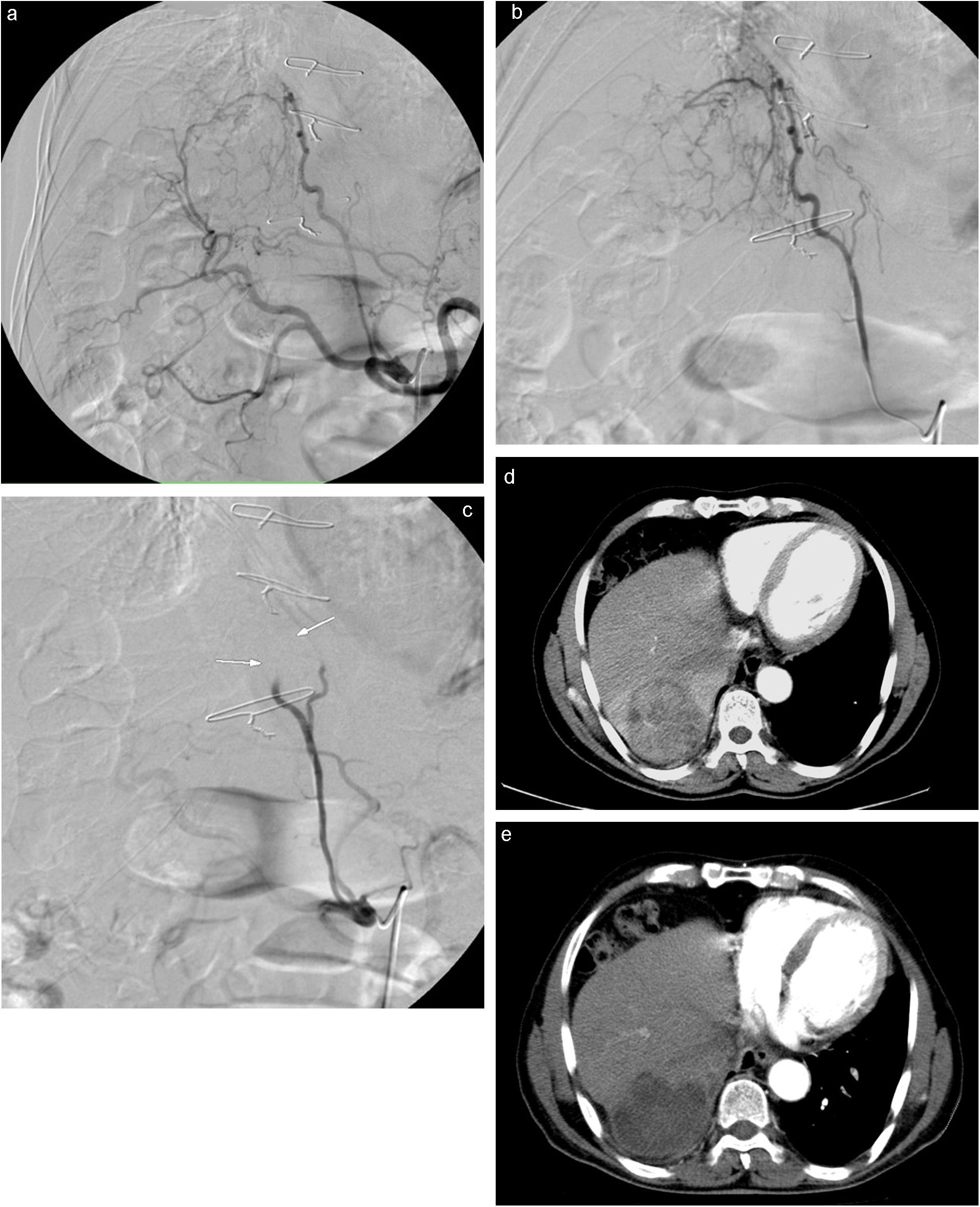
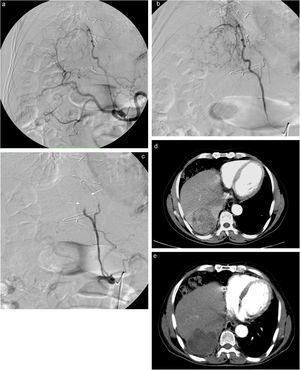
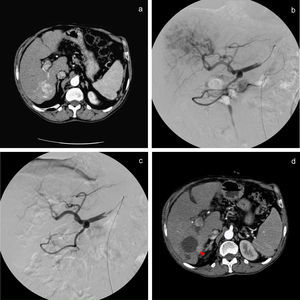
Angiografia que muestra gran LOE hepática hipervascular de 6cm dependiente de arteria frénica derecha y hepática derecha (a y b), con excelente resultado en control postembolización (c). Cortes axiales de TC de junio de 2008 previo a quimioembolización que muestran la lesión hiperdensa en relación con CHC (d) y control realizado en febrero de 2009 tras 2 sesiones de TACE de precisión que muestra la imagen hipodensa sin captación de contraste iv, en relación con respuesta completa (CR) (e).
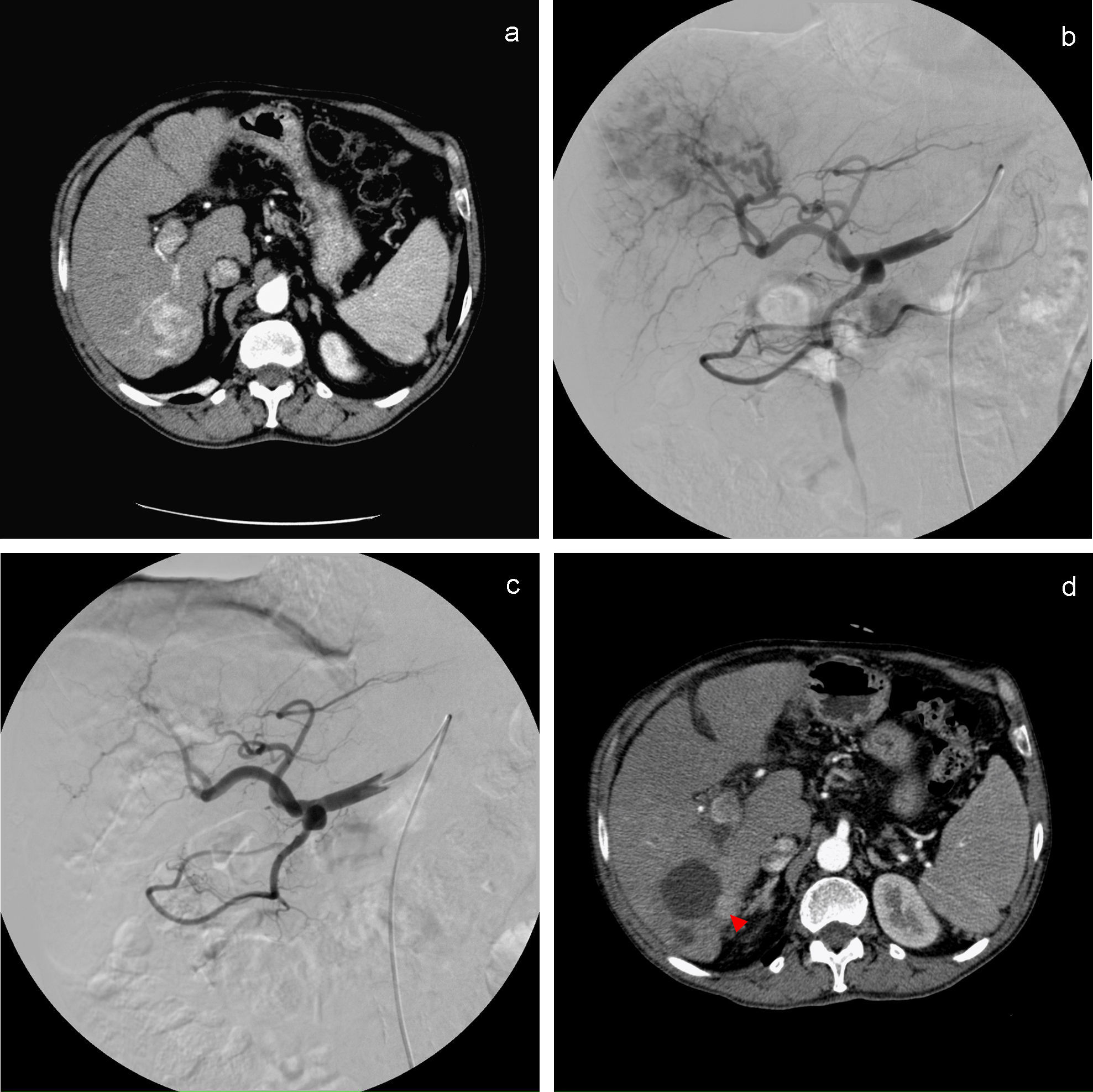
TC abdominopélvico en la fase arterial que muestra LOE hipervascular en el segmento vi (a). b) Angiografía que muestra LOE hepática hipervascular dependiente de las ramas segmentarias de la arteria hepática derecha. c) Angiografía postembolización que muestra la oclusión de los vasos nutrientes del tumor. d) TC abdominopélvico de control a los 3 meses de la TACE que muestra una pequeña captación nodular periférica del contraste iv (punta de flecha) en relación con la respuesta parcial (PR).
La media de estancia hospitalaria de los pacientes incluidos en el estudio fue de 3 días.
La mediana de seguimiento es de 19 meses, con un rango de 4–30 meses.
La mediana de supervivencia de nuestros pacientes es de 19 meses.
DiscusiónLa quimioembolización transarterial representa una de las opciones terapéuticas más ampliamente empleadas en los pacientes con CHC en estadios intermedios o avanzados y, por tanto, no resecables quirúrgicamente ni susceptibles de ablación local percutánea.
La TACE convencional se basa en la inyección intraarterial de un agente quimioterápico emulsionado en un aceite yodado y una partícula embolizante. Sin embargo, no hay un estándar para la realización de la quimioembolización de CHC y la elección del agente quimioterápico y del material de embolización varía de un centro a otro. Las partículas DC Bead® se cargan in vitro con doxorubicina y cuando se liberan en las arterias nutricias del tumor producen la embolización de dichos vasos a la vez que se libera de forma continua y local en el propio tumor, lo que conlleva un a mayor necrosis del tumor y menores efectos sistémicos secundarios, por menor paso del agente citostático a la circulación sistémica8. Esto ha sido demostrado por estudios farmacocinéticos publicados por otros autores5. Además la dosis de doxorrubicina empleada, 150mg, es muy superior a la administrada en la TACE convencional, donde la dosis ronda los 20–30mg/m2 con una dosis media empleada de 40–50mg.
El seguimiento postratamiento y la tasa de respuesta ha sido evaluada mediante TC, realizándose TC trifásico tras la administración de contraste iv. Sin embargo, la presencia de lipiodol de quimioembolizaciones previas limita considerablemente la capacidad de la TC para visualizar el realce de la lesión y, por lo tanto, disminuye la fiabilidad para identificar el tejido tumoral viable y valorar la respuesta. La valoración de la respuesta por TC se puede realizar en periodos fijos o sin pauta fija9–12. Otros autores incluso han correlacionado los hallazgos radiológicos en cuanto a grado de necrosis con la histología de las lesiones13.
Asimismo, está demostrado que realizar varias sesiones es más eficaz en términos de obtener necrosis tumoral y mejor control local del tumor, aunque su beneficio sobre la supervivencia aún no está claro. Además es fundamental la quimioembolización supraselectiva con la oclusión del pedículo o pedículos vasculares que irrigan la tumoración, para conseguir la mayor necrosis posible del tumor con el mayor respeto posible del hígado no tumoral, puesto que como ya hemos comentado la reserva funcional hepática es factor pronóstico importante en la supervivencia de estos pacientes4.
Nuestros pacientes se han sometido a un máximo de 3 sesiones de quimioembolización con DC Bead, y dichas sesiones se han programado cada 2–3 meses pero siempre teniendo en cuenta la respuesta tumoral y aparición de restos de tumor viable, así como nuevos nódulos, en los controles rutinarios de TC; o si existe aumento de la alfa-fetoproteína en los controles analíticos. Otros autores repiten las sesiones de TACE de forma rutinaria cada 2–3 meses. Grosso et al12 establecen que se deberían practicar TACE repetidas de forma rutinaria en aquellos nódulos de gran tamaño (>de 5cm) sin embargo, TACE únicas pueden ser suficientes para tumores de menor tamaño y por tanto, esperar a resultados para programar nuevas sesiones de TACE.
Todos los tumores de nuestro estudio eran hipervasculares y la tasa de respuesta objetiva es de un 64,70%, resultado discretamente inferior a los de otros autores que osciló entre el 67 y 70%6,11, si bien contamos con menor número de pacientes y menor tiempo de seguimiento, lo cual limita la interpretación de nuestros resultados6,7. En cualquier caso la tasa de respuesta obtenida con las partículas DC Bead es superior a la obtenida con la TACE-protocolo clásico, que se establece en un 35%2. Tras 2 sesiones de TACE mediante DC Bead, un paciente de nuestro estudio fue incluido en la lista de trasplante hepático.
En cuanto al porcentaje de complicaciones en nuestra serie es de un 9,99%, similar al de otras series publicadas en la literatura7 e inferior al de la TACE convencional (27,50%)14. Esta cifra no incluye el síndrome postembolización, al igual que las principales series publicadas en la literatura6,7,10,12.
Una de las limitaciones de nuestro estudio es que más de un tercio de nuestros pacientes ha recibido tratamientos previos (35,29%).
En conclusión, los resultados obtenidos en nuestra serie muestran que la TACE-precisión con microesferas precargadas de adriamicina (DC Bead) es un procedimiento eficaz, seguro y bien tolerado por los pacientes, que aumenta la tasa de respuesta tumoral. No obstante, la mediana de seguimiento de nuestro estudio es algo inferior a 2 años, por lo que aún es pronto para aventurar conclusiones definitivas, aunque los resultados preliminares son prometedores.
AutoríaLa Dra. Mabel García-Hidalgo, y el Dr. Carlos Lanciego han concebido y diseñado el estudio, han colaborado en la obtención de los datos, su análisis e interpretación y han redactado el trabajo, así como la revisión de las correcciones.
La Dra. Gemma De La Cruz ha contribuido a proporcionar los datos de seguimiento clínico de los pacientes. Para ello ha contando con la colaboración de los Dres. Rafael Gómez y Tomás Artaza, que no figuran en la autoría. Asimismo, la Dra. De la Cruz ha contribuido a redactar las cuestiones referentes a los datos analíticos y seguimiento de los pacientes.
El Dr. Javier Velasco y el Dr. Lorenzo García han contribuido a realizar procedimientos de TACE en algunos de los casos y han realizado asimismo, una revisión crítica del manuscrito, aportando datos de interés relevante para la elaboración del mismo.
El Dr. José María Pinto ha realizado los controles de imagen de TAC trifásico, que han permitido conocer los datos de seguimiento de los pacientes y sus grados de respuesta según criterios EASL -RECIST, y ha contribuido a la revisión del artículo, con las consecuentes aportaciones intelectuales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Rafael Gómez Rodríguez y Tomás Artaza Varasa.