Sabemos que la COVID-19 afecta a múltiples órganos. Sin embargo, sus primeros efectos en el tejido muscular todavía no se han esclarecido. Este estudio tiene por objetivo investigar las alteraciones iniciales que se observan en el músculo pectoral de pacientes con COVID-19.
Materiales y métodosLas áreas del músculo pectoral (AMP) y el índice del músculo pectoral (IMP) de 139 pacientes diagnosticados de COVID-19 se midieron a partir de tomografías computarizadas (TC) torácicas obtenidas en el momento de establecer el primer diagnóstico y en los 6meses posteriores al mismo. El efecto de la infección en el área muscular se investigó mediante la evaluación de alteraciones entre las dos mediciones. La afectación pulmonar de la infección en la primera TC se evaluó según la puntuación de gravedad de la TC (CT severity score [CT-SS]). También se investigaron los efectos de la clínica del paciente, la CT-SS, la duración del ingreso y los antecedentes de intubación en las alteraciones del área muscular.
ResultadosAl comparar los valores del AMP y el IMP se observó una disminución estadísticamente significativa de los valores en el grupo con una TC de control en comparación con el grupo con una TC de primer diagnóstico. Se observó una mayor diferencia en los pacientes intubados. La CT-SS se asoció a una disminución del IMP.
ConclusiónLa COVID-19 es una de las causas de sarcopenia aguda. El músculo pectoral forma parte del músculo esquelético, y puede producirse una disminución del área muscular en los periodos iniciales de la enfermedad.
It is known that COVID-19 has multisystemic effects. However, its early effects on muscle tissue have not been clearly elucidated. The aim of this study is to investigate early changes in the pectoral muscle in patients with COVID-19 infection.
Materials and methodsThe pectoral muscle areas (PMA) and pectoral muscle index (PMI) of 139 patients diagnosed with COVID-19 were measured from chest CTs taken at the time of the first diagnosis and within 6months after the diagnosis. The effect of the infection on the muscle area was investigated by evaluating whether there was a change between the two measurements. Lung involvement of the infection in the first CT was scored with the CT severity score (CT-SS). In addition, the effects of patients’ clinics, CT-SS, length of hospital stay, and intubation history on changes in the muscle area were investigated.
ResultsWhen the PMA and PMI values were compared, there was a statistically significant decrease in the values in the control CT group compared to the first diagnosis CT group. The difference was found higher in intubated patients. CT-SS was associated with a decrease in PMI.
ConclusionCOVID-19 is one of the causes of acute sarcopenia. Pectoralis muscle is part of the skeletal muscle, and there may be a decrease in the muscle area in the early period of the disease.
La sarcopenia es un síndrome caracterizado por la pérdida de masa de músculo esquelético y la degeneración de la calidad del músculo. Puede ocurrir en pacientes con peso normal, sobrepeso o un peso insuficiente y, por consiguiente, no es equivalente a la pérdida de peso común o la caquexia1. Según el segundo grupo de trabajo europeo sobre la sarcopenia en ancianos (European Working Group on Sarcopenia in Older People 2 [EWGSOP2]), la sarcopenia aguda se define como la sarcopenia que aparece en los 6meses posteriores a un acontecimiento provocado por estrés2. La sarcopenia aguda se observa generalmente en pacientes hospitalizados. La edad avanzada es un factor de riesgo; sin embargo, cada vez está más aceptada la idea de que puede producirse a cualquier edad. La sarcopenia aguda puede darse en personas con estructuras musculares previamente fuertes, después de haber sufrido una evolución grave de la enfermedad3.
La enfermedad provocada por el Coronavirus 2019 (COVID-19) causa anorexia, pérdida de peso y disminución de los niveles de albúmina en seres humanos. A pesar de no disponer de estudios suficientes4-6, esto indica que la COVID-19 grave se asocia a caquexia, mialgia y pérdida muscular. Además, el reposo en cama puede provocar la aparición de sarcopenia grave durante el periodo de recuperación posterior a la COVID-197.
La tomografía computarizada (TC) y la resonancia magnética (RM) son técnicas de diagnóstico por la imagen sensibles capaces de diferenciar el tejido adiposo y otros tejidos blandos. Por lo tanto, se pueden considerar métodos de referencia para predecir el tejido adiposo y la masa de músculo esquelético8. Se ha publicado que el área del músculo pectoral (AMP) registrada mediante TC se asocia a una medición de bioimpedancia de masa magra, función pulmonar, síntomas y capacidad de hacer ejercicio. Asimismo, se ha observado que los valores bajos de AMP y el índice del músculo pectoral (IMP) obtenido al dividir el AMP por el cuadrado de la altura del paciente son factores pronósticos en muchas enfermedades benignas y malignas9,10.
Sin embargo, estos cambios no se conocen muy bien en la evolución de la COVID-19. El objetivo de este estudio fue investigar el efecto de la COVID-19 en las áreas musculares (AMP e IMP) mediante TC.
Materiales y métodosDiseño del estudio y pacientesSe trata de un estudio retrospectivo aprobado por el comité de ética de nuestro hospital. No se exigió la necesidad de obtener el consentimiento informado.
Los criterios de inclusión en el estudio fueron: prueba de la reacción en cadena de la polimerasa positiva (reverse transcription-polymerase chain reaction [RT-PCR]) en muestras nasofaríngeas o bucofaríngeas obtenidas entre los meses de abril y julio de 2020, y dos TC torácicas: en el momento del diagnóstico (en los primeros 4días después del diagnóstico) y durante los 6meses posteriores al mismo. Los criterios de exclusión fueron: pacientes menores de 18años, artefactos por movimiento en la TC y posición asimétrica en la TC que pudiera afectar las mediciones.
Evaluación clínicaEl cuadro clínico inicial de los pacientes se evaluó y puntuó según cuatro categorías: 1 (enfermedad leve): síntomas clínicos leves o mínimos; 2 (enfermedad extendida): presencia de fiebre y síntomas respiratorios, ausencia de disnea o necesidad de aporte de oxígeno; 3 (enfermedad grave): fiebre o sospecha de infección de las vías respiratorias y disnea grave y/o frecuencia respiratoria elevada (≥30 respiraciones por minuto) y/o disminución de la saturación de oxígeno (SpO2 ≤93% con aire ambiente) y/o PaO2/FiO2 ≤300mmHG; 4 (enfermedad crítica): disnea que precisa ventilación mecánica, choque séptico y otra insuficiencia orgánica que requiera seguimiento y tratamiento en la unidad de cuidados intensivos (UCI)10.
Las enfermedades adicionales que presentaban los pacientes, como, por ejemplo, la hipertensión, el asma, la enfermedad pulmonar obstructiva crónica, la insuficiencia cardíaca, las neoplasias malignas, la inmunodepresión, la arteriopatía coronaria, la diabetes o la nefropatía crónica, se registraron como enfermedades concomitantes.
Se registraron las hospitalizaciones, los antecedentes de intubación y la mortalidad. Los pacientes se dividieron en cuatro grupos en términos de hospitalización: grupo 1: pacientes no hospitalizados; grupo 2: pacientes hospitalizados durante menos de 10días; grupo 3: pacientes hospitalizados durante más de 10días; grupo 4: pacientes con seguimiento en la UCI.
Protocolo de TCTodas las TC torácicas se realizaron en decúbito supino, con retención de la respiración durante la inspiración y sin administrar medio de contraste intravenoso. Todas las exploraciones se realizaron en el dispositivo utilizado para pacientes con sospecha de COVID-19 y con el mismo protocolo de obtención de imágenes (escáner de TC de 16cortes Toshiba Alexion, Toshiba Medical Systems, Nasu, Japón). La imagen pulmonar se obtuvo desde el vértice pulmonar hasta el diafragma en todos los casos. Se utilizaron los siguientes parámetros técnicos: modulación del flujo del tubo: 00-250mAs, voltaje del tubo: 90-120kV; grosor del corte: 3mm; factor de paso: 0,8; tiempo de rotación: 75s; campo visual: 250-300mm, y matriz: 512×512.
Evaluación de la TCEn los pacientes incluidos en el estudio, la puntuación se calculó en términos de afectación pulmonar en la primera TC torácica obtenida durante los primeros 4días posteriores al diagnóstico, y la puntuación de gravedad de la TC torácica (CT severity score [CT-SS]) se calculó en la primera imagen de TC. Los pulmones se dividieron en 20 segmentos según la segmentación bronquial de Boyden: 10 segmentos en el pulmón derecho y 10 segmentos en el pulmón izquierdo. Se adjudicaron 0 puntos si el segmento era normal, 1 punto si había una afectación del 50% del segmento y 2 puntos si había una afectación de más del 50%. La puntuación total de la TC se calculó como el total de puntuaciones de los segmentos. La puntuación total varió entre 0 (sin afectación) y 40 (es decir, más del 50% de cada segmento debería estar afectado en los 20 segmentos)11. Dos radiólogos, con 9 y 12años de experiencia en el diagnóstico por la imagen mediante TC, evaluaron las imágenes de las TC torácicas de forma independiente, en condiciones de enmascaramiento con respecto a la edad y los resultados analíticos y clínicos de los pacientes. Para la evaluación de la TC se utilizó un centro de ventana de −500 unidades de Hounsfield (UH) y un ancho de ventana de 1.500UH. En caso de desacuerdo entre los dos radiólogos con respecto a la CT-SS, un tercer radiólogo, con 30años de experiencia, evaluó las imágenes, y la decisión se tomó de forma compartida.
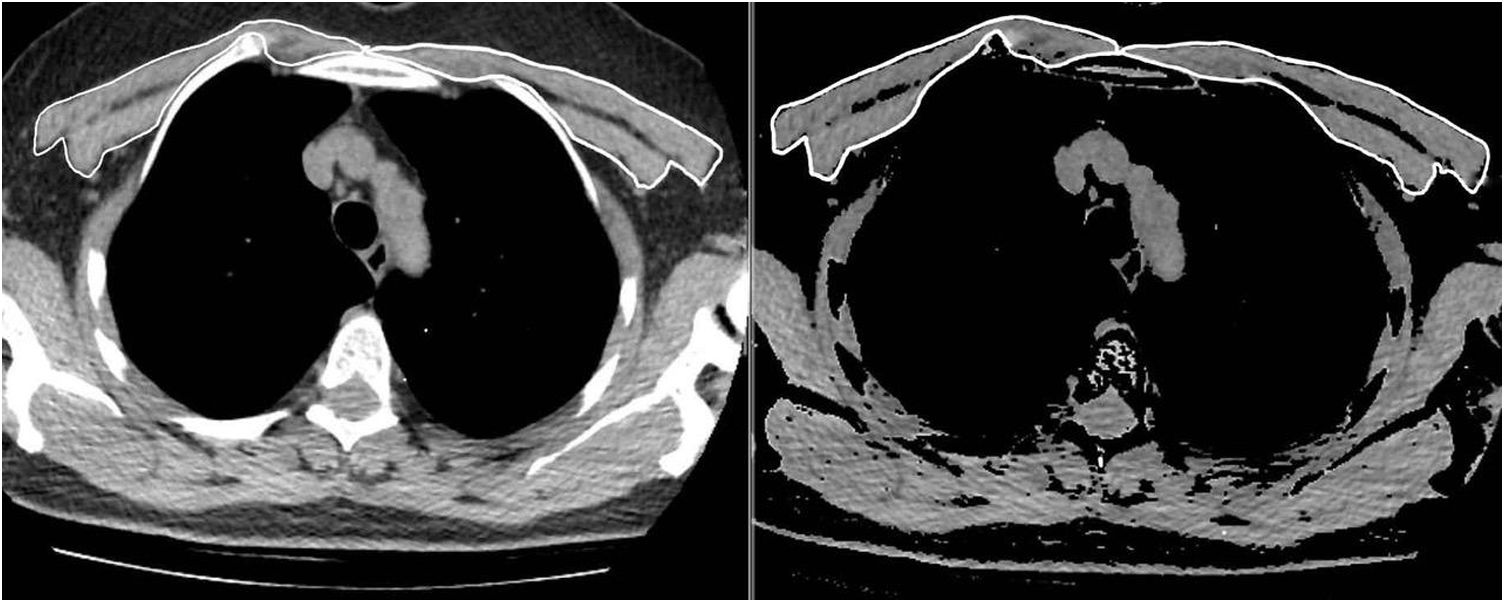
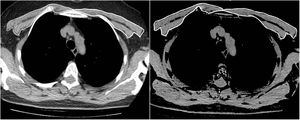
Los mismos dos radiólogos realizaron las mediciones del AMP de la primera y la segunda TC, en condiciones de enmascaramiento con respecto al nombre, la edad y los resultados analíticos y clínicos de los pacientes, así como la fecha de la TC. Para lograr el acuerdo entre observadores, un segundo radiólogo observador repitió las mediciones del AMP de 63 pacientes consecutivos de toda la población mediante el mismo método y en condiciones de enmascaramiento con respecto a los resultados de la primera medición. Los músculos pectorales mayor y menor se representaron en el intervalo de atenuación entre −50 y 90UH en una única sección superior al cayado aórtico, de forma similar a la bibliografía (fig. 1). El valor del AMP (cm2) se calculó sumando las áreas bilaterales de músculo pectoral mayor y menor10. Además, el IMP se calculó dividiendo el valor del AMP por el cuadrado de la altura del paciente (cm2/m2).
Análisis estadísticosPara los análisis estadísticos se utilizó NCSS (Number Cruncher Statistical System) 2007 (Kaysville, Utah, EE.UU.). Se utilizaron métodos estadísticos descriptivos (media, desviación estándar, mediana, primer cuartil, tercer cuartil, frecuencia, porcentaje, mínimo, máximo). La conformidad de los datos cuantitativos con respecto a la distribución normal se evaluó mediante la prueba de Shapiro-Wilk y evaluaciones gráficas. Se utilizó la prueba de la t para grupos dependientes para evaluar el cambio observado en las mediciones del AMP y los valores del IMP de la primera medición y de la medición de control. Para comparar las variables cuantitativas con la distribución normal entre los dos grupos se utilizó la prueba de la t para grupos independientes. Para comparar las variables cuantitativas sin distribución normal entre los dos grupos se utilizó la prueba de la U de Mann-Whitney. Para comparar las variables cuantitativas sin distribución normal entre más de dos grupos se utilizó la prueba de Kruskal-Wallis. Los análisis de correlación de Pearson y de Spearman se utilizaron para evaluar la relación entre las variables cuantitativas, y se utilizó el nivel del coeficiente de correlación intraclase (CCI) para evaluar el acuerdo entre observadores. Se realizaron análisis de regresión logística univariante y multivariante con el fin de determinar los factores que afectan la intubación y la mortalidad. Se realizaron análisis de regresión lineal univariante y multivariante con el fin de determinar los factores que afectan la CT-SS. La significación estadística se determinó en p<0,05.
ResultadosLa edad de 139 pacientes incluidos en el estudio osciló entre los 27 y los 87años (media: 59,01±14,34). El 43,2% de los pacientes eran mujeres (n=60) y el 56,8% eran varones (n=79). La puntuación CT-SS de los casos osciló entre 0 y 38. El 75,5% de los pacientes (n=105) presentaban enfermedades concomitantes.
Las tasas de hospitalización fueron las siguientes: grupo 1: 8,6% (n=12); grupo 2: 30,3% (n=42); grupo 3: 30,3% (n=42), y grupo 4: 30,8% (n=43). El 15,8% de los pacientes (n=22) habían sido intubados y el 11,5% de ellos murieron (n=16).
El intervalo de tiempo entre la primera TC y la TC de control osciló entre 2 y 137días, con una media de 39,5 ±42,01días. Este intervalo de tiempo fue inferior a 30días en el 55,4% de los pacientes (n=77), de entre 30 y 90días en el 23,7% (n=33), y de 90días o más de 90días en el 20,9% (n=29).
Los valores del AMP oscilaron entre 10,01 y 53,21cm2 en la primera TC torácica, y entre 10,36 y 52,5cm2 en la segunda TC torácica. Los valores del IMP oscilaron entre 4,12 y 18,67cm2/m2 en la primera TC torácica, y entre 4,15 y 18,42cm2/m2 en la TC torácica de control.
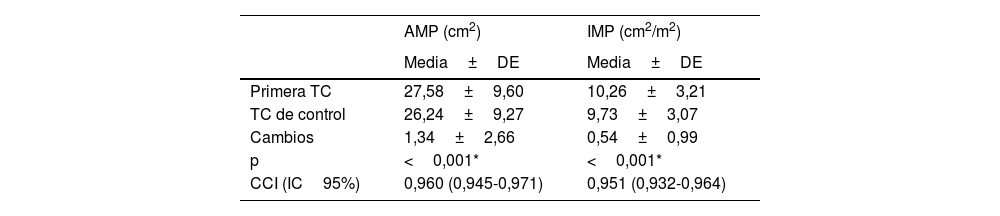
Al comparar las mediciones de la primera TC y la TC de control se observó que una media de 1,34±2,66cm2 del cambio en los valores del AMP y una media de 0,54±0,99cm2/m2 del cambio en los valores del IMP eran estadísticamente significativas (p<0,001) (tabla 1).
Distribución de las mediciones del AMP y el IMP en función del seguimiento de las TC
| AMP (cm2) | IMP (cm2/m2) | |
|---|---|---|
| Media±DE | Media±DE | |
| Primera TC | 27,58±9,60 | 10,26±3,21 |
| TC de control | 26,24±9,27 | 9,73±3,07 |
| Cambios | 1,34±2,66 | 0,54±0,99 |
| p | <0,001* | <0,001* |
| CCI (IC95%) | 0,960 (0,945-0,971) | 0,951 (0,932-0,964) |
AMP: área del músculo pectoral; CCI: coeficiente de correlación intraclase; IMP: índice del músculo pectoral.
Prueba de la t de grupos dependientes.
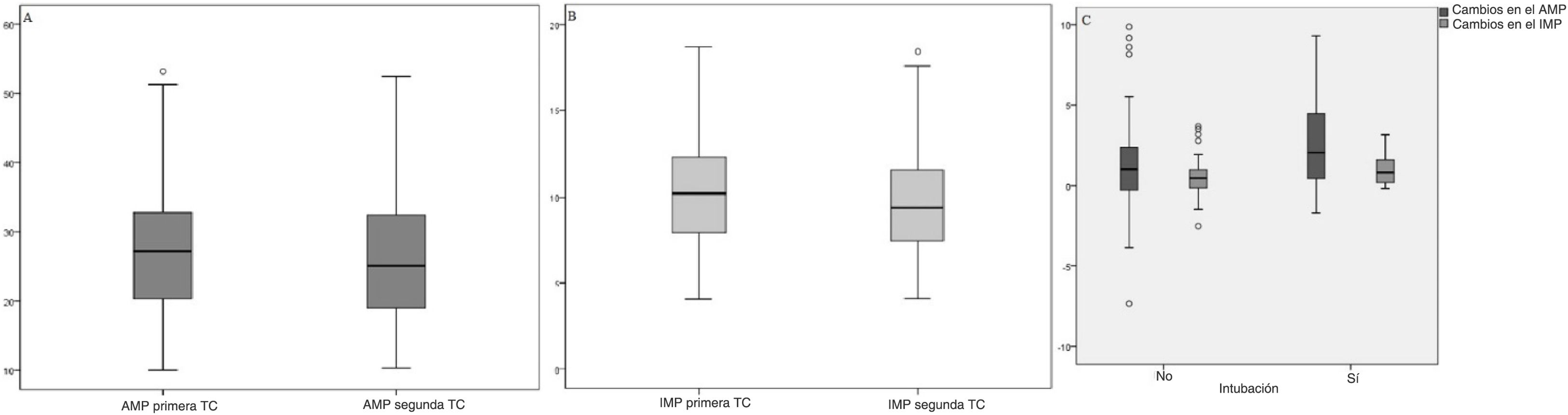
Los cambios en las puntuaciones del AMP y el IMP no son estadísticamente significativos en función del sexo, las enfermedades concomitantes, el tiempo transcurrido entre la primera medición y el control, la duración del ingreso hospitalario y la mortalidad (p>0,05). Mientras que los cambios en las puntuaciones del AMP y el IMP eran estadísticamente significativos en términos del estado de intubación (p<0,05), se observó que la diferencia era superior en los pacientes intubados (tabla 2). La distribución de los valores de AMP-IMP en la primera TC torácica y la TC torácica de control, y la distribución de las diferencias de AMP-IMP en términos de intubación, se muestran en la figura 2.
Evaluaciones en función de los cambios en el AMP y el IMP
| Cambios en el AMP (Δ) | Cambios en el IMP (Δ) | ||
|---|---|---|---|
| Edad | ra | 0,057 | 0,046 |
| p | 0,506 | 0,593 | |
| Puntuación clínica | rb | 0,101 | 0,098 |
| p | 0,237 | 0,250 |
| Media±DE | Media±DE | |
|---|---|---|
| Sexo | ||
| Femenino | 1,02±1,66 | 0,46±0,72 |
| Masculino | 1,59±3,21 | 0,59±1,15 |
| pc | 0,183 | 0,427 |
| Enfermedades concomitantes | ||
| Ninguna | 0,91±2,73 | 0,41±1,04 |
| Sí | 1,48±2,64 | 0,58±0,97 |
| pc | 0,272 | 0,399 |
| OR (IC 95%) | OR (IC 95%) | |
|---|---|---|
| Intervalo de tiempo entre la primera TC y la TC de control | ||
| <30 días | 0,80 (−0,08-2,60) | 0,38 (−0,04-0,98) |
| 30-90 días | 1,35 (−0,12-2,75) | 0,55 (−0,04-1,21) |
| >90 días | 1,13 (−1,71-2,83) | 0,50 (−0,23-1,17) |
| pd | 0,746 | 0,794 |
| Hospitalización | ||
| Pacientes no hospitalizados | 0,34 (−0,61-1,82) | 0,14 (−0,15-0,65) |
| Pacientes hospitalizados durante menos de 10 días | 0,97 (−0,78-2,59) | 0,49 (−0,31-1,14) |
| Pacientes hospitalizados durante más de 10 días | 1,42 (0,12-2,64) | 0,54 (0-0,98) |
| Pacientes con seguimiento en la unidad de cuidados intensivos | 1,13 (−0,08-4,1) | 0,5 (−0,04-1,46) |
| pd | 0,241 | 0,302 |
| Intubación | ||
| No | 1,01 (−0,28-2,37) | 0,46 (−0,15-0,98) |
| Sí | 2,05 (0,43-4,47) | 0,82 (0,18-1,6) |
| pe | 0,034* | 0,033* |
| Muerte | ||
| No | 1,1 (−0,27-2,69) | 0,5 (−0,11-1,11) |
| Sí | 0,65 (0,11-2,88) | 0,27 (0,04-1,17) |
| pe | 0,719 | 0,707 |
AMP: área del músculo pectoral; IMP: índice del músculo pectoral.
A)Distribución del área del músculo pectoral (AMP). B)Valores del índice del músculo pectoral (IMP) en la primera tomografía computarizada torácica y la de control. C)Distribución de las diferencias de área de músculo pectoral de índice de músculo pectoral en función del estado de intubación.
Se observó que el coeficiente de acuerdo entre los dos observadores era CCI 0,960 (IC95%: 0,945-0,971) para las mediciones del AMP, y CCI 0,951 (IC95%: 0,932-0,964) para las mediciones del IMP, lo que demuestra un perfecto acuerdo.
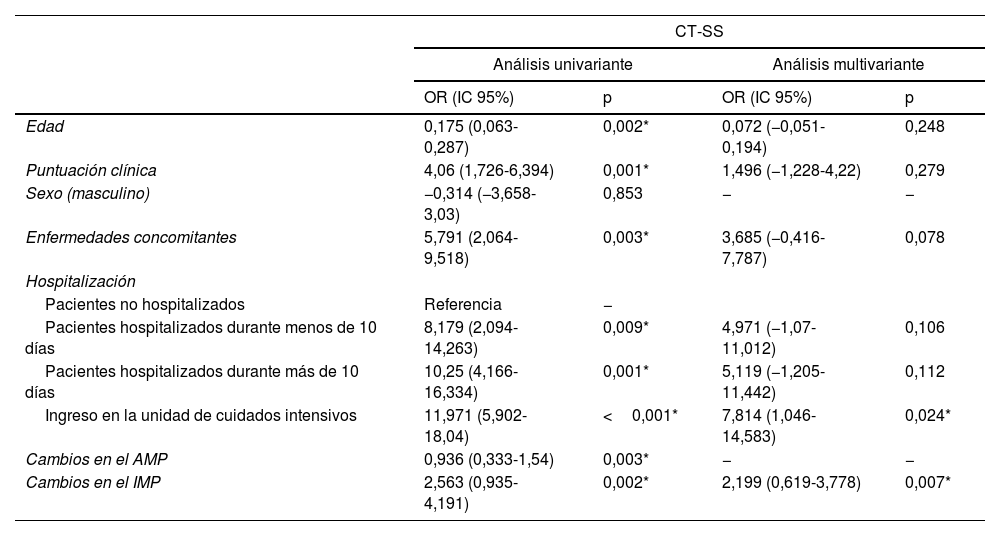
Se realizaron análisis de regresión lineal univariante y multivariante para determinar los factores que afectan la CT-SS y la intubación. En las evaluaciones univariante se observó que la edad, la puntuación clínica, las enfermedades concomitantes, el tiempo de hospitalización y los valores del cambio del AMP y el IMP influían de forma significativa en la CT-SS (p<0,05). Estas variantes se incluyeron en el análisis multivariante. El modelo obtenido se consideró estadísticamente significativo (F=4,850; p<0,001, R2adj=0,182). El efecto del ingreso en la UCI y los valores del IMP resultaron ser significativos en el modelo. La CT-SS de los pacientes hospitalizados en la unidad de cuidados intensivos resultó ser 7,814 superior a las puntuaciones de los pacientes que no fueron hospitalizados (OR: 7,814; IC95%: 1,046-14,583), p=0,024). Al aumentar el valor del cambio del IMP en una unidad se produjo un aumento de 2,199 unidades en la CT-SS (OR: 2,199; IC95%: 0,619-3,778; p=0,007) (tabla 3).
Resultados de los análisis univariante y multivariante de los factores que afectan la CT-SS
| CT-SS | ||||
|---|---|---|---|---|
| Análisis univariante | Análisis multivariante | |||
| OR (IC 95%) | p | OR (IC 95%) | p | |
| Edad | 0,175 (0,063-0,287) | 0,002* | 0,072 (−0,051-0,194) | 0,248 |
| Puntuación clínica | 4,06 (1,726-6,394) | 0,001* | 1,496 (−1,228-4,22) | 0,279 |
| Sexo (masculino) | −0,314 (−3,658-3,03) | 0,853 | − | − |
| Enfermedades concomitantes | 5,791 (2,064-9,518) | 0,003* | 3,685 (−0,416-7,787) | 0,078 |
| Hospitalización | ||||
| Pacientes no hospitalizados | Referencia | − | ||
| Pacientes hospitalizados durante menos de 10 días | 8,179 (2,094-14,263) | 0,009* | 4,971 (−1,07-11,012) | 0,106 |
| Pacientes hospitalizados durante más de 10 días | 10,25 (4,166-16,334) | 0,001* | 5,119 (−1,205-11,442) | 0,112 |
| Ingreso en la unidad de cuidados intensivos | 11,971 (5,902-18,04) | <0,001* | 7,814 (1,046-14,583) | 0,024* |
| Cambios en el AMP | 0,936 (0,333-1,54) | 0,003* | − | − |
| Cambios en el IMP | 2,563 (0,935-4,191) | 0,002* | 2,199 (0,619-3,778) | 0,007* |
AMP: área del músculo pectoral; CT-SS: puntuación de gravedad de la TC; IMP: índice del músculo pectoral.
Análisis de regresión lineal.
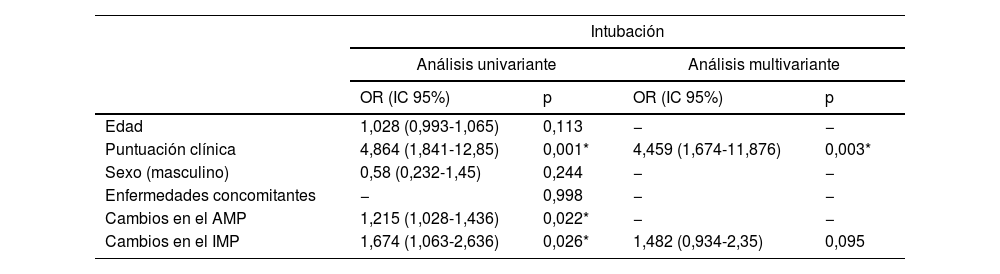
Como resultado de las evaluaciones univariante se observó que la puntuación clínica y los valores del cambio del AMP y el IMP estaban asociados de forma significativa con la intubación (p<0,05). Estas variantes se incluyeron en el análisis multivariante. El modelo obtenido se consideró estadísticamente significativo (χ2=16,751; p<0,001). El efecto de la puntuación clínica se consideró significativo en el modelo. Al aumentar la puntuación clínica en una unidad se produjo un aumento de 4,459 unidades en la intubación (OR: 4,459; IC95%: 1,674-11,876; p=0,003) (tabla 4).
Resultados de los análisis univariante y multivariante de los factores que afectan la intubación
| Intubación | ||||
|---|---|---|---|---|
| Análisis univariante | Análisis multivariante | |||
| OR (IC 95%) | p | OR (IC 95%) | p | |
| Edad | 1,028 (0,993-1,065) | 0,113 | − | − |
| Puntuación clínica | 4,864 (1,841-12,85) | 0,001* | 4,459 (1,674-11,876) | 0,003* |
| Sexo (masculino) | 0,58 (0,232-1,45) | 0,244 | − | − |
| Enfermedades concomitantes | − | 0,998 | − | − |
| Cambios en el AMP | 1,215 (1,028-1,436) | 0,022* | − | − |
| Cambios en el IMP | 1,674 (1,063-2,636) | 0,026* | 1,482 (0,934-2,35) | 0,095 |
AMP: área del músculo pectoral; IMP: índice del músculo pectoral.
Análisis de regresión logística.
Se realizaron análisis de regresión logística univariante para determinar los factores que afectan la mortalidad. El análisis multivariante no se realizó porque se observó que solo el efecto de la puntuación clínica era significativo en las evaluaciones univariante. El modelo obtenido para la puntuación clínica se consideró estadísticamente significativo (χ2=14,505; p<0,001). El aumento de una unidad en la puntuación clínica resultó aumentar el riesgo de mortalidad en 7,114 veces (OR: 7,114; IC95%: 2,053-24,654; p=0,002).
DiscusiónEn nuestro estudio, al comparar las mediciones del AMP y el IMP obtenidas a partir de la primera TC de los pacientes con diagnóstico de COVID-19 con las TC obtenidas posteriormente, se observó una disminución estadísticamente significativa de los valores en la evolución de la enfermedad.
Mientras que una sarcopenia inferior a seis meses se considera aguda, una sarcopenia de más de seis meses se considera crónica2,12. La poca cantidad de músculo podría aumentar la necesidad de rehabilitación y afectar a la duración del ingreso hospitalario13. Para poder confirmar la presencia de sarcopenia aguda debe demostrarse la presencia de una disminución rápida de la masa y la función musculares. Las mediciones musculares deben realizarse antes de la enfermedad en sus etapas iniciales3. La TC se considera el método de referencia para la medición de las áreas musculares14. En un estudio se ha demostrado que la medición del AMP mediante un único corte axial en imágenes de TC torácica se asocia a mediciones espirométricas relacionadas con la enfermedad pulmonar obstructiva crónica15. En otro estudio se ha observado que el AMP está positivamente correlacionado con la masa de músculo esquelético del organismo y que esta correlación se mantiene en función del sexo, el peso y la edad. Estos resultados indican que las mediciones del AMP en un único corte son indicadores que se podrían usar para la masa de músculo esquelético en la población general8. Los resultados de nuestro estudio indican que existe una pérdida del AMP en el proceso agudo posterior a la COVID-19 en nuestra población evaluada. En un estudio realizado en pacientes adultos con COVID-19, la puntuación de gravedad de la neumonía, el AMP y el IMP se han asociado con ciertos resultados negativos relacionados con la enfermedad10. En nuestro estudio se observó que la edad, la puntuación clínica, las enfermedades concomitantes, la hospitalización y el cambio de los valores del AMP y el IMP entre las dos imágenes de TC tenían un efecto significativo en la CT-SS como resultado de las evaluaciones realizadas para determinar los factores que afectan la CT-SS.
Los efectos mecánicos de la COVID-19 en el músculo esquelético todavía no se conocen de forma exacta16. Se sobreentiende que la falta de músculo y el riesgo de presentar sarcopenia aguda aumentan en personas que se han recuperado de la COVID-1913,17.
Entre un cuarto y la mitad de los pacientes sintomáticos con COVID-19 presentan mialgia y fatiga16. El SARS-CoV-2 penetra en el interior de las células mediante la serina-proteasa transmembrana a través del receptor de la segunda enzima convertidora de la angiotensina (ECA2). Tras la unión al receptor, la envoltura vírica se fusiona con la membrana celular y el material genético del virus se introduce en la célula7,16,18. Los receptores de la ECA2 se encuentran en todo el organismo y, por lo tanto, se pueden producir daños en diversos tejidos. La mialgia y la pérdida muscular se pueden explicar parcialmente por la presencia del receptor de la ECA2 en el músculo7. Algunos datos indican que el dolor muscular no aumenta a medida que la COVID-19 se intensifica19. Sin embargo, otros estudios insinúan que la mialgia es un factor pronóstico importante de la gravedad de las enfermedades generales en pacientes con resultados anómalos en la TC y la radiografía torácicas20.
En pacientes con infección por SARS se han observado mialgia y disfunción muscular generalizadas. Esta afección demuestra que existe una disminución de la fuerza y la resistencia muscular debida a los efectos proinflamatorios de la posible infección vírica16. En pacientes con COVID-19 e hipoalbuminemia se produce un aumento en una serie de citocinas inflamatorias, como la proteína C-reactiva, el factor de necrosis tumoral alfa (TNF-α) y la interleucina (IL). La respuesta de citocinas tiene un impacto negativo en la síntesis de proteínas en el músculo4,13. El interferón gamma (IFN-γ), la IL 1beta, la IL-6, la IL-17 y el TNF-α pueden inducir la proteólisis en la fibra muscular16. A medida que las células envejecen, la proliferación celular se detiene y se secretan cantidades elevadas de citocinas inflamatorias. Por consiguiente, la inflamación y los efectos de las enfermedades agudas podrían intensificarse con la edad13.
La anorexia forma parte de la COVID-19. La anosmia y la ageusia que se producen en la COVID-19 son una de las causas que la provocan. También se puede producir anorexia como consecuencia de los elevados niveles de citocinas inflamatorias7.
Se ha observado una desmielinización de las neuronas en pacientes con infección por SARS, que también puede contribuir a provocar debilidad muscular y fatiga. Además, a muchos pacientes con infección por SARS se le han administrado corticoesteroides para limitar la inflamación aguda, y estos fármacos pueden provocar directamente atrofia muscular16.
En nuestro estudio no se observó una significación estadística entre los valores del AMP y el IMP detectados entre dos imágenes de TC y la edad, las puntuaciones clínicas, el sexo, las enfermedades concomitantes, el intervalo de tiempo entre la primera TC y la TC de control, la hospitalización y la mortalidad. Esto nos lleva a considerar que la infección afecta a la disminución del área muscular como factor independiente.
Se ha observado que la disminución de función muscular de los pacientes con COVID-19 es más evidente en aquellos que han recibido cuidados intensivos. Esta afección puede estar relacionada con el periodo prolongado de reposo en cama y los relajantes musculares utilizados para permanecer en decúbito prono21,22. Otro motivo de pérdida muscular y debilidad en la COVID-19 es la inmovilidad de los pacientes sometidos a ventilación mecánica en la UCI23. Se cree que la sarcopenia se asocia a una disminución del grosor del músculo del diafragma24. Disminuciones repentinas del grosor del músculo del diafragma en pacientes hospitalizados pueden provocar disnea, lo que a su vez podría prolongar la necesidad de ventilación mecánica en pacientes hospitalizados25. En nuestro estudio se observó que la intubación influía de forma significativa en la disminución de los valores del AMP y el IMP, hecho que nos permite considerar que la intubación puede influir en la pérdida del área muscular.
Giraudo et al.26 realizaron un estudio retrospectivo en el que midieron los valores en UH de los músculos paravertebrales en TC torácicas durante las tres primeras semanas de hospitalización en pacientes con COVID-19. En los resultados que publicaron, concluyeron que la pérdida muscular de los pacientes con COVID-19 podría ser una indicación de ingreso en la UCI. En el estudio de Attaway et al.27 el AMP, el músculo sacroespinal y el cambio porcentual normalizado a los 30días en áreas musculares transversales de pacientes con COVID-19 se compararon con los observados en pacientes sin COVID 19. En este estudio se observó sarcopenia aguda, determinada mediante la disminución del AMP y el área del músculo sacroespinal, en pacientes con COVID-19, y estos resultados se asociaron con desenlaces desfavorables. Estos hallazgos avalan los resultados obtenidos en nuestro estudio.
Nuestro estudio presenta ciertas limitaciones. Dado que solo se incluyeron pacientes con COVID-19 cuyas imágenes de TC se obtuvieron durante el diagnóstico, no fue posible evaluar a los pacientes que no precisaron la realización de una TC a nivel clínico en su primera consulta. Al no disponer de registros sobre la ageusia, la pérdida del apetito, la mialgia y los síntomas musculares en las historias clínicas de los pacientes, no fue posible evaluar y comparar estos síntomas. Además, no disponíamos de los valores sanguíneos de citocinas inflamatorias en algunos pacientes, por lo que no pudimos estudiar los efectos de la respuesta de las citocinas inflamatorias en el músculo. Sin embargo, este método no se encuentra disponible en la práctica habitual de muchos centros y expone a los participantes a un riesgo de radiación adicional. Nuestro estudio fue retrospectivo y no fue necesaria la exposición adicional a radiación. Debido al diseño retrospectivo de nuestro estudio, la potencia estadística de los análisis es relativamente débil. En nuestro estudio, el intervalo entre ambas TC fue variable. Asimismo, podía haber un sesgo de selección, ya que no es lo mismo disponer de una TC realizada cuatro o seis meses más tarde.
ConclusionesEn conclusión, la COVID-19 provoca una disminución del AMP y el IMP, mediciones del músculo pectoral, y atrofia en el músculo esquelético. Este efecto negativo se asocia de forma significativa a pacientes intubados. Dado que los valores del AMP y el IMP pueden medirse en pacientes con TC torácica sin necesidad de realizar exploraciones adicionales, podrían ayudar a valorar la evolución de la enfermedad.
FinanciaciónNo se han recibido aportaciones económicas de ningún centro u organización para realizar este estudio.
Autoría- 1.
Responsables de la integridad del estudio: YA, SOG, ESG, BH, IS.
- 2.
Concepción del estudio: AY, SOG.
- 3.
Diseño del estudio: AY, SOG, ESG.
- 4.
Recopilación de los datos: AY, ESG.
- 5.
Análisis e interpretación de los datos: AY, SOG.
- 6.
Procesamiento estadístico: AY, SOG, ESG.
- 7.
Búsqueda bibliográfica: AY, SOG, ESG, BH, IS.
- 8.
Redacción del borrador del artículo: AY, SOG, ESG, BH, IS.
- 9.
Revisión crítica del manuscrito y contribución significativa a nivel intelectual: BH, IS.
- 10.
Aprobación de la versión final: AY, SOG, ESG, BH, IS.
Los autores declaran no tener ningún conflicto de intereses.