Analizar el rendimiento diagnóstico de la angio-TC pulmonar y comparar distintos valores de corte del dímero-D para el diagnóstico de tromboembolia pulmonar (TEP) aguda en pacientes con y sin infección por SARS-CoV-2.
Materiales y métodosAnálisis retrospectivo de todas las angio-TC pulmonares realizadas consecutivamente por sospecha de TEP en un hospital de tercer nivel durante 2 periodos distintos. El primero de diciembre del 2020 a febrero del 2021 y el segundo de diciembre del 2017 a febrero del 2018. Se recogieron los resultados del dímero-D durante las 24h previas a la realización de las angio-TC pulmonares, así como el resultado de estas últimas para todos los pacientes incluidos. Se analizaron la sensibilidad, especificidad, valores predictivos, área bajo la curva (AUC) y patrón de tromboembolia para 6 valores distintos del dímero-D y la extensión del tromboembolia. Durante el periodo de la pandemia se registró si los pacientes tenían enfermedad por SARS-CoV-2.
ResultadosTras desestimar 29 estudios de baja calidad, se incluyeron 492 para el análisis. De ellos, 352 fueron realizados durante la pandemia; 180 en enfermos con COVID-19 y 172 sin la enfermedad. La frecuencia absoluta de TEP diagnosticados durante la pandemia fue mayor (34 durante el periodo previo a la pandemia y 85 durante la pandemia, correspondiendo 47 de este último grupo a pacientes con COVID-19). No se encontraron diferencias significativas al comparar el AUC para los valores del dímero-D. Los valores óptimos calculados a partir de las curvas ROC fueron distintos (2.200, 4.800 y 3.200μg/l en pacientes con COVID-19, sin COVID-19 y en diagnosticados durante el periodo prepandemia, respectivamente). La distribución periférica de los trombos fue más frecuente en pacientes con COVID-19 (72%), respecto a los pacientes sin COVID-19 y los diagnosticados antes de la pandemia, con un OR de 6,6, IC del 95%: 1,5-24,6 (p<0,05) al compararla con la distribución central.
ConclusionesEl número de angio-TC realizadas y TEP diagnosticados durante la pandemia aumentó debido a la infección por SARS-CoV-2. Los valores de corte del dímero-D óptimos y la distribución del TEP fueron distintos en los grupos con y sin COVID-19.
To analyze the diagnostic performance of pulmonary CT angiography and to compare different D-dimer cutoffs for the diagnosis of acute pulmonary embolism in patients with and without SARS-CoV-2 infections.
Materials and methodsWe retrospectively analyzed all consecutive pulmonary CT angiography studies done for suspected pulmonary embolism in a tertiary hospital during two time periods: the first December 2020 through February 2021 and the second December 2017 through February 2018. D-dimer levels were obtained less than 24hours before the pulmonary CT angiography studies. We analyzed the sensitivity, specificity, positive and negative predictive values, area under the receiver operating curve (AUC), and pattern of pulmonary embolism for six different values of D-dimer and the extent of the embolism. During the pandemic period, we also analyzed whether the patients had COVID-19.
ResultsAfter excluding 29 poor-quality studies, 492 studies were analyzed; 352 of these were done during the pandemic, 180 in patients with COVID-19 and 172 in patients without COVID-19. The absolute frequency of pulmonary embolism diagnosed was higher during the pandemic period (34 cases during the prior period and 85 during the pandemic; 47 of these patients had COVID-19). No significant differences were found in comparing the AUCs for the D-dimer values. The optimum values calculated for the receiver operating characteristic curves differed between patients with COVID-19 (2200 mcg/L), without COVID-19 (4800 mcg/L), and diagnosed in the prepandemic period (3200 mcg/L). Peripheral distribution of the emboli was more common in patients with COVID-19 (72%) than in those without COVID-19 and than in those diagnosed before the pandemic [OR 6.6, 95% CI:1.5?24.6, p<0.05 when compared to central distribution].
ConclusionsThe number of CT angiography studies and the number of pulmonary embolisms diagnosed during the pandemic increased due to SARS-CoV-2 infection. The optimal D-dimer cutoffs and the distribution of the pulmonary embolisms differed between the groups of patients with and without COVID-19.
La infección por SARS-CoV-2 fue descrita por primera vez en diciembre de 2019, en el distrito oeste del sur de China, como una infección respiratoria causante del síndrome de distrés respiratorio agudo en algunos pacientes.
El estado proinflamatorio desencadenado por la infección se ha relacionado con la aparición de complicaciones trombóticas y tromboembólicas1. La aparición de TEP en estos pacientes parece ser resultado de trombosis local secundaria al proceso inflamatorio2.
Independientemente del mecanismo etiopatogénico, el TEP es más común en aquellos pacientes con infección por SARS-CoV-2 grave tratados intrahospitalariamente3, en especial en unidades de Cuidados Intensivos (UCI), aunque también ocurre en enfermos no ingresados4,5. En un metaanálisis, Jiménez et al.3 analizaron la incidencia de enfermedad tromboembólica venosa en pacientes con COVID-19 y encontraron una incidencia del 7,1% de TEP en 32 de los 49 estudios incluidos, y cuando se analizaba de forma separada a los pacientes tratados en la UCI, la incidencia alcanzaba el 27,9%. La sospecha de TEP en pacientes con infección por SARS-CoV-2 aumenta con la existencia de alteraciones gasométricas e inestabilidad hemodinámica desproporcionadas para el tiempo y tipo de evolución, siendo el método diagnóstico de elección la angio-TC pulmonar.
El algoritmo para la toma de decisiones en pacientes hospitalizados con sospecha de TEP incluye variables clínicas y el resultado del dímero-D6. En los pacientes con COVID-19 los valores del dímero-D se elevan frecuentemente como marcador de coagulopatía y de gravedad de la enfermedad7.
Valores elevados del dímero-D se han asociado con una mayor gravedad de la enfermedad, un mayor riesgo de ingreso en UCI y una mayor mortalidad1. Sin embargo, esta frecuente elevación del dímero-D en pacientes con neumonía grave por SARS-CoV-2 puede generar confusión e impide su uso como criterio para apoyar o descartar la sospecha de TEP en pacientes con riesgo bajo-intermedio8.
Múltiples estudios han evaluado la rentabilidad diagnóstica del dímero-D3,9–13, sin embargo, existe escasa información comparativa entre grupos de pacientes con y sin COVID-19 durante periodos de alta incidencia de la enfermedad.
La Sociedad Europea de Radiología (ESR) y la Sociedad Europea de Imagen Torácica (ESTI) recomiendan el empleo de la angio-TC pulmonar para descartar TEP en pacientes con infección por SARS-CoV-2 con requerimiento de oxígeno suplementario o fallo respiratorio persistente que tengan escasas alteraciones pulmonares en las pruebas de imagen9. En la práctica clínica de nuestro centro, se han seguido dichos criterios, sin embargo, la elevación del dímero-D también ha influido en la toma de decisiones para la realización de pruebas de imagen.
En este escenario, nuestro objetivo fue el de evaluar retrospectivamente la rentabilidad diagnóstica de la angio-TC pulmonar para el diagnóstico de TEP y comparar distintos valores de corte del dímero-D en 2 periodos distintos, el primero con una alta incidencia de COVID-19 durante la pandemia y otro previo a la aparición de la enfermedad. Por último, comparamos el patrón de distribución del TEP en ambas poblaciones.
Material y métodosDiseño del estudioEstudio de rentabilidad diagnóstica en el que incluimos de forma consecutiva a todos los pacientes a los que se les realizó una angio-TC pulmonar en nuestro centro por sospecha de TEP durante 2 periodos distintos. El comité de ética de nuestro hospital aprobó este estudio bajo el número de registro PI2021-077. Se desestimó la necesidad de solicitar consentimiento informado en estos pacientes dada la naturaleza retrospectiva.
Se dividió a los pacientes en 2 grupos, dependiendo de la fecha en que se realizó la angio-TC pulmonar. Se incluyó en un primer grupo (grupo A) a aquellos valorados en un periodo coincidiendo con un pico de incidencia de COVID-19 en nuestro hospital (de diciembre del 2020 a febrero del 2021) y en un segundo grupo (grupo B) a los valorados en un periodo similar del año, pero previo a la aparición de la pandemia COVID-19 (diciembre del 2017 a febrero del 2018).
Se dividió a los pacientes del grupo A en 2 subgrupos, clasificándolos como pacientes con COVID-19 si tenían una prueba de reacción en cadena de polimerasa (PCR) positiva para SARS-CoV-2 o una IgM positiva con IgG negativa previas a la realización de la angio-TC pulmonar, o si tenían una sospecha clínica y epidemiológica elevada con hallazgos típicos de COVID-19 en la angio-TC pulmonar (opacidades en vidrio deslustrado o consolidaciones bilaterales, periféricas y basales, con o sin engrosamiento vascular). Dentro del subgrupo de pacientes sin COVID-19 se incluyó a aquellos que tenían una prueba PCR y anticuerpos negativos, así como ausencia de sospecha clínica elevada.
Se excluyó a todos los pacientes con angio-TC pulmonares que tenían artefactos de movimiento importantes o escaso realce arterial pulmonar que limitase el diagnóstico de TEP.
Se obtuvo la siguiente información de cada paciente: edad, sexo, estancia intrahospitalaria en la UCI, resultado de la angio-TC (incluyendo el patrón de distribución del TEP), valor del dímero-D y resultado de la prueba PCR para SARS-CoV-2 y los anticuerpos IgM e IgG.
Adquisición y análisis de las angio-TC pulmonaresLa adquisición de las angio-TC pulmonares fue realizada en un scanner Siemens SOMATOM GoUp, con colimación de 32 x 0,7mm, con voltaje de 110kV y miliamperaje modulado.
El protocolo de administración de contraste iodado fue realizado inyectando 40 a 70ml a una velocidad de 4ml/s, seguidos de 40ml de solución salina a la misma velocidad, con inicio de la adquisición de las imágenes 4 segundos tras alcanzarse un umbral de 150 unidades Hounsfield en la arteria pulmonar principal.
Todos los estudios fueron analizados por 2 radiólogos de la sección de radiología torácica con 6 y 20 años de experiencia. Se diagnosticó TEP a los pacientes que tenían al menos un defecto de repleción en la arteria pulmonar principal o sus ramas visible en la angio-TC pulmonar14. Respecto al patrón de distribución del TEP, se consideró periférico si afectaba a las arterias segmentarias o subsegmentarias y central si afectaba a alguna pulmonar principal o sus ramas lobares. Por último, la medición cuantitativa del dímero-D fue realizada mediante inmunoanálisis fotométrico con látex.
Análisis estadísticoLa frecuencia de angio-TC pulmonares positivas y negativas fue calculada para cada grupo, así como la asociación entre la infección por SARS-CoV-2 y el desarrollo de TEP mediante el test estadístico de la chi al cuadrado.
Se analizó la rentabilidad diagnóstica para el diagnóstico de TEP de distintos valores del dímero-D (500, 1.000, 1.500, 2.000, 3.500, 5.000μg/l) en ambos grupos calculando la sensibilidad, especificidad y valores predictivos positivo y negativo para cada uno de esos valores. Los valores de corte óptimos del dímero-D para los distintos grupos fueron calculados mediante el análisis de las curvas ROC y las AUC obtenidas y fueron comparadas mediante el test de Delong.
La distribución del TEP en todos los grupos se comparó mediante el test de la chi al cuadrado.
Se empleó el software SPSS para Windows (versión 25.0, Inc. Chicago, IL., EE. UU.).
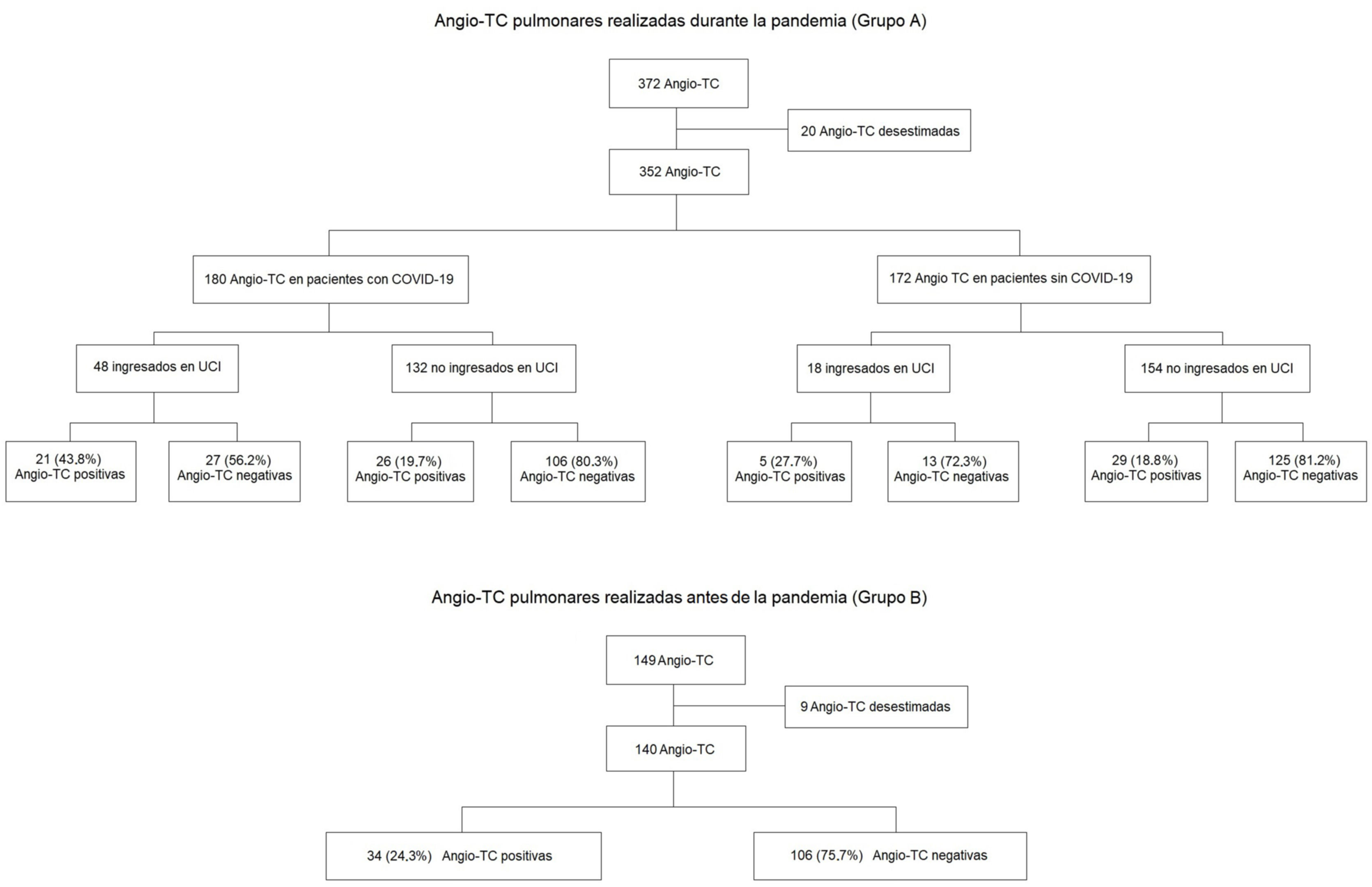
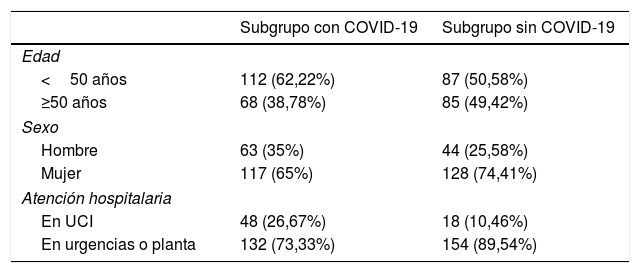
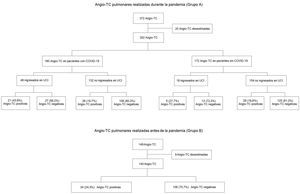
ResultadosPacientes incluidos y frecuencia de la angio-TC pulmonarEl diagrama de flujo de pacientes incluidos y excluidos y el porcentaje de positividad de la angio-TC para cada grupo aparecen en la figura 1. Se incluyó a un total de 492 pacientes para el análisis tras desestimar 29 con estudios de mala calidad técnica. De este total, 140 correspondían a aquellos realizados durante el periodo previo a la pandemia y 352 a los realizados durante la pandemia; de ellos, 180 fueron asignados al subgrupo de pacientes con COVID-19 y 172 al grupo de pacientes sin COVID-19. La edad, el sexo y la presencia de ingreso en la UCI de los pacientes realizados durante la pandemia se incluyen en la tabla 1.
Datos epidemiológicos de los pacientes incluidos en los subgrupos del grupo A
| Subgrupo con COVID-19 | Subgrupo sin COVID-19 | |
|---|---|---|
| Edad | ||
| <50 años | 112 (62,22%) | 87 (50,58%) |
| ≥50 años | 68 (38,78%) | 85 (49,42%) |
| Sexo | ||
| Hombre | 63 (35%) | 44 (25,58%) |
| Mujer | 117 (65%) | 128 (74,41%) |
| Atención hospitalaria | ||
| En UCI | 48 (26,67%) | 18 (10,46%) |
| En urgencias o planta | 132 (73,33%) | 154 (89,54%) |
Del total de angio-TC pulmonares realizadas durante la pandemia (grupo A), 85 pacientes (24%) tuvieron TEP; de ellos, algo más de la mitad (55,3%) correspondía a pacientes con COVID-19. Se diagnosticó TEP en el 19,8%% de los pacientes sin COVID-19 y el 26,1%% de los pacientes con COVID-19. Del total de pacientes con COVID-19 ingresados en la UCI, hasta el 43,8% desarrolló TEP, mientras que esto solo ocurrió en el 19,7% de los no ingresados (fig. 1).
Respecto a las angio-TC pulmonares realizadas durante el periodo previo a la pandemia (grupo B), un total de 34 pacientes (24,3%) tuvo TEP.
No existieron diferencias estadísticamente significativas en el riesgo de desarrollo de TEP en pacientes con COVID-19 al compararlos con los del subgrupo sin COVID-19 (p=0,22) y con los pacientes del grupo B (p=0,42).
Rentabilidad diagnóstica del dímero-DLa mediana de los valores del dímero-D en pacientes con TEP y COVID-19 fue similar a la de los pacientes sin COVID-19 (2.400μg/l, P25: 1.100-P75: 6.400 vs. 3.000μg/l, P25: 1.500-P75: 7.000, respectivamente).
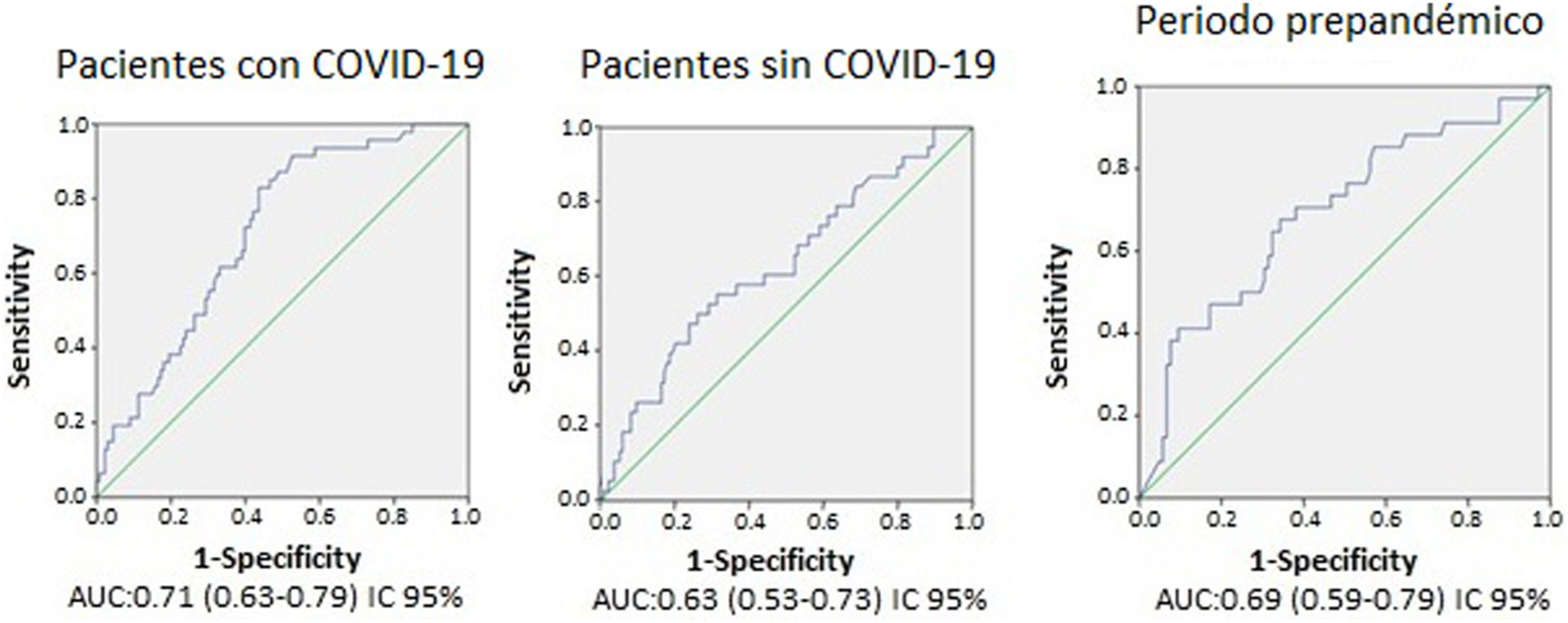
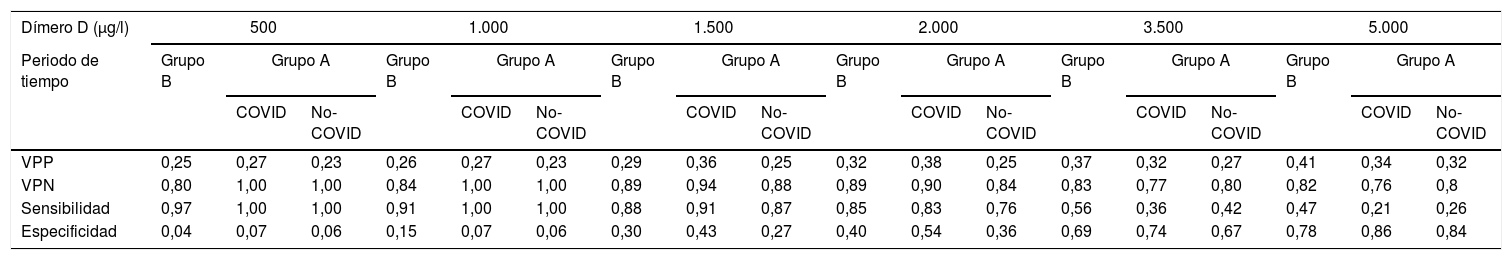
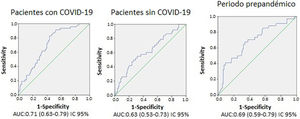
Se obtuvieron distintos resultados de sensibilidad, especificidad y valores predictivos positivo y negativo para los 6 valores de corte del dímero-D analizados en ambos grupos (tabla 2). A pesar de ello, no se encontraron diferencias al comparar el AUC de los valores del dímero-D (0,71 para pacientes con COVID-19, 0,63 para pacientes sin COVID-19 y 0,69 para los pacientes del grupo B, p >0,05) (fig. 2).
Rentabilidad diagnóstica de los diferentes valores del dímero-D
| Dímero D (μg/l) | 500 | 1.000 | 1.500 | 2.000 | 3.500 | 5.000 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Periodo de tiempo | Grupo B | Grupo A | Grupo B | Grupo A | Grupo B | Grupo A | Grupo B | Grupo A | Grupo B | Grupo A | Grupo B | Grupo A | ||||||
| COVID | No-COVID | COVID | No-COVID | COVID | No-COVID | COVID | No-COVID | COVID | No-COVID | COVID | No-COVID | |||||||
| VPP | 0,25 | 0,27 | 0,23 | 0,26 | 0,27 | 0,23 | 0,29 | 0,36 | 0,25 | 0,32 | 0,38 | 0,25 | 0,37 | 0,32 | 0,27 | 0,41 | 0,34 | 0,32 |
| VPN | 0,80 | 1,00 | 1,00 | 0,84 | 1,00 | 1,00 | 0,89 | 0,94 | 0,88 | 0,89 | 0,90 | 0,84 | 0,83 | 0,77 | 0,80 | 0,82 | 0,76 | 0,8 |
| Sensibilidad | 0,97 | 1,00 | 1,00 | 0,91 | 1,00 | 1,00 | 0,88 | 0,91 | 0,87 | 0,85 | 0,83 | 0,76 | 0,56 | 0,36 | 0,42 | 0,47 | 0,21 | 0,26 |
| Especificidad | 0,04 | 0,07 | 0,06 | 0,15 | 0,07 | 0,06 | 0,30 | 0,43 | 0,27 | 0,40 | 0,54 | 0,36 | 0,69 | 0,74 | 0,67 | 0,78 | 0,86 | 0,84 |
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los valores de corte óptimos del dímero-D calculados para los distintos grupos fueron 2.200, 4.800 y 3.200μg/l para los pacientes con COVID-19, sin COVID-19 y para los del grupo B, respectivamente. Ajustando dichos valores a una sensibilidad del 90%, se obtuvieron los siguientes valores de corte: 1.600, 1.100 y 1.350μg/l para los pacientes con COVID-19, sin COVID-19 y para los del grupo B (tabla 2), respectivamente.
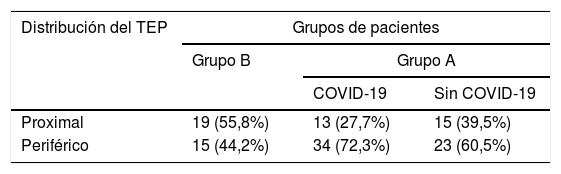
Distribución del tromboembolia pulmonarSe encontró una mayor frecuencia relativa de TEP con distribución periférica en los pacientes con COVID-19 (tabla 3) al compararlos con los pacientes del subgrupo sin COVID-19 y los del grupo B (OR=6,6, IC del 95%, 1,5-24,6, p=0,01).
DiscusiónNuestro análisis ha demostrado un incremento absoluto en el número de las angio-TC pulmonares solicitadas y de pacientes con TEP detectados durante un periodo de la pandemia de COVID-19 en nuestro centro, a expensas de un mayor número de casos detectados en enfermos con COVID-19, con una mayor frecuencia de TEP con distribución periférica. A pesar de ello, la tasa de positividad se ha mantenido y los valores del dímero-D son similares en los diferentes grupos.
La frecuencia relativa de angio-TC pulmonares positivas en pacientes con COVID-19 (26,1%) en nuestro estudio está en el rango de las descritas previamente en un metaanálisis y otros estudios (24-37%)3,11–13,15–17. Se han publicado distintas tasas de positividad según el servicio hospitalario en donde el paciente ha sido evaluado. En un estudio con evaluación de pacientes tratados en el servicio de Urgencias, la tasa de positividad fue menor (del 7,7%)18 que la encontrada en pacientes con infección grave tratados en la UCI donde se alcanzan positividades de hasta el 50%13–17,19. En nuestro estudio, la incidencia en los pacientes ingresados en UCI fue del 43,8% frente al 19,7% en el resto de los pacientes con COVID-19.
Se han realizado algunas comparaciones de la frecuencia de TEP durante periodos similares de tiempo, mostrando un aumento durante la pandemia1. En nuestro trabajo, la frecuencia relativa de angio-TC pulmonares positivas en los pacientes con COVID-19 fue similar a la de los pacientes sin COVID-19 durante la pandemia (el 26,1 y el 22,1%, respectivamente) y, además, ambas fueron similares a la de los pacientes diagnosticados durante el periodo prepandémico (24,3%). A pesar de ello, el número total de angio-TC pulmonares realizadas y TEP diagnosticados aumentó considerablemente durante la pandemia. Esta situación también ha sido descrita recientemente por Schuzl et al.20, que encontraron un aumento del 61,8% en el número de angio-TC realizadas durante la época de pandemia, manteniendo la misma tasa de positividad. No obstante, la tasa de positividad de ese estudio, de alrededor del 11%20, es menor que la nuestra en todos los grupos (por encima del 20%). Estas diferencias podrían deberse a distintas pautas de actuación en 2 comunidades geográficamente alejadas con protocolos de realización de angio-TC también diferentes.
Se ha demostrado que la frecuencia de TEP diagnosticados aumenta cuando es buscado activamente3 y este podría ser un factor que condicione este aumento absoluto de casos pero, por otro lado, puede ser debido a una mayor proporción de casos con COVID-19 grave valorados durante este periodo21.
Los valores del dímero-D empleados conjuntamente con las escalas de riesgo para el diagnóstico de TEP6 podrían requerir ajustarse debido a la elevación del mismo en pacientes con infección por SARS-CoV-2 grave8. Se han propuesto valores de corte del dímero-D para el diagnóstico de TEP y trombosis venosa periférica (TVP) distintos a los usualmente empleados para la población general12,13,19. Sin embargo, algunos de estos estudios solo incluyen a los enfermos críticos, tratados en UCI y otros solo a aquellos con sospecha de TVP, con distintos criterios de inclusión.
Existe gran heterogeneidad de resultados para la sensibilidad, la especificidad y los valores predictivos de distintos valores del dímero-D evaluados en algunos estudios que incluyen a pacientes con infección por SARS-CoV-2 y sospecha de TEP12,13,22–27. En nuestro estudio, el valor de corte óptimo del dímero-D obtenido mediante el análisis de las curvas ROC en los pacientes con COVID-19 fue de 2200μg/l. Sin embargo, la sensibilidad para este valor fue baja (de 0,83) al compararla con otros valores.
Obtuvimos una mayor sensibilidad (0,91), así como un mayor predictivo negativo, a partir de valores por debajo de 1.500μg/l.
En estudios previos, se ha propuesto la obtención de un valor de corte óptimo a través del índice de Youden. Este es un índice estadístico cuyo resultado expresa la mayor sensibilidad y especificidad combinadas posible. Se ha obtenido el valor de 2.590μg/l en un estudio previo24, con sensibilidad del 83,3% y especificidad del 83,8%. En este estudio los pacientes tenían criterios de gravedad (como disminución de la saturación, taquicardia y un rápido deterioro clínico) que podrían explicar el valor de corte más elevado.
En un metaanálisis realizado por Kwee et al.19 se ha propuesto un valor de corte muy parecido (2.500μg/l), obteniéndose una especificidad menor (51%) y una sensibilidad similar (80%).
Valores de corte del dímero-D más elevados se han analizado en otros estudios, obteniéndose menor sensibilidad sin aportar un gran aumento en la especificidad. En alguno de ellos15, la sensibilidad encontrada para el valor de corte de 5.000μg/l fue de 75%, con una especificidad del 78% y un VPP del 70%. En nuestro estudio, este valor de corte aportaba una sensibilidad extremadamente baja, del 34% para los pacientes con COVID-19.
Respecto a la rentabilidad diagnóstica del dímero-D, evaluada a través del AUC en nuestro estudio, esta fue buena para los 2 subgrupos del grupo A, así como para el grupo anterior a la pandemia (grupo B); sin embargo, no encontramos diferencias significativas al comparar los grupos de pacientes con y sin la enfermedad. Se han publicado resultados similares con AUC alrededor de 0,8 en pacientes con COVID-19 en otro estudio de diseño similar al nuestro18; sin embargo, no se comparaban los resultados con pacientes sin la enfermedad.
En nuestro estudio, los valores de corte del dímero-D óptimos obtenidos a partir de las curvas ROC han aportado una baja sensibilidad en todos los grupos. Dado que el dímero-D se ha empleado como una prueba para desestimar a los pacientes con sospecha baja-intermedia de TEP, los valores de corte óptimo para este fin deben basarse en una sensibilidad elevada. En nuestro estudio, esto se apreció con valores del dímero-D de 1.500μg/l en los pacientes con COVID-19.
Respecto a la distribución del TEP, la frecuencia relativa del TEP periférico fue mayor en pacientes con COVID-19 (72,3%) que en aquellos sin COVID-19 (60,5%) y los de antes de la pandemia (44,2%), con diferencias estadísticamente significativas para el desarrollo de TEP periférico en pacientes con COVID-19 respecto al resto de pacientes. Estos resultados son similares a otros estudios, siendo la distribución segmentaria o subsegmentaria la predominante en todos ellos (55-70%)2,15,19,24,28. Esta distribución se ha relacionado en otro estudio con la aparición de trombosis en las áreas de parénquima pulmonar con aumento de la atenuación en vidrio deslustrado2. Estos hallazgos concuerdan con los encontrados en las necropsias de pacientes con COVID-19 de trombosis in situ en arterias pulmonares de pequeño calibre19,29–31.
Nuestro estudio tiene algunas limitaciones. En primer lugar, se ha realizado de forma retrospectiva en un único centro. En segundo lugar, el protocolo seguido para la realización de las angio-TC pulmonares durante la pandemia ha sido el habitual, basado en las guías clínicas, sin que se hayan utilizado protocolos específicos para pacientes con COVID-19. En tercer lugar, es posible que exista un sesgo en la clasificación dentro del grupo A, debido a la existencia de falsos negativos en la PCR y la inclusión de algunos pacientes en el subgrupo con la enfermedad a pesar de tener una PCR negativa, pudiendo este sesgo atenuar la diferencia en los valores de corte óptimos observados en los distintos grupos. En cuarto lugar, no se ha estratificado la enfermedad por SARS-CoV-2 por su extensión, que es un factor que puede influir en la incidencia de TEP. En quinto lugar, no se han ajustado los valores de corte del dímero-D a la edad de los pacientes, siendo esto un factor que podría afectar a la rentabilidad diagnóstica. Por último, se trata de una serie previa a la introducción de la vacunación; a pesar de ello, los resultados pueden ser útiles para describir el comportamiento de una enfermedad emergente como la COVID-19 y podrían ser aplicables en nuevas pandemias.
En conclusión, nuestro estudio aporta evidencia reforzando los hallazgos de una elevada incidencia de complicaciones tromboembólicas en los pacientes con COVID-19 con un aumento absoluto en el número de angio-TC y de enfermos con TEP comparado con un periodo prepandémico. Los TEP tienen una distribución predominantemente periférica en los pacientes con COVID-19. Los valores de corte del dímero-D por debajo de 1.500μg/l aportan una sensibilidad mayor del 90% en pacientes con COVID-19.
Autoría- 1.
Responsable de la integridad del estudio: JJAJ.
- 2.
Concepción del estudio: JMCG, JJAJ y EGG.
- 3.
Diseño del estudio: JJAJ y AUV.
- 4.
Obtención de los datos: JMCG y PSS.
- 5.
Análisis e interpretación de los datos: JMCG, JJAJ y EGG.
- 6.
Tratamiento estadístico: JMCG y JJAJ.
- 7.
Búsqueda bibliográfica: JJAJ y AUV.
- 8.
Redacción del trabajo: JMCG, JJAJ y AUV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JJAJ y EGG.
- 10.
Aprobación de la versión final: JMCG, JJAJ, AUV, EGG y PSS.
Los autores declaran no tener ningún conflicto de intereses.