A causa de la evolución demográfica actual de los gru-pos de población occidentales, el colectivo de pacientes presenta también una edad cada vez más avanzada. Debido a las cifras absolutas crecientes de personas de edad avanzada, una proporción porcentual creciente de pacientes de edad avanzada y muy avanzada en la población general, así como al incremento del número y la proporción de personas de edad muy avanzada (más de 80 años), aumentan las probabilidades de que en la práctica cotidiana sea preciso adoptar medidas endodónticas en pacientes con un estado de salud general disminuido. En este contexto, adquiere cada vez mayor importancia el conocimiento profundo de las posibles interacciones entre las dolencias endodónticas y las sistémicas. El artículo aborda las dolencias relevantes y su relevancia para el tratamiento endodóntico. En términos generales, puede afirmarse sin lugar a dudas que algunas dolencias sistémicas interactúan con los tra-tamientos de los conductos radiculares, lo cual afecta esencialmente a las tasas de éxito. Pero las inflamaciones de origen endodóntico también pueden perjudicar al estado de salud general. Es preciso considerar las modificaciones pertinentes del tratamiento endodóntico y de las medicaciones, así como la necesidad de una protección antibiótica profiláctica. Por regla general, la exis-tencia de dolencias sistémicas no constituye una contraindicación del tratamiento endodóntico.
(Quintessenz. 2012;63(1):21-9)
IntroducciónEn los últimos años se han observado, sobre todo en la parodontología, numerosas interacciones entre dolencias periodontales y sistémicas9. Pese a que hasta la fecha no se dispone de datos exhaustivos acerca de la endodoncia, numerosos estudios y sinopsis han abordado ya el tema «endodoncia y salud general».
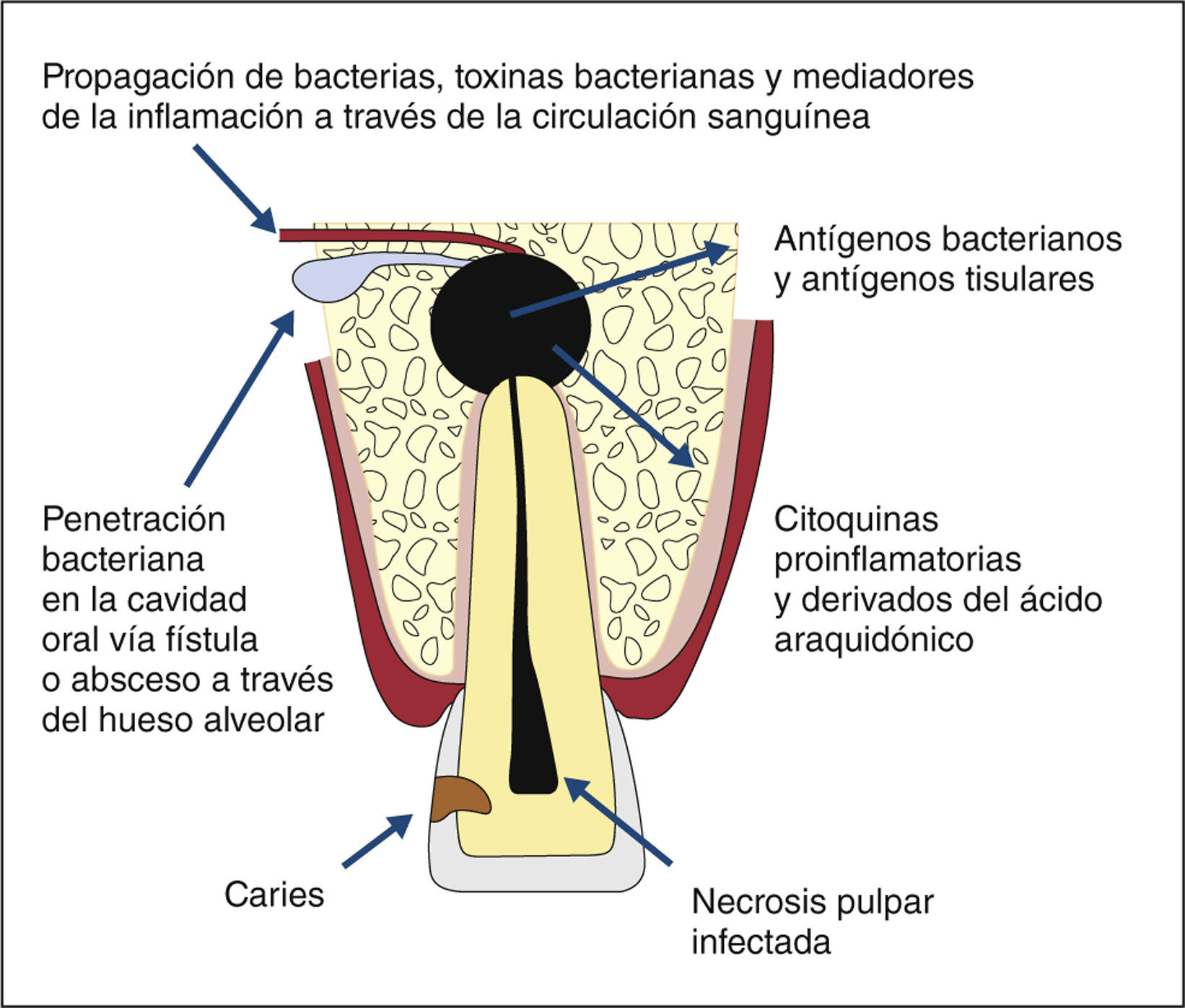
Si bien la extensión de una inflamación o la inducción de trastornos patológicos discurre mayoritariamente par-tiendo del endodonto en dirección al organismo (fig. 1), algunos factores merecen un estudio a fondo también en la dirección inversa, puesto que determinadas dolencias u otros factores sistémicos (por ejemplo, tabaquismo) afectan ciertamente a la salud de la pulpa y pueden influir en procesos patológicos y de curación en el tejido pulpar y en el periodonto apical (fig. 2).
Este artículo arroja luz sobre algunas correlaciones entre la endodoncia y la salud general, presenta los co-nocimientos que se tienen actualmente al respecto y describe las modificaciones del tratamiento que pudieran ser necesarias.
Efecto focalCon el título «The role of sepsis and antisepsis in me-dicine» (El papel de la sepsis y la antisepsis en la medicina), el cirujano estadounidense Hunter pronunció en 1911 una conferencia de gran trascendencia en la que, entre otras cosas, expuso lo siguiente: «Las obtura-ciones de oro, las fundas de oro, los puentes de oro, las coronas de oro, las prótesis fijas construidas en, sobre o alrededor de dientes enfermos conforman un verdadero mausoleo de oro sobre una masa de sepsis para el cual no existe paralelo en todo el ámbito de la medicina o la cirugía… Los peores casos de anemia, gastritis, fiebre de origen desconocido, trastornos nerviosos y todos los tipos de depresión mental, hasta lesiones reales de la médula, infecciones reumáticas crónicas, enfermedades renales, todas aquellas que tengan su origen en, o es-tén gravemente complicadas por la sepsis oral producida por estas trampas doradas de sepsis» (citado según Pa-llash y Wahl48).
Esta ponencia catapultó bruscamente de vuelta a la Edad Media a la por entonces todavía joven endodonto-logía y marcó el inicio de una fase, que duró hasta finales de los años 30, y que hasta ahora se conoce, no desacertadamente, como «era de la exodoncia». Pallash y Wahl48 describen en términos bastante drásticos las conse-cuencias del incendiario discurso de Hunter: «… con-duciendo a la extracción generalizada de dientes compro-metidos endodónticamente y a la desaparición virtual de la terapia endodóntica en los Estados Unidos». Lo que siguió fue una «orgía de extracciones». Los denomina-dos «100 percenters» extraían sin contemplaciones todos los dientes no vitales y que presentaran cualquier otro motivo de sospecha, mientras que los extremistas pro-pagaban directamente, en aras de la seguridad, la extracción de todos los dientes («therapeutic edentulation» o «the clean-sweep»). Aquellos odontólogos que continua-ban realizando tratamientos de los conductos radiculares fueron tachados de «casi criminales». No fue hasta los años 60 y 70 cuando se refutaron las teorías de la «in-fección focal»43.
Periodontitis apicalDiversos estudios abordan la cuestión de qué factores de salud general pueden influir en la aparición de una periodontitis apical. En un estudio de más de 600 per-sonas seleccionadas al azar en Aarhus (Dinamarca), se identificaron como indicadores de riesgo de una periodontitis apical el tabaquismo (influencia débil), las irre-gularidad en las visitas al odontólogo, más de dos lesiones cariosas, más de tres restauraciones coronales insuficientes y, ante todo, la presencia de obturaciones de conductos radiculares. En cambio, los factores so-cioeconómicos no desempeñaban ningún papel30. Se ob-tuvieron resultados controvertidos en cuanto a la relación entre el tabaquismo y la periodontitis apical en los estudios de Bergström et al.7, quienes no pudieron de-mostrar la influencia del consumo de tabaco sobre la fre-cuencia de las lesiones periapicales (1,9 a 1,0 lesiones por persona).
En un estudio de 34 pacientes, quienes presentaban signos clínicos o radiológicos de una periodontitis apical persistente como mínimo un año después de haberse sometido a un tratamiento de los conductos radiculares, y de 66 pacientes sin signos de dolencia perirradicular, se observaron diferencias significativas en la frecuencia de aparición de un marcador genético (alelo 2 de la in-terleuquina-1β). IL-1β regula la respuesta del huésped a las infecciones microbianas y es un modulador de la reabsorción ósea. En presencia del alelo 2 se cuadruplica la producción de la IL-1β, lo cual a su vez puede mante-ner en marcha una inflamación perirradicular. Los auto-res llegaron a la conclusión de que marcadores genéticos específicos, en combinación con un incremento de la secreción de IL-1β, aumentan el riesgo de persistencia de lesiones perirradiculares41.
En pacientes con periodontitis apical detectable radio-lógicamente se observaron concentraciones en sangre de IL-1, IL-2, IL-6 y ADMA (dimetilarginina asimétrica) en la sangre significativamente más elevadas. En la eco-cardiografía no se observaron diferencias. Los valores de la ERF (reserva de flujo endotelial) resultaron significativamente más bajos en comparación con los sujetos de estudio sanos, lo cual, en combinación con los valores de IL-2 incrementados, apunta a una disfunción endotelial temprana en presencia de una periodontitis apical, y por consiguiente a una asociación a dolencias cardiovas-culares12.
En el tejido periapical de pacientes con artritis reu-mática se detectaron factores de reuma (inmunoglobu-lina), pero no se detectó una mayor prevalencia de lesiones perirradiculares en pacientes con reuma32,33.
Por su parte, la periodontitis apical manifiesta puede repercutir en la salud general. Por regla general, la de-fensa inmunológica en el periápice evita eficazmente la dispersión directa (hematógena) de microorganismos des-de el conducto radicular, pero por ejemplo citoquinas como IL-6, IL-1 o TNF pueden ser transportadas por la sangre hasta regiones lejanas del organismo37. En el en-sayo con animales, los antígenos introducidos en el conducto radicular provocaron una reacción tanto local como sistémica del sistema inmunitario13,47. Un estudio pilo-to anterior con 36 pacientes reveló que los valores de diversos marcadores de inflamación (proteínas de fase aguda, entre otros CRP, IgA, IgG, IgM) variaban tan solo parcialmente tras el tratamiento apical quirúrgico en pacientes con periodontitis apical. Sin embargo, tres meses después de la apicectomía se observaron reduccio-nes significativas de todas las proteínas36,38.
Al examinar los microorganismos que circulaban por el sistema vascular tras un tratamiento de los conductos radi-culares, se constató sin lugar a dudas que procedían del sistema de conductos radiculares infectado tratado14,17–19.
En el ensayo con animales, la inducción de un absceso periapical influyó en el embarazo: El aumento significa-tivo del TNF-α, de la glucosa en sangre y de la concentración de insulina en el suero reveló que los animales desarrollaron una resistencia a la insulina que repercutía en el desarrollo del embarazo. En los animales se obser-vó una prolongación del embarazo, así como un aumento significativo del peso de los neonatos2. No se dispone de más datos acerca del embarazo y la endodoncia.
Los escasos estudios existentes confirman que, en principio, las infecciones endodónticas pueden perfecta-mente provocar manifestaciones en órganos y compar-timentos del organismo alejados. No obstante, actual-mente todavía no se ha demostrado la existencia de una relación fuertemente causal ni mucho menos conclu-yente entre la periodontitis apical y las enfermedades sistémicas como la postulada en la era de la infección focal35,37.
AnacoresisPara tejido pulpar inflamado pero todavía irrigado se ha demostrado la posibilidad de una colonización por parte de microorganismos diseminados hematógenamen-te (anacoresis)8,55. La frecuencia con la que se da en realidad una pulpitis o periodontitis apical «retrógra-da» de origen hematógeno no está clara, pero esta vía infecciosa está considerada clínicamente irrelevante44.
En el ensayo con animales no se pudo detectar la presencia de microorganismos inyectados por vía intrave-nosa en conductos radiculares instrumentados21.
Bacteriemia y tratamiento de conductos radicularesLos tratamientos endodónticos de un sistema de conductos radiculares infectado van ligados a una bacteriemia en el 0 al 54% de los casos5,15,16,20,31,54 (tabla 1). El máximo riesgo se da ya unos 30 s después de la intervención, y la bacteriemia no persiste durante más de 10 a 15min aproximadamente43. Se demostró conclu-yentemente que los microorganismos presentes en la sangre proceden realmente de infecciones intrarradicu-lares15,18,29. La instrumentación más allá del ápice resultó en un incremento de entre el 25 y el 30% de la inciden-cia de bacteriemias4,6,17,31.
Incidencia de bacteriemias tras intervenciones endodónticas (apicectomía y endodoncia)
| Momento del estudio | Resultado | Fuente |
| Tras apicectomía | 6 de 56 muestras (10%) positivas | Rahn et al. 198749 |
| Tras endodoncia ortógrada | 1 de 30 muestras positivas (sobreinstrumentación) | Baumgartner et al. 19764 |
| Tras endodoncia ortógrada | 4 de 20 muestras (20%) positivas | Heimdahl et al. 199026 |
| Tras endodoncia ortógrada | 11 de 26 muestras (42%) positivas7/13 con sobreinstrumentación4/13 sin sobreinstrumentación | Debelian et al. 199517 |
Se cree que alrededor del 20% de los casos de endocarditis infecciosos son atribuibles a intervenciones odontoló-gicas o infecciones dentales54. Según un estudio retros-pectivo, durante el cual se examinó a lo largo de 13 años a 53 pacientes aquejados de endocarditis infecciosa, en el 13,2% de los casos la causa podría haber sido un tratamiento endodóntico34. Dado que la mortalidad de una endocarditis infecciosa continúa situándose actualmen-te en el 15,7%, antes de un tratamiento de los conductos radiculares es necesaria una profilaxis antibiótica en los si-guientes pacientes58:
- •
pacientes con sustitución de válvula cardiaca mediante prótesis mecánicas o biológicas;
- •
pacientes que hayan sufrido una endocarditis de origen microbiano (crónica);
- •
pacientes con defectos cardiacos complejos congénitos con cianosis;
- •
pacientes con defectos cardiacos corregidos quirúrgicamente dentro de los primeros 6 meses tras la intervención, así como
- •
pacientes con defectos cardiacos corregidos quirúrgicamente con secuelas, colindantes con el material extraño (no epitelializado).
Para la protección antibiótica profiláctica se recomienda una administración de antibióticos oral única en dosis elevada entre 30 y 60min antes del tratamiento, confor-me al esquema reproducido en la tabla 2.
En paralelo a la protección antibiótica profiláctica, antes y durante el tratamiento deberían llevarse a cabo en-juagues bucales repetidos con antisépticos. Estos redu-cen sensiblemente la incidencia de bacteriemia, pero no pueden sustituir a una profilaxis antibiótica.
Endodoncia y cardiopatías coronariasLa vecindad anatómica entre el endodonto infectado y el hueso vital irrigado, así como la detección del paso de microorganismos a la vía sanguínea (véase abajo) apo-yan la conjetura de que una inflamación puede dar lugar a complicaciones sistémicas antes, durante o después de un tratamiento de conductos radiculares, entre las cuales se cuentan también problemas cardiovasculares. Esto se ve respaldado por el hecho de que se han confirmado mecanismos comparables para enfermedades periodon-tales y existen similitudes entre la periodontitis y la necrosis pulpar por lo que respecta a la flora bacteriana9. En ambos casos se produce, como respuesta a las bacte-rias anaerobias gramnegativas, una producción excesiva de citoquinas, las cuales pueden, a través de la circulación sistémica, contribuir a daños vasculares y a dolencias cardiovasculares. Sin embargo, la periodontitis marginal y la periodontitis apical se diferencian en la extensión de la superficie colonizada por los microbios y por consi-guiente por la carga microbiana total, de modo que cabe descartar analogías directas. No obstante, Bate et al.3 pu-dieron demostrar que las bacterias procedentes de conduc-tos radiculares infectados pueden desencadenar, bajo de-terminadas circunstancias (presencia de ciertas proteínas ligantes de fibronectina y fibrinógeno), una endocarditis infecciosa. Las incidencias de endocarditis bacterianas causadas por intervenciones odontológicas como conse-cuencia de las bacteriemias mencionadas se sitúan, para paciente sanos, en 1 por cada 14,2 millones de tratamien-tos odontológicos, para pacientes que ya han sufrido endocarditis en 1 por cada 95.000, para pacientes con sus-titución de válvula cardiaca en 1 por cada 114.000 y para pacientes con cardiopatía reumática en 1 por cada 142.000 tratamientos odontológicos48.
De 40 pacientes con hipertensión, más del 75% presentaron un o más dientes con periodontitis apical, mien-tras que este porcentaje alcanzó únicamente el 61% en el grupo de control. La proporción de pacientes con obtu-raciones de conductos radiculares se diferenció en un 6%, la proporción de dientes endodonciados con respecto al número total de dientes se situó en 3,1 o el 1,8%, y la proporción de dientes endodonciados con periodontitis apical se situó en 65 o el 43%. Las diferencias no fueron significativas en ninguno de los casos, de modo que no pudo demostrarse una relación entre el estado periapical y la hipertensión53. En cambio, un estudio prospecti-vo con 49.334 dientes endodonciados a lo largo de 2 años confirma que una hipertensión (sistólica & 140mmHg, diastólica 3=90mmHg) constituye un factor de riesgo significativo para extracciones dentales tras el tratamiento de conductos radiculares. A su vez, la presencia simul-tánea de diabetes mellitus o cardiopatía coronaria incre-menta significativamente el riesgo de pérdida dental56.
En análisis de sangre de pacientes con dientes endodonciados no se detectó ningún incremento de los valo-res de proteína C reactiva (PCR). La PCR es un marca-dor de inflamación cuyos valores están correlacionados con las cardiopatías coronarias1. Caplan et al.10 veri-ficaron la relación entre las lesiones perirradiculares y las cardiopatías coronarias. Durante un periodo de hasta 32 años, 708 varones fueron sometidos periódi-camente cada tres años a exámenes médicos generales y odontológicos. Entre los sujetos de estudio menores de 40 años pudo establecerse una relación entre la apa-rición de lesiones perirradiculares y la aparición de cardiopatías coronarias, mientras que en personas de mayor edad no se observó ninguna relación estadísticamente significativa.
En otro estudio, Caplan et al.11 examinaron la relación entre el tratamiento endodóntico (según las indicaciones de los pacientes) y las cardiopatías coronarias en más de 6.000 participantes en un estudio de mayor envergadu-ra sobre el riesgo de cardiopatías arterioescleróticas en los Estados Unidos. Entre los participantes con más de 25 dientes propios, las personas con dos y más endodon-cias (según indicaciones propias) presentaron una mayor probabilidad de padecer cardiopatía coronaria. Sin embargo, los autores recomendaron precaución al evaluar los datos. También Oikarinen et al.46 describieron una relación significativa entre la periodontitis apical detectable radiológicamente y la cardiopatía coronaria (infarto de miocardio agudo o angina de pecho), si bien señalaron que de ello no puede derivarse ninguna relación causal.
Los participantes varones en un estudio sobre la salud de sujetos de estudio que trabajaban en el ámbito sanita-rio con más de una endodoncia (como sustituto de la inflamación pulpar) presentaron un riesgo más elevado de cardiopatía coronaria. Esto se aplicó exclusivamente a odontólogos (cociente de tasas de incidencia: 1,38), mientras que para los no odontólogos no pudo demostrarse la misma correlación (cociente de tasas de incidencia: 1,03). Los autores consideraron posible una asociación débil entre la inflamación de la pulpa y la cardiopatía coronaria28.
Jansson et al.27 agruparon diversos parámetros dentales (dientes ausentes, lesiones apicales, caries, pérdida ósea marginal) y describieron una relación significativa con cardiopatías coronarias letales. La periodontitis apical por sí sola no presentó esta correlación. Pero si se añade una lesión perirradicular a la suma total de la carga infecciosa («total burden of infection»), puede superarse el valor crítico.
Mattila et al.39 estudiaron el estado de salud oral (caries, periodontitis, lesiones apicales, pericoroni-tis) de 100 pacientes con infarto de miocardio agudo y de 102 sujetos de estudio del grupo de control. Los pacientes con infarto de miocardio presentaron un estado de salud oral considerablemente peor, pero no se desglosa-ron con detalle los hallazgos individuales. En 125 personas que había sufrido infarto de miocardio y 125 personas sanas, Willershausen et al.57 estudiaron la relación entre el infarto y las infecciones dentales crónicas. Los pacientes con infarto de miocardio presentaron un peor estado de salud oral con más dientes ausentes, menos dientes endodonciados y más lesiones periapicales. En cambio, la correlación entre el número de lesiones apicales y el nivel de PCR no fue significativa.
Grau et al.25 encontraron en 166 pacientes con isque-mia cerebrovascular aguda un número significativamente mayor de lesiones dentales (periodontitis apical, periodontitis marginal) que en los sujetos de estudio sanos. En cambio, si bien Meurman et al.40 observaron un peor estado de salud oral y un mayor nivel de marcadores de inflamación en la sangre de pacientes con cardiopatía coronaria que en los pacientes de control sanos, no pu-dieron establecer ninguna correlación con parámetros endodónticos (frecuencia de obturaciones de conductos radiculares o lesiones periapicales). Cotti et al.12 descu-brieron un incremento de los marcadores de inflamación en la sangre en presencia de una periodontitis apical, pero el examen cardiológico no reveló diferencias con pacientes sin periodontitis apical.
En 36 pacientes con ateromas de la arteria carótida detectables radiológicamente se detectaron más infeccio-nes dentales (periodontitis apical, lesiones de la furcación, lesiones cariosas cercanas a la pulpa, pericoronitis, defectos óseos verticales) que en las personas del gru-po de control sano. Por lo que respecta a la frecuencia de lesiones perirradiculares, no se constató ninguna di-ferencia significativa23. Los autores señalaron que la relación entre las infecciones dentales y las enfermedades cardiovasculares todavía no está esclarecida y que hasta ahora tan solo es posible especular. La hipótesis que pa-rece más probable actualmente es que aparecen en los vasos sanguíneos principalmente lesiones arterioescleró-ticas cuyo crecimiento es favorecido y acelerado por bac-teriemias recurrentes (de origen dental).
En un estudio transversal en mujeres de 38 a 84 años no se pudo establecer ninguna relación entre la cardiopatía coronaria y el número de lesiones periapicales24. Mattila et al.39 describieron una relación entre infecciones dentales (periodontales y endodontales) y la arterioes-clerosis coronaria en hombres, mientras que esta relación no pudo demostrarse en mujeres, posiblemente debido a un número de pacientes insuficiente.
A día de hoy todavía no se ha esclarecido si las infecciones endodontales están implicadas como causas úni-cas o simplemente como cofactores en la etiología y la patogénesis de enfermedades cardiovasculares, y si la can-tidad de la infección o la composición cualitativa de los microorganismos implicados desempeña el papel decisivo. Es probable una relación entre las dolencias endodontales y la cardiopatía coronaria, pero todavía no es posible cuantificar el alcance y la frecuencia.
En el tratamiento de pacientes con marcapasos, antes de la intervención es preciso determinar si pueden pro-ducirse interferencias con equipos eléctricos (determinación eléctrica de la longitud, equipos eléctricos para comprobar la sensibilidad, instrumentos de ultrasonidos). Los aparatos modernos para la determinación eléctrica de la longitud de trabajo endodóntica, los instrumentos de comprobación de la pulpa eléctricos y los aparatos de ultrasonidos (a excepción de los aparatos accionados magnetoestrictivamente) pueden utilizarse hoy en día con seguridad50,52. En casos de duda debería consultarse a un internista o cardiólogo.
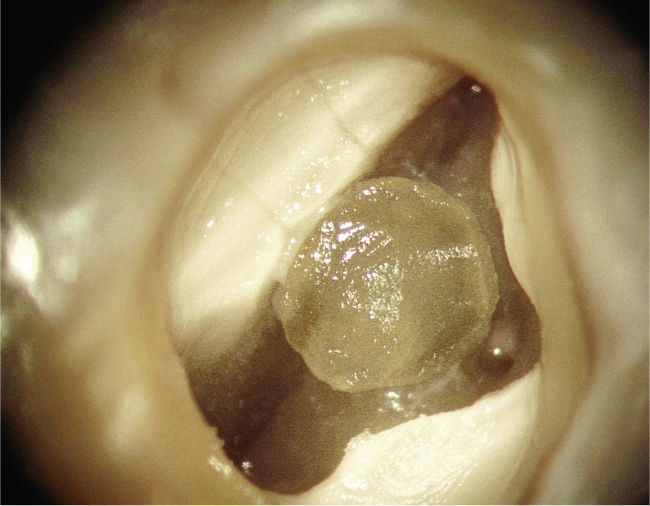
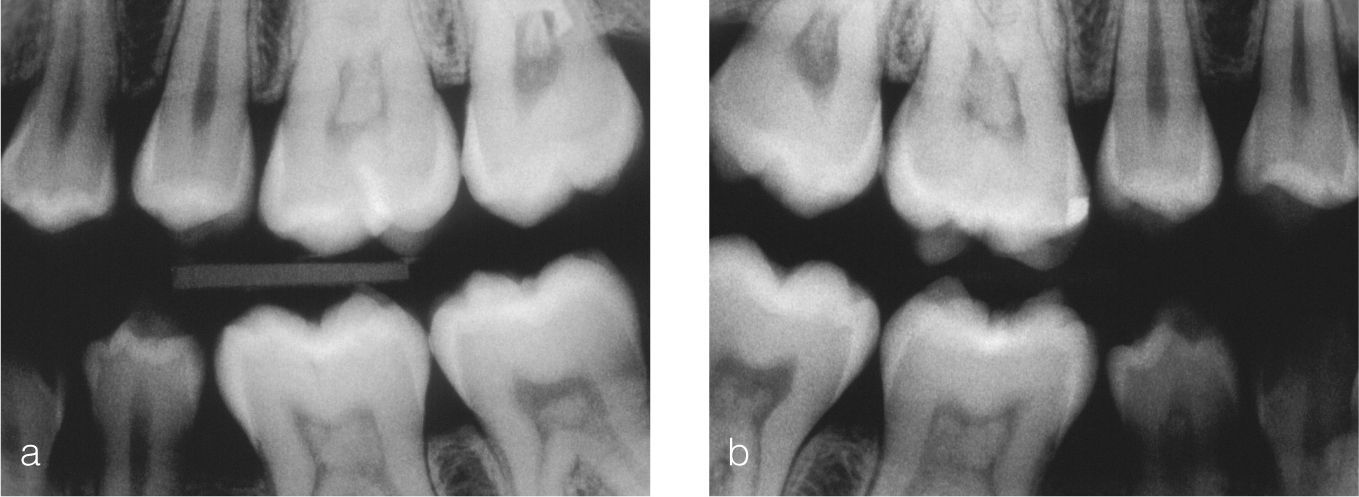
Dentículos y enfermedades generalesSin embargo, los hallazgos dentales también pueden re-velar indicios de enfermedades cardiovasculares, renales y otras (figs. 3–5):
- •
En pacientes con cardiopatía coronaria se observó la aparición frecuente de dentículos22.
- •
Se observó un mayor número de calcificaciones pul-pares en pacientes con arterioesclerosis coronaria42.
- •
Se determinaron la hipercalcemia, la gota y los cálcu-los renales como factores que predisponen a las calcificaciones de la pulpa51.
- •
En pacientes con enfermedades renales en estadio terminal se observaron con mayor frecuencia estrechamien-tos y calcificaciones de la cámara pulpar45 (fig. 6).
La presencia frecuente de dentículos intrapulpa-res puede constituir un indicio de la existencia de enfermedades sistémicas (cardiopatía coronaria, enfermedades renales, gota).