La capecitabina (Xeloda®) es un profármaco del 5-fluorouracilo (5-FU), aprobado en 2001 por la FDA para el tratamiento del cáncer de mama y colorrectal metastásico. Se administra por vía oral y tiene menor tasa de complicaciones sistémicas que su metabolito activo, el 5-FU. Sin embargo, los efectos adversos cutáneos son más frecuentes, entre los que se encuentran los trastornos de la pigmentación1. En los últimos años, se ha incrementado significativamente el empleo de este quimioterápico, lo que hace indispensable el conocimiento de sus efectos secundarios.
Presentamos 2pacientes que manifestaron distintos patrones de hiperpigmentación cutánea y de mucosa oral tras el tratamiento con capecitabina.
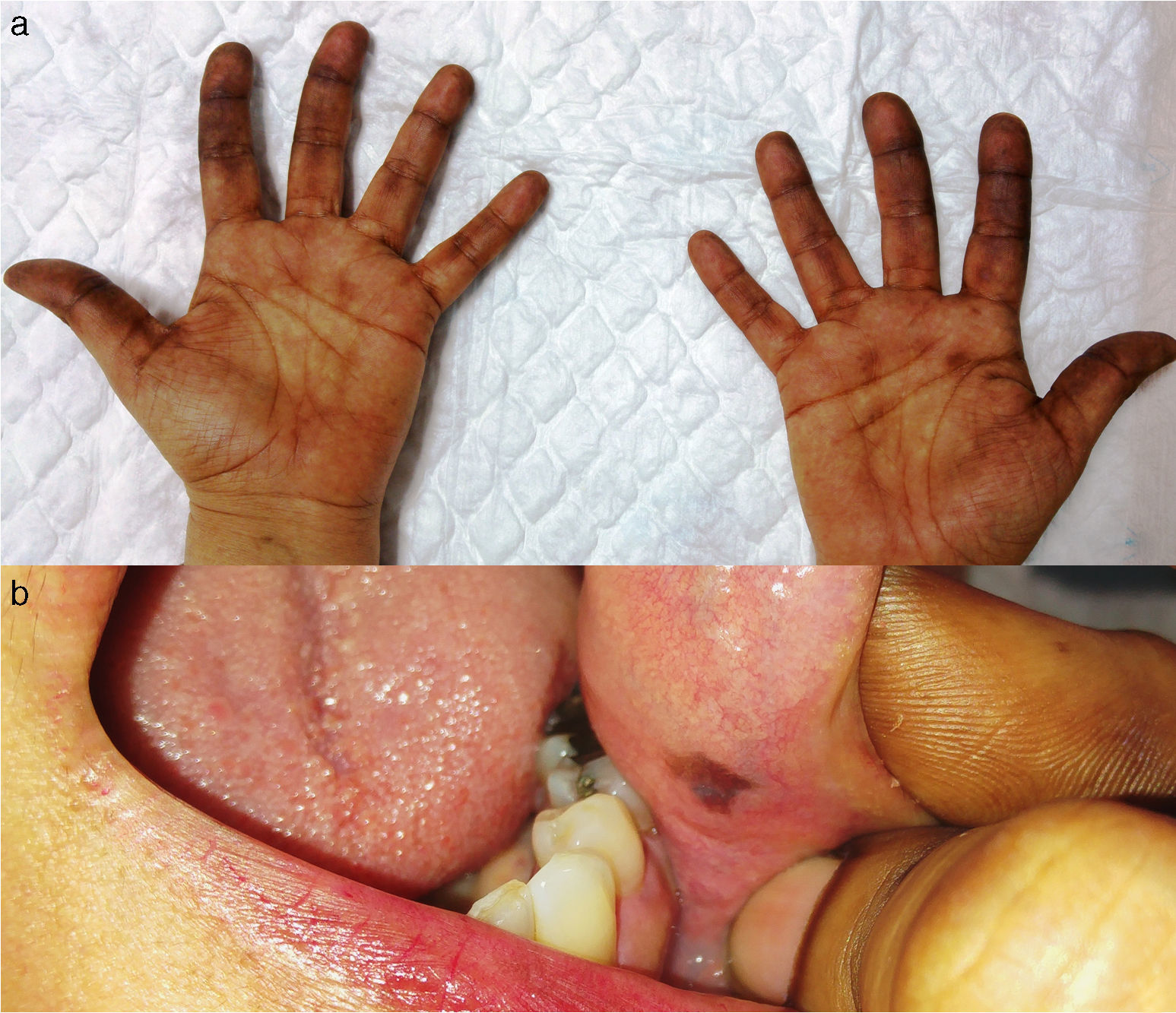
Caso 1Una mujer de 56 años de edad, diagnosticada de cáncer colorrectal metastásico que, tras el tercer ciclo de tratamiento con capecitabina, presentó hiperpigmentación palmo-plantar difusa, más marcada en los pliegues (fig. 1a). No asociaba eritema, descamación ni sintomatología dolorosa. Además, en la mucosa yugal se observó una única mácula marrón redondeada, de aproximadamente 4mm de bordes bien definidos (fig. 1b). Se realizó seguimiento, y se evidenció la desaparición de las lesiones cutáneas y mucosas 3meses después de que se suspendiera el fármaco por falta de eficacia.
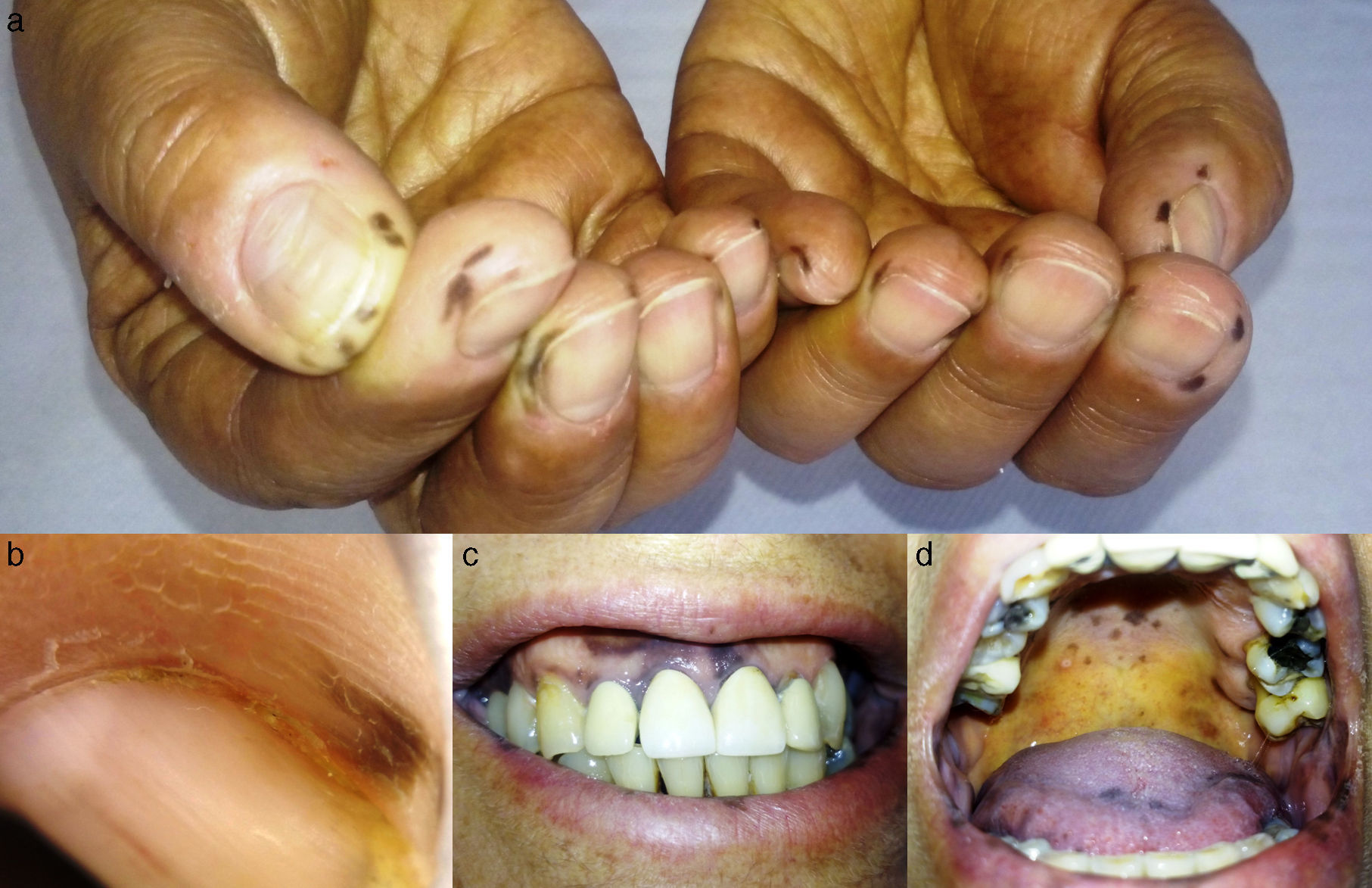
Caso 2Una mujer de 65 años de edad, diagnosticada de carcinoma de mama metastásico, consultó porque tras 2ciclos de tratamiento con capecitabina se evidenciaron múltiples máculas hiperpigmentadas marrones, de entre 1 y 8mm de diámetro, con bordes irregulares pero bien definidos, distribuidas en las palmas y plantas (fig. 2a). El estudio dermatoscópico de las lesiones acrales reveló un patrón homogéneo central y paralelo a la cresta periférico (fig. 2b). En la mucosa labial, gingival, yugal y palatina también se observaron lesiones maculosas con características clínicas similares (fig. 2c y d). Se propuso biopsia cutánea de una de las máculas palmares, que la paciente rechazó, por lo que se realizó seguimiento. Las lesiones cutáneas y mucosas se resolvieron 4 meses después de que se suspendiera el tratamiento por hipertransaminasemia intensa.
a) Máculas marrones redondeadas con márgenes bien definidos, de entre 2 y 8mm de diámetro, con localización periungueal; b) imagen dermatoscópica de una de las anteriores, que muestra patrón homogéneo central y paralelo a la cresta periférico; c) manchas hiperpigmentadas mal definidas en mucosa gingival y labial; d) máculas marrones en mucosa palatina y lingual.
La capecitabina es un antineoplásico de administración oral, que se transforma en 5-FU, su único metabolito activo, por la acción de la timidín fosforilasa. La concentración de esta enzima se encuentra aumentada en ciertos tejidos tumorales, pero también en los queratinocitos de la piel y las mucosas, lo que podría justificar su mayor tasa de efectos adversos cutáneos2. La eritrodisestesia palmo-plantar o síndrome mano-pie es el más frecuente y el que reviste mayor gravedad, y requiere en muchas ocasiones el descenso de la dosis o la suspensión del tratamiento3. Otras alteraciones cutáneas, tales como la alopecia, la mucositis, la inflamación de queratosis actínicas preexistentes o las alteraciones de la pigmentación, se presentan con menor frecuencia y en raras ocasiones justifican la modificación del tratamiento. Sin embargo, su conocimiento es fundamental para evitar alarmas innecesarias y mejorar la adherencia terapéutica.
Las alteraciones de la pigmentación aparecen en aproximadamente un 3% de los pacientes tratados con este fármaco4, y pueden adoptar diferentes patrones de presentación, en muchos casos con afectación acral5. Se trata de un efecto adverso poco frecuente, que requiere seguimiento, pero que no precisa la suspensión del fármaco.
La patogénesis no es bien conocida: se postula que el fármaco ejercería un efecto tóxico indirecto en las glándulas suprarrenales, originando un aumento en la secreción de melanotropina y una toxicidad directa en los melanocitos, que estimularía la síntesis de melanina6. Además, se sumaría un componente de pigmentación postinflamatoria7. Tampoco se conoce la causa del predominio acral de estas alteraciones.
La capecitabina se administra en ciclos de 2 semanas, con una de descanso entre ellos: los trastornos de la pigmentación aparecen tras los primeros ciclos de tratamiento y se resuelven espontáneamente unos meses después de su suspensión.
La hiperpigmentación generalizada difusa y la palmo-plantar difusa o en los pliegues constituyen las formas más frecuentes de presentación; son más habituales en los pacientes de fototipos oscuros y de sexo femenino. Estas hiperpigmentaciones se presentan de manera asintomática, tras los primeros ciclos del tratamiento, y se mantienen estables hasta su suspensión, momento en el que remiten progresivamente8. Existen casos publicados en los que el patrón acral difuso o en pliegues ha precedido a la aparición de un síndrome mano-pie, por lo que algunos autores proponen considerar este patrón de hiperpigmentación como un estadio incipiente de eritrodisestesia palmo-plantar, o bien un marcador de su posterior aparición. Sin embargo, el escaso número de casos descritos no permite establecer con seguridad esta secuencia, por lo que no se considera indicador suficiente para reducir la dosis o parar el tratamiento9,10. En el caso de nuestra paciente, la hiperpigmentación se mantuvo durante el tratamiento, sin clínica sugestiva de eritrodisestesia.
La erupción lentiginosa es menos frecuente, con tropismo palmo-plantar en la mayoría de las ocasiones. La lentiginosis eruptiva fue descrita por Hutchinson en 1986, secundaria a enfermedades ampollosas o en estados de inmunosupresión, relacionados con neoplasias, infección por el VIH o por fármacos8,11. El cuadro clínico consiste en la aparición de múltiples máculas marrones milimétricas, redondeadas y de contornos bien definidos tras los primeros ciclos de tratamiento, con afectación fundamentalmente palmo-plantar; siendo excepcionales las lesiones en las mucosas7. La dermatoscopia de estas lesiones puede revelar diversos patrones: homogéneo, en celosía, corona de glóbulos o paralelo a la cresta12–14. En el estudio histológico se describe mínimo aumento en el número de los melanocitos maduros, con hiperplasia de estos y melanización de la capa basal, con melanófagos en dermis7,8. Los hallazgos histológicos parecen corresponder a lentigos simples, más que a nevus melanocíticos verdaderos, con infrecuente visualización de melanocitos atípicos o de formación de nidos12,15. A pesar de los datos de atipia clínica o dermatoscópica que en ocasiones presentan estas lesiones, su curso clínico, con resolución completa tras la suspensión del fármaco, orienta a benignidad15. No se han descrito hasta el momento casos de trasformación maligna, pero algunos autores proponen la realización de biopsia cutánea en los casos en los que existan características clínicas o dermatoscópicas de atipia, y seguimiento en el resto8,12.
A nuestra paciente se le propuso realizar una biopsia cutánea, debido a los datos de atipia dermatoscópica, pero rechazó la intervención. Se realizó seguimiento, y se comprobó la resolución de las lesiones tras la suspensión de la quimioterapia.
La hiperpigmentación mucosa puede asociarse a los cuadros descritos o aparecer de manera aislada, constituyendo, en cualquier caso, una manifestación excepcional tras la administración de capecitabina16. Puede presentarse en las mucosas labial, gingival, yugal o palatina, en forma de máculas bien definidas, o de manera difusa. El diagnóstico diferencial debe realizarse con: pigmentación racial, síndrome de Laugier-Hunziker, melanosis macular, síndrome de Addison o síndrome de Peutz-Jeggers, entre otros8.
Otras alteraciones de la pigmentación descritas en la literatura son la melanoniquia longitudinal, la hiperpigmentación de zonas radiadas o la hiperpigmentación de las zonas fotoexpuestas en los pacientes con vitíligo17,18.
Se han presentado 2pacientes con diferentes tipos de hiperpigmentación tras el tratamiento con capecitabina; en ambos destaca la afectación mucosa, escasamente descrita en la literatura.
Es importante reconocer los distintos patrones de pigmentación por capecitabina para tener una actitud adecuada, debido al empleo cada vez mayor de este fármaco. En la mayoría de las ocasiones bastará con realizar un seguimiento e informar adecuadamente al paciente, al ser excepcional la necesidad de modificar o suspender el tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.