Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora
array:23 [ "pii" => "S0025775313006805" "issn" => "00257753" "doi" => "10.1016/j.medcli.2013.10.002" "estado" => "S300" "fechaPublicacion" => "2013-12-21" "aid" => "2743" "copyright" => "Elsevier España, S.L.. Todos los derechos reservados" "copyrightAnyo" => "2013" "documento" => "article" "crossmark" => 0 "subdocumento" => "fla" "cita" => "Med Clin. 2013;141:550-5" "abierto" => array:3 [ "ES" => false "ES2" => false "LATM" => false ] "gratuito" => false "lecturas" => array:2 [ "total" => 1512 "formatos" => array:3 [ "EPUB" => 6 "HTML" => 866 "PDF" => 640 ] ] "itemSiguiente" => array:18 [ "pii" => "S0025775313002595" "issn" => "00257753" "doi" => "10.1016/j.medcli.2013.03.015" "estado" => "S300" "fechaPublicacion" => "2013-12-21" "aid" => "2542" "copyright" => "Elsevier España, S.L." "documento" => "simple-article" "crossmark" => 0 "subdocumento" => "cor" "cita" => "Med Clin. 2013;141:556-7" "abierto" => array:3 [ "ES" => false "ES2" => false "LATM" => false ] "gratuito" => false "lecturas" => array:2 [ "total" => 1130 "formatos" => array:3 [ "EPUB" => 5 "HTML" => 623 "PDF" => 502 ] ] "es" => array:10 [ "idiomaDefecto" => true "cabecera" => "<span class="elsevierStyleTextfn">Carta al Editor</span>" "titulo" => "Hidrología Médica, una especialidad poco conocida" "tienePdf" => "es" "tieneTextoCompleto" => "es" "paginas" => array:1 [ 0 => array:2 [ "paginaInicial" => "556" "paginaFinal" => "557" ] ] "titulosAlternativos" => array:1 [ "en" => array:1 [ "titulo" => "Medical Hydrology, a unknown speciality" ] ] "contieneTextoCompleto" => array:1 [ "es" => true ] "contienePdf" => array:1 [ "es" => true ] "autores" => array:1 [ 0 => array:2 [ "autoresLista" => "Francisco Maraver, Iluminada Corvillo, Ana Isabel Martín-Megías, Francisco Armijo" "autores" => array:4 [ 0 => array:2 [ "nombre" => "Francisco" "apellidos" => "Maraver" ] 1 => array:2 [ "nombre" => "Iluminada" "apellidos" => "Corvillo" ] 2 => array:2 [ "nombre" => "Ana Isabel" "apellidos" => "Martín-Megías" ] 3 => array:2 [ "nombre" => "Francisco" "apellidos" => "Armijo" ] ] ] ] ] "idiomaDefecto" => "es" "EPUB" => "https://multimedia.elsevier.es/PublicationsMultimediaV1/item/epub/S0025775313002595?idApp=UINPBA00004N" "url" => "/00257753/0000014100000012/v1_201312070117/S0025775313002595/v1_201312070117/es/main.assets" ] "itemAnterior" => array:18 [ "pii" => "S0025775313005253" "issn" => "00257753" "doi" => "10.1016/j.medcli.2013.07.003" "estado" => "S300" "fechaPublicacion" => "2013-12-21" "aid" => "2674" "copyright" => "Elsevier España, S.L." "documento" => "simple-article" "crossmark" => 0 "subdocumento" => "crp" "cita" => "Med Clin. 2013;141:543-9" "abierto" => array:3 [ "ES" => false "ES2" => false "LATM" => false ] "gratuito" => false "lecturas" => array:2 [ "total" => 2098 "formatos" => array:3 [ "EPUB" => 7 "HTML" => 1257 "PDF" => 834 ] ] "es" => array:11 [ "idiomaDefecto" => true "cabecera" => "<span class="elsevierStyleTextfn">Conferencia clinicopatológica</span>" "titulo" => "Mujer de 40 años con cefalea y diplopía" "tienePdf" => "es" "tieneTextoCompleto" => "es" "paginas" => array:1 [ 0 => array:2 [ "paginaInicial" => "543" "paginaFinal" => "549" ] ] "titulosAlternativos" => array:1 [ "en" => array:1 [ "titulo" => "A 40-year-old woman with headache and diplopia" ] ] "contieneTextoCompleto" => array:1 [ "es" => true ] "contienePdf" => array:1 [ "es" => true ] "resumenGrafico" => array:2 [ "original" => 0 "multimedia" => array:7 [ "identificador" => "fig0005" "etiqueta" => "Figura 1" "tipo" => "MULTIMEDIAFIGURA" "mostrarFloat" => true "mostrarDisplay" => false "figura" => array:1 [ 0 => array:4 [ "imagen" => "gr1.jpeg" "Alto" => 625 "Ancho" => 1000 "Tamanyo" => 105116 ] ] "descripcion" => array:1 [ "es" => "<p id="spar0005" class="elsevierStyleSimplePara elsevierViewall">La tomografía computarizada craneal con contraste intravenoso mostró las cisternas basales libres y la línea media centrada. No se identificaron lesiones parenquimatosas ni captaciones anómalas de contraste.</p>" ] ] ] "autores" => array:1 [ 0 => array:2 [ "autoresLista" => "Josep Dalmau, Joan Berenguer, Albert Saiz" "autores" => array:3 [ 0 => array:2 [ "nombre" => "Josep" "apellidos" => "Dalmau" ] 1 => array:2 [ "nombre" => "Joan" "apellidos" => "Berenguer" ] 2 => array:2 [ "nombre" => "Albert" "apellidos" => "Saiz" ] ] ] ] ] "idiomaDefecto" => "es" "EPUB" => "https://multimedia.elsevier.es/PublicationsMultimediaV1/item/epub/S0025775313005253?idApp=UINPBA00004N" "url" => "/00257753/0000014100000012/v1_201312070117/S0025775313005253/v1_201312070117/es/main.assets" ] "es" => array:17 [ "idiomaDefecto" => true "cabecera" => "<span class="elsevierStyleTextfn">Investigación clínica y bioética</span>" "titulo" => "Uso de la simulación en la investigación clínica" "tieneTextoCompleto" => true "paginas" => array:1 [ 0 => array:2 [ "paginaInicial" => "550" "paginaFinal" => "555" ] ] "autores" => array:1 [ 0 => array:3 [ "autoresLista" => "Toni Monleón-Getino" "autores" => array:1 [ 0 => array:3 [ "nombre" => "Toni" "apellidos" => "Monleón-Getino" "email" => array:1 [ 0 => "amonleong@ub.edu" ] ] ] "afiliaciones" => array:1 [ 0 => array:2 [ "entidad" => "Departamento de Estadística, Universidad de Barcelona, Barcelona, España" "identificador" => "aff0005" ] ] ] ] "titulosAlternativos" => array:1 [ "en" => array:1 [ "titulo" => "Use of the simulation in the clinical investigation" ] ] "resumenGrafico" => array:2 [ "original" => 0 "multimedia" => array:7 [ "identificador" => "fig0015" "etiqueta" => "Figura 3" "tipo" => "MULTIMEDIAFIGURA" "mostrarFloat" => true "mostrarDisplay" => false "figura" => array:1 [ 0 => array:4 [ "imagen" => "gr3.jpeg" "Alto" => 1030 "Ancho" => 1328 "Tamanyo" => 172485 ] ] "descripcion" => array:1 [ "es" => "<p id="spar0025" class="elsevierStyleSimplePara elsevierViewall">Simulación de ensayo clínico con el programa ICEBERGSIM.</p>" ] ] ] "textoCompleto" => "<span class="elsevierStyleSections"><span id="sec0005" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0005">Introducción</span><span id="sec0010" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0010">Perspectiva actual en la Unión Europea</span><p id="par0005" class="elsevierStylePara elsevierViewall">La investigación clínica se orienta hacia la búsqueda y el desarrollo de fármacos y tecnologías sanitarias cada vez más eficaces y seguras, y que estas lleguen a los clínicos asistenciales y a los pacientes. Con el séptimo Programa Marco de Investigación 2007-2013 (VIIPM)<a class="elsevierStyleCrossRefs" href="#bib0005"><span class="elsevierStyleSup">1,2</span></a> la Unión Europea (UE) apostó, entre otros razonamientos, por la implantación de la simulación para optimizar las nuevas tecnologías sanitarias dedicando uno de los apartados a salud. En el Servicio de Información de CORDIS de la UE pueden verse las principales características de los proyectos<a class="elsevierStyleCrossRef" href="#bib0015"><span class="elsevierStyleSup">3</span></a> relacionados con la <span class="elsevierStyleItalic">clinical trial simulation</span> (CTS, «simulación de ensayos clínicos») por valor de unos 18 millones de euros dentro del VIIPM.</p><p id="par0010" class="elsevierStylePara elsevierViewall">También constan 345 proyectos de simulación en temas relacionados con la salud dentro del VIIPM, ya sea en realización o bien realizados. Estas cifras constatan que la UE apuesta por el uso de esta tecnología, no solo en el presente, sino en el futuro de la salud de sus ciudadanos, aunque con matices. Las técnicas de simulación deben usarse, entre otras muchas que hay, en procesos de validación interna de resultados y dentro de su justa medida.</p></span><span id="sec0015" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0015">Desarrollo clínico y uso de la simulación en salud. Situemos los ensayos clínicos</span><p id="par0015" class="elsevierStylePara elsevierViewall">El desarrollo clínico de un nuevo fármaco comprende la elaboración de ensayos clínicos con arreglo a un proceso de investigación secuencial y acumulativo de conocimientos estructurado en 4 fases (<a class="elsevierStyleCrossRef" href="#fig0005">fig. 1</a>). La información generada durante las fases iniciales del desarrollo clínico se utiliza para conocer mejor las características del fármaco y su comportamiento en el organismo humano, y así poder diseñar estudios posteriores que aporten la evidencia empírica y causal necesaria para establecer la seguridad y eficacia terapéutica de una determinada pauta posológica del fármaco en investigación. Una revisión extensa de las diferentes fases de un ensayo clínico puede encontrarse en Monleón (2009)<a class="elsevierStyleCrossRef" href="#bib0020"><span class="elsevierStyleSup">4</span></a>, y un resumen muy breve del mismo en la <a class="elsevierStyleCrossRef" href="#fig0005">figura 1</a>, donde pueden observarse las pruebas preclínicas previas al ensayo clínico de las fases <span class="elsevierStyleSmallCaps">i</span> a <span class="elsevierStyleSmallCaps">iii</span> y la fase <span class="elsevierStyleSmallCaps">iv</span> o de poscomercialización del fármaco, aunque existe bibliografía más específica<a class="elsevierStyleCrossRefs" href="#bib0025"><span class="elsevierStyleSup">5,6</span></a> que la que se presenta en este breve artículo. Estas fases pueden superponerse, pero se diferencian por sus objetivos<a class="elsevierStyleCrossRefs" href="#bib0035"><span class="elsevierStyleSup">7,8</span></a>, que pueden verse en la <a class="elsevierStyleCrossRef" href="#tbl0005">tabla 1</a>.</p><elsevierMultimedia ident="fig0005"></elsevierMultimedia><elsevierMultimedia ident="tbl0005"></elsevierMultimedia><p id="par0020" class="elsevierStylePara elsevierViewall">Por otra parte, el uso de modelos matemáticos como instrumentos de evaluación de alternativas es cada vez mayor en la evaluación económica de servicios y tecnologías sanitarias para la toma de decisiones en la gestión sanitaria. Hasta ahora se han usado fundamentalmente 2 tipos de modelos: 1) árboles de decisión, que han sido muy utilizados para las enfermedades de carácter agudo, y 2) modelos de Markov, que han sido usados en enfermedades crónicas o que presentan estados de salud recurrentes<a class="elsevierStyleCrossRef" href="#bib0025"><span class="elsevierStyleSup">5</span></a>. Sin embargo, tanto unos como otros presentan importantes limitaciones a la hora de modelar de forma realista ciertos procesos o enfermedades, y por ello está creciendo el interés y el uso de los modelos de simulación de episodios discretos<a class="elsevierStyleCrossRefs" href="#bib0045"><span class="elsevierStyleSup">9–11</span></a>, especialmente útil para extrapolar los resultados de los ensayos clínicos a la farmacoeconomía<a class="elsevierStyleCrossRef" href="#bib0060"><span class="elsevierStyleSup">12</span></a>.</p><p id="par0025" class="elsevierStylePara elsevierViewall">La CTS en el sentido del cálculo del tamaño de la muestra o del cálculo de la potencia estadística ha sido ampliamente utilizada en los últimos 15 años<a class="elsevierStyleCrossRefs" href="#bib0065"><span class="elsevierStyleSup">13,14</span></a>, especialmente en aquellos diseños experimentales complejos en que se empleaban diversas variables primarias y secundarias, y las repercusiones en el cálculo del tamaño de la muestra eran importantes. Un ejemplo de este tipo de estudios se halla en Sankok et al.<a class="elsevierStyleCrossRef" href="#bib0075"><span class="elsevierStyleSup">15</span></a>, y fue realizado bajo los auspicios de la <span class="elsevierStyleItalic">Food and Drug Administration</span> (FDA). Otros ejemplos de la aplicación de la simulación a los ensayos clínicos oncológicos, especialmente a optimizar su diseño y disminuir el tamaño muestral utilizando diseños secuenciales y análisis intermedios, se encuentran en Monleón et al. (2008)<a class="elsevierStyleCrossRef" href="#bib0020"><span class="elsevierStyleSup">4</span></a>. La FDA dedica también diversas recomendaciones del uso de la estadística bayesiana para la realización de ensayos de tipo secuencial <span class="elsevierStyleItalic">(interim analysis)</span> en la guía <span class="elsevierStyleItalic">Guidance for industry and FDA staff. Guidance for the use of bayesian statistics in medical device clinical trials</span><a class="elsevierStyleCrossRef" href="#bib0080"><span class="elsevierStyleSup">16</span></a>.</p><p id="par0030" class="elsevierStylePara elsevierViewall">El objetivo de este manuscrito es actualizar la información disponible sobre la implantación de la CTS, describir qué dicen las grandes agencias gubernamentales (FDA y <span class="elsevierStyleItalic">European Medicines Agency</span> [EMA]) sobre la cuestión, ver qué tipos de CTS y en qué tipos de ensayos se están utilizando, así como enumerar sus limitaciones. En el artículo se mostrará cómo realizar en la práctica una CTS y, finalmente, se presentará un apartado especial sobre la importancia de la estadística bayesiana en CTS.</p></span></span><span id="sec0020" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0020">Implantación actual de la tecnología. ¿Qué dicen las grandes agencias reguladoras <span class="elsevierStyleItalic">(Food and Drug Administration/European Medicines Agency)</span> sobre su uso?</span><p id="par0035" class="elsevierStylePara elsevierViewall">Una revisión sobre la implantación actual de la CTS se encuentra en la conferencia <span class="elsevierStyleItalic">Clinical trial simulations in the critical path initiative and regulatory decision making</span><a class="elsevierStyleCrossRef" href="#bib0085"><span class="elsevierStyleSup">17</span></a> que fue auspiciada por la FDA. En <span class="elsevierStyleItalic">Clinical trial simulations: Applications and trends</span><a class="elsevierStyleCrossRef" href="#bib0075"><span class="elsevierStyleSup">15</span></a> se presenta una interesante descripción pormenorizada de estudios de simulaciones y uso de modelización en los ensayos clínicos en áreas concretas como fármacos antidiabéticos (página 175), cardiovasculares (página 199), quimioterápicos, infecciones y resistencia a infecciones (página 251), psiquiátricos (página 329 y 345), y un interesante capítulo de fármacos de uso en Pediatría (página 401).</p><p id="par0040" class="elsevierStylePara elsevierViewall">La FDA en una de sus directrices<a class="elsevierStyleCrossRef" href="#bib0090"><span class="elsevierStyleSup">18</span></a> indica que reconoce que la planificación de ensayos se puede mejorar por CTS empleando modelos farmacológicos cuantitativos de exposición-respuesta, efectos en el grupo de placebo, y de progresión de la enfermedad. La FDA indica que le gustaría fomentar el uso de esta técnica para facilitar la exploración de alternativas de diseño de prueba para aumentar la probabilidad de éxito de los ensayos (<span class="elsevierStyleItalic">Guidance for industry. End-of-phase 2A meetings</span>, FDA<a class="elsevierStyleCrossRef" href="#bib0090"><span class="elsevierStyleSup">18</span></a>). En la <a class="elsevierStyleCrossRef" href="#tbl0010">tabla 2</a> pueden observarse algunos fármacos cuyas aprobaciones en la FDA han tenido en cuenta el uso de CTS<a class="elsevierStyleCrossRefs" href="#bib0085"><span class="elsevierStyleSup">17,19–21</span></a>.</p><elsevierMultimedia ident="tbl0010"></elsevierMultimedia><p id="par0045" class="elsevierStylePara elsevierViewall">No se han encontrado referencias sobre normativas explícitas de la EMA con respecto al uso de la CTS para la aprobación de un fármaco basadas o apoyadas por CTS. Solo se encontró una escueta referencia al uso de la simulación y la modelización en los ensayos clínicos: <span class="elsevierStyleItalic">«Modelling and simulation methodology provides an opportunity to improve the efficiency of medicine development, as well as to facilitate the regulatory assessment of medicines. It can be applied in a range of areas, including early medicine development, dose finding, clinical pharmacology, studying special populations, and the optimisation and analysis of pivotal clinical trials»</span><a class="elsevierStyleCrossRef" href="#bib0110"><span class="elsevierStyleSup">22</span></a>. A pesar de la ausencia de normativa de la EMA, esto no quiere decir que en las evaluaciones no se haga referencia a ello. Esta agencia ha realizado recientemente el <span class="elsevierStyleItalic">Workshop European Medicines Agency-European Federation of Pharmaceutical Industries and Associations modelling and simulation workshop</span><a class="elsevierStyleCrossRef" href="#bib0115"><span class="elsevierStyleSup">23</span></a> sobre esta temática.</p><p id="par0050" class="elsevierStylePara elsevierViewall">Otros ejemplos de ensayos clínicos recientes que han sido simulados previamente a su realización pueden verse en numerosos estudios<a class="elsevierStyleCrossRefs" href="#bib0025"><span class="elsevierStyleSup">5,24–26</span></a>, pero una buena recopilación de casos se encuentra en el libro editado por Kimko y Peck en 2011<a class="elsevierStyleCrossRef" href="#bib0105"><span class="elsevierStyleSup">21</span></a>, que ha sido comentado anteriormente. En Mandel et al. (2013)<a class="elsevierStyleCrossRef" href="#bib0120"><span class="elsevierStyleSup">24</span></a> se presenta un análisis que tiene como objetivo cuantificar el efecto de fingolimod, un tratamiento oral para la esclerosis múltiple remitente recidivante, en la progresión de la discapacidad. En Bruno et al. (2012)<a class="elsevierStyleCrossRef" href="#bib0125"><span class="elsevierStyleSup">25</span></a> se realizan diversas simulaciones de dosis de capacitabina y docetaxel en cáncer de mama metastásico antes de realizar un ensayo clínico de fase <span class="elsevierStyleSmallCaps">iii</span> pivotal de capacitabina y docetaxel a partir de los resultados de un ensayo fase <span class="elsevierStyleSmallCaps">ii</span>.</p><p id="par0055" class="elsevierStylePara elsevierViewall">Existe evidencia de que las CTS se encuentran incluidos en muy pocos protocolos de ensayos clínicos, pero la expansión de las capacidades de la industria cada vez es mayor, como puede comprobarse en la <a class="elsevierStyleCrossRef" href="#tbl0010">tabla 2</a>, más teniendo presente que un 40-45% de los proyectos con CTS de la industria farmacéutica se encuentran dentro de la fase <span class="elsevierStyleSmallCaps">i</span> a <span class="elsevierStyleSmallCaps">ii</span>a<a class="elsevierStyleCrossRef" href="#bib0075"><span class="elsevierStyleSup">15</span></a>, aunque estos datos deben tomarse con prudencia, ya que la cita es de 2007 y no se ha encontrado una actualización más reciente. En la <a class="elsevierStyleCrossRef" href="#tbl0010">tabla 2</a> no se indica en ningún caso que la aprobación del medicamento se haya basado en una CTS, sino que se ha utilizado como una información más y complementaria dentro de la evaluación global del fármaco. Hay que tener presente que las agencias también aceptan las extrapolaciones, el efecto clase y muchas otras asunciones en su toma de decisión para determinados aspectos de las condiciones de uso de un medicamento, y la CTS es un punto adicional en este largo y complejo proceso.</p><p id="par0060" class="elsevierStylePara elsevierViewall">Científicos de la FDA utilizan actualmente <span class="elsevierStyleItalic">software</span> de CTS (ver más adelante) para mejorar el modelado en un ensayo clínico cuantitativo. El objetivo suele ser mejorar el diseño del ensayo y predecir los resultados en base a la sistematización de la información vinculada a los resultados esperables, como puede verse en la <a class="elsevierStyleCrossRef" href="#fig0010">figura 2</a>.</p><elsevierMultimedia ident="fig0010"></elsevierMultimedia></span><span id="sec0025" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0025">Límites de la simulación de ensayos clínicos y dificultades para su generalización</span><p id="par0065" class="elsevierStylePara elsevierViewall">No todo son ventajas y la CTS no siempre puede utilizarse. En primer lugar, debe comentarse que la CTS no puede sustituir la realidad, solo ayudar; no haber hecho el experimento correcto no puede ser sustituido por una buena y correctísima CTS. Otra gran dificultad es que no existe un estándar para realizar CTS, no existe un manual que indique: en este caso debes hacer esto y en este otro caso debes hacer lo otro. Sí que existen manuales donde se presentan ejemplos, metodología, <span class="elsevierStyleItalic">software</span>, pero son tantos y tan variados tipos de ensayos clínicos, objetivos, datos, covariables, propiedades estocásticas de las variables de medida que es casi imposible generalizar todos los escenarios posibles.</p><p id="par0070" class="elsevierStylePara elsevierViewall">Por otra parte, hay que comentar que aunque se realice una correctísima CTS, en ciencia todo tiene una limitación y debemos conocer hasta dónde puede llegarse con esta metodología. El primer error o límite sería utilizar CTS para intentar predecir los resultados clínicos durante más tiempo del estudiado en el ensayo clínico, lo que puede no ser correcto: no debemos extrapolar las conclusiones extraídas fuera del rango de las observaciones utilizadas para construir el modelo en que se basa el ensayo clínico (por ejemplo, un modelo farmacológico farmacocinética/farmacodinamia [PK/PD]). Todas las hipótesis empleadas en estas extrapolaciones deben ser explícitamente formuladas y verificadas minuciosamente mediante el análisis de sensibilidad.</p></span><span id="sec0030" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0030">Tipos de simulaciones que se están utilizando actualmente y razón de su utilización</span><p id="par0075" class="elsevierStylePara elsevierViewall">Una clasificación general de los tipos de CTS, compartida por Kimko y Peck (2011)<a class="elsevierStyleCrossRef" href="#bib0105"><span class="elsevierStyleSup">21</span></a> y citada en el capítulo 1 de <span class="elsevierStyleItalic">Clinical trial simulation and quantitative pharmacology</span>, es la que diferencia los modelos según el propósito general de la CTS. En esta clasificación se distingue entre: 1) modelos donde se recogen objetivos relacionados con el ensayo y su ejecución, como los de tipo estadístico, que tienen que ver con el tamaño muestral o la potencia estadística; 2) modelos de progresión de la enfermedad, donde se tienen en cuenta los cambios fisiopatológicos de los sujetos durante el ensayo, y 3) modelos farmacológicos. Otra clasificación puede observarse en la <a class="elsevierStyleCrossRef" href="#tbl0015">tabla 3</a> y se ha adaptado de Lesko (2007)<a class="elsevierStyleCrossRef" href="#bib0085"><span class="elsevierStyleSup">17</span></a>; está referida a cuando se hace la simulación durante la modelización, durante la ejecución o bien durante el análisis de la ejecución del modelo.</p><elsevierMultimedia ident="tbl0015"></elsevierMultimedia><p id="par0080" class="elsevierStylePara elsevierViewall">Algunas de las principales razones para utilizar CTS serían las que se resumen en la <a class="elsevierStyleCrossRef" href="#tbl0020">tabla 4</a>, y van desde construir modelos integrados con diferentes variables principales, hasta tener en cuenta comportamientos no lineales de las variables de estudio, pasando por realizar predicciones o bien prever variaciones en la regulación que todavía no se han producido.</p><elsevierMultimedia ident="tbl0020"></elsevierMultimedia><p id="par0085" class="elsevierStylePara elsevierViewall">En la <a class="elsevierStyleCrossRef" href="#tbl0020">tabla 4</a> se presenta una razón novedosa para la realización de una CTS: evaluar posibles cambios normativos en ensayos clínicos por parte de las agencias reguladoras como, por ejemplo, diseños secuenciales novedosos y eficientes. Estas CTS pretenden facilitar la futura aprobación de diseños similares, como es el caso del realizado por Levin et al. (2011)<a class="elsevierStyleCrossRef" href="#bib0135"><span class="elsevierStyleSup">27</span></a>, donde se presenta un ensayo innovador, aleatorizado de fase <span class="elsevierStyleSmallCaps">ii</span>/<span class="elsevierStyleSmallCaps">iii,</span> de tenecteplasa frente a rt-PA para el accidente cerebrovascular isquémico agudo. Se realizaron más de 1.000 escenarios de simulación, cada uno involucrando 40.000 repeticiones para intentar demostrar la eficiencia de un novedoso diseño secuencial con un nuevo criterio de parada, obteniéndose resultados muy interesantes.</p></span><span id="sec0035" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0035">Simulación de un ensayo clínico</span><p id="par0090" class="elsevierStylePara elsevierViewall">Para simular un ensayo clínico existen muchas metodologías, tipos, programas informáticos, etc. Una amplia revisión puede encontrarse en Monleón y Ocaña (2006)<a class="elsevierStyleCrossRef" href="#bib0010"><span class="elsevierStyleSup">2</span></a>, donde se explica la simulación de diversos ensayos clínicos con objetivos diversos, como el cálculo del tamaño muestral o simplemente con objetivos PK/PD. A su vez, una buena descripción de la base matemática de cómo simular ensayos clínicos basados en modelización de efectos fijos, lineales generalizados y no lineales puede encontrarse en el libro <span class="elsevierStyleItalic">Pharmacometrics: The science of quantitative pharmacology</span> (páginas 103 a 136), en el apartado dedicado a <span class="elsevierStyleItalic">Linear, generalized linear, and nonlinear mixed effect models</span><a class="elsevierStyleCrossRef" href="#bib0140"><span class="elsevierStyleSup">28</span></a>.</p><p id="par0095" class="elsevierStylePara elsevierViewall">Una metodología habitual para simular ensayos clínicos es crear una sintaxis o unas librerías utilizando la sintaxis de un paquete estadístico profesional; así, en el trabajo de Monleón y Ocaña (2006)<a class="elsevierStyleCrossRef" href="#bib0010"><span class="elsevierStyleSup">2</span></a> se utilizó el paquete estadístico SAS<a class="elsevierStyleCrossRef" href="#bib0145"><span class="elsevierStyleSup">29</span></a> para llevar a cabo las simulaciones, o bien un programa informático que ejecuta modelos de simulación de episodios discretos realizado en C (LeanSim<a class="elsevierStyleCrossRef" href="#bib0150"><span class="elsevierStyleSup">30</span></a>, Universidad Politécnica de Cataluña). Otro artículo interesante que explica la simulación de un ensayo clínico de fase <span class="elsevierStyleSmallCaps">iii</span> puede verse en Monleón et al. (2004)<a class="elsevierStyleCrossRef" href="#bib0155"><span class="elsevierStyleSup">31</span></a>, donde se utilizó un modelo lineal de efectos mixtos para aproximar la respuesta al fármaco. Las macros de SAS específicas para la realización de ensayos clínicos farmacológicos pueden encontrarse en la Unidad de Bioestadística de la <span class="elsevierStyleItalic">School of Public Health</span> de la <span class="elsevierStyleItalic">University of Minnesota</span><a class="elsevierStyleCrossRef" href="#bib0160"><span class="elsevierStyleSup">32</span></a>. Pueden encontrarse sintaxis estadísticas para crear CTS en paquetes estadísticos gratuitos y ampliamente difundidos, como en R Package o en C<a class="elsevierStyleCrossRefs" href="#bib0165"><span class="elsevierStyleSup">33,34</span></a>.</p><p id="par0100" class="elsevierStylePara elsevierViewall">Algunos programas informáticos, como ICEBERGSIM-<span class="elsevierStyleItalic">Clinical Trial Simulator</span><a class="elsevierStyleCrossRef" href="#bib0175"><span class="elsevierStyleSup">35</span></a>, son gratuitos y han sido creados gracias al VI Programa Marco de la UE para permitir a la industria farmacéutica incorporar esta tecnología. Este programa informático ha sido creado por el consorcio Practihc <span class="elsevierStyleItalic">(Pragmatic Randomized Controlled Trials in Healthcare)</span>, que es una acción financiada por la UE, que proporciona herramientas de libre acceso, y la capacitación y orientación a los investigadores en los países en desarrollo que estén interesados en realizar CTS. Este programa informático permite simular decisiones y estimaciones de parámetros clínicos (como la tasa de respuesta del medicamento ensayado) realizadas utilizando datos obtenidos en ensayos clínicos anteriores. Se puede calcular el número de pacientes y la potencia estadística que se debería utilizar. Se puede utilizar también para determinar y mostrar las consecuencias de diferentes decisiones de los ensayos clínicos.</p><p id="par0105" class="elsevierStylePara elsevierViewall">Los usuarios también pueden especificar las proporciones de pacientes que podrían abandonar el seguimiento o no podrían cumplir con sus tratamientos. En la <a class="elsevierStyleCrossRef" href="#fig0015">figura 3</a> puede verse una simulación de un sencillo ensayo clínico aleatorizado (grupo control y grupo tratado) con el programa ICEBERGSIM, donde la <span class="elsevierStyleItalic">relative risk reduction</span> (RRR, «reducción del riesgo relativo») es de 26,1% para el grupo de interés (tratamiento) frente al grupo control. En esta figura puede verse también el intervalo de confianza del RRR frente al valor p de significación para la variable principal del modelo. Se ha utilizado un determinado nivel de significación, potencia, tasa de abandonos, nivel de cumplimiento, etc. Esto permite determinar mejor el número de pacientes necesario para el ensayo y las consecuencias de los diferentes escenarios de lo que pasaría si el ensayo clínico no fuera bien.</p><elsevierMultimedia ident="fig0015"></elsevierMultimedia><p id="par0110" class="elsevierStylePara elsevierViewall">Otro programa informático comercial muy difundido, especialmente en EE. UU., para la realización de CTS es el <span class="elsevierStyleItalic">Pharsight Trial Simulator</span><a class="elsevierStyleCrossRef" href="#bib0180"><span class="elsevierStyleSup">36</span></a>, que permite definir y probar modelos de fármacos interactivos, explorar y comunicar los atributos de diseño del estudio, y la realización de análisis estadísticos y de sensibilidad a través de resúmenes gráficos y estadísticos.</p></span><span id="sec0040" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0040">¿Cómo añadir nuestra experiencia clínica anterior a un nuevo ensayo clínico?</span><p id="par0115" class="elsevierStylePara elsevierViewall">El Teorema de Bayes permite calcular la probabilidad de que ocurra un suceso, condicionada a la ocurrencia de otro anterior (probabilidad condicionada). Una aplicación del Teorema de Bayes es el estudio de las pruebas diagnósticas, ya que es la base para los cálculos de sensibilidad, especificidad y los valores predictivos. La novedad de aplicar la metodología bayesiana en la práctica médica consiste en tener en cuenta información externa previa o «probabilidad a priori», y calcular cómo se modifica mediante la evidencia o «verosimilitud» proporcionada por determinadas pruebas empíricas, para obtener una nueva probabilidad condicionada por la evidencia empírica o «probabilidad a posteriori». También permite realizar análisis secuenciales (la observación repetida de determinado suceso un número de veces no fijadas de antemano) e incorporar al razonamiento las probabilidades subjetivas<a class="elsevierStyleCrossRefs" href="#bib0185"><span class="elsevierStyleSup">37,38</span></a>.</p><p id="par0120" class="elsevierStylePara elsevierViewall">La FDA<a class="elsevierStyleCrossRef" href="#bib0095"><span class="elsevierStyleSup">19</span></a> indica que algunas estrategias de modelado y CTS se prestan a un enfoque bayesiano que podría ser útil. La probabilidad predictiva bayesiana depende de las probabilidades de los resultados condicionados a los que se ha observado hasta un punto intermedio (análisis intermedio, <span class="elsevierStyleItalic">interim analysis</span>, corte de datos), puede ayudar a la hora de decidir si se debe continuar el estudio, aumentar el tamaño muestral o bien parar<a class="elsevierStyleCrossRef" href="#bib0080"><span class="elsevierStyleSup">16</span></a>. De esta manera el diseño del estudio es todavía capaz de mantener el control sobre el error de tipo <span class="elsevierStyleSmallCaps">i</span> (falso positivo) en el diseño frecuentista.</p><p id="par0125" class="elsevierStylePara elsevierViewall">Una revisión muy interesante sobre el uso del Teorema de Bayes en los ensayos clínicos aparece en Vallvé (2003)<a class="elsevierStyleCrossRef" href="#bib0195"><span class="elsevierStyleSup">39</span></a>. La idea básica es que nunca comenzamos un estudio sin un conocimiento previo de la enfermedad y de su tratamiento. Los datos que resultarán de dicho estudio se utilizarán para modificar nuestros conocimientos previos, así:</p><p id="par0130" class="elsevierStylePara elsevierViewall">Probabilidad posterior<span class="elsevierStyleHsp" style=""></span>=<span class="elsevierStyleHsp" style=""></span>constante<span class="elsevierStyleHsp" style=""></span>×<span class="elsevierStyleHsp" style=""></span>verosimilitud<span class="elsevierStyleHsp" style=""></span>×<span class="elsevierStyleHsp" style=""></span>probabilidad previa</p><p id="par0135" class="elsevierStylePara elsevierViewall">Por ejemplo, si hay que planificar un nuevo ensayo clínico donde el objetivo principal es la tasa de respuesta de un nuevo medicamento (n<span class="elsevierStyleHsp" style=""></span>=<span class="elsevierStyleHsp" style=""></span>20 pacientes), podemos utilizar la experiencia anterior de otros ensayos clínicos para simular la tasa de respuestas del nuevo grupo. Debe contarse con información relevante, como saber que en un ensayo anterior ha obtenido una tasa de respuestas del 40% (<span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>=<span class="elsevierStyleHsp" style=""></span>0, 4), y teniendo datos de cuál es la distribución de probabilidades de <span class="elsevierStyleItalic">θ</span>:</p><p id="par0140" class="elsevierStylePara elsevierViewall"><span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>→<span class="elsevierStyleHsp" style=""></span><span class="elsevierStyleItalic">Beta</span>(<span class="elsevierStyleItalic">α</span>, <span class="elsevierStyleItalic">β</span>), distribución de probabilidades beta, la tasa de respuesta <span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>∈<span class="elsevierStyleHsp" style=""></span>(0, 1)</p><p id="par0145" class="elsevierStylePara elsevierViewall">En el estudio clínico previo, se determinó que <span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>=<span class="elsevierStyleHsp" style=""></span>0, 4 y <span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>→<span class="elsevierStyleHsp" style=""></span><span class="elsevierStyleItalic">Beta</span>(9.2, 13.8)</p><p id="par0150" class="elsevierStylePara elsevierViewall">Aplicando el criterio del Teorema de Bayes:<elsevierMultimedia ident="eq0005"></elsevierMultimedia></p><p id="par0155" class="elsevierStylePara elsevierViewall">Determinamos, utilizando un método bayesiano computacional con WINBUGS<a class="elsevierStyleCrossRef" href="#bib0200"><span class="elsevierStyleSup">40</span></a> (Markov chain Monte Carlo), que la probabilidad para tener una tasa de respuesta (<span class="elsevierStyleItalic">θ</span>) superior o igual a 15 en 20 pacientes (tasa de respuesta del 75% o <span class="elsevierStyleItalic">θ</span><span class="elsevierStyleHsp" style=""></span>≥<span class="elsevierStyleHsp" style=""></span>0, 75) es de 0,151, es decir, muy baja.</p></span><span id="sec0045" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0045">Conclusiones</span><p id="par0160" class="elsevierStylePara elsevierViewall">La modelización y la CTS mejoran la eficiencia del desarrollo de los nuevos medicamentos y, en general, de las tecnologías sanitarias.</p><p id="par0165" class="elsevierStylePara elsevierViewall">Para que la CTS tenga éxito debe existir una teoría biológica detrás del modelo, es decir, un proceso de modelado con vínculos causales que explique el proceso de acción del fármaco y su eficacia y eficiencia.</p><p id="par0170" class="elsevierStylePara elsevierViewall">Una metodología habitual para simular ensayos clínicos es crear una sintaxis o unas librerías utilizando un paquete estadístico profesional.</p><p id="par0175" class="elsevierStylePara elsevierViewall">El marco bayesiano proporciona una forma de postular modelos para el diseño del estudio y las opciones de adaptación que probabilísticamente podrían ocurrir, y es especialmente útil en los ensayos clínicos secuenciales.</p></span><span id="sec0050" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0050">Información adicional</span><p id="par0180" class="elsevierStylePara elsevierViewall">La sección Investigación clínica y bioética (ICB) es una iniciativa de la Sociedad Española de Farmacología Clínica (SEFC) dirigida a todos aquellos profesionales interesados en la investigación clínica y la ética de la investigación. El objetivo del ICB es apoyar el adecuado desarrollo de la investigación clínica en España (<a href="http://www.se-fc.org/icbdigital">www.se-fc.org/icbdigital</a>).</p><p id="par0185" class="elsevierStylePara elsevierViewall">Las siguientes instituciones colaboran de forma desinteresada en esta sección: Chiesi España, Grünenthal España, Gilead Sciences, Bayer HealthCare, PharmaMar, Roche Farma y AstraZeneca.</p></span><span id="sec0055" class="elsevierStyleSection elsevierViewall"><span class="elsevierStyleSectionTitle" id="sect0055">Conflicto de intereses</span><p id="par0190" class="elsevierStylePara elsevierViewall">Los autores declaran no tener ningún conflicto de intereses.</p></span></span>" "textoCompletoSecciones" => array:1 [ "secciones" => array:11 [ 0 => array:3 [ "identificador" => "sec0005" "titulo" => "Introducción" "secciones" => array:2 [ 0 => array:2 [ "identificador" => "sec0010" "titulo" => "Perspectiva actual en la Unión Europea" ] 1 => array:2 [ "identificador" => "sec0015" "titulo" => "Desarrollo clínico y uso de la simulación en salud. Situemos los ensayos clínicos" ] ] ] 1 => array:2 [ "identificador" => "sec0020" "titulo" => "Implantación actual de la tecnología. ¿Qué dicen las grandes agencias reguladoras (Food and Drug Administration/European Medicines Agency) sobre su uso?" ] 2 => array:2 [ "identificador" => "sec0025" "titulo" => "Límites de la simulación de ensayos clínicos y dificultades para su generalización" ] 3 => array:2 [ "identificador" => "sec0030" "titulo" => "Tipos de simulaciones que se están utilizando actualmente y razón de su utilización" ] 4 => array:2 [ "identificador" => "sec0035" "titulo" => "Simulación de un ensayo clínico" ] 5 => array:2 [ "identificador" => "sec0040" "titulo" => "¿Cómo añadir nuestra experiencia clínica anterior a un nuevo ensayo clínico?" ] 6 => array:2 [ "identificador" => "sec0045" "titulo" => "Conclusiones" ] 7 => array:2 [ "identificador" => "sec0050" "titulo" => "Información adicional" ] 8 => array:2 [ "identificador" => "sec0055" "titulo" => "Conflicto de intereses" ] 9 => array:2 [ "identificador" => "xack69533" "titulo" => "Agradecimientos" ] 10 => array:1 [ "titulo" => "Bibliografía" ] ] ] "pdfFichero" => "main.pdf" "tienePdf" => true "fechaRecibido" => "2013-09-13" "fechaAceptado" => "2013-10-17" "multimedia" => array:8 [ 0 => array:7 [ "identificador" => "fig0005" "etiqueta" => "Figura 1" "tipo" => "MULTIMEDIAFIGURA" "mostrarFloat" => true "mostrarDisplay" => false "figura" => array:1 [ 0 => array:4 [ "imagen" => "gr1.jpeg" "Alto" => 1077 "Ancho" => 1619 "Tamanyo" => 119975 ] ] "descripcion" => array:1 [ "es" => "<p id="spar0005" class="elsevierStyleSimplePara elsevierViewall">Esquema de las diferentes fases del desarrollo de un fármaco: las preclínicas, las clínicas <span class="elsevierStyleSmallCaps">i</span> a <span class="elsevierStyleSmallCaps">iii,</span> y la fase <span class="elsevierStyleSmallCaps">iv</span> o de poscomercialización del fármaco.</p> <p id="spar0010" class="elsevierStyleSimplePara elsevierViewall">PK/PD: farmacocinética/farmacodinamia.</p>" ] ] 1 => array:7 [ "identificador" => "fig0010" "etiqueta" => "Figura 2" "tipo" => "MULTIMEDIAFIGURA" "mostrarFloat" => true "mostrarDisplay" => false "figura" => array:1 [ 0 => array:4 [ "imagen" => "gr2.jpeg" "Alto" => 1481 "Ancho" => 2167 "Tamanyo" => 175754 ] ] "descripcion" => array:1 [ "es" => "<p id="spar0015" class="elsevierStyleSimplePara elsevierViewall">Esquema de simulación de ensayos clínicos.</p> <p id="spar0020" class="elsevierStyleSimplePara elsevierViewall">R: <span class="elsevierStyleItalic">R Project for Statistical Computing</span>; SAS: <span class="elsevierStyleItalic">Statistical Analysis Systems</span>; SPSS: <span class="elsevierStyleItalic">Statistical Package for the Social Sciences</span>.</p>" ] ] 2 => array:7 [ "identificador" => "fig0015" "etiqueta" => "Figura 3" "tipo" => "MULTIMEDIAFIGURA" "mostrarFloat" => true "mostrarDisplay" => false "figura" => array:1 [ 0 => array:4 [ "imagen" => "gr3.jpeg" "Alto" => 1030 "Ancho" => 1328 "Tamanyo" => 172485 ] ] "descripcion" => array:1 [ "es" => "<p id="spar0025" class="elsevierStyleSimplePara elsevierViewall">Simulación de ensayo clínico con el programa ICEBERGSIM.</p>" ] ] 3 => array:7 [ "identificador" => "tbl0005" "etiqueta" => "Tabla 1" "tipo" => "MULTIMEDIATABLA" "mostrarFloat" => true "mostrarDisplay" => false "tabla" => array:1 [ "tablatextoimagen" => array:1 [ 0 => array:2 [ "tabla" => array:1 [ 0 => """ <table border="0" frame="\n \t\t\t\t\tvoid\n \t\t\t\t" class=""><thead title="thead"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-head\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t" style="border-bottom: 2px solid black">Fase del ensayo clínico \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-head\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t" style="border-bottom: 2px solid black">Objetivo \t\t\t\t\t\t\n \t\t\t\t</td></tr></thead><tbody title="tbody"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Fase I \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Pretenden demostrar seguridad de la molécula y orientar hacia la pauta de administración más adecuada para fases posteriores \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Fase II \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Pretenden obtener información preliminar sobre la eficacia del producto y establecer la relación dosis-respuesta. Son estudios terapéuticos exploratorios \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Fase III \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Evalúan la eficacia y seguridad del tratamiento experimental en las condiciones de uso habituales y con respecto a las alternativas terapéuticas disponibles para la indicación estudiada. Son estudios terapéuticos de confirmación \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Fase IV \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Estudian la efectividad y seguridad en la utilización clínica diaria, así como condiciones de uso diferentes a las autorizadas, como nuevas indicaciones \t\t\t\t\t\t\n \t\t\t\t</td></tr></tbody></table> """ ] "imagenFichero" => array:1 [ 0 => "xTab433647.png" ] ] ] ] "descripcion" => array:1 [ "es" => "<p id="spar0030" class="elsevierStyleSimplePara elsevierViewall">Objetivos de las diferentes fases de un ensayo clínico</p>" ] ] 4 => array:7 [ "identificador" => "tbl0010" "etiqueta" => "Tabla 2" "tipo" => "MULTIMEDIATABLA" "mostrarFloat" => true "mostrarDisplay" => false "tabla" => array:2 [ "leyenda" => "<p id="spar0040" class="elsevierStyleSimplePara elsevierViewall">Fuente: Monleón et al.<a class="elsevierStyleCrossRef" href="#bib0050"><span class="elsevierStyleSup">10</span></a></p>" "tablatextoimagen" => array:1 [ 0 => array:2 [ "tabla" => array:1 [ 0 => """ <table border="0" frame="\n \t\t\t\t\tvoid\n \t\t\t\t" class=""><thead title="thead"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-head\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t" style="border-bottom: 2px solid black">Escenario \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-head\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t" style="border-bottom: 2px solid black">¿Que se solicitaba en el registro del fármaco? \t\t\t\t\t\t\n \t\t\t\t</td></tr></thead><tbody title="tbody"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Aprobación pediátrica de trileptal \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Indicación como monoterapia y dosis sin eficacia clínica \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Aprobación de un subgrupo de ácido zoledrónico \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Aprobación para la dosificación en insuficiencia renal con estudio clínico \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Evaluación de la seguridad de busulfán en pacientes pediátricos \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Recomendaciones de etiquetado para la monitorización terapéutica de fármacos sin estudio clínico \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Bloqueador del canal de calcio debido a la dosificación \t\t\t\t\t\t\n \t\t\t\t</td><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">Aprobación de dosificación más óptima con nuevos ensayos \t\t\t\t\t\t\n \t\t\t\t</td></tr></tbody></table> """ ] "imagenFichero" => array:1 [ 0 => "xTab433646.png" ] ] ] ] "descripcion" => array:1 [ "es" => "<p id="spar0035" class="elsevierStyleSimplePara elsevierViewall">Algunos fármacos cuyas aprobaciones en la <span class="elsevierStyleItalic">Food and Drug Administration</span> han sido complementadas con simulación de ensayos clínicos<a class="elsevierStyleCrossRef" href="#bib0050"><span class="elsevierStyleSup">10</span></a></p>" ] ] 5 => array:7 [ "identificador" => "tbl0015" "etiqueta" => "Tabla 3" "tipo" => "MULTIMEDIATABLA" "mostrarFloat" => true "mostrarDisplay" => false "tabla" => array:2 [ "leyenda" => "<p id="spar0050" class="elsevierStyleSimplePara elsevierViewall">PK-PD: farmacocinética/farmacodinamia.</p><p id="spar0055" class="elsevierStyleSimplePara elsevierViewall">Fuente: Lesko<a class="elsevierStyleCrossRef" href="#bib0085"><span class="elsevierStyleSup">17</span></a>.</p>" "tablatextoimagen" => array:1 [ 0 => array:2 [ "tabla" => array:1 [ 0 => """ <table border="0" frame="\n \t\t\t\t\tvoid\n \t\t\t\t" class=""><tbody title="tbody"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">1. Modelo de desarrollo: modelos PK-PD, a veces relacionados con la progresión de la enfermedad y el efecto del placebo, donde se tienen en cuenta modelos con covariables, la variabilidad, la respuesta del placebo, etc. \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">2. Ejecución del modelo: simular los ensayos clínicos con el fin de dar respuestas a preguntas específicas: la dosis óptima, la probabilidad de beneficio o riesgo, el tamaño de la muestra, los efectos del abandono de la medicación (incumplimiento) y la respuesta placebo \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">3. Análisis de ejecución: visualizar los datos, cualificar biomarcadores, análisis de sensibilidad de las características de diseño, informar de las decisiones tomadas, etc. \t\t\t\t\t\t\n \t\t\t\t</td></tr></tbody></table> """ ] "imagenFichero" => array:1 [ 0 => "xTab433649.png" ] ] ] ] "descripcion" => array:1 [ "es" => "<p id="spar0045" class="elsevierStyleSimplePara elsevierViewall">Tipos de simulación de ensayos clínicos según Lesko (2007)</p>" ] ] 6 => array:7 [ "identificador" => "tbl0020" "etiqueta" => "Tabla 4" "tipo" => "MULTIMEDIATABLA" "mostrarFloat" => true "mostrarDisplay" => false "tabla" => array:2 [ "leyenda" => "<p id="spar0065" class="elsevierStyleSimplePara elsevierViewall">Fuente: Lesko<a class="elsevierStyleCrossRef" href="#bib0085"><span class="elsevierStyleSup">17</span></a>.</p>" "tablatextoimagen" => array:1 [ 0 => array:2 [ "tabla" => array:1 [ 0 => """ <table border="0" frame="\n \t\t\t\t\tvoid\n \t\t\t\t" class=""><tbody title="tbody"><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">1. Para replicar el comportamiento de los procesos modelados y realizar predicciones (por ejemplo, acerca de la dosis óptima) \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">2. Para construir modelos integrados con más variables (por ejemplo, el cambio longitudinal [tiempo] en biomarcadores) \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">3. Visualizar las relaciones no lineales entre variables (por ejemplo, la exposición y el beneficio o riesgo) \t\t\t\t\t\t\n \t\t\t\t</td></tr><tr title="table-row"><td class="td" title="\n \t\t\t\t\ttable-entry\n \t\t\t\t " align="left" valign="\n \t\t\t\t\ttop\n \t\t\t\t">4. Marco normativo: para evaluar posibles cambios normativos en ensayos clínicos por parte de las agencias reguladoras como, por ejemplo, diseños secuenciales novedosos, y facilitar la futura aprobación de diseños similares \t\t\t\t\t\t\n \t\t\t\t</td></tr></tbody></table> """ ] "imagenFichero" => array:1 [ 0 => "xTab433648.png" ] ] ] ] "descripcion" => array:1 [ "es" => "<p id="spar0060" class="elsevierStyleSimplePara elsevierViewall">Razones para utilizar la simulación de ensayos clínicos según Lesko (2007)</p>" ] ] 7 => array:5 [ "identificador" => "eq0005" "tipo" => "MULTIMEDIAFORMULA" "mostrarFloat" => false "mostrarDisplay" => true "Formula" => array:5 [ "Matematica" => "Probabilidad   posterior=constante×verosimilitud×probabilidad   previa" "Fichero" => "si1.jpeg" "Tamanyo" => 4852 "Alto" => 41 "Ancho" => 361 ] ] ] "bibliografia" => array:2 [ "titulo" => "Bibliografía" "seccion" => array:1 [ 0 => array:2 [ "identificador" => "bibs0005" "bibliografiaReferencia" => array:40 [ 0 => array:3 [ "identificador" => "bib0005" "etiqueta" => "1" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Fundación Española para la Ciencia y la Tecnología. Oficina Europea. Programa Marco. Sector Salud [consultado 1 Jul 2013]. Disponible en: <a id="intr0010" class="elsevierStyleInterRef" href="http://www.oficinaeuropea.es/programa-marco/cooperacion/salud">http://www.oficinaeuropea.es/programa-marco/cooperacion/salud</a>" ] ] ] 1 => array:3 [ "identificador" => "bib0010" "etiqueta" => "2" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "La simulación como herramienta de optimización de la investigación clínica" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:2 [ 0 => "A. Monleón" 1 => "J. Ocaña" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:5 [ "tituloSerie" => "Med Clin (Barc)" "fecha" => "2006" "volumen" => "127" "paginaInicial" => "702" "paginaFinal" => "704" ] ] ] ] ] ] 2 => array:3 [ "identificador" => "bib0015" "etiqueta" => "3" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "CORDIS. Community Research and Development Information Service, 2013 [consultado 1 Jul 2013]. Disponible en: <a id="intr0015" class="elsevierStyleInterRef" href="http://cordis.europa.eu/fetch%3FCALLER=FP7_PROJ_EN%26QZ_WEBSRCH=clinical+trial+simulation%26QM_PJA=%26USR_SORT=EN_QVD+CHAR+DESC">http://cordis.europa.eu/fetch?CALLER=FP7_PROJ_EN&QZ_WEBSRCH=clinical+trial+simulation&QM_PJA=&USR_SORT=EN_QVD+CHAR+DESC</a>" ] ] ] 3 => array:3 [ "identificador" => "bib0020" "etiqueta" => "4" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Introducción" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:1 [ 0 => "T. Monleón" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Libro" => array:4 [ "titulo" => "Manual de introducción a la simulación de ensayos clínicos" "fecha" => "2009" "editorial" => "Publicacions i Edicions, Universitat de Barcelona" "editorialLocalizacion" => "Barcelona" ] ] ] ] ] ] 4 => array:3 [ "identificador" => "bib0025" "etiqueta" => "5" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Design of phase <span class="elsevierStyleSmallCaps">i</span> studies in Oncology" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "B. Tranchand" 1 => "R. Bruno" 2 => "G. Freyer" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "LibroEditado" => array:4 [ "titulo" => "Pharmacometrics: The science of quantitative pharmacology" "paginaInicial" => "781" "paginaFinal" => "802" "serieFecha" => "2007" ] ] ] ] ] ] 5 => array:3 [ "identificador" => "bib0030" "etiqueta" => "6" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Ensayos clínicos virtuales, ¿realidad o ficción?" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:2 [ 0 => "J.J. Pérez-Ruixo" 1 => "B. Valenzuela" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:6 [ "tituloSerie" => "Farm Hosp" "fecha" => "2005" "volumen" => "29" "paginaInicial" => "153" "paginaFinal" => "157" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/16013940" "web" => "Medline" ] ] ] ] ] ] ] ] 6 => array:3 [ "identificador" => "bib0035" "etiqueta" => "7" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Ensayos clínicos aleatorizados (CONSORT)" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:1 [ 0 => "A. Cobos-Carbó" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:7 [ "tituloSerie" => "Med Clin (Barc)" "fecha" => "2005" "volumen" => "125" "numero" => "Supl 1" "paginaInicial" => "21" "paginaFinal" => "27" "itemHostRev" => array:3 [ "pii" => "S1130634311700204" "estado" => "S300" "issn" => "11306343" ] ] ] ] ] ] ] 7 => array:3 [ "identificador" => "bib0040" "etiqueta" => "8" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Ensayos en sujetos sanos" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "O.M. Bakke" 1 => "X. Carné" 2 => "F. García Alonso" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "LibroEditado" => array:4 [ "titulo" => "Ensayos clínicos con medicamentos" "paginaInicial" => "138" "paginaFinal" => "156" "serieFecha" => "1994" ] ] ] ] ] ] 8 => array:3 [ "identificador" => "bib0045" "etiqueta" => "9" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Los modelos de simulación de eventos discretos en la evaluación económica de tecnologías y productos sanitarios" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:4 [ 0 => "J.M. Rodríguez-Barrios" 1 => "D. Serrano" 2 => "T. Monleón" 3 => "J. Caro" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:6 [ "tituloSerie" => "Gac Sanit" "fecha" => "2008" "volumen" => "22" "paginaInicial" => "151" "paginaFinal" => "161" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/18420015" "web" => "Medline" ] ] ] ] ] ] ] ] 9 => array:3 [ "identificador" => "bib0050" "etiqueta" => "10" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "PMC34 bibliographic review of discrete events simulation studies in health technology evaluation" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "T. Monleón" 1 => "J.M. Rodríguez-Barrios" 2 => "D. Serrano" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:5 [ "tituloSerie" => "Value Health" "fecha" => "2007" "volumen" => "10" "numero" => "Suppl" "paginaInicial" => "A461A462" ] ] ] ] ] ] 10 => array:3 [ "identificador" => "bib0055" "etiqueta" => "11" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Discrete event simulation: The preferred technique for health economic evaluations?" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "J. Caro" 1 => "J. Möller" 2 => "D. Getsios" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1111/j.1524-4733.2010.00775.x" "Revista" => array:7 [ "tituloSerie" => "Value Health" "fecha" => "2010" "volumen" => "13" "paginaInicial" => "1056" "paginaFinal" => "1060" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/20825626" "web" => "Medline" ] ] "itemHostRev" => array:3 [ "pii" => "S0300289611002687" "estado" => "S300" "issn" => "03002896" ] ] ] ] ] ] ] 11 => array:3 [ "identificador" => "bib0060" "etiqueta" => "12" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Contribution of modeling approaches and virtual populations in transposing the results of clinical trials into real life and in enlightening public health decisions" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "F. Gueyffier" 1 => "C.B. Strang" 2 => "G. Berdeaux" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.2515/therapie/2012042" "Revista" => array:6 [ "tituloSerie" => "Therapie" "fecha" => "2012" "volumen" => "67" "paginaInicial" => "367" "paginaFinal" => "374" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/23110837" "web" => "Medline" ] ] ] ] ] ] ] ] 12 => array:3 [ "identificador" => "bib0065" "etiqueta" => "13" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Sample size calculation and blinded sample size recalculation in clinical trials where the treatment effect is seasured by the relative risk" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:2 [ 0 => "M. Pobiruchin" 1 => "M. Kieser" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:5 [ "tituloSerie" => "Commun Stat Simul Comput" "fecha" => "2013" "volumen" => "42" "paginaInicial" => "1643" "paginaFinal" => "1653" ] ] ] ] ] ] 13 => array:3 [ "identificador" => "bib0070" "etiqueta" => "14" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Adaptive designs for noninferiority trials" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "P. Gao" 1 => "L.Y. Liu" 2 => "C. Mehta" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1002/bimj.201200034" "Revista" => array:6 [ "tituloSerie" => "Biom J" "fecha" => "2013" "volumen" => "55" "paginaInicial" => "310" "paginaFinal" => "321" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/23494872" "web" => "Medline" ] ] ] ] ] ] ] ] 14 => array:3 [ "identificador" => "bib0075" "etiqueta" => "15" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Some comments on frequently used multiple end-point ajustement methods in clinical trials" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "A.J. Sankok" 1 => "M.F. Huque" 2 => "S.D. Dubey" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:6 [ "tituloSerie" => "Stat Med" "fecha" => "1997" "volumen" => "16" "paginaInicial" => "2529" "paginaFinal" => "2542" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/9403954" "web" => "Medline" ] ] ] ] ] ] ] ] 15 => array:3 [ "identificador" => "bib0080" "etiqueta" => "16" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "U.S. Department of Health and Human Services. Food and Drug Administration. Center for Devices and Radiological Health. Guidance for industry and FDA staff. Guidance for the use of bayesian statistics in medical device clinical trials. February 5, 2010 [consultado 1 Jul 2013]. Disponible en: <a id="intr0025" class="elsevierStyleInterRef" href="http://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm071121.pdf">http://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm071121.pdf</a>" ] ] ] 16 => array:3 [ "identificador" => "bib0085" "etiqueta" => "17" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Lesko JL. Clinical trial simulations in the critical path initiative and regulatory decision making. Clinical Trial Simulations: Many questions, few answers. AAPS Annual Meeting, San Diego, California, 2007 [consultado 1 Jul 2013]. Disponible en: <a id="intr0030" class="elsevierStyleInterRef" href="http://www.fda.gov/downloads/AboutFDA/CentersOffices/CDER/ucm106242.pdf">http://www.fda.gov/downloads/AboutFDA/CentersOffices/CDER/ucm106242.pdf</a>" ] ] ] 17 => array:3 [ "identificador" => "bib0090" "etiqueta" => "18" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "U.S. Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). September 2009. Guidance for industry. End-of-phase 2A Meetings [consultado 1 Jul 2013]. Disponible en: <a id="intr0035" class="elsevierStyleInterRef" href="http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM079690.pdf">http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM079690.pdf</a>" ] ] ] 18 => array:3 [ "identificador" => "bib0095" "etiqueta" => "19" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "U.S. Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Center for Biologics Evaluation and Research (CBER). February 2010. Guidance for industry. Adaptive design clinical trials for drugs and biologics [consultado 1 Jul 2013]. Disponible en: <a id="intr0040" class="elsevierStyleInterRef" href="http://www.fda.gov/downloads/Drugs/Guidances/ucm201790.pdf">http://www.fda.gov/downloads/Drugs/./Guidances/ucm201790.pdf</a>" ] ] ] 19 => array:3 [ "identificador" => "bib0100" "etiqueta" => "20" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Utilisation of pharmacokinetic-pharmacodynamic modelling and simulation in regulatory decision-making" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:2 [ 0 => "J.V. Gobburu" 1 => "P.J. Marroum" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.2165/00003088-200140120-00001" "Revista" => array:6 [ "tituloSerie" => "Clin Pharmacokinet" "fecha" => "2001" "volumen" => "40" "paginaInicial" => "883" "paginaFinal" => "892" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/11735607" "web" => "Medline" ] ] ] ] ] ] ] ] 20 => array:3 [ "identificador" => "bib0105" "etiqueta" => "21" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Kimko HHC, Peck CC, editors. Clinical trial simulations. Applications and trends (AAPS advances in the pharmaceutical sciences series). New York, Dordrecht, Heidelberg, London: Springer; 2011. p. 527." ] ] ] 21 => array:3 [ "identificador" => "bib0110" "etiqueta" => "22" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "European Medicines Agency. Methodologies and statistics [consultado 1 Jul 2013]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/special_topics/general/general_content_000353.jsp∣=WC0b01ac05800baedd" ] ] ] 22 => array:3 [ "identificador" => "bib0115" "etiqueta" => "23" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "European Medicines Agency. European Medicines Agency-European Federation of Pharmaceutical Industries and Associations modelling and simulation workshop. London, UK; 2011. [consultado 1 Jul 2013]. Disponible en: <a id="intr0045" class="elsevierStyleInterRef" href="http://www.ema.europa.eu/ema/index.jsp%3Fcurl=pages/news_and_events/events/2011/07/event_detail_000440.jsp%26mid=WC0b01ac058004d5c3">http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/events/2011/07/event_detail_000440.jsp∣=WC0b01ac058004d5c3</a>" ] ] ] 23 => array:3 [ "identificador" => "bib0120" "etiqueta" => "24" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Estimating time to disease progression comparing transition models and survival methods--An analysis of multiple sclerosis data" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:5 [ 0 => "M. Mandel" 1 => "F. Mercier" 2 => "B. Eckert" 3 => "P. Chin" 4 => "R. Betensky" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1111/biom.12002" "Revista" => array:6 [ "tituloSerie" => "Biometrics" "fecha" => "2013" "volumen" => "69" "paginaInicial" => "225" "paginaFinal" => "234" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/23410536" "web" => "Medline" ] ] ] ] ] ] ] ] 24 => array:3 [ "identificador" => "bib0125" "etiqueta" => "25" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Simulations to assess phase <span class="elsevierStyleSmallCaps">ii</span> non-inferiority trials of different doses of capecitabine in combination with docetaxel for metastatic breast cancer" "autores" => array:1 [ 0 => array:2 [ "etal" => true "autores" => array:6 [ 0 => "R. Bruno" 1 => "L. Lindbom" 2 => "F. Schaedeli Stark" 3 => "P. Chanu" 4 => "F. Gilberg" 5 => "N. Frey" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1038/psp.2012.20" "Revista" => array:5 [ "tituloSerie" => "CPT Pharmacometrics Syst Pharmacol" "fecha" => "2012" "volumen" => "1" "paginaInicial" => "e19" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/23835839" "web" => "Medline" ] ] ] ] ] ] ] ] 25 => array:3 [ "identificador" => "bib0130" "etiqueta" => "26" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Population pharmacokinetics of sifalimumab, an investigational anti-interferon-α monoclonal antibody, in systemic lupus erythematosus" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "R. Narwal" 1 => "L.K. Roskos" 2 => "G.J. Robbie" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1007/s40262-013-0085-2" "Revista" => array:6 [ "tituloSerie" => "Clin Pharmacokinet" "fecha" => "2013" "volumen" => "52" "paginaInicial" => "1017" "paginaFinal" => "1027" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/23754736" "web" => "Medline" ] ] ] ] ] ] ] ] 26 => array:3 [ "identificador" => "bib0135" "etiqueta" => "27" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Statistical aspects of the TNK-S2B trial of tenecteplase versus alteplase in acute ischemic stroke: An efficient, dose-adaptive, seamless phase <span class="elsevierStyleSmallCaps">ii</span>/<span class="elsevierStyleSmallCaps">iii</span> design" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:6 [ 0 => "B. Levin" 1 => "J.L. Thompson" 2 => "B. Chakraborty" 3 => "G. Levy" 4 => "R. MacArthur" 5 => "E.C. Haley" ] ] ] ] ] "host" => array:1 [ 0 => array:2 [ "doi" => "10.1177/1740774511410582" "Revista" => array:6 [ "tituloSerie" => "Clin Trials" "fecha" => "2011" "volumen" => "8" "paginaInicial" => "398" "paginaFinal" => "407" "link" => array:1 [ 0 => array:2 [ "url" => "https://www.ncbi.nlm.nih.gov/pubmed/21737464" "web" => "Medline" ] ] ] ] ] ] ] ] 27 => array:3 [ "identificador" => "bib0140" "etiqueta" => "28" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Linear, generalized linear, and nonlinear mixed effect models" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:2 [ 0 => "F. Ezzet" 1 => "J.C. Pinheiro" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "LibroEditado" => array:4 [ "titulo" => "Pharmacometrics: The science of quantitative pharmacology" "paginaInicial" => "103" "paginaFinal" => "136" "serieFecha" => "2007" ] ] ] ] ] ] 28 => array:3 [ "identificador" => "bib0145" "etiqueta" => "29" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Analysis of clinical trials using SAS: A practical guide" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:4 [ 0 => "A. Dmitrienko" 1 => "G. Molenberghs" 2 => "C. Chuang-Stein" 3 => "G. Offen" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:3 [ "tituloSerie" => "Cary:SAS Institute" "fecha" => "2005" "itemHostRev" => array:3 [ "pii" => "S0272523111000864" "estado" => "S300" "issn" => "02725231" ] ] ] ] ] ] ] 29 => array:3 [ "identificador" => "bib0150" "etiqueta" => "30" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Flexible discrete events simulation of clinical trial using LeanSim. Prooceedings in computational statistics" "autores" => array:1 [ 0 => array:2 [ "etal" => true "autores" => array:6 [ 0 => "T. Monleón" 1 => "J. Ocaña" 2 => "E. Vegas" 3 => "P. Fonseca" 4 => "A. Riera" 5 => "J. Montero" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Libro" => array:5 [ "fecha" => "2004" "paginaInicial" => "1519" "paginaFinal" => "1529" "editorial" => "Physica-Verlag/Springer" "editorialLocalizacion" => "Heidelberg" ] ] ] ] ] ] 30 => array:3 [ "identificador" => "bib0155" "etiqueta" => "31" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Monleón T, Ocaña J, Arnaiz JA, Carner X, Riba N, Soy D. Modelización, simulación y validación de un ensayo clínico de Fase I. Comunicación presentada en la IX Conferencia Española de Biometría. Oviedo, España, 2004." ] ] ] 31 => array:3 [ "identificador" => "bib0160" "etiqueta" => "32" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "School of Public Health. University of Minnesota. Simulations using SAS procedures [consultado 1 Jul 2013]. Disponible en: <a id="intr0055" class="elsevierStyleInterRef" href="http://www.biostat.umn.edu/~john-c/5421/notes.023b">http://www.biostat.umn.edu/∼john-c/5421/notes.023b</a>" ] ] ] 32 => array:3 [ "identificador" => "bib0165" "etiqueta" => "33" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Lawson B, Leemis L. Monte Carlo and discrete-event simulations in C and R. En: Mason SJ, Hill RR, Moench L, Rose O, editors. Proceedings of the 2008 Winter Simulation Conference USA [consultado 1 Jul 2013]. Disponible en: <a id="intr0060" class="elsevierStyleInterRef" href="http://www.mathcs.richmond.edu/~blawson/papers/wsc2008.pdf">http://www.mathcs.richmond.edu/∼blawson/papers/wsc2008.pdf</a>" ] ] ] 33 => array:3 [ "identificador" => "bib0170" "etiqueta" => "34" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Zhou M. Use software R to do survival analysis and simulation. A tutorial. Department of Statistics, University of Kentucky; 2013 [consultado 1 Jul 2013]. Disponible en: <a id="intr0065" class="elsevierStyleInterRef" href="http://www.ms.uky.edu/~mai/Rsurv.pdf">http://www.ms.uky.edu/∼mai/Rsurv.pdf</a>" ] ] ] 34 => array:3 [ "identificador" => "bib0175" "etiqueta" => "35" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "European Commission's 5th Framework. ICEBERGSIM, Clinical Trial Simulation tools [consultado 1 Jul 2013]. Disponible en: <a id="intr0070" class="elsevierStyleInterRef" href="http://randomization.org/">http://randomization.org/</a>" ] ] ] 35 => array:3 [ "identificador" => "bib0180" "etiqueta" => "36" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Pharsight<span class="elsevierStyleSup">®</span> software [consultado 1 Jul 2013]. Disponible en: <a id="intr0075" class="elsevierStyleInterRef" href="http://www.pharsight.com/products/prod_pts_home.php">http://www.pharsight.com/products/prod_pts_home.php</a>" ] ] ] 36 => array:3 [ "identificador" => "bib0185" "etiqueta" => "37" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Monleón A, Barnadas A, Roset M, Hernandez-Boluda JC, Pérez, P, Llombart, A. (Coordinación T. Monleón). Metodología de investigación y estadística en oncología y hematología (casos prácticos). Barcelona: EDIMAC; 2005." ] ] ] 37 => array:3 [ "identificador" => "bib0190" "etiqueta" => "38" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Diseños secuenciales y análisis intermedio en la investigación clínica: tamaño versus dificultad" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:3 [ 0 => "T. Monleón" 1 => "A. Barnadas" 2 => "M. Roset" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:5 [ "tituloSerie" => "Med Clin (Barc)" "fecha" => "2009" "volumen" => "132" "paginaInicial" => "437" "paginaFinal" => "442" ] ] ] ] ] ] 38 => array:3 [ "identificador" => "bib0195" "etiqueta" => "39" "referencia" => array:1 [ 0 => array:2 [ "contribucion" => array:1 [ 0 => array:2 [ "titulo" => "Revisión crítica del ensayo clínico pragmático" "autores" => array:1 [ 0 => array:2 [ "etal" => false "autores" => array:1 [ 0 => "C. Vallvé" ] ] ] ] ] "host" => array:1 [ 0 => array:1 [ "Revista" => array:5 [ "tituloSerie" => "Med Clin (Barc)" "fecha" => "2003" "volumen" => "121" "paginaInicial" => "384" "paginaFinal" => "388" ] ] ] ] ] ] 39 => array:3 [ "identificador" => "bib0200" "etiqueta" => "40" "referencia" => array:1 [ 0 => array:1 [ "referenciaCompleta" => "Departament of Statistics. University of British Columbia. Introduction to Bayesian Monte Carlo methods in WINBUGS [consultado 1 Jul 2013]. Disponible en: <a id="intr0080" class="elsevierStyleInterRef" href="http://www.stat.ubc.ca/~gavin/WinBUGSdocs/WinBUGS%20lectures%20.pdf">http://www.stat.ubc.ca/∼gavin/WinBUGSdocs/WinBUGS%20lectures%20.pdf</a>" ] ] ] ] ] ] ] "agradecimientos" => array:1 [ 0 => array:4 [ "identificador" => "xack69533" "titulo" => "Agradecimientos" "texto" => "<p id="par0195" class="elsevierStylePara elsevierViewall">Al Dr. Jordi Ocaña, por introducirme en el mundo de la simulación, sus consejos y recomendaciones. A los revisores, por sus sugerencias y aportaciones.</p>" "vista" => "all" ] ] ] "idiomaDefecto" => "es" "url" => "/00257753/0000014100000012/v1_201312070117/S0025775313006805/v1_201312070117/es/main.assets" "Apartado" => array:4 [ "identificador" => "16839" "tipo" => "SECCION" "es" => array:2 [ "titulo" => "Investigación clínica y bioética" "idiomaDefecto" => true ] "idiomaDefecto" => "es" ] "PDF" => "https://static.elsevier.es/multimedia/00257753/0000014100000012/v1_201312070117/S0025775313006805/v1_201312070117/es/main.pdf?idApp=UINPBA00004N&text.app=https://www.elsevier.es/" "EPUB" => "https://multimedia.elsevier.es/PublicationsMultimediaV1/item/epub/S0025775313006805?idApp=UINPBA00004N" ]
Consulte los artículos y contenidos publicados en este medio, además de los e-sumarios de las revistas científicas en el mismo momento de publicación
Esté informado en todo momento gracias a las alertas y novedades
Acceda a promociones exclusivas en suscripciones, lanzamientos y cursos acreditados
Medicina Clínica, fundada en 1943, es la única publicación semanal de contenido clínico que se edita en España y constituye el máximo exponente de la calidad y pujanza de la medicina española. Son características fundamentales de esta publicación el rigor científico y metodológico de sus artículos, la actualidad de los temas y, sobre todo, su sentido práctico, buscando siempre que la información sea de la mayor utilidad en la práctica clínica. Los contenidos de Medicina Clínica abarcan dos frentes: trabajos de investigación original rigurosamente seleccionados atendiendo a su calidad, originalidad e interés, y trabajos orientados a la formación continuada, encomendados por la revista a autores relevantes (Editoriales, Revisiones, Conferencias clínicas y clínico-patológicas, Diagnóstico y Tratamiento). En estos artículos se ponen al día aspectos de destacado interés clínico o conceptual en la medicina actual. Medicina Clínica es un vehículo de información científica de reconocida calidad, como demuestra su inclusión en los más prestigiosos y selectivos índices bibliográficos del mundo.
Current Contents/Clinical Medicine, Journal Citation Reports, SCI-Expanded, Index Medicus/Medline, Excerpta Medica/EMBASE, IBECS, IME, MEDES, PASCAL, SCOPUS, ScienceDirect
Ver másEl factor de impacto mide la media del número de citaciones recibidas en un año por trabajos publicados en la publicación durante los dos años anteriores.
© Clarivate Analytics, Journal Citation Reports 2022
SJR es una prestigiosa métrica basada en la idea de que todas las citaciones no son iguales. SJR usa un algoritmo similar al page rank de Google; es una medida cuantitativa y cualitativa al impacto de una publicación.
Ver másSNIP permite comparar el impacto de revistas de diferentes campos temáticos, corrigiendo las diferencias en la probabilidad de ser citado que existe entre revistas de distintas materias.
Ver más¿Es usted profesional sanitario apto para prescribir o dispensar medicamentos?
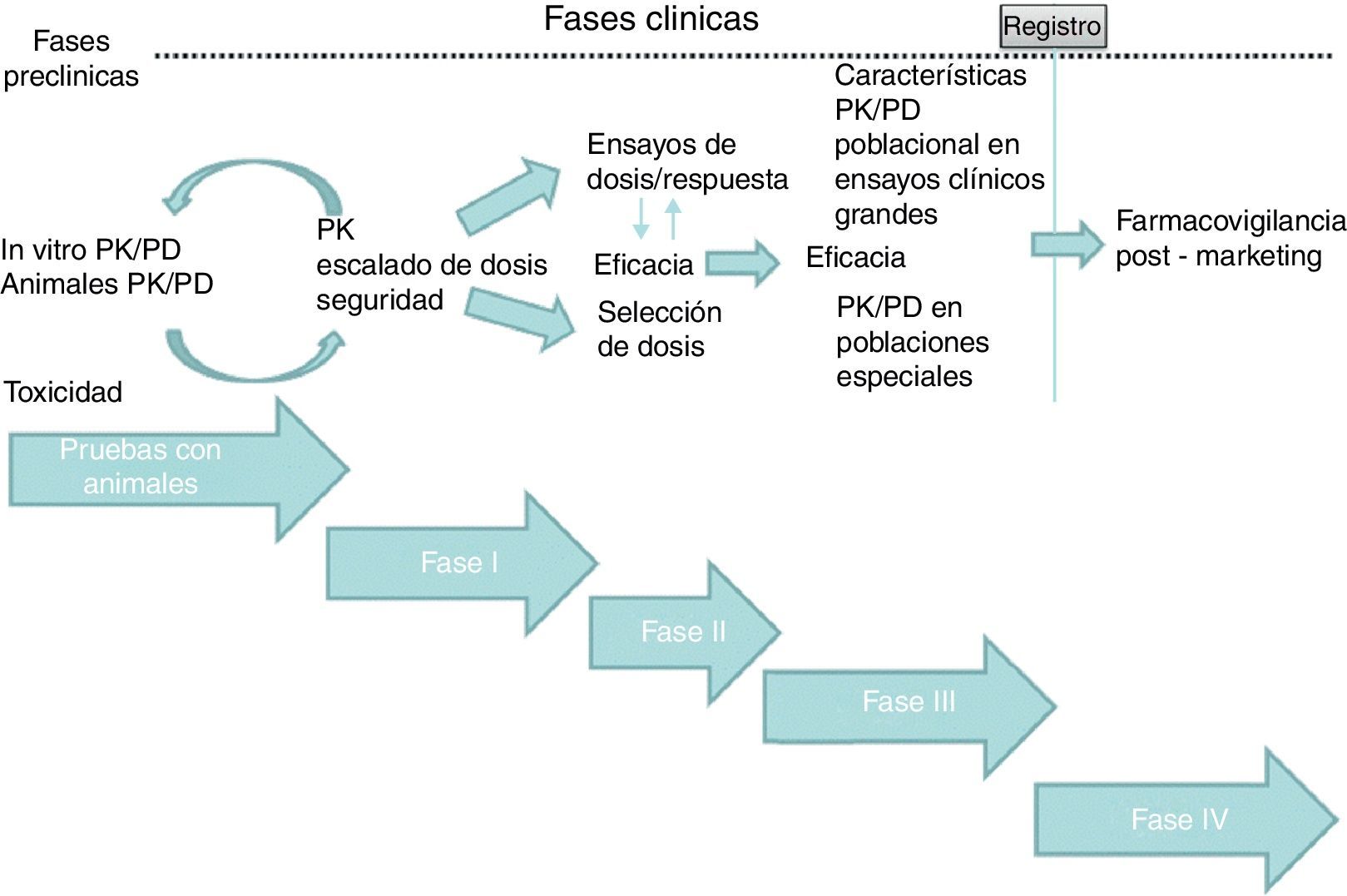
Are you a health professional able to prescribe or dispense drugs?
Você é um profissional de saúde habilitado a prescrever ou dispensar medicamentos