Comparar el desenlace clínico (mortalidad y/o ingreso en UCI) a 30 días de los pacientes ingresados por neumonía moderada-grave por SARS-CoV-2 tratados con dexametasona tras el estudio RECOVERY frente aquellos tratados con metilprednisolona ajustada al peso.
MétodosEstudio de cohortes retrospectivo de 65 pacientes con neumonía moderada-grave que recibieron 6 mg/día de dexametasona (grupo DXM) frente a 80 tratados con metilprednisolona ajustada al peso (grupo MTPN).
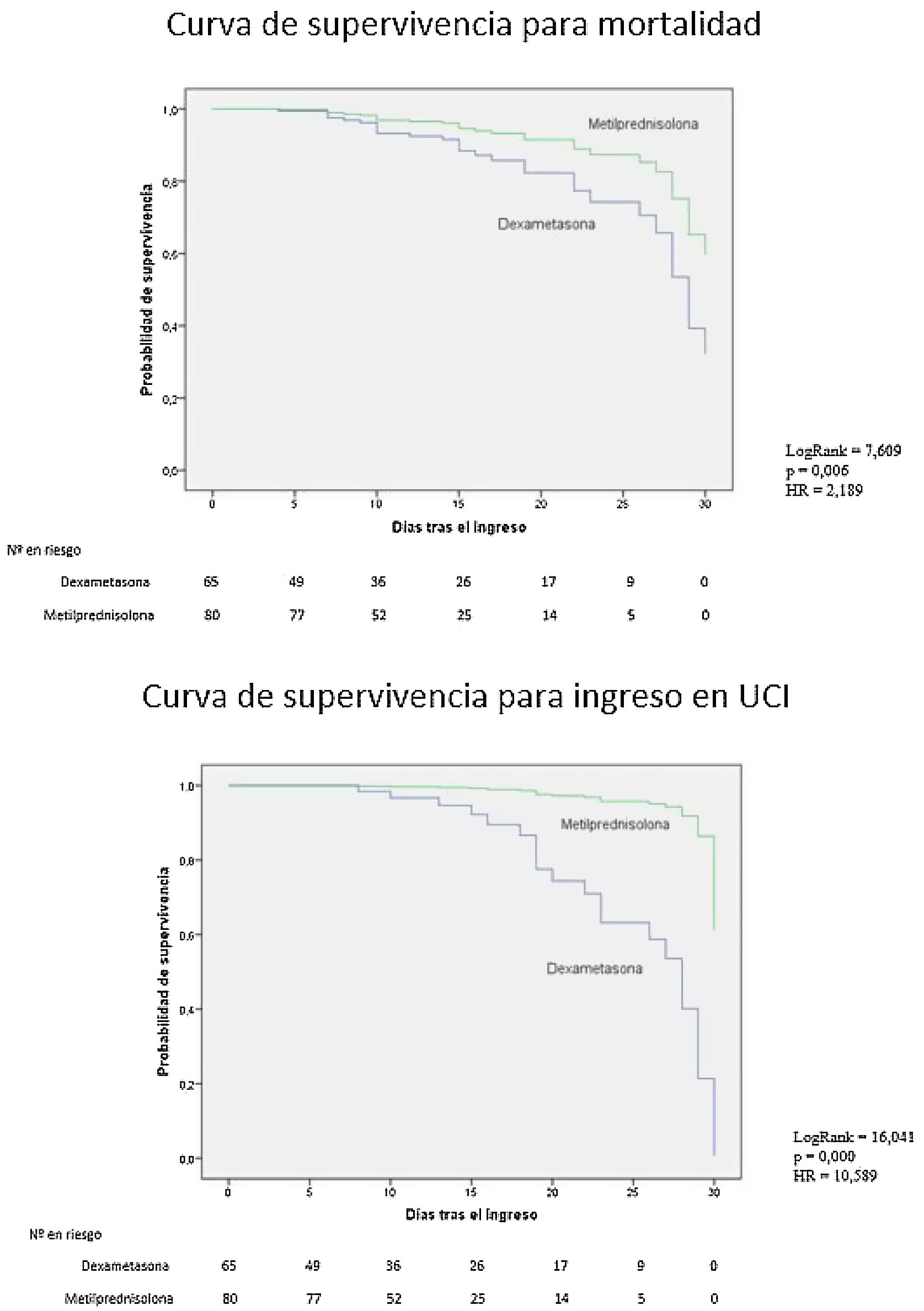
ResultadosFallecieron 21 (32,3%) pacientes del grupo DXM vs. 8 (10%) del grupo MTPN (valor p < 0,001) y 29 (44,6%) del grupo DXM requirieron ingreso en UCI vs. 2 (2,5%) del grupo MTPN (valor p < 0,001). No hubo diferencias basales respecto a características sociodemográficas con un qSOFA medio superior en el grupo MTPN. La razón de riesgo para la mortalidad y el ingreso en UCI ajustada por edad, sexo y PCR al ingreso fue de 2,189 (1,082-4,426; IC 95%) y 10,589 (2,139-48,347; IC 95%) para el grupo DXM, respectivamente, vs. grupo MTPN.
ConclusionesLa mortalidad e ingreso en UCI fue menor en pacientes tratados con metilprednisolona ajustada al peso frente a los tratados con dexametasona.
To compare the 30-day outcome (mortality and/or ICU admission) of patients admitted for moderate-severe SARS-CoV-2 pneumonia treated with dexamethasone after the Recovery study versus those treated with weight-adjusted methylprednisolone.
MethodsRetrospective cohort study of 65 patients with moderate-severe pneumonia who received dexamethasone 6 mg/day (DXM group) versus 80 treated with weight-adjusted methylprednisolone (MTPN group).
ResultsTwenty-one (32.3%) patients in the DXM group died vs. 8 (10%) in the MTPN group (p-value < 0.001) and 29 (44.6%) in the DXM group required ICU admission vs. 2 (2.5%) of the MTPN group (p-value < 0.001). There were no baseline differences regarding sociodemographic characteristics with a higher mean qSOFA in the MTPN group. The hazard ratio for mortality and ICU admission adjusted for age, sex, and admission CRP was 2.189 (1.082–4.426; 95% CI) and 10.589 (2.139–48.347; 95% CI) for the DXM group, respectively, vs. MTPN group.
ConclusionsMortality and admission to the ICU were lower in patients treated with weight-adjusted methylprednisolone compared to those treated with dexamethasone.
La dexametasona ha demostrado reducir mortalidad en pacientes con neumonía moderada/grave por SARS-CoV-2 que precisan oxigenoterapia, lo que ha generalizado su uso como tratamiento inicial en la mayoría de los protocolos.
En estos pacientes, la fase hiperinflamatoria es consecuencia de una disregulación de la respuesta inmune con un marcado aumento de reactantes de fase aguda que conduce a un empeoramiento clínico, habitualmente entre el sexto al décimo día tras el inicio de los síntomas. En el tratamiento de muchas enfermedades inflamatorias, los corticoides se ajustan al peso del paciente y así se realizó durante los primeros meses de la pandemia, existiendo evidencia desde marzo de 2020 del uso de dosis altas de MTPN asociadas a una menor mortalidad1. Tras la publicación del Randomised evaluation of COVID-19 therapy (RECOVERY)2, dicho protocolo se modificó recomendando la administración de dosis fijas de 6 mg/día de dexametasona durante diez días. Tras este cambio, nuestra impresión en práctica clínica fue que en muchos pacientes esta dosis de dexametasona resultaba insuficiente derivando en un peor desenlace clínico. Por ello, nos propusimos analizar el desenlace clínico (mortalidad y/o ingreso en UCI) a 30 días de los de los 65 primeros pacientes que recibieron dexametasona en comparación con una cohorte histórica que habían recibido metilprednisolona ajustada al peso.
MétodosEntre los días 1 y 31 de diciembre de 2020 recogimos retrospectivamente 65 pacientes mayores de edad ingresados en el Hospital Clínico de Granada con neumonía por SARS-CoV-2 moderada/grave con necesidad de oxigenoterapia, confirmada por PCR de exudado nasofaríngeo que recibieron en las primeras 24 h del ingreso dexametasona 6 mg/día además del tratamiento estándar que incluía remdesivir si cumplía criterios para ello y heparina de bajo peso molecular (HBPM) a dosis terapéuticas. Se compararon con una cohorte histórica de pacientes ingresados en nuestro hospital entre el 15 de marzo y el 15 de mayo de 2020 tratados en las primeras 24 h del ingreso con MTPN ajustada al peso junto con tratamiento estándar consistente en azitromicina, hidroxicloroquina, lopinavir/ritonavir y HBPM. Nuestro protocolo en este periodo incluía el uso de metilprednisolona ajustada al peso con reducción progresiva durante 15 días (1-2 mg/kg/día de MTPN i.v. de tres a cinco días; posteriormente 40 mg/día tres días, 30 mg/día tres días, 20 mg/día tres días y finalmente 10 mg/día tres días).
Ingresaron un total 129 pacientes en el primer periodo y 91 en el segundo. Se excluyeron del estudio los pacientes que ingresaron directamente en Unidad de Cuidados Intensivos (UCI).
Al ingreso, todos los pacientes tenían una duración desde el inicio de los síntomas entre seis y 11 días (mediana 7 y rango intercuartílico 5 a 10 días). Se recogieron comorbilidades, SaFiO2 al ingreso y calculamos los índices CURB-65 y quick sepsis related organ failure assessment (qSOFA). Los datos de laboratorio analizados fueron ferritina, PCR, fibrinógeno, dímero D y procalcitonina. Analizamos la extensión de la neumonía con base en la radiografía o tomografía computarizada (TAC) torácica, según las directrices del sistema de clasificación de la Sociedad Británica de Imagen Torácica (BSTI). El desenlace clínico se comparó entre ambos grupos a los 30 días.
Tras el análisis descriptivo, estudiamos las diferencias entre las variables consideradas; para las cualitativas se realizó la prueba χ2 para comparación de proporciones y para las cuantitativas se comprobó la normalidad a través del test de Kolmogorov-Smirnov, usando la prueba U de Mann-Whitney para la estimación de diferencias significativas en aquellas variables procedentes de poblaciones independientes que no estaban normalmente distribuidas y la t de Student para comparación de medias de poblaciones independientes en variables que cumplían la normalidad. El test de Wilcoxon se empleó en la comparación de muestras pareadas procedentes de poblaciones no normales. Realizamos dos regresiones de Cox para calcular por separado el hazard ratio para mortalidad e ingreso en UCI de un grupo respecto a otro. Estas se corrigieron por edad, género y PCR al ingreso, añadiendo las curvas de supervivencia de Kaplan-Meier. El software estadístico utilizado es SPSS Versión 23 (IBM Corp., Armonk, NY, EE. UU.).
El estudio fue realizado según los principios de la declaración de Helsinki, obteniéndose el dictamen favorable del CEIM/CEI Provincial de Granada.
ResultadosLas características basales, comorbilidades, afectación radiográfica, qSOFA, CURB-65 se recogen en la tabla 1. Los datos analíticos y desenlace clínico en la tabla 2.
Características basales, comorbilidades, grado de afectación radiológica e índices de severidad al ingreso
| Dexametasona(n = 65) | Metilprednisolona(n = 80) | ||
|---|---|---|---|
| n (%) | n (%) | χ2 (valor p) | |
| Características basales | |||
| Edad (> 65) | 40 (61,5%) | 49 (61,25%) | 0,001 (0,972) |
| Sexo (varón) | 28 (43,1%) | 45 (56,25%) | 2,489 (0,115) |
| HTA | 44 (67,7%) | 39 (48,75%) | 5,525 (0,022*) |
| EPOC/asma | 6 (9,2%) | 18 (22,50%) | 4,572 (0,033*) |
| Obesidad | 17 (26,2%) | 33 (41,25%) | 3,618 (0,057) |
| Card. isquémica | 4 (6,2%) | 4 (5%) | 0,092 (0,762) |
| Ins. cardiaca | 10 (7,2%) | 8 (10%) | |
| Diabetes | 19 (29,2%) | 13 (16,25%) | 3,514 (0,061) |
| I. renal | 10 (15,4%) | 11 (13,75%) | 0,077 (0,781) |
| Infiltrado multilobar | 50 (76,9%) | 61 (76,3%) | 5,391 (0,068) |
| Afectación TAC (moderada o severa) | 25 (86,2%) n = 25 | 28 (75,7%) n = 37 | |
| Anticoagulación | 6 (16,7%) | 6 /7,5%) | 2,249 (0,134) |
| Mín, Máx, Q1, Q2, Q3 | Mín, Máx, Q1, Q2, Q3 | U de Mann-Whitney (valor p) | |
| CURB-65 | 0, 3, 1, 2, 2 | 0, 5, 1, 2, 2 | 2.382,500 (0,341) |
| qSOFA | 0, 7, 1, 2, 3 | 0, 3, 0, 0, 1 | 556,000 (0,000**) |
HTA: hipertensión arterial: EPOC: enfermedad pulmonar obstructiva crónica; TAC: tomografía computarizada; CURB-65: escala de predicción de mortalidad utilizada en pacientes con neumonía adquirida en la comunidad; qSOFA: quick sequential organ failure assessment; Mín: valor mínimo; Máx: máximo; Q1: primer cuartil; Q2: mediana o segundo cuartil; Q3: tercer cuartil, x¯: media, sx: desviación típica.
Desenlaces primarios, estancia media hospitalaria y características analíticas basales y a los tres días de tratamiento, en los distintos grupos de tratamiento
| Dexametasona (n = 65) | Metilprednisolona (n = 80) | Comparación de grupos:dexametasona/metilprednisolona | ||
|---|---|---|---|---|
| Desenlaces primarios | χ2(valor p) | |||
| Ingreso en UCI | n (%) | 29 (44,6%) | 2 (2,5%) | 37,843 (0,000***) |
| Intubación | n (%) | 23 (35,4%) | 2 (2,5%) | 27,179 (0,000***) |
| Exitus | n (%) | 21 (32,3%) | 8 (10%) | 15,347 (0,000***) |
| tde Student (valor p) | ||||
| Estancia media hospitalaria | x¯sx | 13,029 (7,469) | 14,722 (6,174) | -1,230 (0,221) |
| Características analíticas | Pre | Post | Pre | Post | U de Mann-Whitney (valor p) |
|---|---|---|---|---|---|
| Ferritina Mín | 80,000 | 52,800 | 105,900 | 79,000 | Pre: 1.804,500 (0,002**) |
| Máx | 4.450,000 | 4.500,000 | 3.772,000 | 4.332,400 | Post: 2.032,000 (0,034*) |
| Q1 | 214,950 | 250,950 | 472,200 | 539,650 | |
| Q2 | 442,900 | 558,550 | 686,200 | 702,550 | |
| Q3 | 830,100 | 1.036,850 | 1.087,225 | 995,200 | |
| Z de Wilcoxon (valor p) | -2,030 (0,042*) post > pre | -2,053 (0,040*) post > pre | |||
| Dímero D | |||||
| Mín | 0,190 | 0,240 | 0,190 | 0,190 | Pre: 2.531,000 (0,907) |
| Máx | 11,660 | 23,580 | 333,000 | 117,000 | Post: 2.420,500 (0,807) |
| Q1 | 0,573 | 0,615 | 0,575 | 0,590 | |
| Q2 | 0,910 | 1,315 | 0,865 | 1,255 | |
| Q3 | 2,158 | 2,703 | 1,910 | 2,805 | |
| Z de Wilcoxon (valor p) | -1,221 (0,222) | -1,432 (0,152) | |||
| Linfocitos | |||||
| Mín | 330 | 190 | 250 | 220 | Pre: 2.120,500 (0,057) |
| Máx | 9.200 | 3.350 | 3.800 | 4.550 | Post: 2.422,000 (0,479) |
| Q1 | 575 | 535 | 705 | 607,5 | |
| Q2 | 800 | 780 | 940 | 820 | |
| Q3 | 1.130 | 1.165 | 1.267,5 | 1.227 | |
| Z de Wilcoxon (valor p) | -0,023 (0,932) | -0,705 (0,481) | |||
| PCR | |||||
| Mín | 5,700 | 4,100 | 3,900 | 0,800 | Pre: 2.114,500 (0,054) |
| Máx | 531,000 | 297,800 | 346,200 | 366,100 | Post: 1.392,500 (0,000**) |
| Q1 | 54,300 | 29,200 | 37,025 | 8,350 | |
| Q2 | 113,500 | 70,700 | 78,100 | 19,950 | |
| Q3 | 177,450 | 124,950 | 143,625 | 68,125 | |
| Z de Wilcoxon (valor p) | -3,950 (0,000**) post < pre | -6,737 (0,000**) post < pre | |||
| PCT | |||||
| Mín | 0,020 | 0,020 | Pre: 2.500,000 (0,510) | ||
| Máx | 10,800 | 2,030 | |||
| Q1 | 0,065 | 0,060 | |||
| Q2 | 0,120 | 0,080 | |||
| Q3 | 0,390 | 0,160 | |||
Pre: pretratamiento; Post: postratamiento; PCT: procalcitonina; Mín: valor mínimo; Máx: máximo; Q1: primer cuartil; Q2: mediana o segundo cuartil; Q3: tercer cuartil; x¯: media; sx: desviación típica.
Fallecieron 21 (32,3%) pacientes del grupo DXM vs. 8 (10%) del grupo MTPN (valor p = 0,000); 29 (44,6%) del grupo DXM requirieron ingreso en UCI vs. 2 (2,5%) del grupo MTPN (valor p = 0,000); 34 (52,3%) del grupo DXM precisaron tratamiento de rescate por empeoramiento respiratorio vs. 2 (2,5%) del grupo MTPN. No hubo asociación entre el desenlace clínico y el tratamiento de rescate empleado. De los pacientes rescatados del grupo DXM, 23 (67,6%) fueron dados de alta a los 30 días y 11 (32,4%) fallecieron. Del grupo MTPN, los dos pacientes rescatados fueron dados de alta. La dosis media acumulada de MTPN recibida por los pacientes del grupo MTPN fue de 756 mg.
La regresión de Cox para mortalidad e ingreso en UCI ajustada, según el grupo de tratamiento, edad, sexo y PCR al ingreso, dio una razón de riesgo de 2,189 (1,082-4,426; IC 95%) y 10,589 (2,139-48,347; IC 95%) respectivamente para el grupo DXM sobre el de MTPN (fig. 1). Los pacientes tratados con dexametasona tienen más del doble de probabilidad de fallecer y más de diez veces de ingresar en UCI que los tratados con MTPN.
Curvas de supervivencia para mortalidad (A) e ingreso en UCI (B) ajustadas por edad, sexo y PCR al ingreso. Las curvas muestran que los pacientes del grupo de DXM tienen 2,2 veces más probabilidad de fallecer y mas de 10 veces de probabilidad de ingresar en UCI que los del grupo de MTPN.
Fármacos inmunomoduladores como anakinra3, tocilizumab4, baricitinib5, corticosteroides o inmunoglobulinas6,7 se utilizan para controlar la fase hiperinflamatoria de la infección por SARS-CoV-2.
Ensayos clínicos como el CoDEX8 y RECOVERY2 han demostrado reducción de mortalidad con el uso de dexametasona. En el RECOVERY, esta reducción en el grupo de pacientes con oxigenoterapia sin ventilación mecánica invasiva fue del 23,3 vs. 26,2%; en aquellos con ventilación mecánica la reducción fue mayor (29,3 vs. 41,4%). Probablemente el hecho de que todos los pacientes de nuestro estudio cumplieran criterios de hiperinflamación haya contribuido a la mayor mortalidad del grupo DXM (32%) en comparación con la del RECOVERY (23,3%) que no consideró este aspecto. La gran diferencia observada de mortalidad (22%) entre nuestra cohorte histórica tratada con metilprednisolona9 y el grupo de DXM nos hace reflexionar sobre el posible impacto negativo en términos de mortalidad por la modificación de los protocolos de tratamiento después del RECOVERY, dado que muchos hospitales sustituyeron dosis altas de metilprednisolona por dosis fija de dexametasona. Es interesante observar la separación de las curvas de supervivencia a partir del sexto a octavo días, que podría ser consecuencia de un bloqueo precoz más efectivo de la tormenta de citocinas –«ventana de oportunidad»– en el grupo MTPN. En nuestro estudio, similar a lo publicado en la literatura, los factores asociados con peor pronóstico fueron la edad, los niveles elevados de PCR y ferritina al ingreso. Aunque la PCR en el momento del ingreso fue mayor en el grupo DXM, y esto podría explicar un moderado incremento de la mortalidad, el resto de las características analíticas y la SaFiO2 al ingreso fueron similares entre ambos grupos. Las comorbilidades se distribuyeron de modo equilibrado, salvo la hipertensión arterial (HTA) incrementada en el grupo DXM y enfermedad pulmonar obstructiva crónica (EPOC) más presente en el grupo MTPN.
Nuestros datos son concordantes con un estudio recientemente publicado10, en el que la administración de metilprednisolona i.v. durante tres días seguida de una pauta oral descendente de prednisona durante 14 días fue superior a 6 mg/día de dexametasona con una supervivencia a 30 días del 92,6 vs. 63,1%.
Las limitaciones de este estudio radican en su carácter unicéntrico, su pequeño tamaño muestral y las características intrínsecas de los estudios observacionales. Consideramos que la aplicación del mismo protocolo terapéutico en cada periodo de tiempo es una fortaleza, máxime cuando en el protocolo del grupo MTPN se incluyeron fármacos sin ningún beneficio o incluso posibles efectos nocivos.
En conclusión, nuestro estudio sugiere un peor desenlace clínico con dosis fijas de 6 mg/día de dexametasona en comparación con metilprednisolona ajustada al peso en pacientes neumonía moderada-grave por SARS-CoV-2 e hiperinflamación. Sería necesario un ensayo clínico aleatorizado comparando ambos brazos de tratamiento para confirmar estas diferencias.
FinanciaciónEste estudio no ha recibido ninguna financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.