La obesidad y la diabetes mellitus tipo 2 (DM2) son problemas globales interrelacionados, y que afectan a 988 y 537 millones de personas, respectivamente, cifras en continuo aumento. La obesidad es un factor clave en la DM2, ya que intensifica la resistencia a la insulina y la disfunción de las células β, acelerando la progresión de la enfermedad. La pérdida de peso mejora el control glucémico, reduce la aparición de comorbilidades y, en algunos casos, induce la remisión de la diabetes. En este sentido, los agonistas del receptor de GLP-1 han revolucionado el tratamiento de la DM2. Desde la introducción de exenatida en 2005, se han desarrollado medicamentos más eficaces que mejoran el control glucémico, reducen el peso y disminuyen la aparición de eventos cardiovasculares. Este artículo analiza los mecanismos de acción y eficacia de estos agentes, destacando avances recientes como los poliagonistas y formulaciones orales.
Obesity and type 2 diabetes mellitus (DM2) are interrelated global problems affecting 988 and 537 million people, respectively, figures that are continuously increasing. Obesity is a key factor in DM2, as it intensifies insulin resistance and β-cell dysfunction, accelerating disease progression. Weight loss improves glycemic control, reduces the occurrence of comorbidities and, in some cases, induces diabetes remission. In this regard, GLP-1 receptor agonists have revolutionized the treatment of DM2. Since the introduction of exenatide in 2005, more effective drugs have been developed that improve glycemic control, reduce weight, and decrease the occurrence of cardiovascular events. This article discusses the mechanisms of action and efficacy of these agents, highlighting recent advances such as polyagonists and oral formulations.
La obesidad y la diabetes mellitus tipo 2 (DM2), han sido en ocasiones referidas como «pandemias gemelas»1 al compartir ambos mecanismos fisiopatológicos comunes. Son enfermedades metabólicas altamente extendidas, y responsables de una enorme carga de morbimortalidad a nivel mundial. Los cálculos más recientes de la Federación Internacional de Diabetes (IDF) indican que el 10,5% de la población adulta mundial entre 20-79 años —537 millones de personas— tiene diabetes2. Por otra parte, datos recientes publicados en el atlas mundial de obesidad, estiman que alrededor de 988 millones de personas en el mundo presentan obesidad (IMC≥30kg/m2)3. Las proyecciones indican, además, un alarmante crecimiento exponencial de ambas condiciones en los próximos años.
La diabetes y la obesidad coexisten en un número creciente de individuos, por lo que una estrategia de tratamiento ideal para la diabetes debe incluir necesariamente un manejo óptimo de la obesidad4. La obesidad, particularmente cuando se asocia con una mayor distribución de grasa abdominal e intraabdominal, es un factor fisiopatológico clave en la DM2, ya que contribuye a la resistencia a la insulina y a la disfunción de las células β, creando un círculo vicioso que acelera la progresión de la enfermedad5. La pérdida de peso en las personas con DM2 induce tanto a una mejoría del control metabólico, como de las comorbilidades asociadas (esteatosis hepática, insuficiencia cardiaca, síndrome de apnea obstructiva del sueño), de la calidad de vida y de los factores de riesgo cardiovascular. Además, se ha demostrado que una pérdida de peso de una magnitud suficiente (en torno al 10-15% o mayor) puede incluso tener un efecto modificador de la enfermedad, y conducir a la remisión de la diabetes6. Sin embargo, lograr y mantener una pérdida de peso significativa en los pacientes con DM2, incluso con intervenciones intensivas sobre el estilo de vida, es especialmente desafiante7.
En este contexto, los agonistas del receptor del péptido 1 similar al glucagón (GLP-1) han emergido en los últimos años como importantes agentes terapéuticos para el manejo de la DM2.
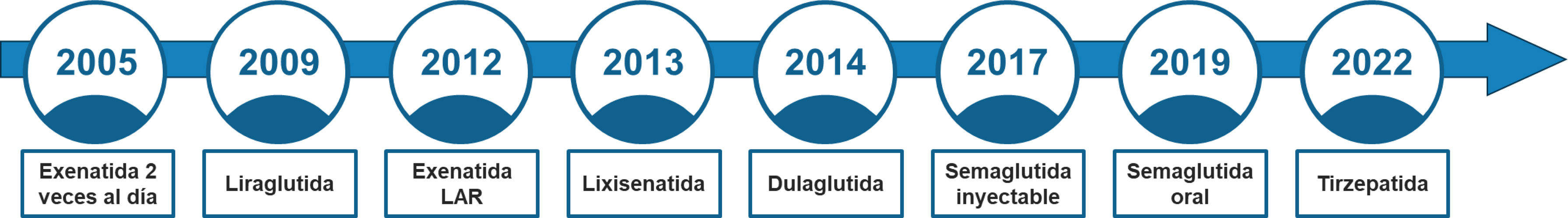
Desde la introducción del primer agonista de GLP-1 para el tratamiento de la DM2, exenatida, como una inyección por vía subcutánea (sc) doble diaria en 2005, su evolución ha incluido el desarrollo de agonistas de mayor potencia y mayor duración de acción (fig. 1), que han permitido su administración sc semanal, el desarrollo de dosis más altas de agentes establecidos, y posteriormente el desarrollo de fármacos con agonismo a otros receptores moleculares además de GLP-1, ya sean agonistas duales (GLP-1 y polipéptido inhibidor gástrico [GIP], GLP1 y glucagón) o triagonistas (GLP-1, GIP y glucagón), el desarrollo de moléculas pequeñas para su administración vía oral, y el desarrollo de combinaciones de agonistas de GLP-1 junto a agonistas del receptor de amilina.
Además de reducciones de HbA1c y en peso corporal de cada vez mayor magnitud, los agonistas de GLP-1 han demostrado beneficios adicionales en reducción de eventos cardiovasculares mayores (MACE), insuficiencia cardíaca, enfermedad renal y muerte cardiovascular en las personas con DM28.
En este artículo, revisaremos los mecanismos de acción, y los efectos sobre control glucémico y reducción de peso, en los programas de desarrollo clínico de los diferentes agonistas de GLP-1 actualmente en uso clínico y los que están aún en investigación en los pacientes con DM2.
Mecanismos de acción de GLP1 en la diabetesGLP-1 es una hormona intestinal con acciones generalizadas sobre el metabolismo con amplios beneficios en la DM2 y en la obesidad. Los sitios principales de expresión de receptores de GLP-1 incluyen las células β y δ pancreáticas, el músculo liso vascular, la aurícula cardíaca, el antro/píloro gástrico, y neuronas entéricas y ganglios de las raíces vagales y dorsales. En el sistema nervioso central, la expresión de GLP-1 es abundante en el área postrema, el núcleo arqueado, el núcleo paraventricular y el hipotálamo ventromedial9. Entre los numerosos efectos metabólicos del GLP-1 se encuentran la estimulación de la secreción de insulina y la supresión de glucagón dependientes de la glucosa, la disminución del vaciamiento gástrico, la inhibición de la ingesta de alimentos, además de efectos cardio y neuroprotectores10. En el páncreas los efectos de GLP-1 pueden contrarrestar el deterioro del «efecto incretina» (amplificación de la secreción de insulina cuando la glucosa se ingiere por vía oral en comparación con la infusión intravenosa) bien conocido en las personas con DM2. El mecanismo fisiopatológico detrás de este defecto incretínico se debe al efecto sinérgico de una modesta disminución en la secreción de incretinas de las células enteroendocrinas asociado a una marcada regulación a la baja de la señalización posreceptor de GLP-1R y GIPR (resistencia incretínica)11.
Recientemente se han desarrollado fármacos poliagonistas, añadiendo a GLP-1 agonismo a otros receptores moleculares como GIP, glucagón o amilina. Debido a la actividad simultánea en varios receptores metabólicamente relevantes, estos multiagonistas pueden ofrecer acciones complementarias y una mayor pérdida de peso corporal con un mejor control glucémico, asociado a una mejor tolerancia relativa con respecto a sus monoterapias constituyentes12.
Eficacia de los agonistas de GLP-1 en la DM2: control glucémicoLos agonistas de GLP-1 son fundamentales en el control glucémico, contribuyendo a reducciones significativas y sostenidas de la HbA1c.
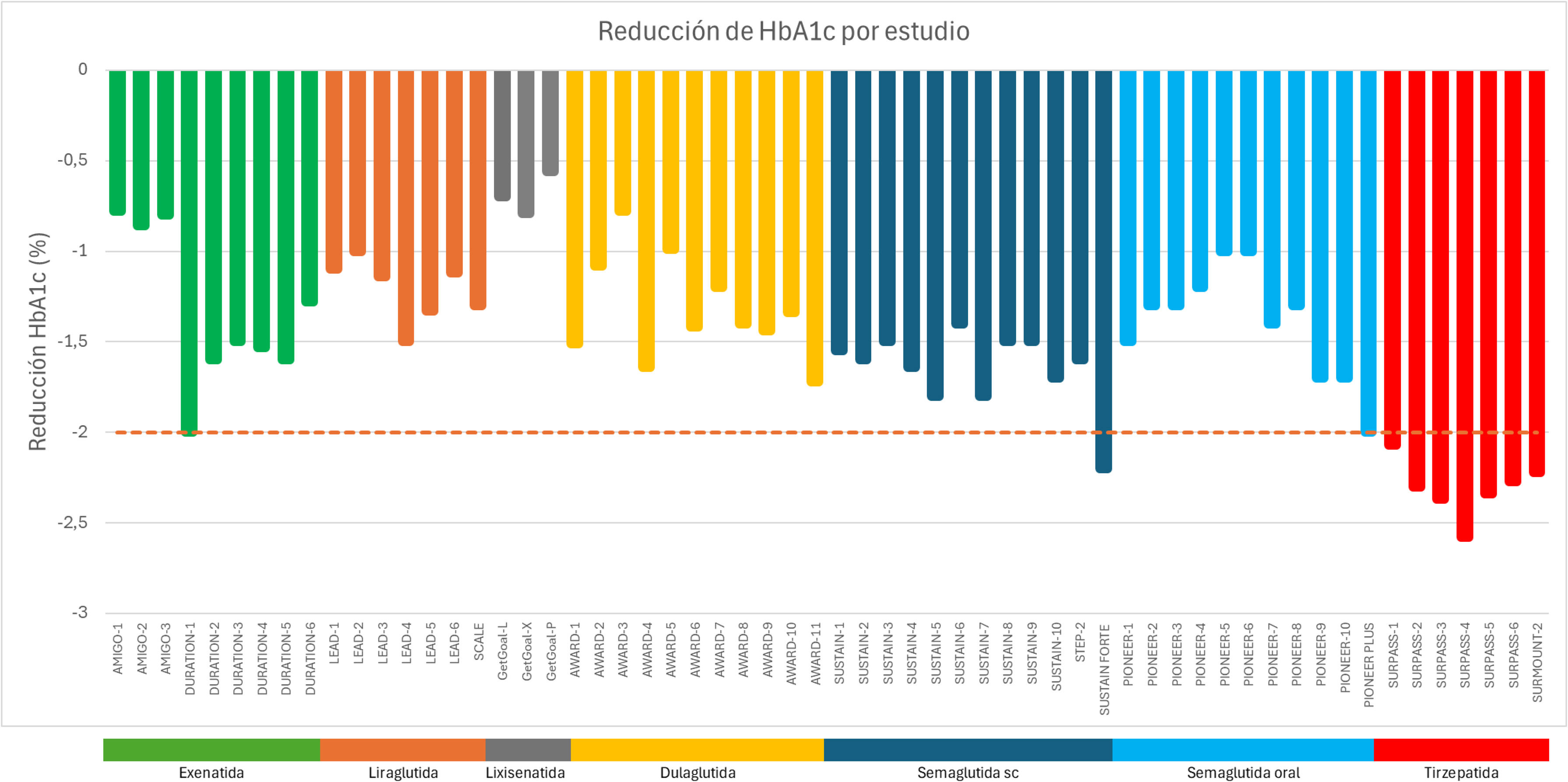
Este apartado analiza su eficacia, desde las formulaciones iniciales hasta los desarrollos más recientes, resaltando su impacto en el control metabólico y su potencial en el tratamiento de la DM2 (tabla 1 y fig. 2).
Mejoría del control glucémico basado en la reducción de la HbA1c y análisis de la reducción ponderal asociada a los agonistas del receptor de GLP-1 por estudio
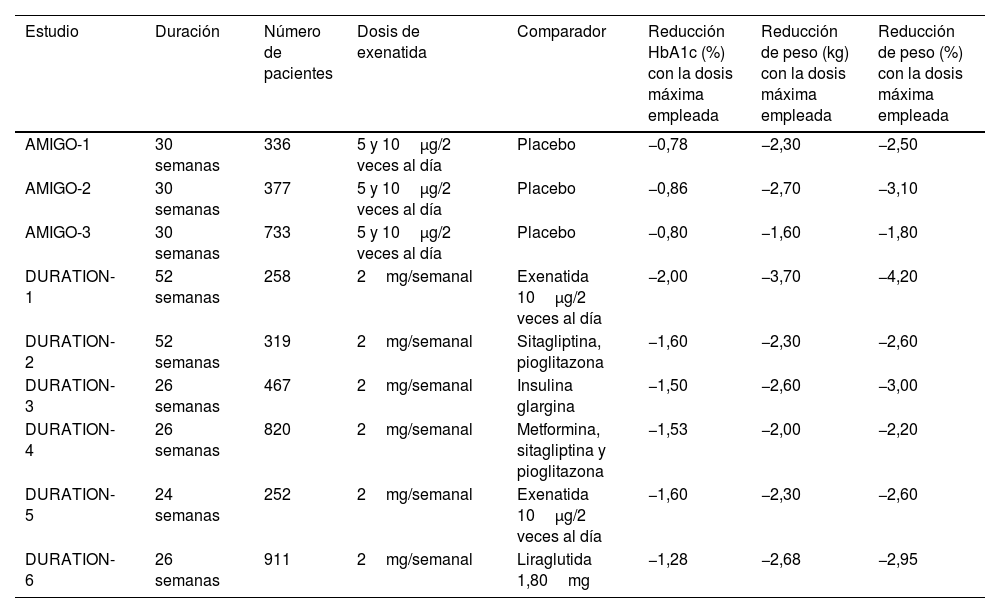
| Estudio | Duración | Número de pacientes | Dosis de exenatida | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| AMIGO-1 | 30 semanas | 336 | 5 y 10μg/2 veces al día | Placebo | −0,78 | −2,30 | −2,50 |
| AMIGO-2 | 30 semanas | 377 | 5 y 10μg/2 veces al día | Placebo | −0,86 | −2,70 | −3,10 |
| AMIGO-3 | 30 semanas | 733 | 5 y 10μg/2 veces al día | Placebo | −0,80 | −1,60 | −1,80 |
| DURATION-1 | 52 semanas | 258 | 2mg/semanal | Exenatida 10μg/2 veces al día | −2,00 | −3,70 | −4,20 |
| DURATION-2 | 52 semanas | 319 | 2mg/semanal | Sitagliptina, pioglitazona | −1,60 | −2,30 | −2,60 |
| DURATION-3 | 26 semanas | 467 | 2mg/semanal | Insulina glargina | −1,50 | −2,60 | −3,00 |
| DURATION-4 | 26 semanas | 820 | 2mg/semanal | Metformina, sitagliptina y pioglitazona | −1,53 | −2,00 | −2,20 |
| DURATION-5 | 24 semanas | 252 | 2mg/semanal | Exenatida 10μg/2 veces al día | −1,60 | −2,30 | −2,60 |
| DURATION-6 | 26 semanas | 911 | 2mg/semanal | Liraglutida 1,80mg | −1,28 | −2,68 | −2,95 |
| Estudio | Duración | Número de pacientes | Dosis de liraglutida | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| LEAD-1 | 26 semanas | 1.041 | 0,60, 1,20 y 1,80 mg | Rosiglitazona y placebo | −1,10 | −2,10 | −2,40 |
| LEAD-2 | 26 semanas | 1.091 | 0,60, 1,20 y 1,80 mg | Glimepirida y placebo | −1,00 | −2,50 | −2,70 |
| LEAD-3 | 52 semanas | 746 | 0,60, 1,20 y 1,80 mg | Glimepirida | −1,14 | −2,90 | −3,30 |
| LEAD-4 | 26 semanas | 533 | 0,60, 1,20 y 1,80 mg | Placebo | −1,50 | −1,90 | −2,10 |
| LEAD-5 | 26 semanas | 581 | 1,8 0mg | Insulina Glargina y placebo | −1,33 | −1,80 | −2,00 |
| LEAD-6 | 26 semanas | 464 | 1,80 mg | Exenatida 10μg/2 veces al día | −1,12 | −3,20 | −3,70 |
| SCALE | 56 semanas | 846 | 3,00 mg | Placebo | −1,30 | −6,00 | −6,50 |
| Estudio | Duración | Número de pacientes | Dosis de lixisenatida | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| GetGoal-L | 24 semanas | 495 | 20μg | Placebo | −0,70 | −1,80 | -−,07 |
| GetGoal-X | 26 semanas | 634 | 20μg | Exenatida 10μg/2 veces al día | −0,79 | −2,96 | −3,13 |
| GetGoal-P | 24 semanas | 484 | 20μg | Placebo | −0,56 | −0,54 | −0,58 |
| Estudio | Duración | Número de pacientes | Dosis de dulaglutida | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| AWARD-1 | 52 semanas | 978 | 0,75 y 1,50 mg | Exenatida 10μg/2 veces al día | −1,51 | −2,90 | −2,50 |
| AWARD-2 | 78 semanas | 810 | 0,75 y 1,50 mg | Insulina glargina | −1,08 | −1,87 | −2,00 |
| AWARD-3 | 52 semanas | 807 | 0,75 y 1,50 mg | Metformina | −0,78 | −2,50 | −2,30 |
| AWARD-4 | 52 semanas | 884 | 0,75 y 1,50 mg | Insulina glargina | −1,64 | −1,40 | −1,50 |
| AWARD-5 | 104 semanas | 1.098 | 0,75 y 1,50 mg | Sitagliptina y placebo | −0,99 | −2,90 | −3,00 |
| AWARD-6 | 26 semanas | 599 | 1,50 mg | Liraglutida (1,8 mg) | −1,42 | −2,30 | −2,40 |
| AWARD-7 | 52 semanas | 577 | 0,75 y 1,50 mg | Insulina glargina | −1,20 | −0,70 | −0,70 |
| AWARD-8 | 24 semanas | 300 | 1,50 mg | Placebo | −1,40 | −1,90 | −2,10 |
| AWARD-9 | 28 semanas | 300 | 1,50 mg | Placebo | −1,44 | −0,70 | −0,70 |
| AWARD-10 | 24 semanas | 424 | 1,50 mg | Placebo | −1,34 | −2,30 | −2,40 |
| AWARD-11 | 52 semanas | 1.842 | 1,50, 3 y 4,50 mg | Dulaglutida 4,50mg y dulaglutida 3mg vs. dulaglutida 1,50 mg | −1,72 | −4,60 | −4,00 |
| Estudio | Duración | Número de pacientes | Dosis de semaglutida sc | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| SUSTAIN-1 | 30 semanas | 387 | 0,50 y 1mg semaglutida semanal | Placebo | −1,55 | −4,53 | −4,78 |
| SUSTAIN-2 | 56 semanas | 1.225 | 0,50 y 1mg semaglutida semanal | Sitagliptina | −1,60 | −6,10 | −6,10 |
| SUSTAIN-3 | 56 semanas | 813 | 1mg semaglutida semanal | Exenatida semanal | −1,50 | −5,60 | −5,82 |
| SUSTAIN-4 | 30 semanas | 1.089 | 0,50 y 1mg semaglutida semanal | Insulina glargina | −1,64 | −5,17 | −5,50 |
| SUSTAIN-5 | 30 semanas | 397 | 0,50 y 1mg semaglutida semanal | Placebo | −1,80 | −6,40 | −6,90 |
| SUSTAIN-6 | 104 semanas | 3.297 | 0,50 y 1mg semaglutida semanal | Placebo | −1,40 | −4,90 | −5,30 |
| SUSTAIN-7 | 40 semanas | 1.201 | 0,50 y 1mg semaglutida semanal | Dulaglutida 0,75 y 1,5 mg | −1,80 | −6,50 | −6,77 |
| SUSTAIN-8 | 52 semanas | 788 | 1mg semaglutida semanal | Canagliflozina 300 mg | −1,50 | −5,30 | −5,85 |
| SUSTAIN-9 | 30 semanas | 302 | 1mg de semaglutida semanal | Placebo | −1,50 | −3,81 | −4,25 |
| SUSTAIN-10 | 30 semanas | 577 | 1mg semaglutida semanal | Liraglutida 1,20 mg | −1,70 | −5,80 | −6,00 |
| STEP-2 | 68 semanas | 1.210 | 2,40mg semaglutida semanal | Semaglutida 1mg semanal y placebo | −1,60 | −9,70 | −9,64 |
| SUSTAIN FORTE | 40 semanas | 961 | 2mg semaglutida semanal | Semaglutida 1mg semanal | −2,20 | −6,90 | −6,89 |
| Estudio | Duración | Número de pacientes | Dosis de semaglutida oral | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| PIONEER-1 | 26 semanas | 703 | 3, 7 y 14mg semaglutida | Placebo | −1,50 | −4,10 | −4,66 |
| PIONEER-2 | 52 semanas | 822 | 14mg semaglutida | Empagliflozina 25 mg | −1,30 | −4,70 | −5,11 |
| PIONEER-3 | 26 semanas | 1.864 | 3, 7 y14mg de semaglutida oral | Sitagliptina 100 mg | −1,30 | −3,10 | −3,39 |
| PIONEER-4 | 26 semanas | 711 | 14mg de semaglutida oral | Liraglutida 1,80 mg | −1,20 | −4,40 | −4,84 |
| PIONEER-5 | 26 semanas | 324 | 14mg de semaglutida oral | Placebo | −1,00 | −3,40 | −3,72 |
| PIONEER-6 | 62 semanas | 3.183 | 14mg semaglutida oral | Placebo | −1,00 | −4,20 | −4,62 |
| PIONEER-7 | 52 semanas | 504 | 3, 7 y 14mg semaglutida | Sitagliptina 100 mg | −1,40 | −2,90 | −3,26 |
| PIONEER-8 | 52 semanas | 731 | 3, 7 y 14mg semaglutida oral | Placebo | −1,30 | −3,70 | −4,31 |
| PIONEER-9 | 52 semanas | 243 | 3, 7 y 14mg semaglutida oral | Liraglutida 0,90 mg | −1,70 | −2,80 | −3,94 |
| PIONEER-10 | 52 semanas | 458 | 3, 7 y 14mg semaglutida oral | Dulaglutida 0,75 mg | −1,70 | −1,90 | −2,63 |
| PIONEER PLUS | 68 semanas | 1.606 | 25 y 50mg semaglutida oral | Semaglutida oral 14 mg | −2,00 | −8,00 | −8,29 |
| Estudio | Duración | Número de pacientes | Dosis de tirzepatida | Comparador | Reducción HbA1c (%) con la dosis máxima empleada | Reducción de peso (kg) con la dosis máxima empleada | Reducción de peso (%) con la dosis máxima empleada |
|---|---|---|---|---|---|---|---|
| SURPASS-1 | 40 semanas | 478 | 5, 10 y 15 mg | Placebo | −2,07 | −9,50 | −10,48 |
| SURPASS-2 | 40 semanas | 1.879 | 5, 10 y 15 mg | Semaglutida 1 mg | −2,30 | −11,20 | −11,95 |
| SURPASS-3 | 52 semanas | 1.444 | 5, 10 y 15 mg | Insulina degludec | −2,37 | −12,90 | −13,68 |
| SURPASS-4 | 52 semanas | 2.002 | 5, 10 y 15 mg | Insulina glargina | −2,58 | −11,70 | −13,00 |
| SURPASS-5 | 40 semanas | 475 | 5, 10 y 15 mg | Placebo | −2,34 | −8,80 | −9,21 |
| SURPASS-6 | 52 semanas | 1.428 | 5, 10 y 15 mg | Insulina Lispro | −2,27 | −11,00 | −12,50 |
| SURMOUNT-2 | 72 semanas | 938 | 10 y 15 mg | Placebo | −2,22 | −14,80 | −14,70 |
Exenatida 2 veces al día (2005): Administración sc 2 veces al día.
Fue el primer agonista del receptor de GLP-1 en uso clínico. Es un derivado de la exendina-4, que es un péptido aislado del veneno salivar del Heloderma suspectum cuya estructura es similar al GLP-1 humano. Tiene una vida media plasmática corta de aproximadamente 2,4h, lo que hace necesario que su administración sea 2 veces al día para lograr un efecto continuo. En los estudios AMIGO (Diabetes Management for Improving Glucose Outcomes), que fueron 3 ensayos aleatorizados, triple ciego, controlados con placebo y multicéntricos de 30 semanas que tenían un diseño similar, se evaluó el impacto del tratamiento con exenatida 2 veces al día (en dosis de 5 y 10μg) en el control glucémico en los pacientes con DM2 con mal control metabólico que estuvieran en tratamiento con metformina y/o sulfonilurea13–15. En la semana 30, la administración de la dosis de 10μg de exenatida produjo una reducción media de la HbA1c de −0,8 a −0,9% en comparación con −0,16 a +0,08% en el grupo placebo.
Liraglutida (2009): Administración sc una vez al día.
Liraglutida es un agonista de GLP-1 modificado con un ácido graso que permite su unión a la albúmina, extendiendo su vida media a aproximadamente 13h, y permitiendo una administración diaria. Las dosis disponibles de liraglutida incluyen 0,60, 1,20 y 1,80mg administrados por vía sc una vez al día (pudiendo llegarse hasta la dosis de 3mg en las presentaciones para su aplicación en obesidad).
En los estudios LEAD (Liraglutide Effect and Action in Diabetes), concretamente en el LEAD-1 y 216,17, la dosis de liraglutida 1,80mg logró reducciones de HbA1c de −1,10 y −1,00%, respectivamente. En el caso de LEAD-418, los resultados mostraron reducciones de HbA1c de hasta −1,50%. Asimismo, liraglutida demostró una mayor eficacia en la reducción de HbA1c en comparación con otros tratamientos como fue el caso en el estudio LEAD-6, donde liraglutida 1,80mg produjo una reducción de HbA1c de −1,12% en comparación con −0,79% que presentó exenatida 2 veces al día19.
Exenatida lar (2012): Administración sc una vez a la semana.
Exenatida LAR es una formulación de liberación prolongada encapsulada en microesferas de poliglicol que permite su administración semanal. La vida media es de aproximadamente 7-10 días. Esta formulación está disponible en una dosis de 2mg administrado una vez por semana por vía sc. La serie de estudios DURATION muestran que la formulación semanal es superior frente a exenatida dos veces al día en la reducción de HbA1c, con reducciones de HbA1c de −2,00 vs. −1,50%, respectivamente (DURATION-1)20 y −1,60 vs. −0,90% (DURATION-5)21; sin embargo, no se mostró superior a liraglutida −1,28 vs. −1,48% (DURATION-6)22.
Lixisenatida (2013): Administración sc una vez al día.
Lixisenatida es un agonista de exendina-4 (al igual que exenatida), que se administra una vez al día debido a su vida media de 2-4h. Está disponible en dosis de 10 y 20μg. En el estudio GetGoal-X, lixisenatida mostró una reducción en HbA1c de −0,79% en comparación con una reducción de −0,96% observada con exenatida dos veces al día23.
Dulaglutida (2014): Administración sc una vez a la semana.
Dulaglutida es una proteína de fusión que contiene una secuencia de GLP-1 fusionada al fragmento Fc de IgG4, con una vida media más larga, lo que le permite una administración semanal. Las dosis disponibles incluyen 0,75, 1,50, 3 y 4,50mg, administradas por vía sc una vez por semana.
En los estudios AWARD, dulaglutida mostró reducciones de HbA1c de hasta −1,51 vs. −0,99% con exenatida 2 veces al día (AWARD 1)24 y −1,42 vs. −1,36% con liraglutida (AWARD-6)25.
En el estudio AWARD-11, que evaluó las dosis más altas de 3 y 4,50mg, dulaglutida 4,50mg proporcionó una reducción superior de HbA1c en comparación con la dosis de 1,50mg. Específicamente, la reducción media de HbA1c a las 36 semanas fue de −1,77% (−1,72% cuando se evaluó a las 52 semanas) con la dosis de 4,50mg vs. −1,54% con la de 1,50mg26.
Semaglutida inyectable (2017): Administración sc una vez a la semana.
Semaglutida inyectable es un agonista de GLP-1 modificado para prolongar la unión a la albúmina, permitiendo una administración semanal gracias a su vida media de 7 días. Semaglutida inyectable está disponible en dosis de 0,25, 0,50 y 1mg administrados una vez por semana (pudiendo llegar hasta la dosis de 2,40mg en su presentación para el tratamiento de la obesidad). En los estudios SUSTAIN (Semaglutide Unabated Sustainability in Treatment of Type 2 Diabetes) 1-10, la reducción de HbA1c con semaglutida 1mg fue entre −1,50 a −1,80%, comparada con exenatida semanal (−0,90%) en SUSTAIN-327, dulaglutida 1,50mg (−1,40%) en SUSTAIN-728 y liraglutida 1,20mg (−1,00%) en SUSTAIN-1029.
En el estudio SUSTAIN FORTE realizado con semaglutida 2mg semanal comparado con la dosis de 1mg semanal, semaglutida 2mg produjo una reducción de −2,20% de HbA1c, mostrando mejores resultados que la dosis de semaglutida 1mg (−1,90%)30.
Semaglutida oral (2019): Administración oral una vez al día (en ayunas, por la mañana separado de la comida, bebida u otros medicamentos).
Semaglutida oral contiene un componente llamado SNAC (ácido salcaprozato sódico), que facilita la absorción de semaglutida en el estómago. SNAC permite que la semaglutida se absorba en la circulación sistémica sin descomponerse en el tracto digestivo, lo cual es un desafío común para los péptidos administrados por vía oral. Está disponible en dosis de 3, 7 y 14mg administrados una vez al día. En los estudios PIONEER, semaglutida oral 14mg mostró una reducción de HbA1c de −1,20% en comparación con liraglutida 1,80mg (−1,10%) en el estudio PIONEER-431 y de −1,70% en comparación con dulaglutida 0,75mg (−1,40%) en el estudio PIONEER-1032.
Además, un estudio más reciente denominado PIONEER PLUS mostró que la semaglutida oral en dosis de 25 y 50mg (aún no comercializadas) fueron superiores a la dosis de 14mg para reducir la HbA1c (−1,80, −2,00 y −1,50%, respectivamente), en adultos con DM2 no controlada de forma adecuada33.
Orforglipron (en fase iii): Administración oral una vez al día.
Orforglipron es un agonista parcial del receptor GLP-1 de administración oral que se encuentra en fase de investigación. Este agonismo parcial parece producir una menor desensibilización del receptor en comparación con los agonistas del receptor de GLP-1 completos22. Las dosis en investigación incluyen hasta 45mg diarios. En un ensayo clínico de fase 2 que evaluó su uso en DM2, orforglipron redujo significativamente la HbA1c −2,10% en comparación con −1,10% para dulaglutida y −0,43% para placebo34.
Agonistas duales del receptor GLP-1/GIPTirzepatida (2022): Administración sc una vez a la semana.
Tirzepatida es un agonista dual que actúa sobre los receptores de GLP-1 y de GIP. Los agonistas duales GLP-1/GIP, ofrecen beneficios adicionales frente a los agonistas de GLP-1 al activar simultáneamente ambos receptores. Esta combinación potencia el control glucémico y la pérdida de peso, ya que mejora la secreción de insulina, reduce la resistencia a esta, y modula el metabolismo de los lípidos, lo que contribuye a una mayor pérdida de grasa. Además, los agonistas duales tienden a ser mejor tolerados, con menos efectos gastrointestinales.
En los estudios SURPASS, tirzepatida 15mg redujo la HbA1c en −2,07% en comparación con placebo (+0,04%) en el estudio SURPASS-135 y −2,30% en comparación con semaglutida inyectable que la redujo un −1,86% en el estudio SURPASS-236. Asimismo, en el estudio SURPASS-4, tirzepatida mostró una disminución significativa de la HbA1c en comparación con la insulina glargina tras 52 semanas, logrando una reducción promedio de −2,58% con la dosis de 15mg vs. −1,44% con insulina glargina37.
Agonistas duales del receptor GLP-1 y glucagónMazdutida (en fase iii): Administración sc una vez a la semana
Mazdutida es un agonista dual de GLP-1 y glucagón, en fase de investigación. La activación adicional del receptor de glucagón puede incrementar el gasto energético, estimulando la termogénesis y promoviendo la lipólisis. Esta combinación podría potenciar la pérdida de peso de forma más efectiva que los agonistas de GLP-1 convencionales. Su formulación permite una administración semanal gracias a una vida media prolongada. En un ensayo fase II, mazdutida mostró reducciones en HbA1c entre −1,41% y −1,67% en comparación con −1,35% para dulaglutida y +0,03% para placebo38.
Triagonistas del receptor GLP-1/GIP/glucagónRetatrutida (en fase iii): Administración sc una vez a la semana.
Retatrutida es un triagonista en fase de investigación que actúa sobre los receptores de GLP-1, GIP y glucagón. Esta triple acción permite efectos sinérgicos sobre la regulación de la glucosa, el peso corporal y el metabolismo lipídico. Formulado para administración semanal, retatrutida está en fase III, con una vida media que permite la dosificación semanal. En ensayos clínicos de fase II, retatrutida redujo la HbA1c en −2,02 vs. −1,41% que consiguió dulaglutida y −0,01% en la rama de placebo39.
Coagonista de GLP-1 y cagrilintidaCagrisema (en fase iii): Administración sc una vez a la semana.
CagriSema es una combinación de semaglutida y cagrilintida, un análogo de amilina que actúa sobre la saciedad y el control del apetito. Al combinar estos 2 mecanismos complementarios, CagriSema tiene el potencial de ofrecer beneficios adicionales sobre el peso y el control glucémico en comparación con los agonistas de GLP-1 aislados. Su farmacocinética permite una administración semanal. En un estudio de fase II, CagriSema redujo la HbA1c en −2,20% comparado con −1,80% para semaglutida y −0,90% para cagrilintida cuando se administraron por separado40.
Eficacia de los agonistas de GLP-1 en DM2: control ponderalLos agonistas del GLP-1 desempeñan un papel fundamental también en la reducción del peso corporal, facilitando reducciones sostenidas y clínicamente relevantes.
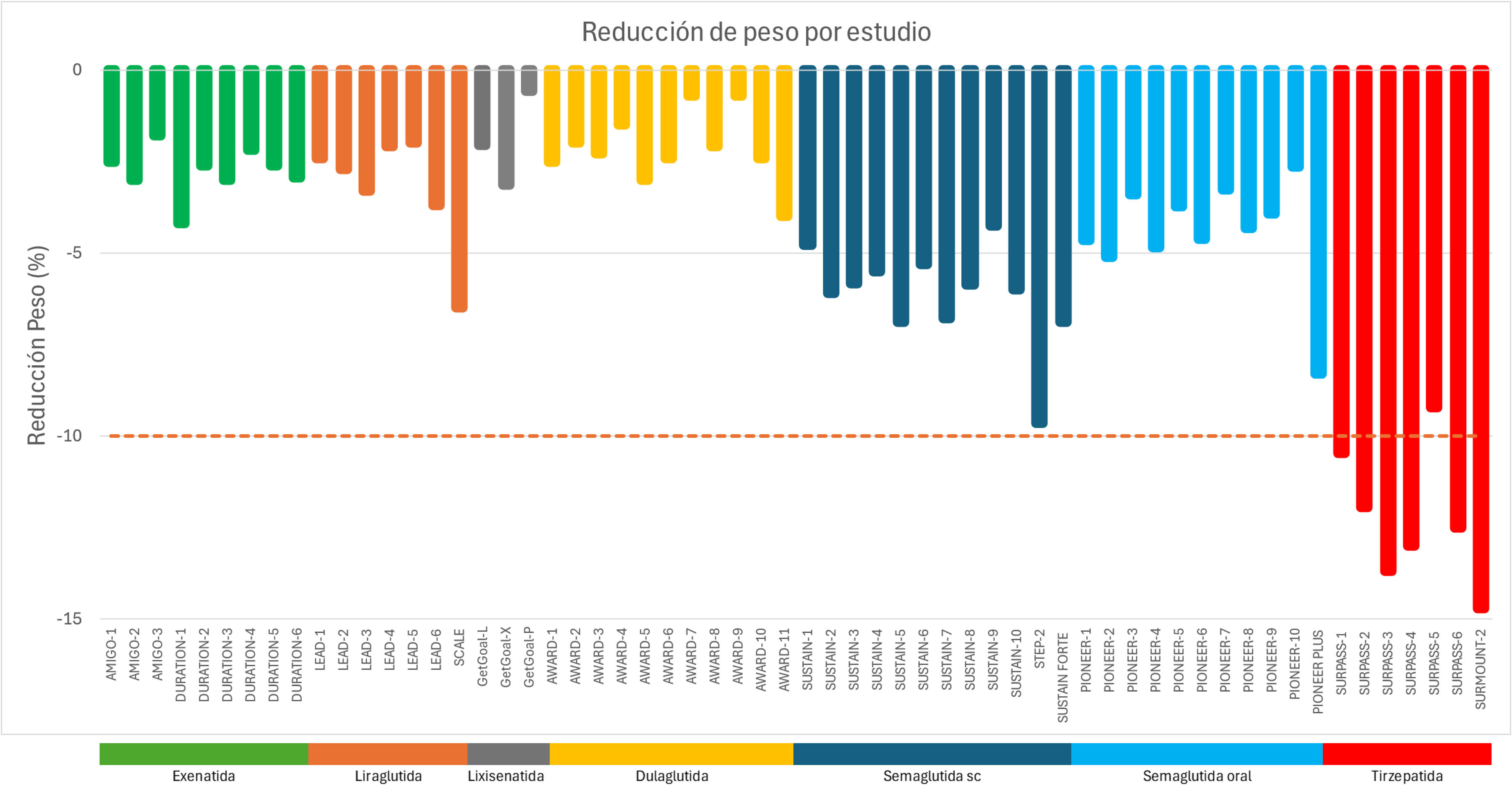
Este apartado aborda su eficacia, desde las primeras formulaciones hasta los desarrollos más recientes, resaltando su influencia en la reducción ponderal y su potencial en el manejo de la obesidad (tabla 1 y fig. 3).
Aunque la evolución del desarrollo de esta clase farmacológica en personas con diabetes ha permitido alcanzar pérdidas de peso que ya superan el 10% (fig. 3), es de reseñar que las pérdidas de peso observadas con la terapia con GLP1 es menor en personas con diabetes que en personas con un peso basal similar sin diabetes. Las causas de estas discrepancias siguen siendo en gran medida desconocidas.
Monoagonistas GLP1Exenatida 2 veces al día (2005): Administración sc 2 veces al día.
En los estudios AMIGO, exenatida sc 2 veces al día a dosis de 5 y 10μg, mostró una pérdida ponderal promedio de 1,60 a 2,70kg, lo que representó entre 1,80 y 3,10% del peso corporal inicial14.
Liraglutida (2009): Administración sc una vez al día.
Los estudios LEAD investigaron la eficacia de liraglutida (1,80mg diario) en DM2, presentando una perdida ponderal promedio en los estudios de −2,10 a −3,30%18. El estudio LEAD-6 comparó la eficacia y seguridad de liraglutida (1,80mg una vez al día) frente a exenatida (10μg dos veces al día), tras 26 semanas, liraglutida mostró una mayor reducción de peso (−3,24 vs. −2,87kg) en comparación con exenatida19. El estudio SCALE (Satiety an Adiposity - Liraglutide Evidence in Non-diabetic and Diabetic Individuals) evaluó liraglutida 3mg en los pacientes con DM2 y obesidad, encontrando una reducción de −6kg en promedio en 56 semanas de seguimiento41.
Exenatida lar (2012): Administración sc una vez a la semana.
La serie de estudios DURATION evaluó la formulación de exenatida de liberación prolongada (2mg una vez por semana). Los resultados mostraron una reducción de peso con una pérdida ponderal promedio de 2 a 3,70kg, lo que representó entre 2,60 y 4,20% del peso corporal inicial20,42.
Lixisenatida (2013): Administración sc una vez al día.
La serie de estudios GetGoal se evaluó lixisenatida a dosis de 20μg cada 24h. Los resultados mostraron una reducción de peso modesta destacando en el estudio GetGoal X una reducción de peso de 2,96kg, lo que representa un 3,13% del peso corporal inicial23.
Dulaglutida (2014): Administración sc una vez a la semana.
En los estudios AWARD, el tratamiento con dulaglutida a dosis de 1,50mg semanal se asoció a una perdida ponderal promedio entre 0,70-2,90kg (0,70-3,00%)24,43, la pérdida de peso se mantuvo de forma consistente durante 104 semanas de seguimiento en el estudio AWARD-544. En el estudio AWARD-11 se evaluó el tratamiento con dosis de 1,50, 3 y 4,50mg de dulaglutida presentando una perdida ponderal promedio de 2,40, 3 y 4kg, respectivamente (2,40, 3,20 y 4%)26.
Semaglutida inyectable (2017): Administración sc una vez a la semana.
En los estudios SUSTAIN, realizados con dosis de 0,50-1mg de semaglutida, se observó una pérdida de peso promedio que varió entre 3,81 y 6,50kg (lo que corresponde a un 4,25-6,77% de pérdida ponderal). En los estudios SUSTAIN-3, SUSTAIN-7 y SUSTAIN-10, se compararon los efectos de semaglutida con otros agonistas de GLP-1, mostrando diferencias significativas en todos los casos27,29,45. El SUSTAIN-6, con seguimiento de 104 semanas, evidenció que la pérdida de peso se mantenía, alcanzando una reducción de 4,90kg con la dosis de 1mg46. En el estudio SUSTAIN-FORTE se evidencia una mayor perdida ponderal con la dosis de 2mg de semaglutida (6,9kg, que representa un 6,89% del peso inicial)30.
Dentro del programa STEP (Semaglutide Treatment Effect in People with Obesity), en STEP-2 se evaluó el efecto de la dosis de 2,40mg de semaglutida en personas con obesidad y DM2 durante 68 semanas. En este estudio, los pacientes experimentaron una pérdida de peso promedio de 9,70kg (equivalente a 9,64% de pérdida ponderal)47.
Semaglutida oral (2019): Administración oral una vez al día.
En los estudios de la serie PIONEER, se evaluó la eficacia de la semaglutida oral en el tratamiento de la DM2, siendo esta la primera formulación de un agonista de GLP-1 administrado por vía oral. Los estudios realizados en personas con DM2 y obesidad (IMC>30kg/m2) mostraron que con la dosis de 14mg de semaglutida, los pacientes experimentaron una pérdida ponderal que varió entre 2,90 y 4,70kg, lo que representa una disminución del peso corporal de entre 3,26 y 5,11%48,49. Por otro lado, en los estudios PIONEER-9 y PIONEER-10, realizados específicamente en población japonesa con sobrepeso, la pérdida ponderal observada fue más modesta en comparación con los estudios previos32,50. En el estudio PIONEER-PLUS, con dosis de semaglutida oral de 25 y 50mg se observaron una mayor perdida ponderal alcanzando los 6,7 y 8kg, respectivamente (6,85-8,29% de peso)33.
Orforglipron (en fase iii): Administración oral una vez al día.
Actualmente en fase III, en el estudio fase II en 26 semanas, orforglipron en dosis de 12mg o más se asoció a pérdidas de peso de hasta –10,10kg, siendo superior a placebo y a dulaglutide34.
Agonistas duales del receptor GLP-1/GIPTirzepatida (2022): Administración sc una vez a la semana.
La serie de estudios SURPASS evaluó la eficacia de tirzepatida en el control de peso y manejo de la DM2, mostrando una pérdida ponderal significativa en comparación con placebo y otros tratamientos antidiabéticos. La duración de los estudios fue de entre 40 y 52 semanas de duración, en los que tirzepatida se administró en dosis de 5, 10, y 15mg, presentando una perdida ponderal de 8,80 a 12,90kg (9,21-13,68%) con la dosis más alta51,52. En el SURPASS-2, al comparar tirzepatida con semaglutida 1mg, la pérdida de peso fue estadísticamente significativa con las 3 dosis de tirzepatida36. Estudios de mayor duración, como el SURMOUNT-2 de 72 semanas, documentaron una pérdida ponderal de hasta 14,80kg (14,70%) en los pacientes con obesidad (IMC 36,10kg/m2)53. En los estudios un alto porcentaje de pacientes lograron al menos una pérdida del 5% de su peso inicial, especialmente en dosis más altas de tirzepatida (10 y 15mg).
Agonistas duales del receptor GLP-1 y glucagónMazdutida (en fase iii): Administración sc una vez a la semana
En un ensayo fase II, los cambios porcentuales medios en el peso corporal desde el inicio hasta la semana 20 dependieron de la dosis y fueron de hasta −7,10% con mazdutida (−2,70% con dulaglutida y −1,40% con placebo)38.
Triagonistas del receptor GLP-1/GIP/glucagónRetatrutida (en fase iii): Administración sc una vez a la semana.
En el estudio en fase II, a 36 semanas se observaron reducciones en el peso corporal dosis dependientes con retatrutida, alcanzando reducciones superiores al 16 vs. 3,00% (0,86kg) con placebo y 2,02% (0,72kg) con 1,5mg de dulaglutida39.
Coagonista de GLP-1 y cagrilintidaCagrisema (en fase iii): Administración sc una vez a la semana.
En fase II el cambio medio en el peso corporal desde el inicio hasta la semana 32 fue de −15,6% con CagriSema vs. −5,1% con semaglutida (p<0,0001) y −8,1% con cagrilintida (p<0,0001)40.
ConclusiónEl incremento global de la obesidad y su estrecha relación con la DM2, han impulsado el desarrollo de tratamientos cada vez más eficaces como los agonistas del receptor de GLP-1. Los monoagonistas han demostrado ser efectivos para mejorar el control glucémico y reducir el peso corporal, además de ofrecer beneficios cardiovasculares. Estos están disponibles en formulaciones tanto inyectables como orales, lo que amplía sus opciones de uso.
Los agonistas duales, que combinan GLP-1 y GIP, aportan ventajas adicionales, como una mayor pérdida de peso y un control glucémico más eficiente. Por su parte, los coagonistas GLP-1/glucagón tienen el potencial de aumentar el gasto energético y promover la lipólisis, lo que podría favorecer una mayor reducción de peso, aunque se requiere más investigación sobre su seguridad y efectos a largo plazo.
Los coagonistas GLP-1/amilina, como CagriSema (semaglutida más cagrilintida), han mostrado resultados alentadores en la pérdida de peso al aumentar la saciedad y controlar el apetito, así como en la reducción de la HbA1c. Y, finalmente, los triagonistas, que actúan sobre GLP-1, GIP y glucagón, ofrecen una regulación metabólica más completa y un gran potencial para la pérdida de peso. A pesar de esto, al igual que el resto de los fármacos que están en fase III, su perfil de seguridad y eficacia todavía está siendo evaluado, y su comercialización dependerá de su tolerancia y viabilidad económica.
Cada una de estas categorías representa una alternativa terapéutica valiosa con resultados prometedores en el control de la DM2 y la obesidad, facilitando un tratamiento más personalizado para cada paciente.
Consideraciones éticasAl tratarse de una revisión bibliográfica, no se requirieron.
FinanciaciónViyey Kishore Doulatram-Gamgaram es beneficiario de un contrato de investigación de la Junta de Andalucía (RHE-0038-2024).
Conflicto de interesesSergio Valdés declara haber recibido apoyo financiero por asistencia a congresos y honorarios como ponente en actividades promovidas por Novo Nordisk y Lilly.