¿ INTRODUCCIÓN
Los tumores cerebrales representan el tumor sólido más frecuente en la edad pediátrica, siendo los astrocitomas los más comunes.1 A nivel mundial representan 60% y son más frecuentes en el sexo masculino, la raza blanca y en menores de cinco años.2 En estudios realizados en población del D. F, la incidencia es de 17 casos por millón por año. La frecuencia de presentación de los tumores cerebrales es de 12%.3
Los estudios publicados sobre factores pronósticos en pacientes con gliomas, se basan en estudios clínicos y de población, como el de Ohgaki y Kleihues.4
La apoptosis o muerte celular programada, es una forma de suicidio celular genéticamente definida, que ocurre de manera fisiológica durante la morfogénesis, la renovación tisular y en la regulación del sistema inmunitario. Se considera que la apoptosis es un mecanismo fisiológico de muerte que se desencadena por diversas señales, las cuales pueden ser fisiológicas o estímulos exógenos ambientales. Las vías de señalización de la apoptosis son dos: la intrínseca y la extrínseca. La vía intrínseca (mitocondrial) se desarrolla cuando la célula esta expuesta a un gran estrés como ocurre cuando se daña la cadena de DNA; la vía extrínseca (citoplasmática) es activada cuando algún ligando pro-apoptótico como Apo2L/TRAIL (de la familia de los Factores de Necrosis Tumoral) se une a un receptor pro-apoptótico como el DR4 y DR5.5 Tanto la vía intrínseca como la extrínseca convergen en la activación de enzimas intracelulares denominadas caspasas, quienes finalmente llevan a la destrucción de las proteínas celulares y con esto la muerte de la célula.6,7 El entendimiento de la apoptosis ha sentado las bases de nuevas terapias que pueden inducir la muerte de las células cancerosas o sensibilizarlas contra los agentes citotóxicos y la radioterapia.8 Estos nuevos agentes incluyen aquellos para la vía extrínseca como el ligando del receptor uno del factor de necrosis tumoral y aquellos de la vía intrínseca como los de la familia BCL-2 como oligonucleótidos antisentido.9 El fracaso en la inducción de la apoptosis constituye una de las principales causas de la resistencia a la quimioterapia en los tumores malignos.10 Dado que determinados hechos celulares pueden ser explicados por trastornos en la regulación de los genes responsables de la apoptosis, como es el caso de la transformación y progresión tumorales,11 se postula que debe de existir una relación entre la subexpresión en las vías de la apoptosis y la presencia de alteraciones cromosómicas.12-25
El objetivo del presente trabajo fue determinar si existe correlación entre la expresión de la apoptosis con la respuesta al tratamiento y sobrevida en niños con astrocitoma.
¿ MÉTODOS
El presente estudio se realizó en la UMAE Hospital de Pediatría Centro Médico Nacional Siglo XXI. De manera subsecuente, se incluyó a 10 pacientes con diagnóstico de astrocitoma confirmado por el servicio de Patología. Se recolectaron los datos clínicos así como de imagen y se estudiaron tanto las vías intrínsecas como extrínsecas de la apoptosis.
Para la determinación de las vías de la apoptosis se realizó el siguiente procedimiento:
Extracción de RNA total: A partir del tejido tumoral extraído, inmediatamente después de la resección, se llevó a cabo la extracción de RNA total, siguiendo el protocolo de Chomczynski y colaboradores (1987) modificado, mediante TRIzol Reagent (Invitrogen) de la siguiente manera:
Se pesó y homogenizó el tejido manteniéndolo siempre dentro de nitrógeno líquido; después se adicionaron 700 mL de TRIzol, agitándose y dejándose cinco minutos a temperatura ambiente. Se añadieron 40 mL de cloroformo, se agitó durante 15 segundos y se dejó reposar cinco minutos a temperatura ambiente. Se centrifugó nuevamente durante 15 minutos a 13 000 rpm a 4°C. Se recuperó la fase acuosa y se adicionó isopropanol en relación 1:1; después se llevó a cabo una tercera centrifugación de cinco minutos a 7500 rpm a 4°C. Se decantó el isopropanol y se lavó la pastilla con etanol al 70%; esta pastilla se centrifugó durante 10 minutos a 7500 rpm a 4°C, se decantó el etanol y se secó la pastilla a temperatura ambiente, para finalmente hidratarla con 30-50 ml de H2O DEPC.
Cuantificación de RNA: El análisis cualitativo del RNA total en las muestras procesadas, se llevó a cabo mediante electroforesis en gel de agarosa al 2%, revelado con bromuro de etidio y luz UV.
La cuantificación se llevó a cabo en un espectrofotómetro (Eppendorf Biophotometer), calibrado a una longitud de onda de ultravioleta a 260 nm;
Para llevar a cabo P C R de cada uno de los genes seleccionados, se utilizaron los iniciadores diseñados para este estudio. Para dicho diseño, se realizó una búsqueda de la secuencia de RNAm correspondiente a cada uno de los transcritos en la base de datos Entrez nucleotide del NCBI, posteriormente se utilizó el programa OLIGO, copiando las secuencias encontradas, dónde se comenzó a buscar una región polimórfica, que presentara menos de 40% de CG, ya que un contenido mayor eleva la TM (temperatura en que se alinean); ubicando la posición donde la G sea más negativa ya que esto le confiere mayor estabilidad, flanqueándola con dos secuencias complementarias en los extremos 5´-3´. Se analizaron la formación de dímeros y la auto complementariedad (plegamiento), la longitud del fragmento obtenido y finalmente se calculó el porcentaje de compatibilidad de los iniciadores u oligonucleótidos. La reacción en cadena de la polimerasa (PCR) para cada gen se realizó con los respectivos programas de amplificación, partiendo del siguiente programa estándar: desnaturalización a 95°C, durante 10 minutos, seguido por 40 ciclos de 95°C por 20 segundos, a 54°C por 20 segundos 72°C por 30 segundos con una extensión final a 72°C por cinco minutos.
Identificación de proteínas relacionadas con apoptosis y proliferación celular mediante Inmunohistoquímica: Se tomaron secciones de tejido tumoral de aproximadamente 1cm3 de diferentes sitios. Las muestras se colocaron en frascos con formol al 10% en solución amortiguadora de fosfatos para su fijación, por un periodo no mayor de 48 horas. Una vez fijadas, las muestras se procesaron mediante técnicas rutinarias de histopatología, se incluyeron en parafina y se cortaran en micrótomo a cuatro micrómetros. Los cortes se tiñeron con Hematoxilina-Eosina. El examen histológico se llevó a cabo mediante microscopía óptica.
Como anticuerpo primario se aplicaron los anticuerpos survivina (monoclonal de ratón), caspasa ocho (policlonal de conejo) de Novus Biological (USA) y Ki-67 (monoclonal de raton), BCL-xL (policlonal de conejo), TRAIL (policlonal de conejo), PCNA (monoclonal de conejo) y fosfo p53-Thr81 (policlonal de raton) de Cell Signaling (USA).
La evaluación se hizo usando microscopía óptica. Como controles positivos se usaron inicialmente cortes de astrocitomas positivos a Ki-67 y como control negativo, cortes sin anticuerpo primario.
Se establecieron las mejores condiciones de procesamiento del protocolo modificado para determinar la dilución del anticuerpo primario más alta que permitiera la detección adecuada de cada una de las proteínas en los cortes de tejidos tumorales de controles.
Igualmente se realizó técnica de microarreglos para la determinación de genes alterados tanto de la vía intrínseca como la extrínseca de la apoptosis
Análisis estadístico: De acuerdo con la escala de medición de las variables se realizó estadística descriptiva con medidas de tendencia central y de dispersión.
¿ RESULTADOS
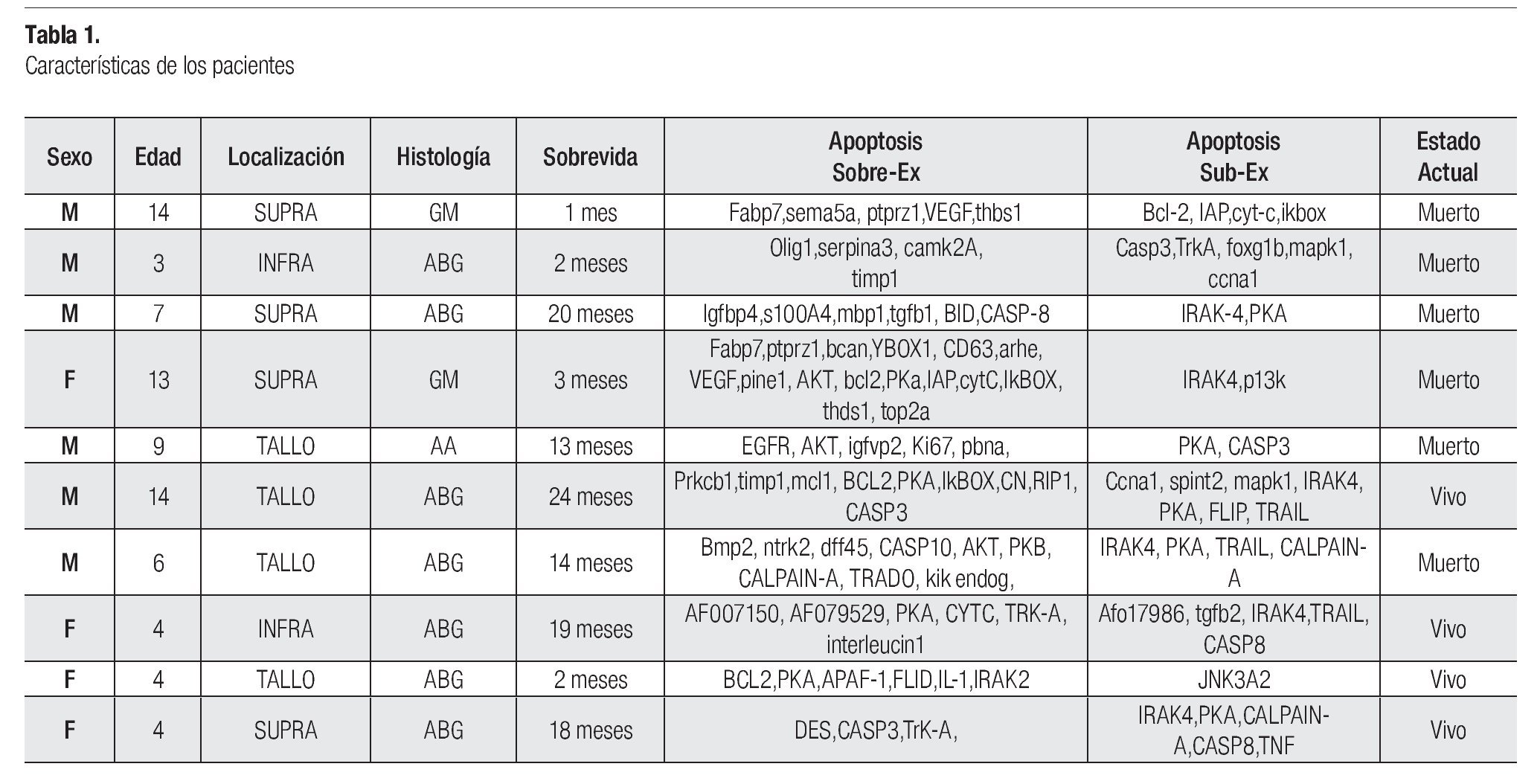
En el presente trabajo, se incluyó a un total de 10 pacientes portadores de astrocitoma diagnosticados en el servicio de Patología del Hospital de Pediatría CMN Siglo XXI del IMSS. De los 10 pacientes estudiados, en todos fue posible determinar las vías de la apoptosis, al contar con muestra suficiente para la extracción del RNA. La media de edad fue de 7.8 años con un rango de tres a 14 años. La relación hombre:mujer fue de 1.5:1, seis hombres y cuatro mujeres (Tabla 1).
Por histología: siete fueron astrocitomas de bajo grado, uno fue astrocitoma anaplásico y dos glioblastomas multiformes.
Por localización: cuatro fueron supratentoriales, dos de cerebelo y cuatro de tallo. De los supratentoriales uno fue en tálamo, uno intraventricular, uno temporoparietal y uno parietal.
De los 10 pacientes incluidos, seis fallecieron y cuatro están vivos.
En todos los pacientes se encontró alteración en alguna vía de la apoptosis, ya sea en la vía intrínseca como extrínseca.
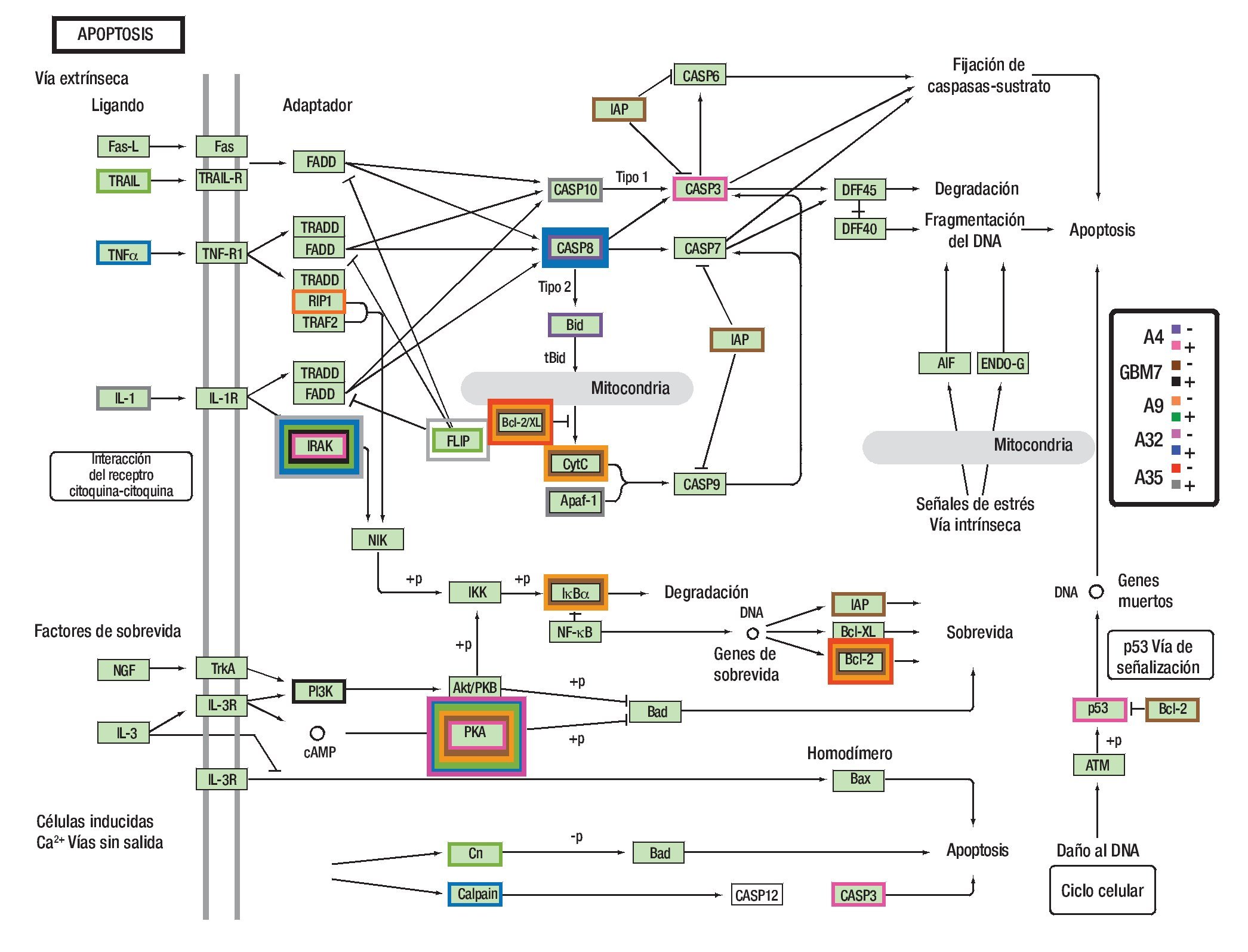
Llamó la atención que en seis de los 10 estudiados, existió una alteración en las caspasas ya sea que estuvieran subexpresadas o sobre expresadas (Figura 1).
Figura 1. Expresión de la caspasas.
PACIENTE - 1 CGLJ
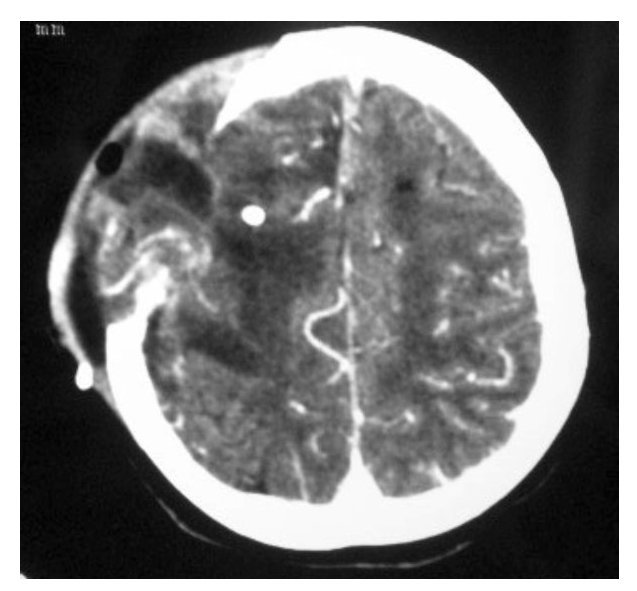
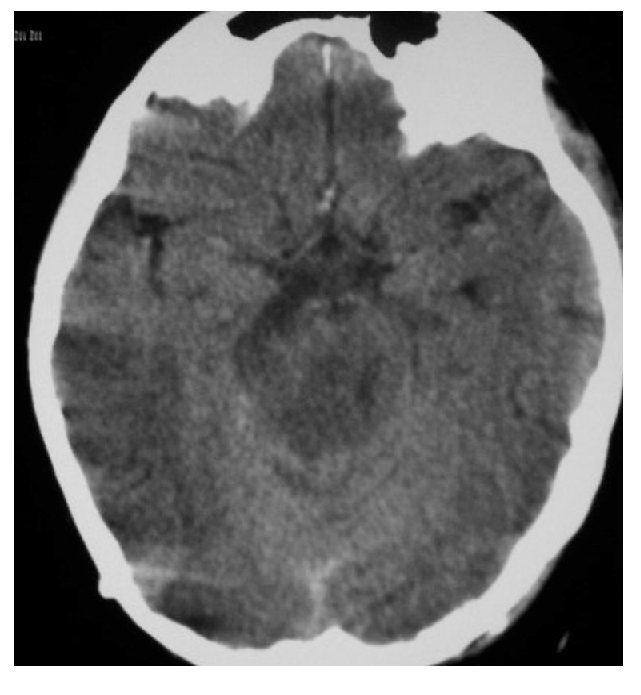
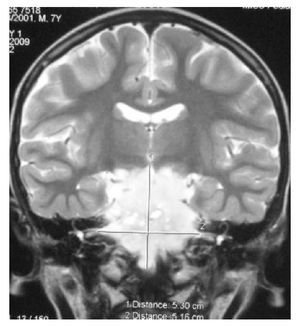
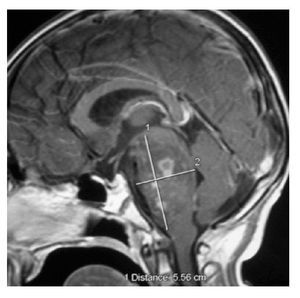
Hombre de 14 años de edad: se diagnosticó en octubre de 2008, con un glioblastoma multiforme intraventricular; se realizó resección parcial y recibió un ciclo de Quimioterapia (QT) con Ifosfamida, Carboplatino y Etoposido (ICE).
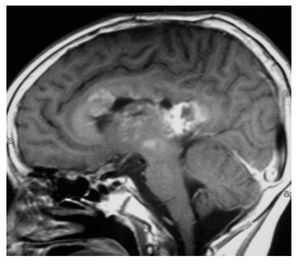
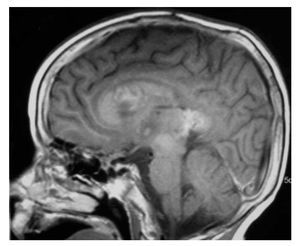
Falleció en noviembre de 2008 por progresión tumoral (Figuras 2 y 3).
Figura 2.
Figura 3.
PACIENTE - 2 VHI
Hombre de tres años de edad; se diagnosticó en agosto de 2007 con un astrocitoma de bajo grado de cerebelo, se realizó resección completa y se envió a Radioterapia, sin embargo fallece en octubre de 2007, por sangrado de tubo digestivo.
PACIENTE - 3 MPG
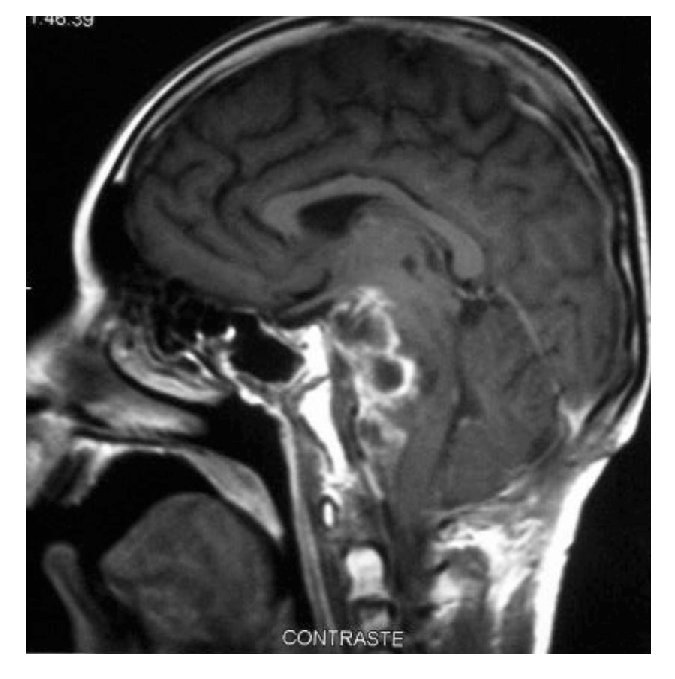
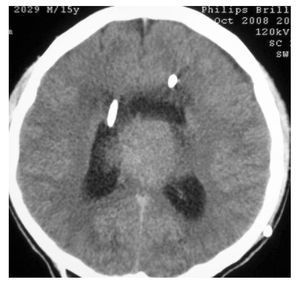
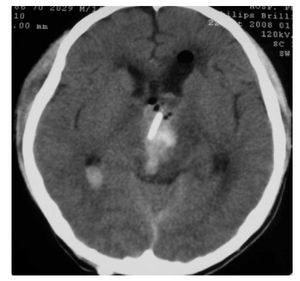
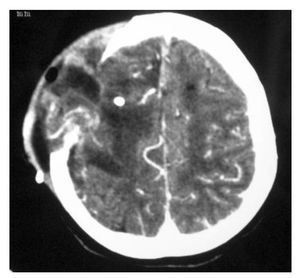
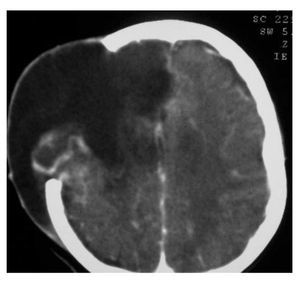
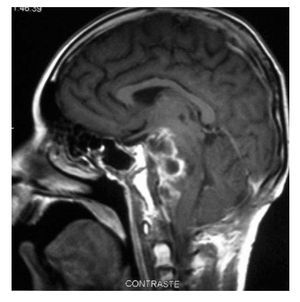
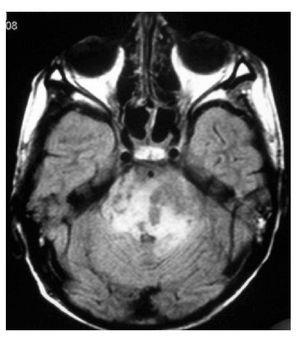
Hombre de siete años de edad; se diagnosticó en octubre de 2007 con un astrocitoma de bajo grado de tálamo, se realizó resección parcial y se envió a radiocirugía en febrero de 2008; sin embargo, presentó progresión tumoral en febrero de 2009, por lo que se realizó nueva resección y se inició Quimioterapia con ICE. Falleció en junio de 2009 por progresión tumoral (Figuras 4 y 5).
Figura 4. IRM al momento de la recaída.
Figura 5.
Al realizar los microarreglos para las vías de la apoptosis, se encontró subexpresión de los genes BID y CASP8 y sobre expresión de los genes IRAK y PKA.
PACIENTE - 4 CVA
Mujer de 13 años de edad; se diagnosticó en septiembre de 2007 con un glioblastoma multiforme temporoparietal, se realizó resección parcial e inició Quimioterapia con ICE. Falleció en diciembre de 2007 por progresión tumoral. (Figuras 6 y 7). Al realizar los microarreglos para las vías de la apoptosis se encontró subexpresión de los genes BCL-2, PKA, IAP, CytC e IKBa y sobre expresión de los genes IRAK y P13K.
Figura 6.
Figura 7.
PACIENTE - 5 GME
Hombre de nueve años de edad; se diagnosticó en noviembre de 2007 con un astrocitoma de alto grado de tallo cerebral, se realizó biopsia únicamente e inicio QT con ICE además de Radioterapia. Falleció en octubre de 2008. (Figuras 8 y 9)
Figura 8.
Figura 9.
PACIENTE - 6 SAM
Hombre de 14 años de edad; se diagnosticó en agosto de 2007 con un astrocitoma de bajo grado de tallo cerebral, se realizó biopsia únicamente, recibió QT con ICE además de RT. Actualmente está vivo. Meses de sobrevida: 36 (Figura 10). Al realizar los microarreglos para las vías de la apoptosis, se encontró subexpresión de los genes BCL-2, PKA, IkBa, Cn, RIPI, p53 y sobre expresión de IRAK, PKA, FLIP, Cn y TRAIL. En este caso llama la atención que el gen PKA se encontró tanto sub como sobre expresado, esto puede ser secundario a las distintas isoformas que todos los genes poseen. El gen TRAIL que esta sobre expresado es el único de la vía extrínseca de la apoptosis, todos los demás corresponden a la vía intrínseca.
Figura 10.
PACIENTE - 7 MSJ
Hombre de seis años de edad; se diagnosticó en marzo de 2008 con un astrocitoma de bajo grado de tallo cerebral, se realizó biopsia únicamente, inicio QT con carboplatino y vincristina y por datos de progresión tumoral se cambió al mes a esquema ICE, además recibió Radioterapia 54 Gy. Falleció en abril de 2009. (Figuras 11 y 12)
Figura 11.
Figura 12.
PACIENTE - 8 ACV
Mujer de cuatro años de edad; se diagnosticó en enero de 2008 con un astrocitoma de bajo grado de cerebelo, se realizo resección parcial por lo que inició tratamiento con QT con carboplatino y vincristina además de Radioterapia. Actualmente con 19 meses de sobrevida.
PACIENTE - 9 SGB
Niña de cuatro años de edad; se diagnosticó en junio de 2009 con un astrocitoma de bajo grado de tallo cerebral, se realizó biopsia únicamente e inicio QT con ICE. Actualmente tiene 22 meses de sobrevida.
PACIENTE - 10 CVF
Niña de cuatro años de edad; se diagnosticó en diciembre de 2007 con un astrocitoma de bajo grado parietal, se realizó resección completa. Actualmente está viva, con 24 meses de seguimiento sin progresión.
DISCUSIÓN
En el presente estudio se estudió de manera integral a 10 pacientes pediátricos portadores de un astrocitoma.
Como se ha comentado ampliamente, el comportamiento biológico de los astrocitomas varía mucho independientemente de su histología, no así en cuanto a su localización se refiere, tal como se corroboró en el presente trabajo, siguen siendo de peor pronóstico, aquellos de localización en el tallo cerebral.
No obstante, aquellos que por histología correspondían a un bajo grado de malignidad, pudimos encontrar que in vitro, podían tener un comportamiento tan agresivo como aquellos tipificados como de alto grado.
Recientemente se ha estudiado e involucrado de manera estrecha las vías de apoptosis con la evolución de la mayoría de los cánceres, incluidos los tumores cerebrales. El conocimiento actual de la apoptosis, como mecanismo regulador y homeostático de los tejidos explica ahora el desarrollo de tejido neoplásico en la mayoría de los casos. Y cualquier alteración o desbalance en éste mecanismo regulador, ya sea tanto en la vía extrínseca regulada por la familia del TNF (factor de necrosis tumoral y TRAIL) o la vía intrínseca mitocondrial, da como resultado el desarrollo de un tumor.30-34
Recientemente se ha querido canalizar éste conocimiento, a fin de desarrollar moléculas que intervengan o favorezcan el desarrollo o estímulo de la apoptosis para tratar varios tipos de cáncer en la edad pediátrica como neuroblastoma y rabdomiosarcoma.
El presente estudio, representa suma importancia, dado que es de los primeros que se desarrollan en Tumores de Sistema Nervioso Central en Pediatría. No pudimos encontrar una alteración genética constante o que se manifestara en una mayor proporción de los casos, dado que encontramos tanto subexpresión como sobre expresión en los genes involucrados con la apoptosis. Sin embargo, llamó fuertemente la atención que alguna alteración de las caspasas por lo menos estuvo presente en seis de los 10 pacientes estudiados, ya sea porque estuvo subexpresada o sobre expresada.
Las caspasas son importantes porque juegan un rol principal en la ejecución de la apoptosis celular, principalmente la caspasa-8 que pareciera llevar la iniciativa para activar el resto de la cascada de los mecanismos de muerte celular. En la vía extrínseca de la apoptosis, la estimulación de los receptores de la muerte del TNF CD-95 (apo-1/Fas) o TRAIL, permiten la activación del iniciador caspasa-8, que directamente se va a unir a la caspasa-3 o alternativamente unirse al receptor de la vía mitocondrial por vía del BID. El BID es miembro de la familia del BCL-2 que activa a la mitocondria para desencadenar la apoptosis.35-37
En este estudio, lo que se pretendió fue estudiar de manera integral tanto desde el punto de vista clínico, como histológico, radiológico y molecular a estos tumores, con el fin de entender a fondo su comportamiento biológico y a futuro poder dirigir de una manera más adecuada un tratamiento específico. Basados en que la evasión de la apoptosis es una característica de las malignidades en la infancia que contribuye a la carcinogénesis así como a la resistencia al tratamiento, se cree que el tener una apoptosis defectuosa en las células tumorales puede convertirse en resistencia tumoral. Para éste punto, las terapias blanco a la apoptosis se pueden dirigir directamente hacia las células cancerosas o incrementar la respuesta de los tumores pediátricos a las terapias convencionales tanto Quimioterapia como Radioterapia.35,37
La idea de activar éstos receptores de la muerte de la familia del TNF es atractiva por su aplicación médica, dado que estos receptores están involucrados en la muerte celular. En éste sentido, el oncogén TRAIL se ha considerado momo el primer candidato, ya que induce la apoptosis en las células cancerosas mientras las normales pasan desapercibidas.
En este contexto, el encontrar estos genes alterados en el presente estudio, cobra más importancia. No pudimos encontrar una correlación directa entre alteración de la vías de apoptosis y sobrevida dado que el tamaño de la muestra es pequeña y en todos los tumores que estudiamos encontramos una alteración en algunos de éstos genes; sin embargo, como ya se mencionó, se corroboró como muy importante y frecuente la identificación de la alteración de algunas de las caspasas, así como el gen TRAIL y BCL-2. El poder continuar este estudio nos permitirá ampliar más la muestra y poder estudiar a fondo éstas líneas celulares con el objeto de poder ajustar y administrar tratamientos blanco mejor dirigidos.
Correspondencia: Dr. Enrique López Aguilar.
Laboratorio de Investigación en Tumores Cerebrales. Av. Cuauhtémoc 330. Colonia Doctores, México, D. F.
Teléfono: 5627 6900, extensión 22528.
Correo electrónico: elopezaguilar@hotmail.com