Introducción
La orina y las vías urinarias, en condiciones normales, son estériles y sólo la uretra distal está colonizada por flora cutánea y vaginal: corynebacterias, estreptococos, estafilococos, lactobacilos, etc.; en ocasiones, y de forma transitoria, pueden albergar Escherichia coli u otros bacilos gramnegativos. Previamente a un episodio de infección urinaria (IU) se produce una colonización vaginal y periuretral persistente a partir de microorganismos que provienen del colon. Desde estas localizaciones, un pequeño número de bacterias ascienden a la vejiga y más excepcionalmente a la pelvis y al parénquima renal. En circunstancias normales estas bacterias son eliminadas por el flujo y las propiedades antibacterianas de la orina y, en menor medida, por la presencia de IgA secretora y los escasos polimorfonucleares presentes en la superficie vesical. Si dichas bacterias no pueden ser eliminadas, se inicia o bien una colonización (adhesión del microorganismo al uroepitelio, su reproducción y eliminación por la orina) o bien una infección (implica lesión del epitelio vesical), dependiendo del equilibrio entre la virulencia de la bacteria, el tamaño del inóculo, los mecanismos defensivos locales y la presencia o no de alteraciones anatómicas o funcionales del tracto urinario 1.
Así pues, la mayoría de los episodios de infección urinaria son producidos por microorganismos provenientes del colon, mientras que una minoría posee una etiología exógena y son producidos por microorganismos ambientales que con frecuencia se han introducido en las vías urinarias durante su manipulación. La pielonefritis de origen hematógeno es extremadamente rara, está producida sobre todo por Staphylococcus aureus y por levaduras, y se da en pacientes graves.
Factores predisponentes de infección urinaria
Los factores de riesgo asociados a la infección del tracto urinario son cambiantes 2-5 y dependen fundamentalmente de la edad, de los hábitos sexuales y de las condiciones fisiológicas y anatómicas del tracto urinario (tabla 1). En mujeres jóvenes el principal factor de riesgo es el coito; según la frecuencia de su práctica, se dispara desde 0 (sin coitos en 7 días) a 2,6 (3 coitos en 7 días) y a 9 veces (7 coitos en 7 días) 2. En mujeres ancianas ingresadas en instituciones sanitarias 3 el principal factor de riesgo es el sondaje vesical y el estado funcional de su aparato urinario. A medida que este último se deteriora, el riesgo de padecer una IU aumenta, con independencia de la presencia o ausencia de sonda vesical. Este capítulo se centra básicamente en el estudio de los factores patogénicos dependientes del microorganismo.
Filogenia de Escherichia coli. Concepto de E. coli patógeno extraintestinal frente a uropatógeno
Por técnicas de electroforesis enzimática multiloci en E. coli se han identificado 4 grupos filogenéticos: A, B1, B2 y D 6. Esta diversidad dentro de la especie es el resultado de 2 procesos evolutivos: mutación y transferencia horizontal de genes.
Basándose en criterios genéticos y clínicos, las cepas de E. coli pueden ser clasificadas en 3 grupos: cepas comensales, cepas patógenas intestinales y cepas patógenas extraintestinales.
Las cepas comensales constituyen el núcleo de la flora fecal en humanos sanos y también en otros mamíferos y aves. Estas cepas, adaptadas a una pacífica convivencia con el huésped, no producen enfermedad intestinal y sólo causan infección extraintestinal cuando existen factores favorecedores como sondas urinarias, deterioro de las defensas, etc. La mayoría de los E. coli comensales humanos derivan de los grupos filogenéticos A y B1 y poseen muy pocos factores de virulencia.
Las cepas de E. coli patógenas intestinales se encuentran raramente en la flora fecal de las personas sanas; por el contrario, se comportan esencialmente como patógenos obligados y causan gastroenteritis cuando son ingeridos en determinadas cantidades, aunque la mayoría de ellos son incapaces de producir enfermedad fuera del tracto intestinal. Se reconocen 6 categorías patogénicas: enterotoxigénico (ETEC), enterohemorrágico/productor de toxina de Shiga (STEC/EHEC), enteropatogénico (EPEC), enteroinvasivo (EIEC), enteroagregativo (EAEC) y difusamente adherente (DAEC). Existe diversidad filogenética dentro de cada uno de estos tipos patógenos, ya que derivan de los grupos A, B1 o D; en cambio, cada tipo patógeno presenta una combinación única de factores virulentos.
A diferencia de los E. coli comensales y patógenos intestinales, los E. coli patógenos extraintestinales (ExPEC), entre los que se incluyen los uropatógenos, derivan principalmente del grupo filogenético B2 y en menor medida del grupo D y albergan genes que codifican factores extraintestinales de virulencia 7-9. Las infecciones que producen pueden afectar a casi todos los órganos y localizaciones anatómicas, excepto el tracto intestinal. En estudios realizados por nuestro equipo se observó que de entre 50 E. coli comensales del intestino de personas sanas, los más frecuentes fueron los derivados del grupo filogenético B1 (34%), seguidos del D (28%), A (20%) y B2 (18%) 10. Por el contrario, los derivados del grupo filogenético B2 fueron los más frecuentes (71%) de entre 50 E. coli productores de cistitis y 50 productores de pielonefritis, seguidos del grupo D (11%), A (10%) y B1 (8%) 9.
Los actuales conocimientos sobre la patogenia de las infecciones producidas por las cepas ExPEC se sustentan en estudios realizados con E. coli productores de IU, bacteriemias y meningitis neonatales. Experimentos en el modelo animal han confirmado su poder patógeno 11. La concentración de genes de virulencia en ciertos linajes evolutivos de E. coli patógenos extraintestinales ha dado como resultado el concepto de clones específicos del síndrome: uropatógenos, asociados a sepsis, a meningitis, etc. Desafortunadamente, estos clones específicos del síndrome, aunque válidos, representan un concepto demasiado limitado, ya que implica que ciertos E. coli poseen factores virulentos específicos que los capacitan para causar únicamente infección en un sitio anatómico determinado; sin embargo, ningún factor de virulencia es capaz de conferir esta propiedad. Además, los ExPEC tienden a acumular diversos factores virulentos, lo que les dota de múltiples perfiles y sugiere la existencia de varias alternativas para causar infección en una determinada localización. Por todo ello, se ha propuesto sustituir el término "E. coli uropatógeno", que se utilizaba para describir cepas capaces de causar IU pero que también causan infecciones en localizaciones extraintestinales no urinarias, por la designación más inclusiva de "E. coli patógeno extraintestinal" (ExPEC) 12.
En general, las cepas productoras de IU no son clonales, si se entiende por clonalidad el hecho de que pertenezcan a un mismo serotipo, posean idénticos factores de virulencia y la misma impronta genética cuando se estudia su ADN. Sin embargo, se han descrito brotes de IU producidos por E. coli pertenecientes a un mismo clon. Así, en Londres, en 1987-1988, E. coli O15:K52:H1 fue la causa de un brote de cistitis, pielonefritis y septicemias adquiridas en la comunidad 13. Este mismo clon 14 se describió en Barcelona en el año 2000. En Estados Unidos, en el año 2001 se describió la diseminación de un clon de E. coli denominado grupo clonal A (CGA), que pertenece a los serogrupos O77 y O11 y es resistente al cotrimoxazol 15.
Factores de virulencia de Escherichia coli. Importancia de la adhesividad
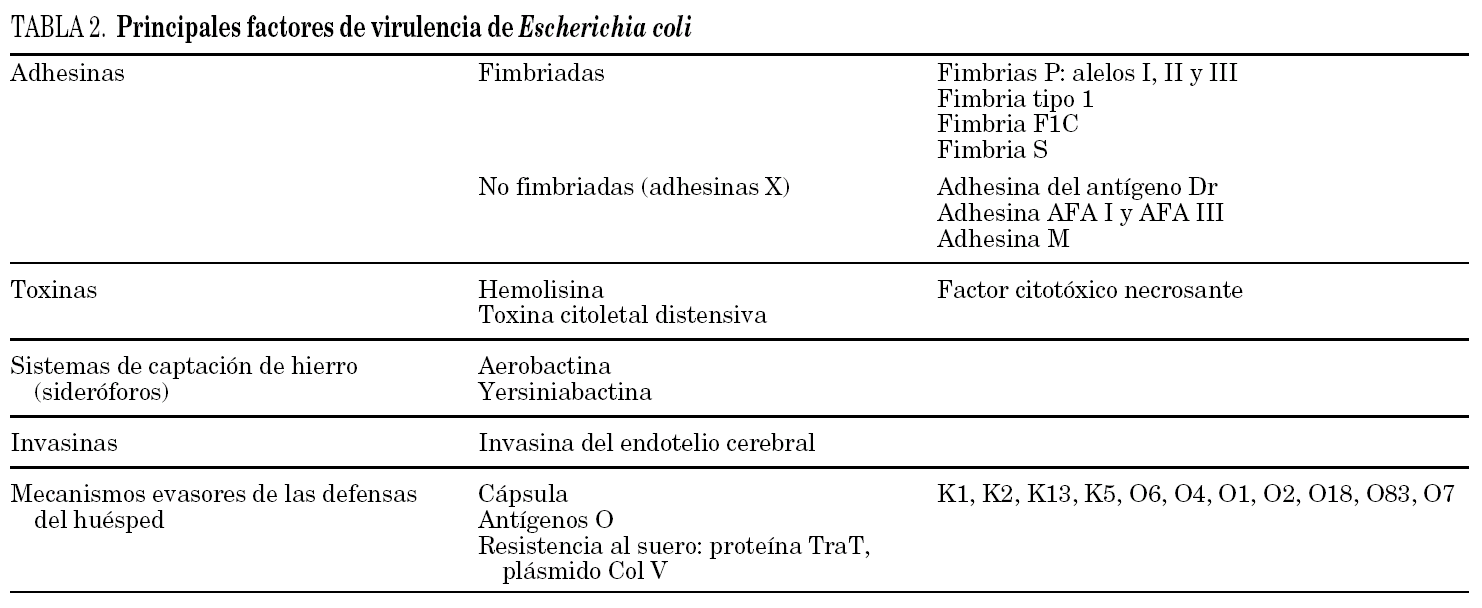
La virulencia de un microorganismo condiciona en gran medida su potencial para establecer una infección. Una cepa de E. coli es tanto más virulenta cuantos más factores de virulencia concurren en ella. No todas las cepas de E. coli, con independencia del grupo filogenético al que pertenecen, poseen la misma capacidad para infectar el aparato urinario. En la tabla 2 se detallan los principales factores de virulencia de E. coli descritos hasta el momento.
En E. coli la mayoría de estructuras adherentes son fimbrias proteicas que se unen a receptores específicos situados en las membranas de las células epiteliales. Una misma cepa puede contener simultáneamente varias adhesinas. La fimbria tipo 1 es la más universal, pues está presente en casi la totalidad de las cepas de E. coli y de otros miembros de la familia Enterobacteriaceae. En su biosíntesis, expresión y función intervienen 8 genes. Su receptor es la α-D-manosa presente en las membranas de la mayoría de las células del huésped. El papel patogénico de las fimbrias tipo 1 ha sido controvertido, aunque actualmente se cree que desempeñan un papel fundamental para iniciar la infección. En las vías urinarias se une a la proteína Tamm-Horsfall (uromucoide rico en manosa excretado por las células epiteliales urinarias). Esta unión actúa como un mecanismo de defensa inespecífico, ya que evita la unión del E. coli a sus 2 receptores urinarios principales, las uroplactinas Ia y Ib. La unión a la proteína Tamm-Horsfall favorece, por tanto, la eliminación de E. coli por la orina. Estudios experimentales demostraron 16 que cuando la capa formada por la proteína Tamm-Horsfall se daña, quedan adheridos al epitelio gran número de E. coli, proceso que podría representar el punto de inflexión en el que la colonización se convierte en infección y explicar la evolución a brotes observada en las IU de repetición. En la vejiga, FimH, la adhesina presente en el extremo distal de la fimbria tipo 1, se une e interacciona con la uroplactina 17.
Esta unión parece ser la señal para activar la cascada defensiva del huésped que incluye la muerte programada y la exfoliación de las células del epitelio vesical y la activación de los mediadores de respuesta inflamatoria (interleucinas y factor de necrosis tumoral [TNF]) 18. Estudios experimentales han demostrado que E. coli es capaz de eludir estos mecanismos defensivos del huésped invadiendo las capas profundas del tejido vesical, replicándose en el interior de sus células y creando biopelículas o pods 19 que contienen bacterias bañadas en una matriz rica en polisacáridos y rodeados por una envoltura de uroplactina. Estas biopelículas pueden constituir un reservorio para los E. coli productores de las IU recurrentes 19. Se ha demostrado que las mutaciones en el gen fimH suprimen totalmente esta cascada patogénica y que la vacuna con la adhesina FimH protege a los ratones y primates de la infección 17,19.
Una medida clásica de profilaxis para evitar nuevos episodios de IU en mujeres con infecciones recurrentes es la administración de antibióticos a dosis bajas. Su eficacia, comprobada inicialmente con cotrimoxazol, ha sido también demostrada con trimetoprim, diversos betalactámicos, nitrofurantoína, fluorquinolonas, y recientemente con fosfomicina-trometamol (3 g cada 10 días). Se ha sugerido que las dosis bajas de antibióticos actuarían, por un lado, reduciendo el número de uropatógenos del reservorio fecal (hecho no siempre demostrable) y, por otro, inhibiendo la expresión de las fimbrias tipo 1 y, por tanto, la unión de los uropatógenos al epitelio vesical y, consecuentemente, la puesta en marcha del proceso patogénico. En un trabajo realizado por nuestro equipo, la fosfomicina se mostró más eficaz que el ciprofloxaxino en la inhibición de la expresión de las fimbrias tipo 1, ya que, bajo concentraciones subinhibitorias de fosfomicina, el 81% de los E. coli estudiados perdía la capacidad de aglutinar a Sacharomyces cerevisiae, mientras que sólo la perdían el 57% de los mismos bajo concentraciones subinhibitorias de ciprofloxaxino 20. Se están realizando estudios en modelos animales para conocer la trascendencia de estos hallazgos.
Las fimbrias P presentan 3 variantes moleculares (I, II y III) que son codificadas por los correspondientes alelos (papG alelo I, papG alelo II, papG alelo III) y se unen a receptores distintos. Probablemente las 3 variantes ejercen funciones patogénicas distintas. La fimbria P variante II es de especial importancia en la producción de pielonefritis. Ello se debe a que sus receptores, constituidos por los glucoesfingolípidos Gal (α1-4) Gal contenidos en los antígenos del grupo sanguíneo P, se encuentran en la vagina, la vejiga, los uréteres y los túbulos renales, lo que facilita la ascensión de los E. coli con fimbrias P a la pelvis renal.
Otra medida profiláctica para evitar las IU recurrentes es la administración oral de preparados a base de arándanos. Inicialmente se sugirió que su efecto protector se debía a su capacidad para acidificar la orina 21, pero posteriormente se observó su capacidad para reducir la adherencia de E. coli y otros uropatógenos. Este efecto inhibidor de la adherencia se creyó debido a la fructosa (contenida en gran cantidad en los arándanos, aunque también en otras frutas), que actuaría como receptora de las fimbrias tipo 1 impidiendo la unión de éstas al uroepitelio, aunque más tarde se comprobó que los arándanos contienen también elevadas proporciones de proantocianidinas del tipo A, compuestos polifenólicos del grupo de los taninos que inhibirían la adhesión de las fimbrias P a las células uroepiteliales 21.
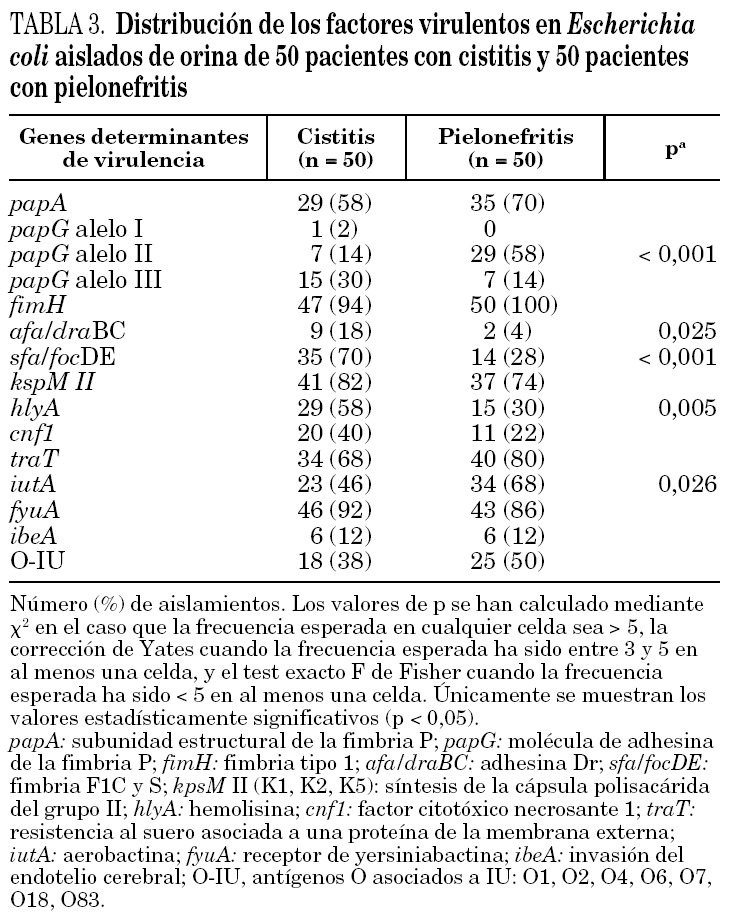
El papel que otros putativos factores de virulencia desempeñan en la patogenia de la IU puede deducirse de los resultados de estudios realizados por nuestro equipo y sólo parcialmente publicados 9 (tabla 3). Los genes fimH, kspM II e fyuA son muy frecuentes y están presentes en más del 70% de las cepas uropatógenas, mientras que papG alelo I, afa/draBC e ibeA se encuentran raramente. Otros genes virulentos están diferentemente distribuidos entre estos 2 síndromes clínicos: papG alelo III, sfa/focDE, hlyA y cnf1 son más prevalentes en la cistitis, mientras que papA (subunidad estructural de la fimbria P), papG alelo II, traT, iutA y los antígenos O asociados a IU lo son en la pielonefritis.
Islas de patogenicidad (PAI)
Recientemente se ha demostrado 22,23 que los genes responsables de los factores de virulencia no se encuentran aislados en el cromosoma bacteriano, sino agrupados en fragmentos de ADN muy particulares denominados "islas de patogenicidad" o PAI. Se trata de elementos genéticos móviles, de gran tamaño (entre 20-200 Kb) y un contenido G + C y un código genético distinto al resto del ADN de la bacteria. Estas piezas genéticas con estructura en forma de mosaico, lo que sugiere que han sido generadas en un proceso secuencial, con el tiempo experimentan mutaciones que homogenizan su código genético con el general de la bacteria, pierden fragmentos no favorables y se confunden con el genoma propio de la bacteria, en un proceso denominado de maduración genética. El mecanismo de movilidad de las PAI es poco conocido; se postula que se comportan como transposones conjugativos, lo que permite, en condiciones de presión selectiva, una difusión de los genes de virulencia que contienen.
En E. coli se han descrito y estudiado las 9 PAI detalladas en la tabla 4. Cada PAI codifica distintos factores, aunque algunos pueden coincidir en más de una PAI. Una misma cepa de E. coli puede albergar diversas PAI. En un estudio realizado por este equipo 10, el 42% de los E. coli aislados de heces de personas sanas (con una media de 1 PAI por aislamiento) presentan PAI, en contraste con el 91% de los E. coli productores de IU (con una media de 3 PAI). La PAI IV536 fue la más frecuente, tanto en cepas comensales como uropatógenas (38% frente al 89%), seguida de la PAI ICFT073 (26% frente al 73%), la PAI IICFT073 (14% frente al 46%), la PAI IIJ96 (8% frente al 34%), la PAI I536 (8% frente al 33%), la PAI II536 (4% frente al 20%) y la PAI III536 (0% frente al 2%). En este mismo estudio 10 se observó que los E. coli del grupo filogenético B2, con independencia de si habían sido aislados en heces de personas sanas o en orina de pacientes con IU, presentan una media de 3,9 PAI, en contraste con una media de 0,9 para los E. coli del grupo D, de 0,4 para los del grupo A y de 0,3 para los del B1.
Flora vaginal normal. Papel protector de Lactobacillus
Todas las situaciones en las que existe una alteración de la flora vaginal normal consistente en una disminución de la población de Lactobacillus y un aumento de la colonización por E. coli y otros uropatógenos, se relacionan con un aumento de la frecuencia de IU. Ello enfatiza el importante papel que Lactobacillus desempeña como árbitro del ecosistema vaginal y en la prevención de la IU. Las situaciones capaces de alterar la flora vaginal normal son tan diversas como la falta de estrógenos y, por tanto, menopausia, vaginosis bacteriana, utilización del espermicida nonoxinol-9 u otros espermicidas, antibioterapia, etc. Raz et al 24, en un estudio realizado en mujeres posmenopáusicas con IU recurrentes, demostraron que la administración de estradiol disminuía de manera significativa el número de episodios de infección y la población vaginal de enterobacterias a la vez que aumentaba la de Lactobacillus, y concluyeron que la estrogenización de la mucosa vaginal promueve el restablecimiento de la flora vaginal normal.
A pesar de que es ampliamente conocido que Lactobacillus es el microorganismo predominante en la vagina premenopáusica (10 7-10 8 unidades formadoras de colonias [UFC]/g de flujo), ni la composición, ni la dinámica de sus diversas poblaciones está bien caracterizada. Dos recientes estudios 25,26 concluyen que la mayoría de las mujeres albergan en la vagina una sola especie de Lactobacillus en un momento dado. De las 35 especies existentes, las halladas con más frecuencia son Lactobacillus crispatus, L. gasseri y L. jensenii. Lactobacillus protege a la vagina frente a la colonización por uropatógenos fundamentalmente porque interfiere la adherencia de los mismos al epitelio vaginal al bloquear sus receptores por mecanismos de exclusión o desplazamiento y porque inhibe la multiplicación de estos uropatógenos mediante la producción y excreción H2O2, ácido láctico y bacteriocinas 27.
Se ha demostrado 27-29 que no todas las cepas de Lactobacillus expresan estas propiedades con la misma intensidad, sino que existen enormes diferencias entre especies e incluso entre cepas de una misma especie. Así, sólo el 10% de las cepas estudiadas por Andreu et al 28 se adhieren de forma potente a las células del epitelio vaginal. Además, una misma cepa de Lactobacillus puede exhibir diferentes capacidades bloqueadoras frente a distintos uropatógenos 29. Más aún, la actividad inhibitoria y el espectro de los uropatógenos inhibidos varían enormemente entre las distintas cepas de Lactobacillus, lo que sugiere que Lactobacillus produce diversas sustancias inhibitorias. En conclusión, algunos Lactobacillus se adhieren ávidamente a las células del epitelio vaginal, otros bloquean eficientemente la adherencia al mismo de los uropatógenos y otros inhiben su crecimiento, y estas propiedades son independientes y acumulativas en una determinada cepa. Ello demuestra la importancia de caracterizar a las cepas de Lactobacillus previamente a su utilización como probióticos en aplicaciones clínicas.
Flora fecal. Dinámica de las poblaciones de Escherichia coli
En diversos estudios, algunos iniciados ya a finales de la década de los sesenta, se ha aislado la cepa de E. coli causante de la IU de entre la flora fecal de la paciente 30,31. Basándose en ellos y con la finalidad de explicar la patogenia de la IU, se sugirió la hipótesis de la vía fecal-perineal-uretral, según la cual la propia flora fecal del huésped constituye el reservorio de las cepas de E. coli causantes de IU 31.
Este fenómeno, unido al hecho de que los antígenos O más comunes en los E. coli aislados en IU eran también los más prevalentes en los E. coli fecales aislados en gente sana, sugirió la hipótesis "prevalente" según la cual las cepas fecales de E. coli productoras de IU son las que se encuentran de forma predominante en heces, es decir, las que se encuentran en el lugar adecuado en el momento adecuado y en número suficiente para entrar en el tracto urinario y causar la infección 32. Por otro lado, los E. coli causantes de IU derivan del grupo filogenético B2 y poseen ciertos (putativos o probados) factores de virulencia y antígenos O con una frecuencia significativamente mayor que los E. coli contenidos en las heces de personas sanas, lo que ha sugerido la hipótesis de "especial patogenicidad" 33. Esta hipótesis defiende que la patogenia de la IU está dirigida por la capacidad virulenta de las cepas causantes de la infección, más que por una simple acción de masa. Sin embargo, la mayoría de los datos epidemiológicos en los que se basa la hipótesis de la "especial patogenicidad" derivan de comparaciones entre cepas productoras de IU y cepas intestinales, pero de huéspedes no relacionados 34,35, por lo que existe la posibilidad de que las diferencias observadas entre ellas puedan ser explicadas por diferencias en el huésped (difíciles de ponderar) o diferencias ambientales más que por diferencias en la virulencia per se de las bacterias. Además, algunos estudios experimentales que evalúan la importancia de los putativos factores de virulencia en relación con la capacidad de una cepa para causar infección urinaria u otras infecciones extraintestinales han concluido que ningún factor desempeña, por sí solo, un papel decisivo o incluso relevante 36. Es decir, hoy día todavía no está claro en qué medida la prevalencia o la especial patogenicidad determinan la producción de la IU, y si su relación varía dependiendo de las características del huésped.
A pesar de que está ampliamente admitido que E. coli es la bacteria predominante de la flora aerobia intestinal normal, se conoce poco acerca del número y la dinámica de las distintas poblaciones o clones de E. coli que coexisten en ella. Por las informaciones de que se dispone, parece que en las heces de personas sanas coexistirían una media de 2-3 clones, con un rango de 1 a 8 31,37,38. Estos clones estarían distribuidos en dominantes o mayoritarios y no dominantes, y su persistencia en heces parece efímera, puesto que van cambiando periódicamente. Además, con frecuencia existe una colonización del tracto urinario, producida por clones tanto dominantes como minoritarios. Nuestro equipo, tras estudiar a 14 mujeres con IU, ha concluido 39 que en 9 (64%) de ellas el clon urinario fue detectado en heces como clon mayoritario, en 4 como único y en 5 acompañando a otros clones. Se observó, además, que los 4 clones urinarios detectados como clones fecales únicos eran menos virulentos que los restantes clones urinarios, y que los E. coli del grupo filogenético B2 provocaron IU siempre que estuvieron presentes en la flora intestinal como población dominante, o cuando, estando ausentes, se trataba de E. coli B2 más virulentos que los B2 contenidos en las poblaciones fecales dominantes. En este trabajo se concluía que la especial patogenicidad es un determinante importante en la patogenia de la IU, aunque la prevalencia permite ocasionalmente que las cepas menos virulentas causen una IU.
Patogenia de las infecciones urinarias recurrentes
Las infecciones recurrentes se clasifican en recidivas y reinfecciones. Las recidivas se deben a la persistencia de la cepa original en el foco de infección. Representan el 20% de las recurrencias, ocurren en general en las primeras semanas tras la aparente curación y la persistencia del microorganismo es debida o bien a un tratamiento antibiótico inadecuado o demasiado corto, o bien a la existencia de una anomalía genitourinaria o al acantonamiento de las bacterias en un lugar inaccesible para el antibiótico (litiasis renal o prostatitis crónica). Las reinfecciones son nuevas infecciones causadas por bacterias distintas y facilitadas por muchos de los factores complicantes de IU que se exponen en la tabla 1.
Un caso especial es el de las mujeres jóvenes con infecciones recurrentes. Aproximadamente el 20% de las mujeres jóvenes que presentan un primer episodio de cistitis padecen recurrencias. Su perfil es el de una mujer sana, sin ninguna anomalía del tracto urinario, que presenta cistitis sintomáticas que cursan a brotes, es decir, períodos con episodios frecuentes seguidos de períodos silentes. Stapleton et al 40 demostraron que estas mujeres poseen con mayor frecuencia (que las mujeres sin IU recurrentes) el serotipo no secretor de grupos sanguíneos y expresan, en las membranas de sus células epiteliales, 2 únicos globósidos: sialosil-galglobósido (SGG) y disialosil-galglobósido (DSGG), que no son expresados por las mujeres secretoras y que actúan como receptores de E. coli uropatógenos. Hasta hace poco se consideraba que estas recurrencias eran reinfecciones, es decir, se debían a cepas distintas. Sin embargo, estudios moleculares han demostrado que se trata de infecciones producidas por la misma cepa de E. coli (aun cuando los episodios estén separados por meses), y la cepa puede estar acantonada en el intestino 41 o en biopelículas o pods en el interior de las células epiteliales vesicales 19.
Agradecimientos
La reflexión sobre la que se sustenta este artículo y muchos de sus resultados no hubieran sido posibles sin M. Sabaté, E. Moreno y T. Pérez, miembros del Equipo de Investigación de Microbiología del Hospital Vall d'Hebron, y muy especialmente del Dr. G. Prats, director del mismo.
Correspondencia: Dra. A. Andreu.
Servei de Microbiologia. Hospital Universitari Vall d'Hebron.
Passeig Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: anandreu@vhebron.net