Comparar la tasa estimada de disposición de glucosa (TeDG), la dosis de insulina y el perfil lipoproteico en niños con diabetes mellitus tipo 1 (DM1) y sobrepeso-obesidad frente a niños con DM1 de peso normal.
MétodosSe seleccionaron 115 pacientes (5-16 años) con DM1 e insulinoterapia intensiva. Se determinaron: peso, talla, índice de masa corporal, perímetro abdominal y de cadera, dosis de insulina, hemoglobina glucosilada, presión arterial y perfil lipoproteico. Los resultados se estratificaron por sexo y edad.
ResultadosNo se encontraron diferencias en la TeDG entre los pacientes con peso normal, sobrepeso y obesidad. No obstante, los niños obesos mayores de 11 años mostraron valores inferiores en la TeDG (9,3±1,3 vs 10,1±0,8mg kg-1min; p<0,01). Los niños con obesidad y sobrepeso precisaban dosis de insulina superiores a aquellos con peso normal, especialmente en UI/m2/día (37,7 vs 36,1 vs 29,4, respectivamente; p<0,007). Los niños con obesidad presentaban concentraciones de colesterol de las lipoproteínas de baja densidad superiores a aquellos con sobrepeso y peso normal (106,5 vs 91,7 vs 91,5mg/dl, respectivamente; p<0,01). Asimismo, no se encontró correlación entre el perímetro abdominal y los distintos marcadores de resistencia a la insulina.
ConclusionesLa TeDG es inferior en niños obesos mayores de 11 años con DM1, por lo que podría considerarse como un marcador de resistencia a la insulina. Las necesidades de insulina son mayores en pacientes con sobrepeso-obesidad, especialmente cuando se cuantifican en UI/m2/día. Los pacientes obesos con DM1 presentan un perfil lipoproteico de riesgo cardiovascular.
To assess the estimated glucose disposal rate (eGDR), insulin dose, and lipoprotein profile in children with type 1 diabetes mellitus (T1DM) and overweight or obesity as compared to children with T1DM and normal weight.
MethodsA total of 115 patients (aged 5-16 years) with T1DM on intensive insulin therapy were recruited. The following parameters were measured: weight, height, body mass index, waist and hip circumference, insulin dose, eGDR, glycosylated hemoglobin, blood pressure, and lipoprotein profile. Results were stratified by sex and age.
ResultsNo significant differences were found in eGDR between children with normal weight, overweight, and obesity. However, obese children older than 11 years had lower eGDR values (9.3±1.3 vs 10.1±0.8mg kg-1min-1; p<0.01). Insulin dose was higher in overweight and obese children, especially in IU/m2/day (37.7 vs 36.1 vs 29.4 respectively; p<0.01). Obese children had higher low-density lipoprotein cholesterol levels than children with overweight and normal weight (106.5 vs 91.7 vs 91.5mg/dL respectively; p<0.01). No correlation was found between waist circumference and the different markers of insulin resistance.
ConclusionsValues of eGDR values were lower in obese children with T1DM older than 11 years, and this may therefore be considered a marker of insulin resistance. Insulin dose was higher in diabetic patients with overweight or obesity, specially in IU/m2/day. Obese children with T1DM had a lipoprotein profile of cardiovascular risk.
El incremento de la adiposidad corporal produce una respuesta inflamatoria sistémica mediada por citocinas y por un aumento de los ácidos grasos libres circulantes que van a desencadenar un estado de resistencia a la insulina (RI), situación considerada como el acontecimiento central del síndrome metabólico (SM) y de todas las comorbilidades que este conlleva1. Se ha observado que, aunque la insulinoterapia intensiva ha reducido la frecuencia de complicaciones microangiopáticas, no ha sucedido lo mismo con las complicaciones macrovasculares derivadas del aumento de los factores de riesgo cardiovascular2, de forma que las características antropométricas y metabólicas de los pacientes con diabetes mellitus tipo 1 (DM1) son cada vez más parecidas a las de los pacientes con diabetes mellitus tipo 2 (DM2)3.
Teniendo en cuenta la morbimortalidad asociada a la RI, resulta esencial establecer su presencia en los pacientes con DM1 con sobrepeso-obesidad. No obstante, su determinación no es sencilla, ya que el denominado clamp euglucémico hiperinsulinémico (patrón oro para el estudio de la RI) es laborioso de realizar en la práctica clínica, los índices HOMA-IR (homeostasis model assessment of insulin resistance) o QUICKI (quantitative insulin sensitivity check index) son poco valorables en pacientes con un déficit endógeno de insulina, como es el caso de la DM1, y el cálculo de las necesidades diarias de insulina es poco preciso y depende de múltiples factores. Por ello, en los últimos años se ha desarrollado la tasa estimada de disposición de glucosa (TeDG), que es un indicador que muestra una buena correlación con el clamp euglucémico hiperinsulinémico4, obteniéndose a partir de la siguiente ecuación: TeDG (en mgkg−1min−1)=24,31–12,22 (cociente cintura-cadera)–3,29 (presencia de hipertensión arterial; si hipertensión arterial=1, si no hay hipertensión arterial=0)–0,57 (valor de la hemoglobina glucosilada)4. Se trata de un modelo cuyos valores muestran una correlación inversa al grado de RI, observándose que los pacientes adultos diagnosticados de SM presentan valores de la TeDG inferiores a aquellos otros que no cumplen criterios de SM1,3-6. Asimismo, dicho parámetro ha demostrado una capacidad superior a la cuantificación de la insulina para predecir el desarrollo de complicaciones vasculares1,5. Hasta el momento, no se ha estudiado la TeDG en series compuestas de forma exclusiva por pacientes menores de 18 años con DM1. Por ello, el objetivo de este trabajo fue comparar los valores de la TeDG y de las necesidades diarias de insulina (en UI/kg/día y UI/m2/día) en pacientes menores de 18 años con DM1 con sobrepeso-obesidad respecto a otro grupo de pacientes menores de 18 años con DM1 con un peso dentro de la normalidad.
Material y métodosDiseño del estudio y población estudiadaSe realizó un estudio transversal, observacional y descriptivo sobre pacientes diagnosticados de DM1 y seguidos en la consulta de endocrinología pediátrica del Hospital General Universitario de Ciudad Real. Los datos se recogieron prospectivamente durante un periodo de 11 meses. Para recoger la población de estudio se utilizó un muestreo no aleatorizado consecutivo. Según estadísticas del propio servicio, y teniendo en cuenta el periodo de selección, se estimó un tamaño muestral de 119 pacientes.
Los criterios de inclusión fueron: diagnóstico de DM1 (presencia de anticuerpos antiinsulina y/o antidescarboxilasa del ácido glutámico y/o antitirosínfosfatasa), edad entre 5 y 16 años y pauta de tratamiento con insulinoterapia intensiva (definida como al menos 3 dosis de insulina subcutánea al día o con sistemas de infusión continua de insulina). Los criterios de exclusión fueron: presentar otras formas de diabetes, edad inferior a 5 años o superior a 16, precisar menos de 3 dosis diarias de insulina subcutánea, y haber transcurrido menos de un año desde el diagnóstico de la diabetes.
Variables estudiadasSe recogieron como variables cualitativas sexo y tipo de insulina, y como variables cuantitativas edad, tiempo de evolución desde el diagnóstico de DM1, dosis de insulina diaria (en UI/kg y en UI/m2), peso, talla, índice de masa corporal (IMC), perímetro abdominal y de cadera, presión arterial (PA), hemoglobina glucosilada (HbA1c), TeDG y perfil lipoproteico, que incluyó colesterol total (CT), colesterol de las lipoproteínas de alta densidad (HDL), colesterol de las lipoproteínas de baja densidad (LDL) y triglicéridos (TG).
El peso se determinó en una báscula electrónica con límites de 0 a 120kg y precisión de 100g, siendo valorado el paciente en ropa interior. La talla se midió con un tallímetro inextensible rígido de pared con límites de 60 a 200cm y precisión de 0,1cm, siendo efectuada la determinación con el paciente descalzo.
Siguiendo las recomendaciones de la «Guía de práctica clínica sobre la prevención y el tratamiento de la obesidad infanto-juvenil» del ministerio de Sanidad7, para la valoración del IMC se tomaron como referencia las gráficas del estudio semilongitudinal de Hernández et al.8, que definen sobrepeso cuando el IMC es igual o superior al percentil 90 (p90) para edad y sexo, y definen obesidad cuando el IMC es igual o superior al percentil 97 (p97) para edad y sexo.
El perímetro abdominal se midió con el paciente en bipedestación tomando al final de la espiración el punto medio entre el reborde costal inferior y la cresta ilíaca. Se utilizaron como gráficas de referencia las de Fernández et al.9, expresándose los valores en desviaciones estándar (DE) respecto a la media.
La medida de la PA se realizó con el paciente en decúbito supino mediante el método auscultatorio utilizando un tensiómetro homologado. Se realizaron 3 determinaciones, anotándose la más baja. Se definió hipertensión arterial (HTA) como una PA sistólica y/o diastólica mayor del percentil 95 (p95) para edad, sexo y percentil de talla. Las tablas de referencia utilizadas fueron las del National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents10.
Se definió SM según los criterios específicos establecidos para la edad pediátrica por la International Diabetes Federation (IDF)11.
La HbA1c se determinó en sangre con el paciente en ayunas, expresándose los resultados según la equivalencia para el método empleado en el Diabetes Control and Complications Trial (DCCT). Se usó el analizador ADAMS A1c modelo HA-8160 (Menarini Diagnóstica SA) mediante cromatografía líquida de alta resolución.
Análisis estadísticoSe utiliza el programa SPSS® para Windows. Se realizó un análisis estadístico descriptivo para las variables cualitativas y cuantitativas, expresándose los resultados mediante tablas de distribución de frecuencias, y como mediana y rango intercuartílico. Asimismo, se realizó un análisis estadístico inferencial mediante el test de correlación de Pearson (entre variables cuantitativas) expresándose los resultados mediante el coeficiente r, la prueba t para la diferencia de medias (entre variables cualitativas y cuantitativas), expresándose los resultados como media y desviaciones estándar, y el análisis de la varianza (entre variables cualitativas y cuantitativas) expresándose los resultados como media y varianza. Todos los datos analizados se estratificaron por sexo y grupos de edad: menores de 11 años (mayoritariamente prepuberales) y con edad mayor o igual a 11 años (con distintos grados de desarrollo puberal en su mayoría). En todos los casos se estableció como nivel de significación estadística una p<0,05.
Aspectos éticos y de confidencialidadEste estudio se llevó a cabo según los principios de la Declaración de Helsinki y enmiendas relativas a la investigación en humanos, habiendo recibido la evaluación favorable del Comité Ético de Investigación Clínica del Hospital General Universitario de Ciudad Real. Para la inclusión en el estudio se requirió de los padres de los pacientes la firma del consentimiento informado.
ResultadosSegún la metodología descrita, se recogieron los datos de 115 pacientes sobre los 119 previstos. Se obtuvo una distribución por sexos con predominio masculino: 69 hombres (60%) y 46 mujeres (40%). La mediana de edad fue de 12,6 años (10,5-15,4), presentando 23 pacientes (20%) una edad menor de 11 años y 92 pacientes (80%) una edad mayor o igual a 11 años. La mediana del tiempo de evolución de la DM1 fue de 4,2 años (2,1-6,8). Respecto a las insulinas de acción lenta, la glargina era la más utilizada (72,1%; n=86); el resto de pacientes utilizaba NPH o detemir. La insulina aspártica era la más utilizada entre las insulinas de acción rápida (80,9%; n=93), y el resto de pacientes utilizaba insulina lispro y regular. No existían diferencias en la distribución de la utilización de los distintos tipos de insulina según los grupos de peso.
El porcentaje de pacientes con sobrepeso-obesidad (IMC mayor o igual al p90) constituyó el 28,6% (n=33), mientras que aquellos con obesidad (IMC mayor o igual al p97) supusieron el 18,2% de la muestra. Al estratificar por sexos, se observó una mayor prevalencia de sobrepeso en las mujeres (39,1%; n=18) que casi duplicaba la frecuencia de los hombres (21,7%; n=15) (p=0,03), acentuándose cuando se examina la prevalencia de obesidad, que supone aproximadamente el triple en el sexo femenino (28,2%; n=13) respecto al masculino (11,5%; n=8) (p=0,001). Cuando se estratificó por grupos de edad no se observaron diferencias significativas. La frecuencia de sobrepeso-obesidad era de 30,3 y 28%, respectivamente, en los grupos de menor (< 11 años) y mayor edad. La frecuencia de obesidad para los mismos grupos fue de 18,1 y 18,2%, respectivamente.
El 6,4% de los pacientes de entre 10 y 16 años cumplía criterios de SM, con un claro predominio femenino (83,3% del total).
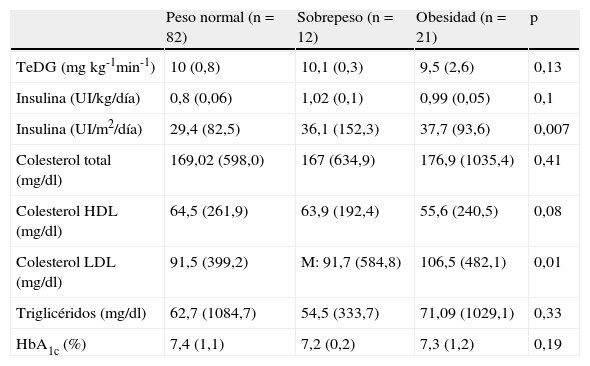
En la tabla 1 se indican los resultados de las medidas de resistencia a la insulina, de control glucémico y de perfil lipídico de los pacientes en los 3 grupos según distribución de peso.
Valores de tasa estimada de disposición de glucosa, dosis de insulina, perfil lipoproteico y hemoglobina glucosilada en los distintos grupos de estudio distribuidos según peso
| Peso normal (n=82) | Sobrepeso (n=12) | Obesidad (n=21) | p | |
| TeDG (mg kg-1min-1) | 10 (0,8) | 10,1 (0,3) | 9,5 (2,6) | 0,13 |
| Insulina (UI/kg/día) | 0,8 (0,06) | 1,02 (0,1) | 0,99 (0,05) | 0,1 |
| Insulina (UI/m2/día) | 29,4 (82,5) | 36,1 (152,3) | 37,7 (93,6) | 0,007 |
| Colesterol total (mg/dl) | 169,02 (598,0) | 167 (634,9) | 176,9 (1035,4) | 0,41 |
| Colesterol HDL (mg/dl) | 64,5 (261,9) | 63,9 (192,4) | 55,6 (240,5) | 0,08 |
| Colesterol LDL (mg/dl) | 91,5 (399,2) | M: 91,7 (584,8) | 106,5 (482,1) | 0,01 |
| Triglicéridos (mg/dl) | 62,7 (1084,7) | 54,5 (333,7) | 71,09 (1029,1) | 0,33 |
| HbA1c (%) | 7,4 (1,1) | 7,2 (0,2) | 7,3 (1,2) | 0,19 |
HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; TeGD: tasa estimada de disposición de glucosa.
Valores expresados como media (M) y varianza (V).
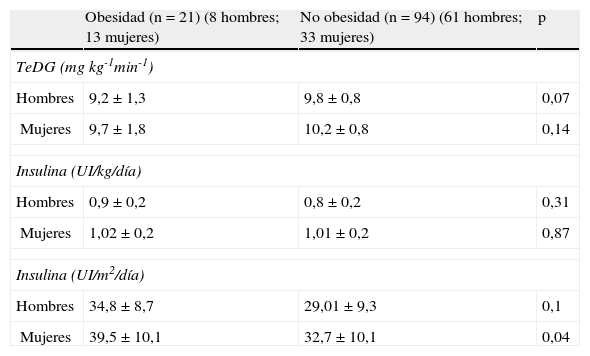
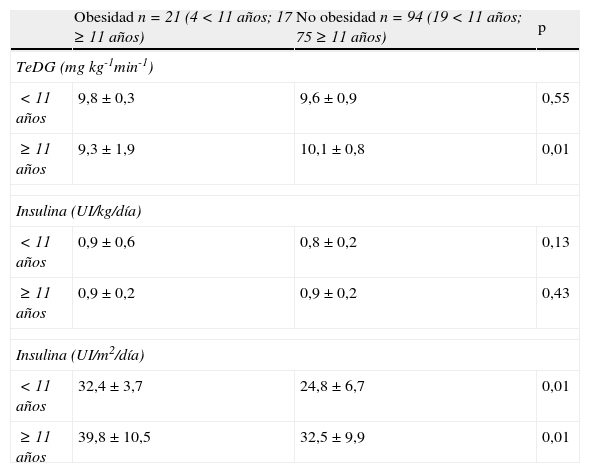
No se observó correlación entre el IMC y el valor de la TeDG (r=−0,158; p=0,006). Al analizar los valores de la TeDG en los 3 grupos de peso normal, sobrepeso y obesidad, no se hallaron diferencias estadísticamente significativas (tabla 1). Cuando se estratificó por sexo tampoco se encontraron diferencias estadísticamente significativas entre los pacientes con obesidad y el resto (tabla 2). Sin embargo, al estratificar por grupos de edad se observa que el grupo de pacientes obesos con DM1 y edad igual o superior a 11 años presentaban valores significativamente menores en el valor de la TeDG respecto a aquellos otros pacientes con DM1 sin obesidad (tabla 3). Por el contrario, en los menores de 11 años no se observaron diferencias estadísticamente significativas (tabla 3).
Marcadores de resistencia a la insulina según sexo
| Obesidad (n=21) (8 hombres; 13 mujeres) | No obesidad (n=94) (61 hombres; 33 mujeres) | p | |
| TeDG (mg kg-1min-1) | |||
| Hombres | 9,2±1,3 | 9,8±0,8 | 0,07 |
| Mujeres | 9,7±1,8 | 10,2±0,8 | 0,14 |
| Insulina (UI/kg/día) | |||
| Hombres | 0,9±0,2 | 0,8±0,2 | 0,31 |
| Mujeres | 1,02±0,2 | 1,01±0,2 | 0,87 |
| Insulina (UI/m2/día) | |||
| Hombres | 34,8±8,7 | 29,01±9,3 | 0,1 |
| Mujeres | 39,5±10,1 | 32,7±10,1 | 0,04 |
TeDG: tasa estimada de disposición de glucosa.
Los valores están expresados como media y desviación estándar.
Marcadores de resistencia a la insulina según edad
| Obesidad n=21 (4<11 años; 17 ≥ 11 años) | No obesidad n=94 (19<11 años; 75 ≥ 11 años) | p | |
| TeDG (mg kg-1min-1) | |||
| <11 años | 9,8±0,3 | 9,6±0,9 | 0,55 |
| ≥ 11 años | 9,3±1,9 | 10,1±0,8 | 0,01 |
| Insulina (UI/kg/día) | |||
| <11 años | 0,9±0,6 | 0,8±0,2 | 0,13 |
| ≥ 11 años | 0,9±0,2 | 0,9±0,2 | 0,43 |
| Insulina (UI/m2/día) | |||
| <11 años | 32,4±3,7 | 24,8±6,7 | 0,01 |
| ≥ 11 años | 39,8±10,5 | 32,5±9,9 | 0,01 |
TeDG: tasa estimada de disposición de glucosa.
Los valores están expresados como media y desviación estándar.
No se observó correlación entre el IMC y la dosis de insulina, ya sea expresada en UI/kg/día (r=0,075; p=0,003) o en UI/m2/día (r=0,290; p=0,034). Al cuantificar la dosis diaria de insulina en UI/kg/día no se apreciaron diferencias significativas entre los pacientes con peso normal, sobrepeso y obesidad (tabla 1), al igual que lo que sucedía al estratificar por sexo (tabla 2) o por grupos de edad (tabla 3).
Por su parte, cuando la dosis de insulina se cuantificó por m2 de superficie corporal, se obtenían diferencias significativas en los grupos de pacientes con peso normal, sobrepeso y obesidad (tabla 1), al igual que entre el grupo de mujeres con obesidad y el resto (tabla 2) y entre los individuos obesos y no obesos de los 2 grupos de edad establecidos (tabla 3).
Perímetro abdominal, tasa estimada de disposición de glucosa y dosis de insulinaEn la muestra analizada no se evidenció correlación entre el perímetro abdominal con la TeDG y la dosis de insulina. Así, se obtuvieron los siguientes resultados: r=−0,271 (p=0,15) para la TeDG, r=0,092 (p=0,004) para la dosis de insulina en UI/kg/día, y r=0,312 (p=0,02) para la dosis en UI/m2/día. Tampoco se observó correlación entre el perímetro abdominal y los parámetros anteriores cuando se estratificó por sexos y por edad.
Tasa estimada de disposición de glucosa y perfil lipoproteicoNo se encontró correlación entre los valores de la TeDG y las concentraciones plasmáticas de CT, c-HDL, c-LDL y TG. Se obtuvieron los siguientes resultados: r=−0,168 (p=0,23) para el CT, r=−0,014 (p=0,08) para el c-HDL, r=−0,132 (p=0,10) para el c-LDL, y r=−0,278 (p=0,12) para los TG.
Sobrepeso, obesidad y perfil lipoproteicoRespecto a la presencia de un perfil lipoproteico de riesgo cardiovascular y su relación con la presencia de sobrepeso u obesidad, se encontraron concentraciones significativamente más elevadas de c-LDL en el grupo de pacientes con obesidad respecto al resto (tabla 1). En cuanto al CT, el c-HDL y los TG no se observaron diferencias significativas entre los distintos grupos.
Por su parte, no se encontró correlación entre el aumento del perímetro abdominal y la presencia de un perfil lipoproteico de riesgo cardiovascular (aumento de CT, c-LDL y TG y descenso del c-HDL). Así, se obtuvieron los siguientes resultados: r=−0,017 (p=0,05) para el CT; r=−0,304 (p=0,17) para el c-HDL; r=0,143 (p=0,25) para el c-LDL y r=0,206 (p=0,04) para los TG.
Tasa estimada de disposición de glucosa, dosis de insulina y hemoglobina glucosiladaNo se observó correlación lineal entre los distintos marcadores de RI estudiados y el valor de la HbA1c. Así, se obtuvieron los siguientes resultados: r=−0,195 (p=0,08) para la TeDG; r=0,089 (p=0,1) para la dosis de insulina en UI/kg/día, y r=0,250 (p=0,06) para la dosis de insulina en UI/m2/día.
Sobrepeso, obesidad y hemoglobina glucosiladaPor último, en la muestra estudiada no se observaron diferencias significativas en el valor de la HbA1c entre el grupo con peso normal, con sobrepeso y con obesidad (tabla 1).
DiscusiónAunque la TeDG es un factor predictor del riesgo de complicaciones vasculares superior a la cuantificación de insulina1,5,12, todos los estudios realizados corresponden a pacientes mayores de 18 años. Por tanto, una de las limitaciones de este estudio radica en que la TeDG se ha obtenido a partir de población adulta exclusivamente4, con lo que los valores para definir hipertensión arterial son diferentes a los empleados en pacientes pediátricos10. Asimismo, el aumento del cociente cintura-cadera en niños prepuberales no siempre se relaciona con un incremento de la adiposidad visceral, sino que a menudo se debe al mayor tamaño relativo de los órganos intraabdominales13.
De forma general, los pacientes con sobrepeso-obesidad presentan valores de la TeDG inferiores al resto; aunque estas diferencias no son significativas. No obstante, solo el 6,4% de nuestra población de 10 a 16 años cumple los criterios de SM, frente a la prevalencia más elevada de Kilpatrick et al.1, Chillarón et al.5, Pambianco et al.6 y Thorn et al.14. Respecto a las complicaciones vasculares de la DM1 y el papel predictor de la TeDG, Chillarón et al.5 observaron que aquellos casos con complicaciones vasculares presentan una TeDG menor de 8,16mg kg-1min-1. Thorn et al.14 refieren que los pacientes con DM1 y microalbuminuria elevada muestran valores menores de la TeDG, y Orchard et al.15 obtienen una TeDG inferior en aquellos con alteraciones coronarias. Aunque en la población del presente estudio no se presentan complicaciones vasculares, los pacientes con SM muestran una TeDG media de 8,15mg kg-1 min-1, similar al valor de Chillarón et al.5.
Si bien en este trabajo las niñas muestran mayor prevalencia de sobrepeso-obesidad, no existen diferencias en la TeDG en función del sexo. Sin embargo, al estratificar por edad, los pacientes con edad igual o superior a 11 años y obesidad muestran una TeDG inferior al resto. Considerando que en nuestro grupo la HTA tiene una escasa influencia en el resultado de la TeDG, la relación cintura-cadera determina en gran parte su valor. Por ello, en pacientes con desarrollo puberal en el que el patrón adiposo se asemeja al del adulto, un aumento del perímetro abdominal puede corresponderse con un aumento de la adiposidad intraabdominal, que a su vez puede conllevar RI. Aunque la estratificación de la TeDG según los estadios de Tanner permitiría observar sus variaciones en función de la progresión de la pubertad, en el presente estudio no ha podido realizarse debido al tamaño muestral insuficiente, por lo que la estratificación realizada por grupos de edad pretende diferenciar aquellos pacientes mayoritariamente prepuberales de aquellos otros con desarrollo puberal.
Respecto a la dosis de insulina en UI/kg/día, en nuestro estudio no existen diferencias significativas en los pacientes con peso normal frente a aquellos con sobrepeso y obesidad, ni se encuentra correlación entre la dosis de insulina y el IMC. Del mismo modo, Shenoy et al.16 y Chillarón et al.5,17 tampoco encuentran diferencias en las necesidades de insulina de los pacientes con sobrepeso-obesidad y el resto. Ferrante et al.18 observaron un aumento en la dosis de insulina sin evidenciar correlación con el peso. Aunque la dosis de insulina varía según las distintas pautas empleadas, no parece un aspecto relevante en nuestros pacientes, ya que predominantemente se emplea la glargina como análogo de acción lenta y la aspártica como análogo de acción rápida. Respecto a la cuantificación de insulina en UI/m2/día, Reinehr et al.19 mostraron que un aumento del IMC se correlacionaba con un incremento de la dosis expresada en m2 de superficie corporal, concluyendo que la dosis en UI/m2/día refleja mejor la influencia del sobrepeso sobre la RI en la DM1 en pacientes pediátricos que cuando se expresa en UI/kg/día. En el actual estudio puede observarse de igual forma que existen diferencias significativas entre los grupos con peso normal, sobrepeso y obesidad, lo que refrendaría que este parámetro es más sensible que la dosis de insulina en UI/kg/día para reflejar los cambios que el sobrepeso produce sobre la sensibilidad a la insulina. Por otra parte, tampoco se encuentra en esta población una correlación entre la dosis de insulina y el perímetro abdominal, lo que sugeriría que este parámetro, a pesar de relacionarse en numerosos estudios en la edad pediátrica con el desarrollo de RI y de SM20-24, no parece ser por sí solo un indicador de la sensibilidad a la insulina en los pacientes diabéticos menores de 18 años.
Aunque las alteraciones lipoproteicas son frecuentes en adultos con DM125, en este estudio únicamente 5 pacientes (4,3%) presentaban un c-HDL inferior a 40mg/dl, y solo 3 (2,6%) mostraron TG superiores a 150mg/dl, que son los valores establecidos para la definición de SM por la IDF11. Asimismo, conviene destacar que las concentraciones medias del c-LDL son significativamente mayores en los pacientes obesos respecto al resto, lo que supone un factor adicional de riesgo cardiovascular. En este sentido, se ha evidenciado que los pacientes con DM1 y RI muestran un perfil lipoproteico más aterogénico, con niveles mayores de c-LDL e inferiores de c-HDL26. En nuestro grupo tampoco se encuentra correlación entre el perímetro abdominal y las distintas lipoproteínas, a diferencia de otros estudios27. Por otra parte, el hecho de no encontrar correlación entre la TeDG y los niveles plasmáticos de las distintas lipoproteínas pudiera deberse a la baja prevalencia de alteraciones del perfil lipídico en esta población.
Al igual que otros estudios realizados en población pediátrica con DM116, en el actual trabajo tampoco se aprecian diferencias significativas en la HbA1c en función del peso corporal. En este sentido, conviene resaltar la importancia que tienen sobre el control glucémico otros factores no considerados en este trabajo, como la frecuencia de autoanálisis, las correcciones de las hiperglucemias con dosis adicionales de insulina, las transgresiones dietéticas, el ejercicio físico, las enfermedades intercurrentes y la variabilidad interindividual.
En conclusión, los pacientes mayores de 11 años con DM1 y obesidad muestran valores inferiores de la TeDG respecto a los no obesos del mismo grupo de edad con DM1. Así, la TeDG podría ser un marcador de RI en estos pacientes, por lo que podría incluirse su determinación para establecer estrategias que permitan un control metabólico óptimo. No obstante, son necesarios más estudios en pacientes pediátricos con DM1 para conocer el papel que la TeDG tiene en el desarrollo de RI.
FinanciaciónEste trabajo ha recibido financiación en la IV Convocatoria de la Fundación Sociosanitaria de Castilla-La Mancha para grupos de investigación en Ciencias de la Salud (referencia AN-2010/49) así como de la Fundación Sociedad Española de Endocrinología Pediátrica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.