El síndrome del ovario poliquístico (SOP), es una endocrinopatía femenina reconocida como un trastorno heterogéneo caracterizado por un hiperandrogenismo y una disfunción ovulatoria que conlleva problemas de fertilidad. Además, las pacientes suelen presentar una sintomatología asociada como la resistencia a la insulina, la intolerancia a la glucosa, la obesidad central y/o el síndrome metabólico que pueden inducir a un aumento del riesgo de enfermedad cardiovascular. Dado que uno de los principales objetivos del tratamiento del SOP es reducir las consecuencias metabólicas relacionadas con la obesidad, la resistencia a la insulina y el síndrome metabólico, las intervenciones dietéticas dirigidas a este propósito pueden resultar eficaces en el tratamiento de este padecimiento.
Se ha llevado a cabo una búsqueda bibliográfica en diferentes bases de datos como Web of Science (WOS), PubMed y Google Académico estableciendo unos criterios de búsqueda previamente definidos. Se han elegido 11 trabajos para su revisión completa y análisis crítico. Entre las diferentes intervenciones que se han utilizado, se han seguido estrategias dietéticas como la Dietary Approaches to Stop Hypertension (DASH), modificaciones en los hidratos de carbono (HC), la inclusión de algún alimento determinado en el patrón dietético habitual y/o los cambios en el estilo de vida. De los resultados obtenidos, destacan las mejoras propiciadas en los marcadores corporales con un régimen DASH, los beneficios promovidos por dietas con modificaciones en los HC, en la resistencia insulínica (IR) y los marcadores hormonales, así como los efectos favorables en las manifestaciones clínicas relacionadas con el hiperandrogenismo, fomentados por el consumo de soja y las modificaciones en el estilo de vida (LSM).
Polycystic ovary syndrome (PCOS) is a female endocrinopathy recognized as a heterogeneous disorder characterized by hyperandrogenism and ovulatory dysfunction that leads to fertility problems. In addition, patients usually present with associated symptoms such as insulin resistance, glucose intolerance, central obesity and/or metabolic syndrome that can induce an increased risk of cardiovascular disease. Since one of the main goals of PCOS is to reduce the metabolic consequences related to obesity, insulin resistance, and the metabolic syndrome, targeted dietary interventions may be effective in treating PCOS.
A bibliographic search has been carried out in different databases such as Web of Science, Pubmed and Google Scholar, establishing previously defined search criteria. Eleven have been chosen for full review and critical analysis. Among the different interventions that have been used, dietary strategies have been followed such as the dietary approaches to stop hypertension (DASH), modifications in carbohydrates, the inclusion of a certain food in the usual dietary pattern and/or lifestyle modifications. Of the results obtained, we highlight the improvements in body markers with a DASH diet, the benefits promoted by diets with modifications in carbohydrates, in insulin resistance and hormonal markers and favorable effects on clinical manifestations related to hyperandrogenism, fostered by soy consumption and lifestyle modifications.
El síndrome del ovario poliquístico (SOP) es una disfunción endocrino-metabólica que constituye la causa más común de hiperandrogenismo tanto en mujeres adolescentes como adultas1. Tiene una prevalencia en aquellas que se encuentran en edad fértil de 8–13%, y constituye 75% de las causas de infertilidad en este grupo etario, también se puede manifestar desde el periodo prepuberal o incluso anteriormente2,3.
En lo que concierne a los criterios de diagnóstico propuestos en el consenso de Rotterdam de 2003, la entidad se confirma con dos de tres criterios: hiperandrogenismo (clínico o bioquímico), ciclos irregulares y morfología de ovario poliquístico. En adolescentes se necesitan tanto los criterios de hiperandrogenismo como de ciclos irregulares, y no se incluye la morfología ovárica por poca especificidad. Los criterios de diagnóstico generan cuatro fenotipos y las características clínicas son heterogéneas, con manifestaciones que típicamente surgen en la niñez y luego evolucionan a lo largo de la vida adolescente y adulta4.
Por otra parte, la anovulación es un trastorno menstrual en el que en la mayoría de los casos cursan con oligomenorrea (presencia de menos de nueve menstruaciones al año o tres ciclos de más de 38 días durante el último año) o amenorrea (ciclos mayores a 90 días). El último criterio diagnóstico implantado por el consenso de Rotterdam en 2003 es la morfología del ovario poliquístico, en el que se trataría como tal si al menos uno de los ovarios tiene 12 o más folículos con un diámetro de entre 2-9 mm o un volumen ovárico superior a 10 mL, en uno o ambos, sin considerar el aspecto subjetivo de ovarios poliquísticos, la distribución folicular ni la imagen del estroma5. En presencia de oligo o anovulación e hiperandrogenismo, no es necesaria la ecografía para el diagnóstico. En las adolescentes, se requiere oligoanovulación e hiperandrogenismo, no estando recomendado el ultrasonido para el diagnóstico6.
FisiopatologíaEn cuanto a la fisiopatología del SOP, destacan tres tipos de alteraciones interrelacionadas: una disfunción neuroendocrina7, una variación de la esteroidogénesis y de la foliculogénesis ovárica determinada por la enzima citocromo P450c171,8 y un trastorno metabólico (resistencia insulínica [IR] e hiperinsulinemia), que a su vez produce un incremento en la secreción de andrógenos tanto en el ovario como en las glándulas suprarrenales, y además, una disminución de la captación de glucosa por parte del órgano blanco.
Por otra parte, hay que destacar que entre las comorbilidades asociadas al SOP se encuentra el síndrome metabólico, caracterizado por un bajo nivel de colesterol de lipoproteínas de alta densidad (HDL) y una relación cintura-cadera (CCi/CCa) elevada9–11.
Asimismo, la obesidad complica la presentación de este síndrome, de ahí la necesidad de encontrar una estrategia terapéutica que genere un cambio en el estilo de vida en cuanto a dieta, ejercicio e intervenciones conductuales12,13, con el objetivo de mejorar la composición corporal, el hiperandrogenismo y la resistencia a la insulina14.
Abordaje nutricionalPara poder obtener una mejora de la composición corporal y de la IR, el manejo nutricional del SOP debe ir dirigido hacia planes de pérdida de peso y enfocado a que los distintos nutrientes que componen la dieta mejoren esa sensibilidad a la insulina, medidas que incluyen la ingesta de cantidades bajas de ácidos grasos saturados (AGS), un consumo suficiente de fibra procedente de cereales integrales, legumbres, verduras y frutas, y un aporte de hidratos de carbono (HC) principalmente con un índice glucémico bajo (LGI)15,6. La reducción de energía entre 500-1.000 kcal/día y del peso entre 5-10% normalizaría la secreción de gonadotropina, el hiperandrogenismo clínico y bioquímico, y mejoraría la sensibilidad a la insulina. No obstante, y a pesar de tratarse de una dieta hipocalórica, las intervenciones dietéticas se ajustan a los estándares nacionales de HC (45-65% del valor calórico total [VCT] de la dieta), proteínas (10-35% del VCT) y grasas (20-35% del VCT)16. Siguiendo esta línea, en algún estudio publicado como el de Szczuko et al.17, además de una reducción en el aporte calórico de la dieta, la introducción de un régimen con un LGI ha conducido a una disminución del modelo homeostático para la resistencia a la insulina (HOMA-IR), la insulina en ayunas (FIB), el colesterol total (CT) y de lipoproteínas de baja densidad (LDL), triglicéridos (TG), circunferencia de cintura (CCi) y la testosterona total (TT) en comparación con dietas con índice glucémico alto (HGI).
Con todo ello, el objetivo principal de este trabajo es evaluar los diferentes tipos de intervenciones dietéticas en el tratamiento del SOP, para así, comparar y establecer las opciones más idóneas para mejorar las manifestaciones clínicas asociadas al mismo. Otros objetivos propuestos son valorar la influencia de las intervenciones dietéticas sobre los marcadores de composición corporal o antropométricos, determinar el efecto de estas en los síntomas asociados a los niveles hormonales relacionados con el hiperandrogenismo y calificar la eficacia del abordaje nutricional en la mejora de la resistencia a la insulina que padece la mayoría de las mujeres con SOP.
MétodosEstrategia de búsquedaPara llevar a cabo la búsqueda de los diferentes artículos científicos se ha recurrido a la base de datos de Web of Science (WOS), PubMed y Google Académico. Las palabras clave y booleanos utilizados en el rastreo de los trabajos principales para la revisión bibliográfica han sido las siguientes:
(«polycystic ovary syndrome» OR «PCOS» OR «Polycystic Ovary Syndrome») AND («diet» OR «diet therapy» OR «dietary intervention» OR «dietary approach» OR «lifestyle» OR «lifestyle modification» OR «lifestyle change»).
Además, se han definido unos criterios de inclusión y exclusión con el fin de establecer una acotación y seleccionar los artículos más actuales y con el mayor grado de evidencia científica posible.
Criterios de selecciónDebido al elevado número de artículos obtenidos en la búsqueda inicial, se han propuesto los siguientes criterios de inclusión y exclusión:
Criterios de inclusión: ensayos clínicos controlados, estudios controlados aleatorizados, revisiones sistemáticas y metaanálisis; publicaciones realizadas en los últimos cinco años (2017-actualidad); trabajos escritos en español o inglés; estudios efectuados en mujeres entre 14-50 años; aquellos en los que se haya llevado a cabo una intervención dietética o modificación del estilo de vida (LSM); ensayos en los que se haya hecho un seguimiento de alguno de los siguientes parámetros: índice de masa corporal (IMC), Cci/Cca, porcentaje de masa grasa (MG) y masa magra (MM), Parámetros hormonales relacionados con el hiperandrogenismo (globulina fijadora de hormonas sexuales [SHBG], hormona antimülleriana [AMH], hormona luteinizante [LH], hormona liberadora de gonadotropina [GnRH]) y parámetros bioquímicos (colesterol HDL, TG, lipoproteínas, glucosa, HOMA-IR).
Criterios de exclusión: estudios realizados en mujeres que presentaran trastornos de hiperandrogenismo e infertilidad diferentes del SOP; ensayos que hayan usado suplementos alimenticios o fármacos para valorar su efecto en comparación con la intervención dietética; aquellos efectuados sobre mujeres embarazadas; estudios comparativos de mujeres que presentan SOP y aquellas que no lo presentan y ensayos en los que se utiliza medicina herbaria para valorar su efecto en SOP.
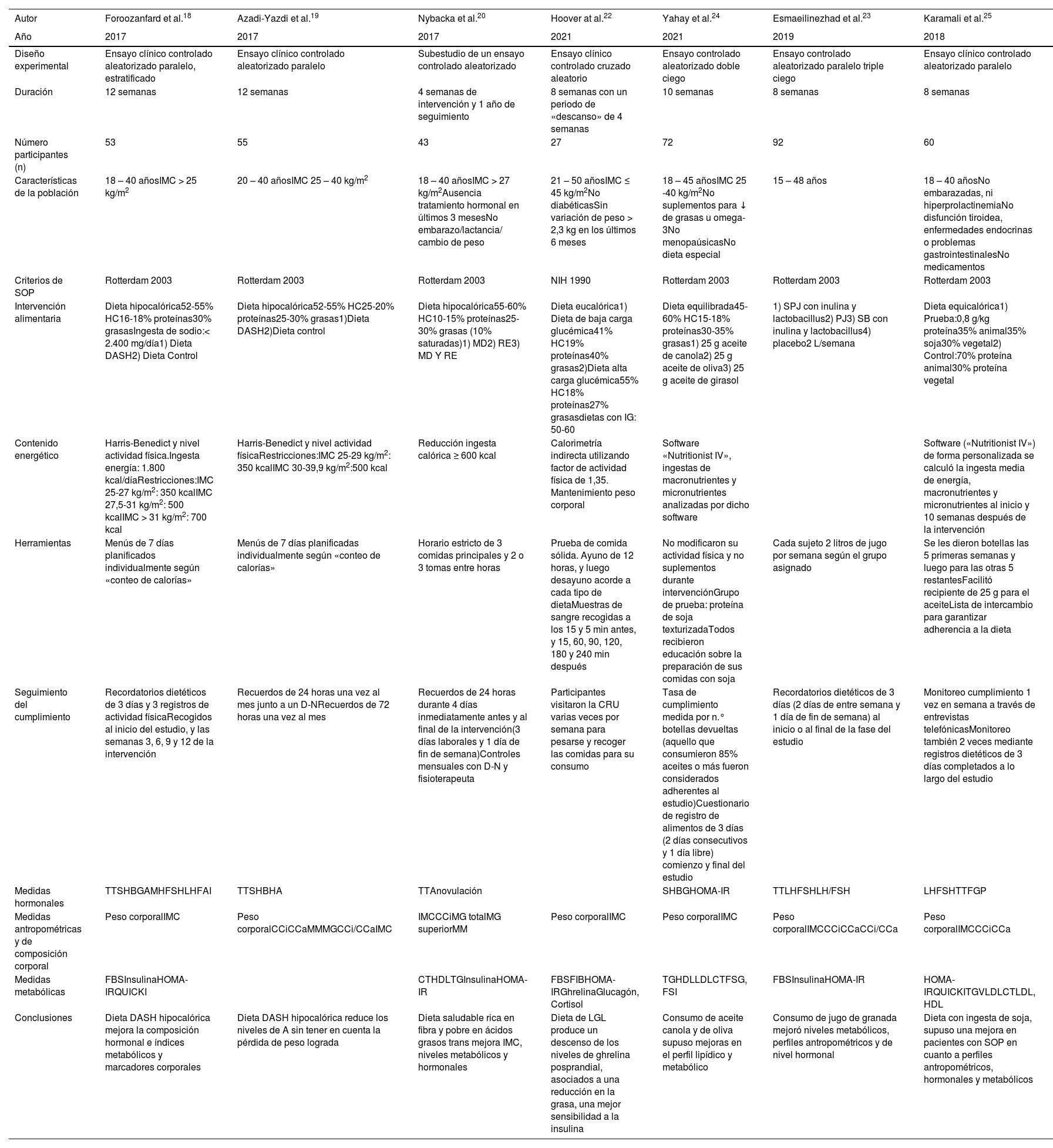
ResultadosLas principales características de los 11 artículos seleccionados para el presente trabajo se encuentran desglosados en los siguientes apartados. En la mayoría de los estudios se reclutaron a mujeres con SOP diagnosticado mediante los criterios de Rotterdam de 2003, con edades comprendidas entre los 14 y 50 años (tablas 1 y 2).
Características de los estudios experimentales seleccionados
| Autor | Foroozanfard et al.18 | Azadi-Yazdi et al.19 | Nybacka et al.20 | Hoover at al.22 | Yahay et al.24 | Esmaeilinezhad et al.23 | Karamali et al.25 |
|---|---|---|---|---|---|---|---|
| Año | 2017 | 2017 | 2017 | 2021 | 2021 | 2019 | 2018 |
| Diseño experimental | Ensayo clínico controlado aleatorizado paralelo, estratificado | Ensayo clínico controlado aleatorizado paralelo | Subestudio de un ensayo controlado aleatorizado | Ensayo clínico controlado cruzado aleatorio | Ensayo controlado aleatorizado doble ciego | Ensayo controlado aleatorizado paralelo triple ciego | Ensayo clínico controlado aleatorizado paralelo |
| Duración | 12 semanas | 12 semanas | 4 semanas de intervención y 1 año de seguimiento | 8 semanas con un periodo de «descanso» de 4 semanas | 10 semanas | 8 semanas | 8 semanas |
| Número participantes (n) | 53 | 55 | 43 | 27 | 72 | 92 | 60 |
| Características de la población | 18 – 40 añosIMC > 25 kg/m2 | 20 – 40 añosIMC 25 – 40 kg/m2 | 18 – 40 añosIMC > 27 kg/m2Ausencia tratamiento hormonal en últimos 3 mesesNo embarazo/lactancia/ cambio de peso | 21 – 50 añosIMC ≤ 45 kg/m2No diabéticasSin variación de peso > 2,3 kg en los últimos 6 meses | 18 – 45 añosIMC 25 -40 kg/m2No suplementos para ↓ de grasas u omega- 3No menopaúsicasNo dieta especial | 15 – 48 años | 18 – 40 añosNo embarazadas, ni hiperprolactinemiaNo disfunción tiroidea, enfermedades endocrinas o problemas gastrointestinalesNo medicamentos |
| Criterios de SOP | Rotterdam 2003 | Rotterdam 2003 | Rotterdam 2003 | NIH 1990 | Rotterdam 2003 | Rotterdam 2003 | Rotterdam 2003 |
| Intervención alimentaria | Dieta hipocalórica52-55% HC16-18% proteínas30% grasasIngesta de sodio:< 2.400 mg/día1) Dieta DASH2) Dieta Control | Dieta hipocalórica52-55% HC25-20% proteínas25-30% grasas1)Dieta DASH2)Dieta control | Dieta hipocalórica55-60% HC10-15% proteínas25-30% grasas (10% saturadas)1) MD2) RE3) MD Y RE | Dieta eucalórica1) Dieta de baja carga glucémica41% HC19% proteínas40% grasas2)Dieta alta carga glucémica55% HC18% proteínas27% grasasdietas con IG: 50-60 | Dieta equilibrada45-60% HC15-18% proteínas30-35% grasas1) 25 g aceite de canola2) 25 g aceite de oliva3) 25 g aceite de girasol | 1) SPJ con inulina y lactobacillus2) PJ3) SB con inulina y lactobacillus4) placebo2 L/semana | Dieta equicalórica1) Prueba:0,8 g/kg proteína35% animal35% soja30% vegetal2) Control:70% proteína animal30% proteína vegetal |
| Contenido energético | Harris-Benedict y nivel actividad física.Ingesta energía: 1.800 kcal/díaRestricciones:IMC 25-27 kg/m2: 350 kcalIMC 27,5-31 kg/m2: 500 kcalIMC > 31 kg/m2: 700 kcal | Harris-Benedict y nivel actividad físicaRestricciones:IMC 25-29 kg/m2: 350 kcalIMC 30-39,9 kg/m2:500 kcal | Reducción ingesta calórica ≥ 600 kcal | Calorimetría indirecta utilizando factor de actividad física de 1,35. Mantenimiento peso corporal | Software «Nutritionist IV», ingestas de macronutrientes y micronutrientes analizadas por dicho software | Software («Nutritionist IV») de forma personalizada se calculó la ingesta media de energía, macronutrientes y micronutrientes al inicio y 10 semanas después de la intervención | |
| Herramientas | Menús de 7 días planificados individualmente según «conteo de calorías» | Menús de 7 días planificadas individualmente según «conteo de calorías» | Horario estricto de 3 comidas principales y 2 o 3 tomas entre horas | Prueba de comida sólida. Ayuno de 12 horas, y luego desayuno acorde a cada tipo de dietaMuestras de sangre recogidas a los 15 y 5 min antes, y 15, 60, 90, 120, 180 y 240 min después | No modificaron su actividad física y no suplementos durante intervenciónGrupo de prueba: proteína de soja texturizadaTodos recibieron educación sobre la preparación de sus comidas con soja | Cada sujeto 2 litros de jugo por semana según el grupo asignado | Se les dieron botellas las 5 primeras semanas y luego para las otras 5 restantesFacilitó recipiente de 25 g para el aceiteLista de intercambio para garantizar adherencia a la dieta |
| Seguimiento del cumplimiento | Recordatorios dietéticos de 3 días y 3 registros de actividad físicaRecogidos al inicio del estudio, y las semanas 3, 6, 9 y 12 de la intervención | Recuerdos de 24 horas una vez al mes junto a un D-NRecuerdos de 72 horas una vez al mes | Recuerdos de 24 horas durante 4 días inmediatamente antes y al final de la intervención(3 días laborales y 1 día de fin de semana)Controles mensuales con D-N y fisioterapeuta | Participantes visitaron la CRU varias veces por semana para pesarse y recoger las comidas para su consumo | Tasa de cumplimiento medida por n.° botellas devueltas (aquello que consumieron 85% aceites o más fueron considerados adherentes al estudio)Cuestionario de registro de alimentos de 3 días (2 días consecutivos y 1 día libre) comienzo y final del estudio | Recordatorios dietéticos de 3 días (2 días de entre semana y 1 día de fin de semana) al inicio o al final de la fase del estudio | Monitoreo cumplimiento 1 vez en semana a través de entrevistas telefónicasMonitoreo también 2 veces mediante registros dietéticos de 3 días completados a lo largo del estudio |
| Medidas hormonales | TTSHBGAMHFSHLHFAI | TTSHBHA | TTAnovulación | SHBGHOMA-IR | TTLHFSHLH/FSH | LHFSHTTFGP | |
| Medidas antropométricas y de composición corporal | Peso corporalIMC | Peso corporalCCiCCaMMMGCCi/CCaIMC | IMCCCiMG totalMG superiorMM | Peso corporalIMC | Peso corporalIMC | Peso corporalIMCCCiCCaCCi/CCa | Peso corporalIMCCCiCCa |
| Medidas metabólicas | FBSInsulinaHOMA-IRQUICKI | CTHDLTGInsulinaHOMA-IR | FBSFIBHOMA-IRGhrelinaGlucagón, Cortisol | TGHDLLDLCTFSG, FSI | FBSInsulinaHOMA-IR | HOMA-IRQUICKITGVLDLCTLDL, HDL | |
| Conclusiones | Dieta DASH hipocalórica mejora la composición hormonal e índices metabólicos y marcadores corporales | Dieta DASH hipocalórica reduce los niveles de A sin tener en cuenta la pérdida de peso lograda | Dieta saludable rica en fibra y pobre en ácidos grasos trans mejora IMC, niveles metabólicos y hormonales | Dieta de LGL produce un descenso de los niveles de ghrelina posprandial, asociados a una reducción en la grasa, una mejor sensibilidad a la insulina | Consumo de aceite canola y de oliva supuso mejoras en el perfil lipídico y metabólico | Consumo de jugo de granada mejoró niveles metabólicos, perfiles antropométricos y de nivel hormonal | Dieta con ingesta de soja, supuso una mejora en pacientes con SOP en cuanto a perfiles antropométricos, hormonales y metabólicos |
A:; AMH: hormona antimülleriana; CCa: circunferencia de cadera; CCi: circunferencia de cintura; CCi/CCa: relación cintura-cadera; CRU: Clinical Research Unit; CT: colesterol total; DASH: Dietary Approaches to Stop Hypertension; D-N: dietista-nutricionista; FAI: índice de andrógenos libres; FBS: glucosa en ayunas; FSH: hormona foliculoestimulante; HC: hidratos de carbono; HDL: lipoproteínas de alta densidad; HOMA-IR: modelo homeostático para la resistencia a la insulina; IG: índice glucémico; IMC: índice de masa corporal; IR: resistencia insulínica; LDL: lipoproteínas de baja densidad; LGL: dieta de baja carga glucémica; LH: hormona luteinizante; MD: intervención con dieta; MG: masa grasa; MM: masa magra; NIH: clasificación NIH de 1990; PJ: jugo de granada; QUICKI: índice de sensibilidad a la insulina; RE: intervención con ejercicio; SB: bebida simbiótica; SHBG: globulina fijadora de hormonas sexuales; SOP: síndrome del ovario poliquístico; SPJ: jugo de granada simbiótico; TG: triglicéridos; TT: testosterona total; VLDL: lipoproteínas de muy baja densidad.
Fuente: elaboración propia.
Características estudios de revisión y metaanálisis seleccionados
| Autor | Abdolahian et al. 28 | Porchia et al. 26 | Kazemi et al. 21 | Shang et al.31 |
|---|---|---|---|---|
| Año | 2020 | 2020 | 2020 | 2021 |
| Estudio | Revisión sistemática y metaanálisis | Metaanálisis | Revisión sistemática y metaanálisis de ensayos controlados aleatorizados | Revisión sistemática y metaanálisis de ensayos controlados aleatorizados |
| Criterios población | Adolescentes | 15 – 31 añosIMC 26 – 40 kg/m2 | 22 – 36 añosIMC 28,7 – 42,7 kg/m2 | |
| Criterios de SOP | Rotterdam 2003NIH 1990 | Rotterdam 2003NIH 1990 | Rotterdam 2003 | Rotterdam 2003NIH 1990 |
| Duración intervención | Variación entre 8 y 30 semanas | Variación entre 8 semanas y 6 meses | Variación entre 2 meses 1 año | |
| Tipo intervención | Aquellos centrados en las modificaciones del estilo de vida en niñas adolescentes con SOP (modificación / intervención del estilo de vida, incluidas las intervenciones nutricionales, de actividad física y conductuales) | Estudios que indicaran tipo de dieta o aporte de macronutrientes, SOP confirmado y contuviesen información sobre IR evaluando HOMA-IREstratificación estudios por porcentaje de HC alto y bajoEstratificación estudios por IR:IR baja/ moderada/ grave | Efectos de una dieta LGIImpacto de una dieta de LGLIntervenciones sin restricción calóricaIntervenciones con reducción de energía de 350-1.000 kcal/día | Resultados primarios: tasas de embarazo clínico, de aborto espontáneo y de ovulaciónResultados secundarios: tasa de regularidad menstrual, AMH, FAI, SHBG, TT puntuación en escala de Ferriman-Gallwey.Patrones dietéticos: dieta baja en carbohidratos, dieta LGI/LGL, dieta DASH, dieta mediterránea |
| Medidas hormonales | SHBGFSHLHTTFAIAMH | TTFAI | AMHFAIEscala Ferriman-GallweySHBGTTTasa de regularidad menstrual | |
| Medidas antropométricas y de composición corporal | Peso corporalIMC | Peso corporalCCi | ||
| Medidas metabólicas | FBSFBIHOMA-IRTG, LDL, HDL | HOMA-IR | HOMA-IRFBSFIBCT, TG, LDL, HDL | |
| Conclusiones | A pesar de que las modificaciones en el estilo de vida mediante la restricción de calorías y la actividad física puede mejorar los parámetros clínicos, metabólicos y hormonales en las adolescentes con SOP, se requieren más estudios para confirmar estos hallazgos | Dietas con bajo % de HC e hipocalóricas son más efectivas para reducir IR, sobre todo en pacientes con IR grave | Dieta LGI se asocia con mejores perfiles cardiometabólicos y reproductivos. Sin embargo, la dieta LGL requiere mayor investigación | La adherencia a dietas bajas en hidratos de carbono suponen una intervención eficaz para mejorar la fertilidad y la salud reproductiva. Dietas hipocalóricas generan mejoras en el hiperandrogenismo Son necesarios más estudios rigurosos y de mayor tamaño muestral para confirmar dichos efectos |
AMH: hormona antimülleriana; CCi: circunferencia de cintura; CCi/CCa: relación cintura-cadera; CT: colesterol total; DASH: Dietary Approaches to Stop Hypertension;; FAI: índice de andrógenos libres; FBS: glucosa en ayunas; FIB: insulina en ayunas; FSH: hormona foliculoestimulante; HC: hidratos de carbono; HDL: lipoproteínas de alta densidad; HOMA-IR: modelo homeostático para la resistencia a la insulina; IMC: índice de masa corporal; IR: resistencia insulínica; LDL: lipoproteínas de baja densidad; LGI: dieta con índice glucémico bajo; LGL: dieta de baja carga glucémica; LH: hormona luteinizante; NIH: clasificación NIH de 1990; SHBG: globulina fijadora de hormonas sexuales; SOP: síndrome del ovario poliquístico; TG: triglicéridos; TT: testosterona total.
Fuente: elaboración propia.
En todos los trabajos se realizaron estrategias a nivel dietético, pero hubo variaciones en cuanto al tipo de estudio, pues en algunos de ellos se efectuaron las propias intervenciones18-22,23-25, mientras que en otros se llevaron a cabo revisiones sistemáticas o metaanálisis de otros estudios21,26,27-28.
Dieta Dietary Approaches to Stop Hypertension. Estrategias dietéticas para detener la hipertensión arterialEn dos de los 11 artículos seleccionados para la revisión, se utilizó una dieta tipo Dietary Approaches to Stop Hypertension (DASH)18,19, la cual consiste en un régimen rico en frutas, verduras, cereales integrales, productos lácteos bajos en grasas y es reducido en grasas saturadas, colesterol, cereales refinados y dulces. Además, la ingesta de sodio sugerida era inferior a 2,4 g/día.
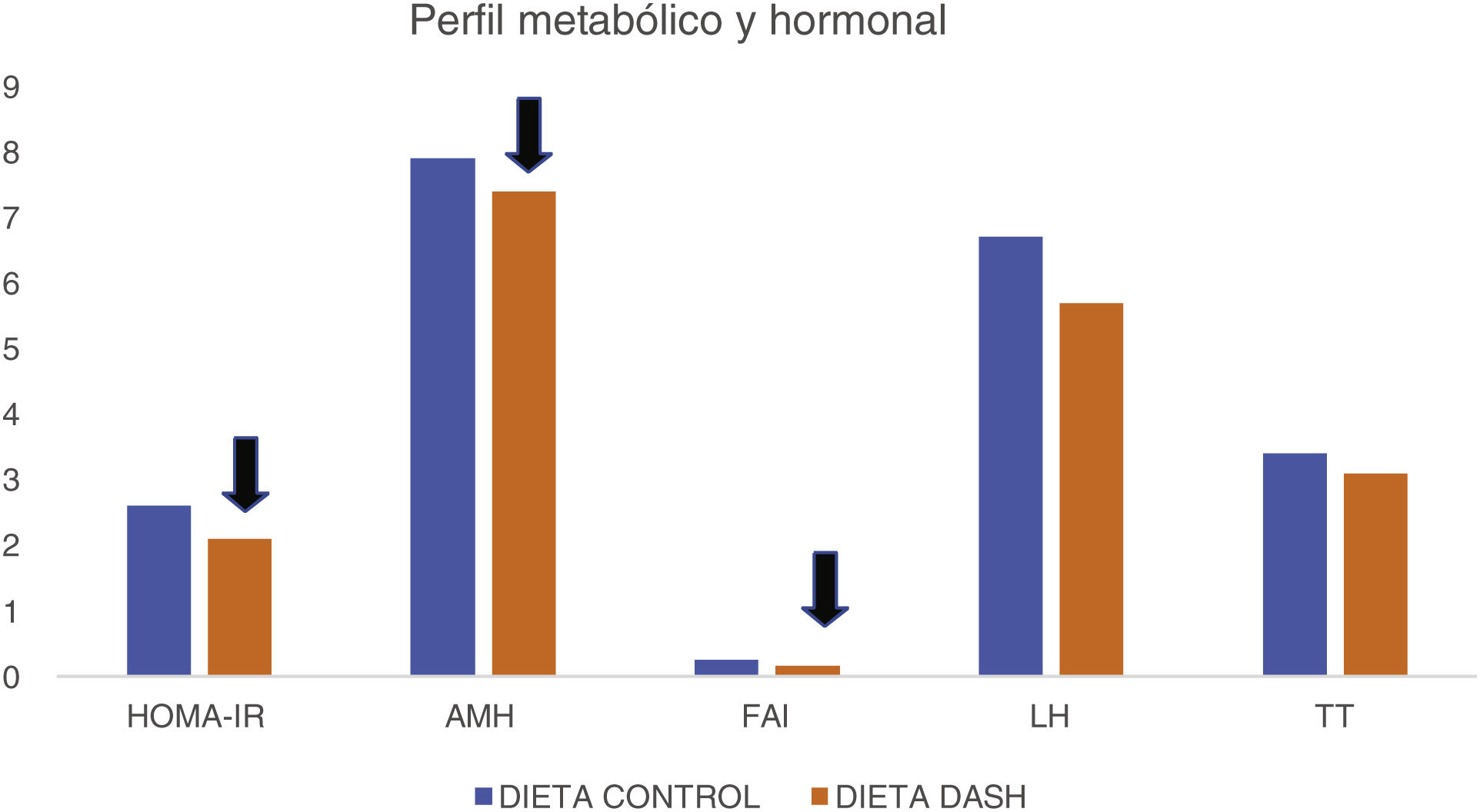
El estudio de Foroozanfard et al.18, que empleó la dieta DASH, es un ensayo clínico controlado aleatorizado paralelo con una duración de 12 semanas. De las 60 mujeres escogidas, finalizaron el estudio 53, con las siguientes características: SOP diagnosticado mediante los criterios de Rotterdam de 2003, un IMC superior a 25 kg/m2 y con edades comprendidas entre 18 y 40 años. Para dicho estudio las participantes fueron asignadas al azar para consumir la dieta DASH baja en calorías (n = 26) o la dieta control (n = 27). Tras la intervención realizada en este estudio, como se puede observar en la figura 1, la dieta DASH hipocalórica produjo una disminución significativa de los niveles de AMH sérica, insulina, HOMA-IR, índice de andrógenos libres (FAI) en comparación con la dieta control, al igual que un aumento significativo en el índice de sensibilidad a la insulina (QUICKI), y los niveles séricos de la globulina fijadora de hormonas sexuales (SHGB). Sin embargo, no se vislumbró efectos significativos de la dieta DASH en otros perfiles metabólicos.
Diferencias entre los perfiles metabólicos y hormonales al final de la intervención18.
AMH: hormona antimülleriana; FAI: índice de andrógenos libres; LH: hormona luteinizante.
En el estudio de Azadi-Yazdi et al.19, de similar diseño, también se utilizó la dieta DASH. De las 60 participantes reclutadas, 55 completaron el estudio con unas edades comprendidas entre 20 y 40 años, con un IMC de 25-40 kg/m2 y con SOP diagnosticado según los criterios de Rotterdam de 2003. Se observó que en cuanto al peso corporal e IMC no hubo grandes diferencias entre grupos tanto antes como después del tratamiento. Sin embargo, en el grupo que mantuvo una dieta DASH se produjo un descenso significativo de la MG, pero no hubo variaciones importantes en cuanto a la MM, CCi, circunferencia de cadera o CCi/CCa entre ambos. Además, en el grupo de la dieta DASH, se observó una mayor disminución de los niveles de androstenediona, y una reducción significativa en los de testosterona sérica e índice de andrógenos libres. En comparación con la dieta control, hubo un aumento de los niveles de SHBG y de la capacidad antioxidante.
Aumento de la ingesta de fibra y reducción grasas transEn el estudio de Nybacka et al.20, se valoró el aumento de la ingesta de fibra y la reducción de grasas trans como principales predictores de la mejora metabólica en pacientes con SOP. Un total de 57 mujeres con SOP, con una edad comprendida entre 18-40 años y que presentaban un IMC > 27 kg/m2 fueron asignadas aleatoriamente a dieta (D, n = 19), ejercicio (E, n = 19) o dieta más ejercicio (DE, n = 19) durante 16 semanas. El grupo D recibió asesoría nutricional por parte de un dietista para reducir su ingesta energética en al menos 600 kcal/día. El grupo E obtuvo un régimen de ejercicio ambulatorio por parte de un fisioterapeuta. El grupo DE tuvo ambas intervenciones.
La evaluación de la ingesta de alimentos se realizó mediante registros de 24 horas durante cuatro días inmediatamente antes y al final de la intervención (tres días laborales y uno de fin de semana). Adicionalmente, se les instauró un horario estricto de tres comidas principales y dos o tres tomas entre horas. Se programaron controles mensuales con dietista – nutricionista y fisioterapeuta para el cumplimiento y discusión de las metas alcanzadas, así como para la fijación de nuevos objetivos, tanto de logro como de aprendizaje para el siguiente mes.
El IMC, la CCi y el CT se redujeron significativamente en los grupos D y DE, así como las LDL y el índice del modelo de evaluación de la homeostasis en el D. En el grupo E, se apreció una disminución en el IMC y la CCi. El predictor más fuerte de un IMC reducido fue el aumento de la ingesta de fibra (-0,44, p = 0,03), mientras que un descenso en el consumo de ácidos grasos trans predijo un índice insulinogénico menor (0,44, p < 0,01).
Estos análisis mostraron que una dieta saludable con un elevado consumo de fibra y una reducción en los niveles de ácidos grasos trans se correlacionan con un menor IMC. De modo que, ese aumento de ingesta de fibra resulta ser un predictor más fuerte en cuanto al descenso del IMC, mientras que la disminución de ácidos grasos trans produce una mejora del índice insulinogénico y de la función ovulatoria.
Cabe destacar que un porcentaje elevado de pacientes no finalizó la dieta (casi 50% de los casos) y abandonaron el tratamiento, por tanto, probablemente sea una dieta efectiva a corto plazo, pero no a largo.
Dietas de baja carga glucémicaEn tres de los 11 estudios seleccionados para la revisión, se utilizaron dietas de baja carga glucémica para determinar su efecto en las mujeres con SOP tanto a nivel cardiometabólico22, como en los cambios producidos en la ghrelina y el glucagón22 y, por último, en la mejora de la sensibilidad a la insulina26.
El estudio de Kazemi et al.21 es una revisión sistemática y metaanálisis de ensayos controlados aleatorios, en el que se usaron bases de datos como PubMed, Medline, Cochrane Database, Instituto internacional de estadística (ISI), WOS y Scopus. Se recogen estudios publicados entre 2009 y 2020 (no se encontraron investigaciones adicionales que cumplieran los criterios de inclusión a partir del 25 de marzo de 2020) y realizados en EE. UU., Canadá, Reino Unido, Irán, Italia y México. La diferencia consistía en dietas con índice glucémico/carga glucémica (IG/CG) más bajo y más alto. Como resultado de dicho estudio, se observó que las dietas LGI en comparación con las HGI mejoraban el estado glucorreductor evaluado por la disminución de HOMA-IR y FIB. La mejora en el perfil lipídico fue demostrada por una reducción de CT, colesterol LDL y TG; la adiposidad abdominal evidenciada por el descenso de la CCi; y el hiperandrogenismo valorado por la reducción de la TT. Sin embargo, no tuvieron efectos significativos sobre la glucosa en ayunas, el colesterol HDL, el peso corporal o el índice de andrógenos libres.
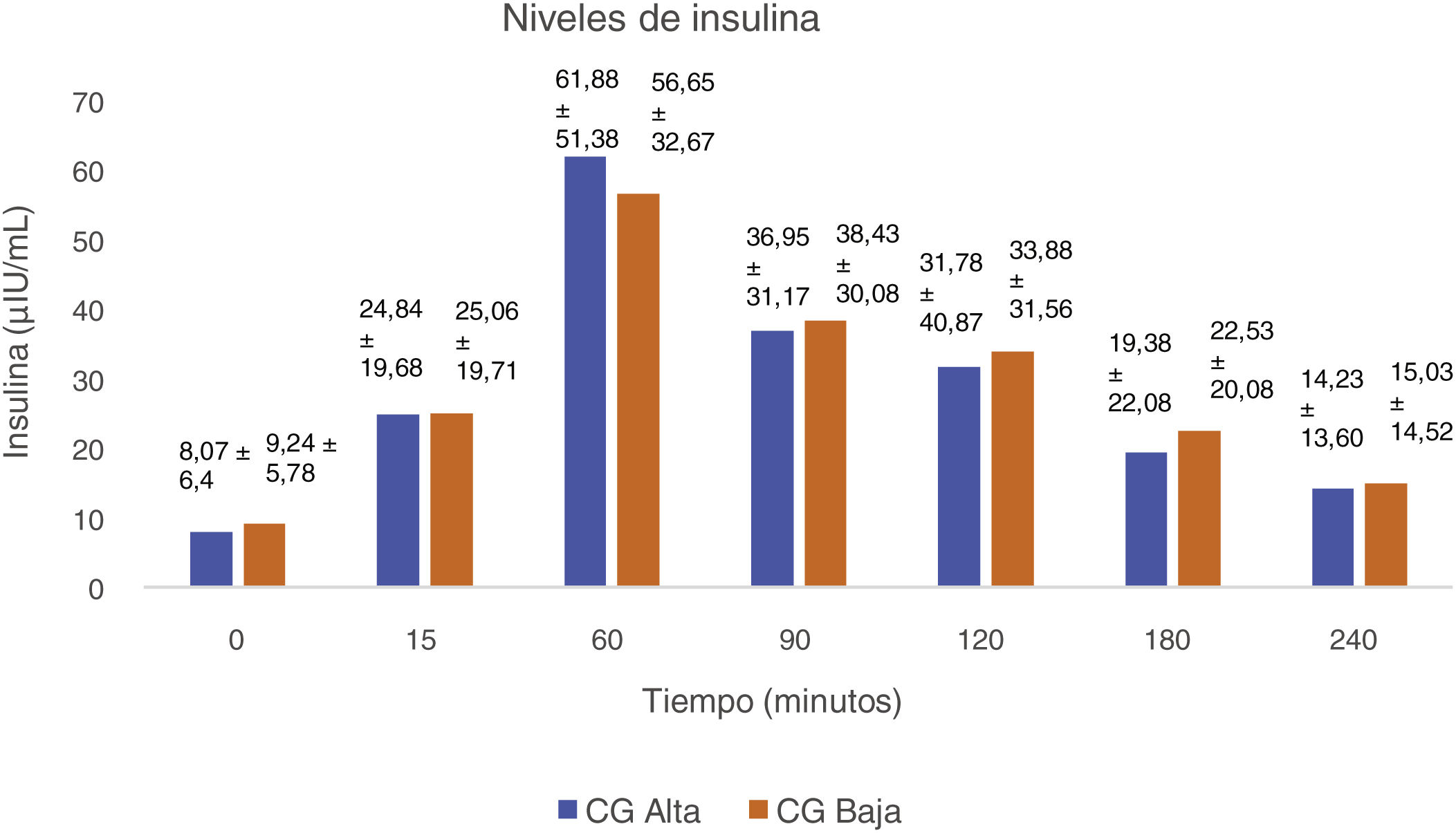
En el estudio de Hoover et al.22, se valoraron los cambios en la ghrelina y el glucagón tras una dieta de baja carga glucémica. Como resultado, se puso de manifiesto que una dieta de estas características reducía los niveles de ghrelina posprandial, la cual se asocia con una disminución de la grasa, una mejor sensibilidad a la insulina como se puede apreciar en la figura 2 y una reducción de la TT. Después de cuatro semanas, la concentración de glucagón en ayunas fue mayor en pacientes que habían seguido una dieta de baja carga glucémica vs. la de alta (p = 0,035). La presencia de valores elevados de glucagón en ayunas se vinculó con una menor sensación de hambre (p = 0,009).
Diferencias de valores de insulina al final de la intervención22.
En otro metaanálisis realizado por Porchia et al.26, se usaron diferentes bases de datos, tales como PubMed, Scopus, Lilacs, Ebsco, en busca de publicaciones hasta el 23 de octubre de 2018, sin ningún tipo de restricción de idioma, en los que los criterios de inclusión eran los siguientes: estudios prospectivos, en los que se indicara el tipo de dieta o aporte de macronutrientes, SOP confirmado y que contuviesen información sobre resistencia insulínica (IR) usando HOMA-IR. En dicho estudio se demostró que las dietas con un porcentaje más bajo de HC eran más efectivas para reducir la IR; que una intervención dietética mejoró de manera significativa la IR en pacientes con IR grave; y que las dietas hipocalóricas pueden contrarrestar la IR en SOP.
Inclusión de diferentes alimentos en el patrón dietético habitualJugo de granadaEn el estudio de Esmaeilinezhad et al.23, se evaluó la influencia del consumo del jugo de granada simbiótico (SPJ) sobre la glucemia, el perfil hormonal sexual y los índices antropométricos, tratándose de un ensayo controlado aleatorizado paralelo, triple ciego ajustado a la declaración de Helsinki y a las Buenas Prácticas Clínicas con una duración de ocho semanas. Las participantes presentaban SOP diagnosticado por criterios de Rotterdam, con edades comprendidas entre los 15 y 48 años. De 135 examinadas solo 92 firmaron el consentimiento informado. Dichas pacientes fueron asignadas de forma aleatoria en proporción 1:1:1:1 a cuatro grupos. Al primero se le administró 2 L de SPJ que contenía inulina y lactobacillus (un litro poseía 20 g de inulina y 2 x 108 UFC/g lactobacillus) por semana; el segundo grupo consumió jugo de granada (PJ) 2 L/semana; el grupo 3: bebida simbiótica (SB) 2 L/semana (un litro contenía 20 g de inulina, 2 x 108 UFC/g lactobacillus y aroma de granada); y el grupo 4, control, recibió placebo, 2 L/semana (un litro de agua y aroma de granada).
Entre los resultados del estudio se observó que en los grupos con SPJ y SB se produjo una disminución significativa de HOMA-IR, IMC, peso y CCi en comparación con los valores iniciales. También se percibió que en dichos grupos se suscitaron cambios significativos de los niveles de glucosa en ayunas (FBS) y en el aumento de la sensibilidad a la insulina en contraste con el grupo control, así como una reducción significativa en la TT en los grupos SPJ y SB en comparación con la línea base.
Aceites vegetalesEn otros estudios como el de Yahay et al.24, se evaluaron los efectos de consumo de aceite de canola y de oliva en comparación con el aceite de girasol sobre el perfil lipídico y la esteatosis hepática en mujeres con SOP.
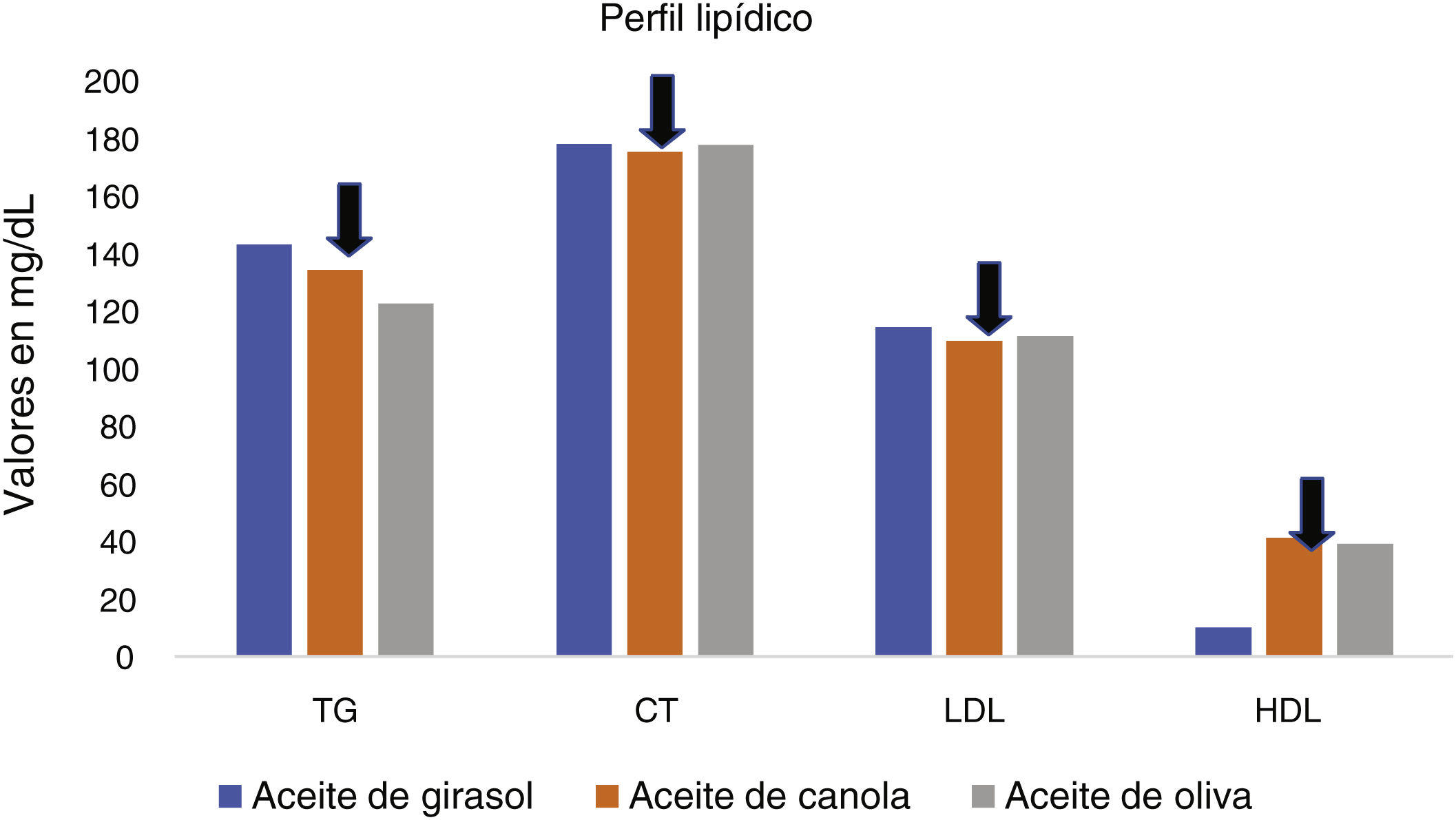
Tras la intervención, se pudo observar que el aceite de canola generó efectos beneficiosos sobre algunos parámetros del perfil lipídico (TG, CT/HDL, LDL/HDL y TG/HDL) (fig. 3) en comparación con el aceite de oliva y girasol, por su buena fuente de ácidos grasos monoinsaturados (MUFA)/ácido alfa-linolénico (ALA). Sin embargo, el aceite de oliva provocó mejoras significativas en cuanto a la gravedad del hígado graso. Asimismo, el de canola y oliva supusieron una marcada reducción de HOMA-IR en comparación con el de girasol, pero ninguno de los tres tipos de aceites provocó ningún cambio significativo en los niveles de SHBG.
Diferencias en el perfil lipídico tras la inclusión de diferentes tipos de aceites24.
En uno de los 11 estudios25 propuestos para la revisión se evaluó la influencia de la ingesta de soja sobre la pérdida de peso, el control glucémico, los perfiles de lípidos y los biomarcadores de inflamación y estrés oxidativo en mujeres que presentan SOP. Se trata de un ensayo clínico controlado aleatorizado paralelo en el que se reclutaron a 60 mujeres de entre 18 y 40 años con SOP diagnosticado mediante los criterios de Rotterdam de 2003. Todas completaron el estudio.
Tras la intervención, el grupo de prueba disminuyó de manera significativa el peso corporal y el IMC en comparación con el grupo de control. Asimismo, la dieta de prueba bajó la tasa de alopecia, aunque no hubo cambios respecto al acné. Además, en dicha dieta de prueba hubo una reducción importante en cuanto a los niveles de insulina sérica, HOMA-IR, en los valores hormonales de TT, TG y lipoproteínas de muy baja densidad (VLDL), mientras que hubo un aumento significativo de QUICKI.
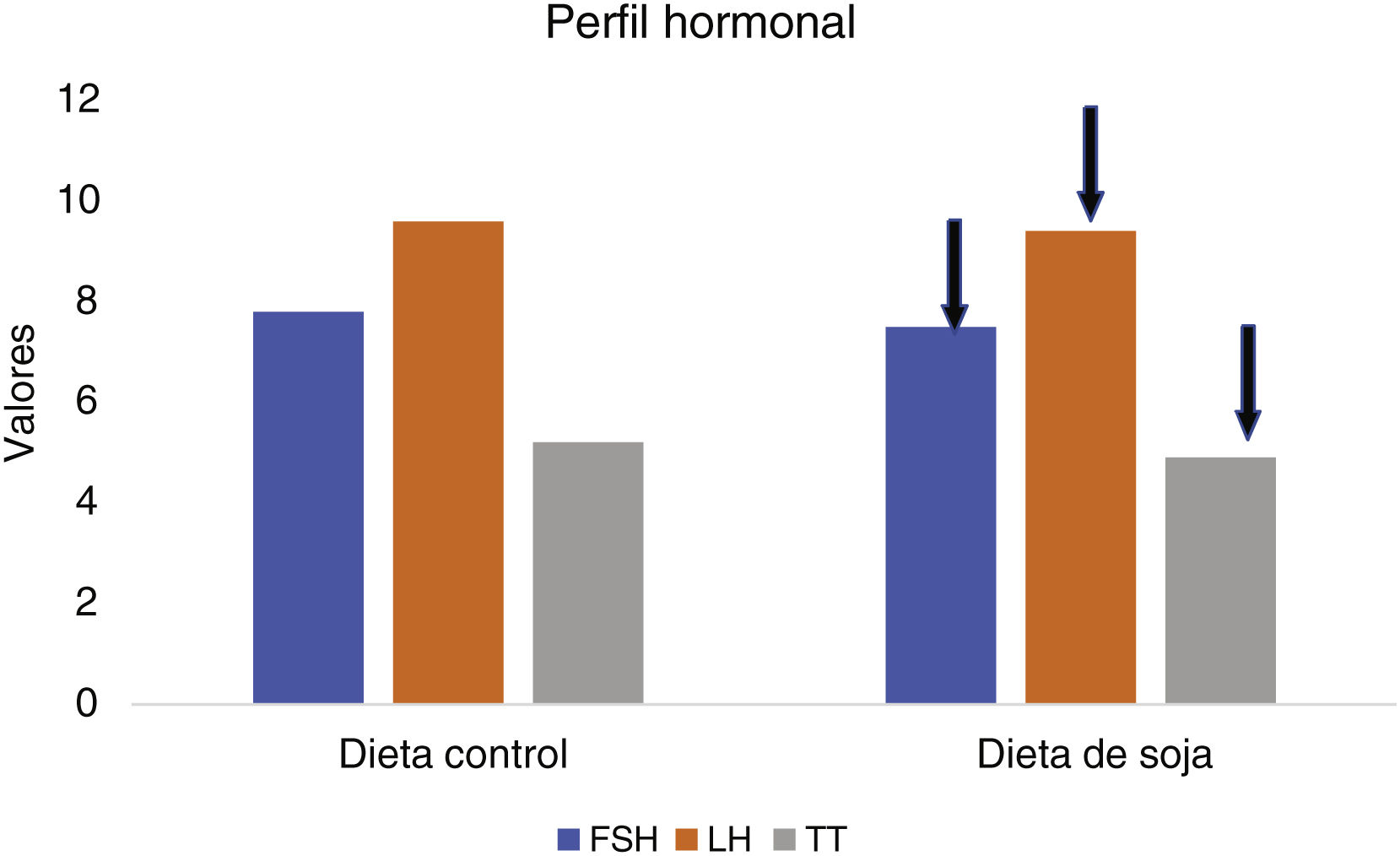
No se observó ningún efecto significativo de la dieta de prueba en LH, hormona foliculoestimulante (FSH) (fig. 4), así como en otros perfiles lipídicos y biomarcadores de inflamación y estrés oxidativo. Respecto a los valores de LH y FSH, no se describe la existencia de un mayor número de ciclos ováricos regulares, y por limitaciones de financiación, no se determinaron otros perfiles hormonales, como testosterona libre, prolactina y 17-OH progesterona.
Diferencias en el perfil hormonal25.
LH: hormona luteinizante.
Se trata de una revisión sistemática y metaanálisis27 de las diferentes modificaciones dietéticas para la salud reproductiva en mujeres con SOP.
En los últimos años, los investigadores han valorado mucho los efectos de las dietas con un LGI en la pérdida de peso y en los cambios metabólicos que resultan de la obesidad. En mujeres con sobrepeso y obesidad, una dieta de LGI combinada con una hipocalórica parece ser más beneficiosa; los regímenes hipocalóricos con LGI redujeron el IMC, el porcentaje de grasa corporal y las concentraciones de leptina, mejoraron el desarrollo de ovocitos y las tasas de fertilidad, así como los ciclos de ovulación en pacientes con SOP y anovulación.
Modificaciones en el estilo de vida (cambios dietéticos + ejercicio físico)Uno de los 11 estudios propuestos28, es una revisión sistemática y metaanálisis en el que se usaron PubMed, WOS, Scopus y Cochrane Library como bases de datos. Se recogieron estudios publicados hasta diciembre de 2019 centrados en investigar LSM en niñas adolescentes con SOP que informasen sobre hirsutismo, ciclos menstruales y andrógenos, parámetros metabólicos como FBS, FIB, HOMA-IR, TG, CT, colesterol LDL, colesterol HDL, parámetros antropométricos y presión arterial.
Los datos obtenidos en cuanto a los efectos de la terapia dietética sola, en parámetros clínicos y bioquímicos del SOP fue limitada, pero el tratamiento dietético general (régimen hipocalórico con intervención en disminución de grasas o reducción de la carga glucémica) se asoció con una diferencia significativa en el IMC y puntuación de la escala de Ferriman-Gallwey, aunque no tuvo efectos significativos sobre los ciclos menstruales, parámetros hormonales y metabólicos. Sin embargo, los datos observados en estudios con una LSM mejoraron trastornos del ciclo menstrual, la resistencia a la insulina y el hiperandrogenismo mediante una reducción de la ingesta de energética y el control de peso.
La LSM mediante la restricción de calorías y la práctica de actividad física de forma regular puede mejorar los niveles clínicos, metabólicos y hormonales en las adolescentes con SOP29,30.
ConclusionesLa dieta DASH con una reducción en la ingesta de calorías y con una alimentación rica en frutas, verduras, vegetales, cereales integrales y productos lácteos bajos en grasa, y las LSM, resultan ser las más favorables en los marcadores de composición corporal, sobre todo en parámetros como el peso corporal y el IMC.
Las dietas que comportan pérdida ponderal entre 5-10%, con un aporte adecuado de nutrientes, mejoran la secreción de gonadotropina, el hiperandrogenismo clínico y bioquímico y la sensibilidad a la insulina.
Los marcadores metabólicos de resistencia a la insulina mejoran con la adherencia a dietas con LGI.
El SPJ y la soja también parecen mejorar la resistencia a la insulina, ciertos parámetros antropométricos (peso, IMC y perímetro de cintura) así como una reducción de los niveles de testosterona.
La ingesta de fibra resulta ser un predictor más fuerte en cuanto a la disminución del IMC, mientras que la reducción de ácidos grasos trans produce una mejora del índice insulinogénico y de la función ovulatoria.
Las dietas hipocalóricas con LGI redujeron el IMC, el porcentaje de grasa corporal y las concentraciones de leptina, mejoraron el desarrollo de ovocitos y las tasas de fertilidad, así como los ciclos de ovulación en pacientes con SOP y anovulación.
En vista del análisis realizado en profundidad de los distintos estudios propuestos para la revisión bibliográfica, se puede comprobar que tanto el efecto de las diferentes intervenciones dietéticas como de las LSM y el ejercicio, suponen un marcado impacto en el tratamiento de las manifestaciones del SOP.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.