Introducción
En la última década, distintos estudios epidemiológicos realizados en el Reino Unido, Suecia, Estados Unidos y Asia han encontrado una relación entre el peso bajo al nacer y un mayor riesgo de desarrollar enfermedades cardiovasculares en la edad adulta1,2. Este riesgo parece ser mayor en las personas con menor peso al nacimiento, pero que alcanzaron una mayor adiposidad, con sobrepeso u obesidad, al final de su infancia3,4.
En parte, esta asociación puede deberse a que los niños con bajo peso al nacer durante su desarrollo y cuando llegan a ser adultos presentan una mayor incidencia de resistencia insulínica5-8 y los trastornos relacionados con ésta: obesidad central9, hipertensión arterial10-14 o diabetes mellitus tipo 26,15.
Existen 2 hipótesis patogénicas, no necesariamente excluyentes, respecto al origen de todas estas asociaciones16. La primera es que cualquier causa de malnutrición fetal produciría un retraso en el crecimiento intrauterino, por lo que, para asegurar el adecuado desarrollo cerebral, se reduciría el de otros tejidos y órganos. En este proceso de adaptación metabólica desempeña un papel especial la insulina, la principal reguladora del desarrollo somático del feto. Así, se originaría un estado de resistencia insulínica, que se conoce como "fenotipo ahorrador", cuya persistencia en la vida posnatal podría favorecer la aparición de todos los trastornos citados17. La segunda hipótesis también reconoce un estado de insulinorresistencia, que se manifiesta ya durante la gestación, debido al efecto de determinados polimorfismos genéticos transmitidos por los padres18,19. Las consecuencias durante el desarrollo intra y extrauterino serían las mencionadas anteriormente; sin embargo, así se explicaría también la mayor frecuencia de las mismas alteraciones en los hermanos y los padres de niños con bajo peso al nacer5,20,21. Además de los estudios clínicos y epidemiológicos, estas hipótesis están soportadas por líneas de investigación experimental con modelos animales y, más recientemente, con estudios de biología y genética molecular22,23.
En este sentido, tiene gran interés el estudio de la posible influencia del desarrollo fetal en la composición de lipoproteínas en sangre del cordón de los recién nacidos. Diversos estudios han demostrado la variación de estas últimas en función de la raza, el sexo, la nutrición materna y ciertos factores obstétricos24-31. Sin embargo, cuando se ha investigado su correlación con parámetros de desarrollo fetal, los resultados han sido contradictorios32.
Por otra parte, es bien conocida la tendencia de los individuos a persistir en una misma posición de la distribución poblacional respecto a determinadas variables, entre las que se encuentran los valores de lipoproteínas33-38. Este fenómeno, también sometido a otros factores étnicos, genéticos, dietéticos y del estilo de vida del individuo39-44, en la bibliografía anglosajona se ha denominado tracking, y justifica la detección precoz de alteraciones lipídicas en la vida de los sujetos, ya que la intervención dietética o de otro tipo desde una edad temprana tendría claras implicaciones preventivas45,46.
El objetivo de este trabajo fue analizar el patrón lipoproteico en sangre de recién nacidos a término y evaluar su posible relación con los parámetros de desarrollo fetal y otras variables obstétricas, en función del sexo.
Pacientes y método
Diseño, selección de la muestra y variables recogidas
Durante un período de 3 meses se recogieron las variables obstétricas (edad materna, semanas de gestación, tipo de parto y test de Apgar en el primer y el quinto minuto tras el nacimiento) y antropométricas (circunferencia cefálica, talla, peso e índice ponderal [IP] de Rohrer: peso [kg]/talla3 [m])47 de 265 recién nacidos consecutivos, resultado de embarazos no gemelares a término (37-42 semanas) y cuyas madres otorgaron su consentimiento. Se calculó el IP, en lugar del índice de masa corporal de Quetelet, cuyo denominador es el cuadrado de la talla, por ser un mejor estimador del desarrollo y la adiposidad en recién nacidos47. Se consideró que presentaban un peso bajo los recién nacidos que tenían un IP inferior a 264. Además de las variables citadas, en el momento del parto se recogió una muestra de sangre de vena umbilical y se midieron en ella las concentraciones de colesterol total y lipoproteínas de alta densidad (HDL), triglicéridos, apolipoproteínas (apo) A-1 y B. El colesterol total y los triglicéridos se cuantificaron por métodos enzimáticos (Boehringer, Mannheim, Alemania). El colesterol unido a HDL (cHDL) se determinó, tras la precipitación de las lipoproteínas de muy baja densidad (VLDL) y de baja densidad (LDL) mediante ácido fosfotúngstico-Mg, por el mismo método que el total. El colesterol unido a LDL (cLDL) se calculó con la fórmula de Friedewald. Las apo A-1 y B se determinaron por inmunofelometría humana (Dade Behring GmbH, Marburg, Alemania).
El protocolo del estudio fue aprobado por el comité ético de investigación clínica.
Análisis estadístico
Debido al carácter exploratorio del estudio no se llevó a cabo una predeterminación formal del tamaño muestral. La estadística descriptiva de las variables cualitativas se expresa mediante su frecuencia relativa o porcentaje, en las variables cuantitativas continuas por su media ± desviación estándar (DE) y por la mediana y el rango intercuartílico en las ordinales. En todos los casos, se analizó su distribución respecto al sexo y, para los parámetros lipídicos, también respecto al IP categorizado. Las variables cualitativas se compararon con la prueba de la x2 o la exacta de Fisher, según procediera. Se comprobó el ajuste a la distribución normal de las variables cuantitativas mediante la prueba de Kolmogorov-Smirnov. Según su resultado, se compararon con las pruebas de la t de Student o la U de Mann-Whitney. Para su correlación, se calcularon los coeficientes r de Pearson o rho de Spearman. Todos los contrastes fueron bilaterales y se consideraron significativos valores de p < 0,05.
Resultados
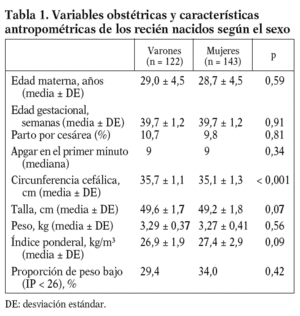
Los partos fueron vaginales en 238 casos y hubo 27 cesáreas. El 54% de los recién nacidos fueron niñas y el 31,9% presentó un IP bajo, es decir inferior a 26 (fig. 1). Los parámetros antropométricos de talla, peso y circunferencia cefálica estuvieron muy correlacionados entre sí y de forma positiva con las semanas de gestación (datos no mostrados). Salvo en la circunferencia cefálica, no hubo diferencias relevantes entre ambos sexos (tabla 1).
Figura 1. Histograma del índice ponderal (kg/m3) de los recién nacidos.
Sin embargo, en cuanto a los parámetros lipídicos, las niñas presentaron concentraciones de colesterol total, cHDL, cLDL, apo A-1 y apo B significativamente más altas que los niños. Las concentraciones de triglicéridos fueron similares (tabla 2).
El perfil lipídico de los niños con bajo índice ponderal respecto a los normales sólo se diferenció en una menor concentración de apo B (tabla 3).
Se observaron correlaciones elevadas y significativas entre las distintas fracciones lipídicas y con las apoproteínas (tabla 4; fig. 2), de acuerdo con lo que se podía esperar por la composición de las distintas lipoproteínas.
Figura 2. Diagramas de dispersión que correlacionan los parámetros lipoproteicos de los recién nacidos (véase también la tabla 4). Los diagramas son simétricos respecto a la diagonal con los nombres de los parámetros.
Al analizar la relación entre las variables antropométricas y lipídicas se observaron también diferencias en ambos sexos (tablas 5 y 6). Hubo una correlación positiva entre los triglicéridos y la edad gestacional, más intensa y significativa en las niñas. Además, sólo en ellas se observaron también ligeras correlaciones positivas entre el peso y el cHDL, así como entre el índice ponderal y el colesterol total y el cHDL y la apo B, y negativa entre la circunferencia cefálica y el cLDL. No hubo relación entre el perfil lipídico y el tipo de parto, vaginal o por cesárea.
Discusión
En este estudio se describe el perfil lipoproteico de una muestra representativa de la población española de recién nacidos a término. El cálculo de su índice ponderal muestra una distribución de sus valores más alta que en otros estudios epidemiológicos4. El valor de 26 kg/m3 con frecuencia se ha escogido en estos pacientes como un punto de corte para evaluar el riesgo de enfermedad cardiovascular, por representar la mediana en los primeros de estos estudios48. En nuestro caso, tanto la media como la mediana se situaron en torno a 27. De hecho, sólo un 3% de los recién nacidos pesaron menos de 2.500 g, el criterio habitual de bajo peso, según la definición de la Organización Mundial de Salud. Mientras que el peso en los niños varones fue similar al de las niñas, su talla y su circunferencia cefálica fueron algo mayores, con el consiguiente descenso de su índice ponderal. En todo caso, se observaron las lógicas correlaciones entre los diferentes parámetros antropométricos (talla, circunferencia cefálica y peso), así como entre éstos y las semanas de gestación en sentido positivo, a pesar de haber limitado el estudio a los niños a término; es decir, excluyendo a los prematuros y posmaduros.
Los valores lipídicos en la sangre de cordón fueron, en todos los casos, sensiblemente inferiores a los que se observan después, durante la infancia y en la edad adulta. Sin embargo, había diferencias importantes en las proporciones de los distintos componentes, que también se han demostrado en otros estudios31. Así, mientras que los valores de colesterol total, LDL, triglicéridos y apo B fueron aproximadamente la cuarta parte de los habituales durante la infancia, las concentraciones de cHDL y apo A-1 fueron cercanas a la mitad. Las distintas fracciones estuvieron también muy correlacionadas, según era previsible por su metabolismo. A diferencia de alguna publicación aislada30, estos valores no estuvieron influidos por el tipo de parto.
En contra de la hipótesis inicial del trabajo, destacó la falta de relación entre las concentraciones lipídicas y los parámetros antropométricos o el índice ponderal calculado. Precisamente, éste es un punto de discusión en la bibliografía por la disparidad entre los resultados de los estudios que lo han analizado24,25,28,32,49-51. En nuestro caso, por tanto, no observamos una influencia clara de los indicadores de desarrollo fetal en el perfil lipídico del recién nacido.
Este hecho no prejuzga la posibilidad de que, posteriormente, durante la infancia y con los cambios lipídicos que se producen en la vida postnatal, sí puedan surgir efectos dependientes o relacionados con el peso bajo al nacer52-58. Estos efectos, como ya se ha afirmado, podrían depender de una mayor resistencia insulínica, de origen genético18 o adquirida durante la etapa fetal59,60, con la interacción de factores nutricionales y del estilo de vida. La observación descrita de un retraso en el inicio del tracking, en cuanto a los parámetros lipídicos, hasta después del año61, podría estar también relacionada con cierta latencia para la manifestación de una dislipemia asociada al bajo peso al nacer. Por otro lado, cuando se ha investigado la influencia del peso al nacer con las concentraciones posteriores de colesterol plasmático, se ha encontrado una relación inversa más clara en los varones que en las mujeres62.
Sin embargo, en nuestro estudio fueron muy relevantes y significativas las diferencias que mostraron los recién nacidos, en función de su sexo, respecto a sus concentraciones lipídicas, con la excepción de los triglicéridos. En todos los casos, fueron más altas entre las niñas. Este hallazgo, puesto también de manifiesto y en el mismo sentido por otras investigaciones29,31,63, puede depender de un fenómeno más intenso de esteroidogénesis hormonal en el feto varón64 y un consumo, por consiguiente, más elevado del colesterol circulante65,66.
Conclusiones
Las diferencias en el perfil lipídico de los recién nacidos dependen más de su sexo que de factores relacionados con el desarrollo fetal. La posible dislipemia asociada al peso bajo al nacer sería, en todo caso, un factor aterogénico de aparición posterior. Su detección durante la infancia tendría implicaciones preventivas, debido a su persistencia en la vida adulta. La confirmación de esta asociación requiere, sin embargo, una valoración simultánea de los posibles condicionantes genéticos, del estilo de vida y nutricionales.