Introducción
La hiperlipemia es un factor de riesgo cardiovascular causado por factores ambientales, genéticos y/o farmacológicos. Los retinoides, los antivirales inhibidores de la proteasa y los bloqueadores beta, entre otros, alteran los valores lipídicos plasmáticos y provocan dislipemia. Los retinoides se utilizan como tratamiento del acné, de la psoriasis y de determinados procesos cancerígenos, y concretamente la isotretinoína (ácido 13-cis-retinoico; 13-cis AR), una de las formas activas de la vitamina A, se ha asociado a alteraciones transitorias en el metabolismo lipídico1 y, en algunos casos, en el metabolismo glucídico2. Aproximadamente el 20% de los pacientes tratados presenta incrementos significativos en los valores plasmáticos de lipoproteínas ricas en triglicéridos (lipoproteínas de muy baja densidad [VLDL]), de colesterol total y de la ratio aterogénica colesterol unido a lipoproteínas de baja densidad (cLDL)/ colesterol unido a lipoproteínas de alta densidad (cHDL). De hecho, existe un estudio que plantea como hipótesis que la isotretinoína pondría de manifiesto una predisposición genética al síndrome metabólico3, y ello está de acuerdo con estudios de nuestro grupo que sugieren una relación entre la vitamina A y alteraciones relacionadas con el síndrome metabólico, como la hiperlipemia familiar combinada4-6.
El incremento en los valores lipídicos puede ser el resultado tanto de un aumento en la síntesis hepática de lipoproteínas7, como de una disminución del catabolismo de las lipoproteínas circulantes8-10. El mecanismo molecular por el cual el 13-cis AR ejerce este efecto es desconocido, aunque podría ser a través de la regulación transcripcional de genes diana implicados en el metabolismo lipídico y glucídico mediada por los receptores de AR (RAR*, ß y *) y los receptores X retinoides (RXR*, ß y *)11 y que es dependiente de ligando.
En pacientes tratados con isotretinoína las concentraciones plasmáticas de 13-cis AR en plasma pueden aumentar considerablemente. Dada la toxici dad del fármaco, es posible que, además de provocar alteraciones en el metabolismo lipídico, provoque alteraciones en procesos endoteliales como la adhesión celular, la permeabilidad y/o la inflamación asociados al inicio y a la progresión de la lesión aterosclerótica. No existen estudios ni in vivo ni in vitro en los que se haya valorado el efecto de la isotretinoína sobre el endotelio, por lo que nosotros proponemos establecer in vitro, en cultivo de células HUVEC, qué genes presentan alterados sus valores de expresión tras una exposición a 13-cis AR y, por lo tanto, dilucidar cuál podría ser la afectación endotelial y qué procesos podrían estar involucrados en ésta.
Material y método
Cultivo celular
Las células endoteliales se obtuvieron a partir de vena de cordones umbilicales (HUVEC) procedentes del servicio de obstetricia del Hospital de Sant Pau. El cultivo primario se obtuvo mediante digestión con colagenasa12. Cultivos primarios de HUVEC se mantuvieron a 37 °C y 5% de CO2 en Medio 199 que contenía 20% de suero bovino fetal (SBF), 2 mmol/l de glutamina, 1 mmol/l de piruvato sódico, 20 mmol/L de HEPES, 30 g/l de suplemento de crecimiento endotelial, 10.000 unidades/l de heparina, 100.000 U/l de penicilina y 100 mg/l de estreptomicina hasta alcanzar la confluencia. Los experimentos se realizaron con células en fase 1. Las células se tripsinizaron (tripsina/ácido etilendiaminotetraacético [EDTA], 0,25/ 0,025%) y se sembraron en placas de 6 pozos donde se mantuvieron en Medio 199 que contenía el 20% de SBF sin ECGS ni heparina durante 48 h. Transcurrido este período, las células se incubaron en ausencia (control) o presencia de 13-cis AR (Sigma Aldrich) 1 µM (dimetilsulfóxido [DMSO]) en Medio 199 que contenía el 1% de SBF durante 6 o 24 h. Se realizaron 2 experimentos en días diferentes. La concentración de 13-cis AR seleccionada es la que permite observar una máxima respuesta, sin ser tóxica para el cultivo celular, para intentar así reproducir el efecto farmacológico. Y los tiempos seleccionados, de 6 y 24 h, permiten detectar genes de expresión temprana y genes de expresión tardía.
Aislamiento de ARN total
El ARN total de cada muestra se extrajo con Trizol (Invitrogen) y se purificó con RNeasy Mini kit y RNase-free DNase Set (QIAGEN) según los protocolos de los fabricantes. Una vez extraído el ARN total se determinó su calidad mediante gel de agarosa al 1%, y se preparó un pool de cada una de las 3 condiciones con los 2 experimentos celulares independientes.
Microarray
El análisis de expresión génica se realizó en el Human Genome U133A Array utilizando la tecnología GeneChip de Affymetrix. El software utilizado para el procesamiento de los arrays y de los resultados fue el Microarray suite versión 5.0 (Affymetrix).
Se analizaron los datos de los pools de HUVEC cultivados con 13-cis AR a 6 y 24 h utilizando como control los datos del pool control. Se consideró que una sonda presentaba expresión diferencial con respecto al control cuando estaba >= 2 veces sobreexpresada o reprimida.
Mediante el programa PANTHER13 (http://www.pantherdb.org) de Applied Biosystems se realizó la anotación funcional y el análisis estadístico de las categorías funcionales sobrerrepresentadas a las 6 y las 24 h con respecto a la base de datos del NCBI (Homo sapiens).
RT-PCR
El ADN complementario (ADNc) se sintetizó a partir de 1 µg de ARN total utilizando random hexamers y la transcriptasa reversa (RT) SuperScript II (Invitrogen). Una alícuota de 5 µl de la reacción de RT se utilizó para la reacción de amplificación de PCR con el kit Assays-on-demand (Applied Biosystems) correspondiente a cada gen. Las reacciones se llevaron a cabo en un ABI PRISM 5700 Sequence Detector (Applied Biosystems). La cuantificación de los resultados se realizó mediante el método threshold (Ct), para el que se utilizó gliceraldehído-3-fosfato deshidrogenasa (GAPDH) como control interno de normalización.
Resultados
Análisis por microarray
A las 6 h de incubación de las células HUVEC con 13-cis AR, 95 sondas presentaron una expresión diferencial de 2 veces sobreexpresadas o reprimidas con respecto al control, de las cuales 81 correspondían a genes descritos; mientras que a las 24 h fueron 279 las sondas con una expresión diferencial, siendo 249 las correspondientes a genes descritos. Estos genes sobreexpresados y reprimidos a las 6 y las 24 h se clasificaron en procesos biológicos. Los procesos biológicos significativamente sobrerrepresentados (p < 0,01) se muestran en la tabla 1. El número de procesos afectados por el estímulo es mayor en el tiempo 24 h, y de éstos los que tienen una posible trascendencia en el proceso aterosclerótico son la adhesión celular, el metabolismo lipídico y la immunidad mediada por el interferón.
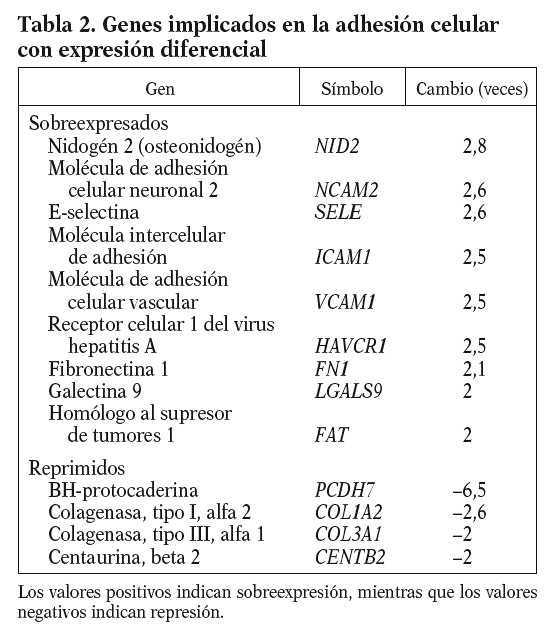
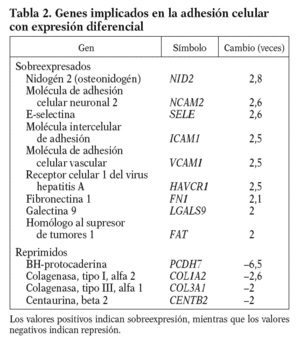
De entre los genes con expresión diferencial del proceso de adhesión celular, cabe resaltar por su papel en el proceso inflamatorio la molécula intercelular de adhesión (ICAM1), la molécula de adhesión celular vascular (VCAM1) y la E-selectina (E-SELE), que promueven el reclutamiento leucocitario y su migración a través de la pared vascular endotelial, y la fibronectina 1 (FN1), que es un componente de la matriz subendotelial (tabla 2).
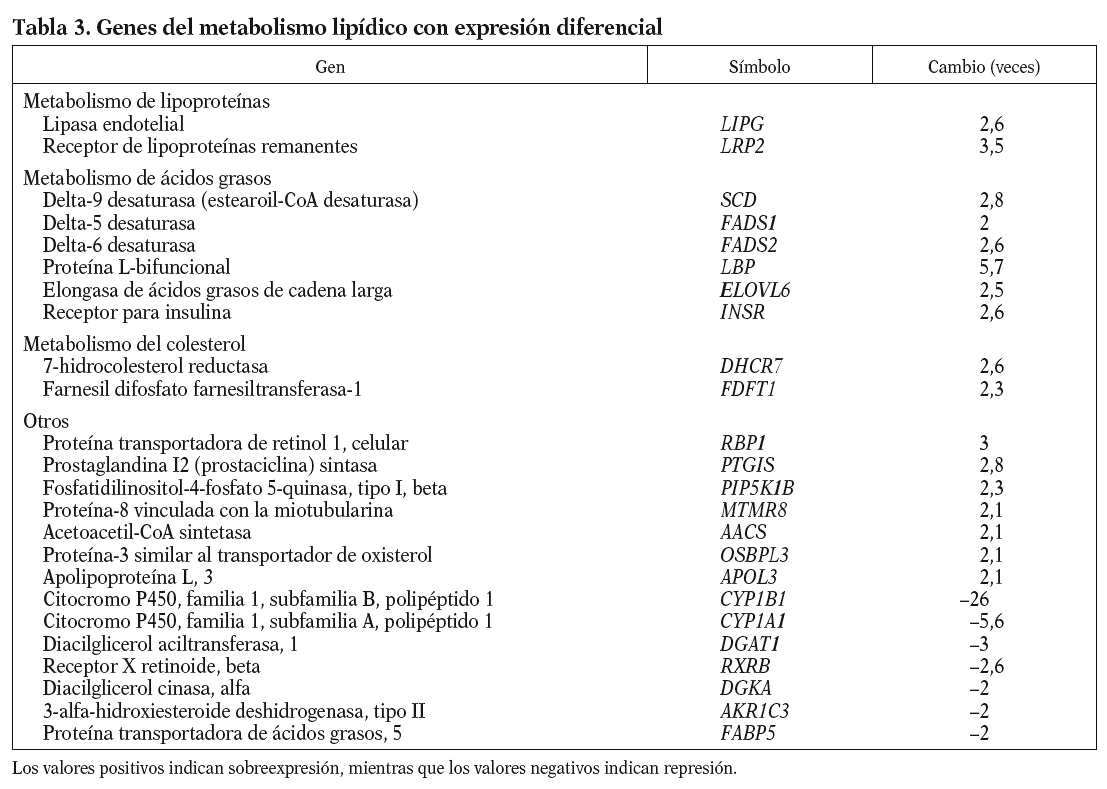
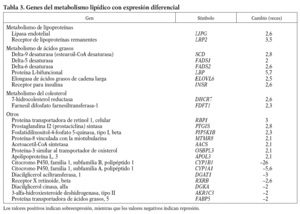
Los genes relacionados con el metabolismo lipídico que presentan cambios en la expresión génica en respuesta al 13-cis AR se muestran en la tabla 3. Se observa un aumento de la expresión de genes que intervienen en la hidrólisis y en el aclaramiento de lipoproteínas ricas en triglicéridos, como el receptor de lipoproteínas remanentes (LRP2), y de las lipoproteínas de alta densidad (HDL) como es la lipasa endotelial (LIPG). Genes implicados en el proceso de modificación de ácidos grasos también se encuentran incrementados. Éstos son la desaturasa de ácidos grasos delta-9 (SCD), que es la enzima limitante en la síntesis de ácidos grasos monoinsaturados, y las desaturasas delta-5 y delta-6 (FADS1 y 2), la proteína L-bifuncional peroxisomal (LBP) y la elongasa de ácidos grasos de cadena larga (ELOVL6), que metabolizan los ácidos grasos esenciales de la dieta a ácidos grasos poliinsaturados de cadena larga; así como el receptor de la insulina (INSR) que interviene en la internalización de ácidos grasos. Y por otro lado aumentan su expresión 2 enzimas que intervienen en la síntesis endógena de colesterol: la farnesil difosfato farnesiltansferasa-1 (FDFT1), que cataliza el primer paso de la síntesis, y la 7-hidrocolesterol reductasa (DHCR7), que cataliza el último paso.
Y finalmente aparece significativamente alterado el proceso biológico de inmunidad mediada por el interferón al que pertenecen el factor regulador de interferón (IRF1), la proteína inducida por interferón (IFIT1) y las oligoadenilatos sintasas (OAS1, OAS2, OAS3 y OASL).
Análisis de la vía de señalización del ácido retinoico por RT-PCR
Para complementar el resultado de expresión obtenido por microarray de algunos de los genes de la vía de señalización del ácido retinoico que pueden estar implicados en el efecto observado por el tratamiento con 13-cis AR, se analizó mediante RT-PCR a tiempo real la expresión de CRABP1 y 2, PPAR*, RXR* y RXR*. Las proteínas transportadoras intracelulares de AR, CRABP1 y 2 controlan la disponibilidad de AR y participan en el complejo de transcripción que se forma en el núcleo. En nuestro experimento sus expresiones se encuentran ligeramente alteradas a los 2 tiempos. Por otro lado, los factores de transcripción que participan en la regulación génica, PPAR*, RXR* y RXR*, aumentan su expresión de forma destacable. PPAR* aumenta de 1,2 veces a las 6 h a 3,2 veces a las 24 h, mientras que RXR* y RXR* aumentan su expresión en 3,5 y 2,2 veces, respectivamente, a las 6 h, aunque este aumento no se mantiene a las 24 h. Contrariamente, RXRß disminuye su expresión en 2,6 veces a las 24 h (resultado obtenido por microarray).
Discusión
Hemos estudiado los efectos biológicos inducidos por el 13-cis AR sobre el endotelio mediante análisis de expresión génica, con el objetivo de evaluar su potencial aterogénico.
Los resultados indican que en contacto con concentraciones farmacológicas de 13-cis AR se producen cambios en el endotelio que pueden suponer un aumento de la adhesividad celular, un aumento del aclaramiento de remanentes de lipoproteínas y una modificación del metabolismo de la HDL.
Adhesión celular
El endotelio, tras un estímulo físico o químico, expresa en su superficie moléculas de adhesión (ICAM, VCAM y E-SELE) que incrementan su capacidad de reclutar e internalizar leucocitos, iniciando así un proceso inflamatorio. Estas moléculas de adhesión se localizan en placas ateroscleróticas humanas14-16, y sus valores en estado soluble se consideran predictores de riesgo cardiovascular17. En nuestras condiciones experimentales el 13-cis AR aumenta en más de 2 veces los valores de ARNm de la ICAM-1, la VCAM-1, la E-SELE y la FN1, lo que sugiere un papel proinflamatorio del fármaco (isotretinoína).
Metabolismo lipídico
La isotretinoína provoca alteraciones lipídicas que son dependientes de la dosis y que generalmente aparecen a las 6 semanas del inicio del tratamiento. Los valores plasmáticos de lipoproteínas ricas en triglicéridos (VLDL) aumentan, y los valores plasmáticos de cHDL disminuyen. En la circulación, tanto las VLDL como los quilomicrones están sujetos al mismo metabolismo intravascular; las lipoproteínas son hidrolizadas mediante las lipasas del endotelio e internalizadas a través de los receptores lipoproteínas de baja densidad (LDL) y LRP2 para su uso por los diferentes tejidos. En nuestro experimento los valores de ARNm de la lipoproteína lipasa no están alterados, lo que es consecuente con resultados obtenidos en otros estudios in vivo en los que su actividad no varía1,18. Sin embargo, detectamos un aumento de más de 3 veces en la expresión de LRP2, que sugiere que el endotelio reacciona al aumento de lipoproteínas inducido por el fármaco, facilitando así la retirada de remanentes de la circulación. Hay que decir que algunos estudios in vivo indican una afectación en esta vía8-10, lo que podría significar que en individuos susceptibles el mecanismo de aclaramiento sería menos eficaz y favorecería la hipertrigliceridemia secundaria al tratamiento.
Como se ha comentado, otro de los efectos secundarios de este fármaco es el descenso de los valores de cHDL. Nuestros resultados muestran que en parte podría ser debido a un aumento en los valores del gen de la lipasa endotelial, que interviene en el catabolismo de la HDL. Estudios en modelos animales muestran que la sobreexpresión de la lipasa endotelial reduce de forma significativa los valores de cHDL19, y en estudios genéticos en humanos se han identificado polimorfismos potencialmente funcionales en individuos con elevados valores de cHDL20.
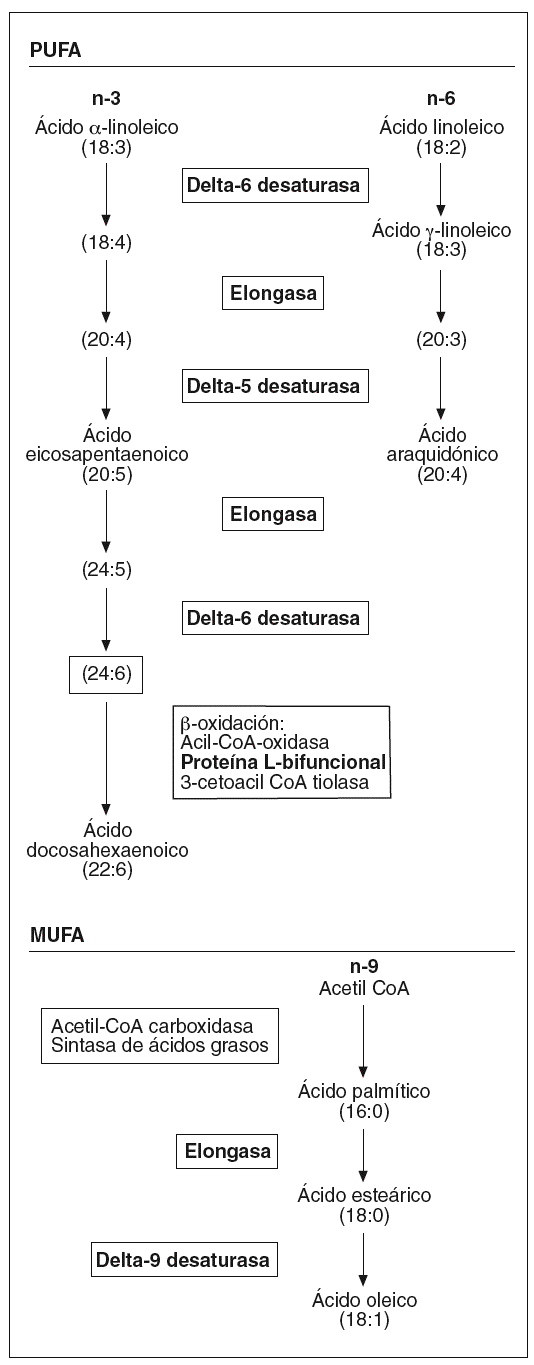
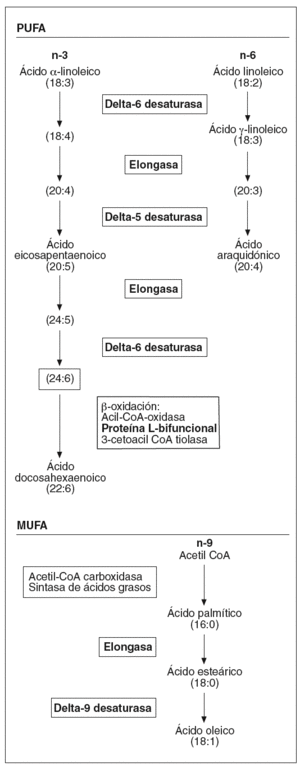
Por otra parte, hemos observado un aumento en la expresión de toda una serie de enzimas involucradas en el metabolismo de los ácidos grasos poliinsaturados de cadena larga (fig. 1) que podría afectar la composición de los fosfolípidos de la membrana, y por lo tanto sus propiedades físicas. Concretamente, la desaturasa delta-9 cataliza la reacción final en la transformación de ácidos grasos de cadena larga a ácidos grasos monoinsaturados, mientras que las desaturasas delta-5 y delta-6, la proteína L-bifuncional y la elongasa de ácidos grasos de cadena larga son esenciales en la formación de ácidos grasos poliinsaturados de cadena larga. Algunos estudios en modelos animales han mostrado una activación de las desaturasas delta-921 y delta-522 por la vitamina A y el AR en el hígado. La importancia de estos ácidos grasos en el proceso aterosclerótico radica en sus diferentes funciones: son ligandos para factores de transcripción que regulan la expresión de genes que codifican para transportadores, proteínas de unión y otros factores involucrados en la diferenciación celular23; intervienen en la respuesta inflamatoria24, e incrementan la fluidez de la membrana25. Referente a esta última función, una sobreexpresión de delta-9 aumenta la proporción de ácidos grasos monoinsaturados frente a los saturados, provocando un cambio en la composición de la membrana plasmática que hace disminuir el flujo de colesterol hacia HDL mediado por ABCA1 y aumenta el flujo pasivo de colesterol26, por lo que podríamos decir que la isotretinoína en el endotelio afectaría el transporte reverso de cHDL.
Figura 1. Esquema de la biosíntesis de los ácidos grasos insaturados. PUFA: ácidos grasos poliinsaturados; MUFA: ácidos grasos monoinsaturados. (En negrita aparecen remarcadas las enzimas que han presentado una expresión diferencial tras el estímulo.)
Otro proceso que también se ve afectado es el de síntesis endógena de colesterol. Las células endoteliales, a diferencia de otros tipos celulares de la vasculatura (células musculares lisas y macrófagos), no acumulan colesterol, aunque sí tienen la maquinaria para sintetizar esteroles. Dos enzimas de la síntesis del colesterol, la FDFT1 y DHCR7, aumentan su expresión por el 13-cis AR.
Inmunidad mediada por el interferón
Por último, cabe incidir en que en respuesta al 13-cis AR aumenta la expresión del IRF-1 y las diferentes oligoadenilatosintasas, lo que podría ser indicativo de una activación inmunológica del endotelio. IRF-1 es un factor de transcripción involucrado en la regulación del crecimiento celular y en la respuesta inmune mediada por interferón * (IFN-*). En diferentes tipos celulares IRF-1 es inducido por ácido todo-trans retinoico (ARNm y proteína) acompañado de un aumento de la expresión de genes diana, como OAS227.
Señalización molecular del 13-cis AR
El 13-cis AR es un efectivo agente farmacológico, aunque presenta poca afinidad tanto por las proteínas transportadoras intracelulares de ácido retinoico (CRABP) como por los receptores nucleares RXR y RAR, a través de los cuales los retinoides median sus efectos biológicos. Uno de los mecanismos de acción propuesto implica una isomerización intracelular a ácido todo-trans retinoico y/o ácido 9-cis retinoico, y serían estas moléculas las que regularían la transcripción génica y mediarían parte del efecto farmacológico descrito28,29. RXR forma heterodímeros permisivos con otros receptores nucleares (PPAR, LXR y FXR) que pueden ser activados tanto por agonistas de RXR como del receptor pareja. Nosotros, por RT-PCR a tiempo real, observamos un aumento en la expresión de RXR*, RXR* y PPAR*, y pensamos que algunos de los efectos observados en nuestro experimento son a través de la regulación transcripcional mediada por estos receptores.
En conclusión, podemos decir que en células endoteliales el tratamiento con 13-cis AR produce cambios en la expresión de genes involucrados en procesos inflamatorios e inmunológicos, así como en el metabolismo de la HDL. Estos procesos, junto con el aumento de los valores de lípidos en plasma, pueden estar contribuyendo a un posible proceso aterosclerótico en estos pacientes.