El objetivo del estudio es valorar el rendimiento diagnóstico de la tomografía computarizada (TC) y la tomografía por emisión de positrones (PET) en la estadificación clínica mediastínica del cáncer pulmonar quirúrgico según los datos de la cohorte prospectiva del Grupo Español de Cirugía Torácica Videoasistida (GEVATS).
MétodosSe han analizado 2.782 pacientes intervenidos por carcinoma pulmonar primario. Se ha estudiado el acierto diagnóstico en la estadificación mediastínica (cN2). Se ha realizado un análisis bivariante y multivariante de los factores que influyen en el acierto. Se ha estudiado el riesgo de pN2 inesperado en los factores con los que se recomienda una prueba invasiva de estadificación: cN1, tumor central o tamaño mayor de 3cm.
ResultadosEl acierto global de la TC y PET en conjunto es del 82,9% con VPP y VPN de 0,21 y 0,93. En tumores mayores de 3cm y a mayor SUVmax del mediastino, el acierto es menor, OR de 0,59 (0,44 – 0,79) y 0,71 (0,66 – 0,75), respectivamente. En el abordaje VATS el acierto es mayor, OR de 2,04 (1,52 – 2,73). El riesgo de pN2 inesperado aumenta con el número de los factores cN1, tumor central o tamaño mayor de 3cm: entre el 4,5% (0 factores) y 18,8% (3 factores), pero no hay diferencias significativas con la realización de prueba invasiva.
ConclusionesLa TC y PET en conjunto tienen un elevado valor predictivo negativo. Su acierto global es menor en tumores mayores de 3cm y SUVmax del mediastino elevado, y mayor en el abordaje VATS. El riesgo de pN2 inesperado es mayor si cN1, tumor central o mayor de 3cm y no varía significativamente con prueba invasiva.
The objective of this study was to assess the diagnostic performance of combined computerised tomography (CT) and positron emission tomography (PET) in mediastinal staging of surgical lung cancer based on data obtained from the prospective cohort of the Spanish Group for Video-Assisted Thoracic Surgery (GEVATS).
MethodsA total of 2782 patients underwent surgery for primary lung carcinoma. We analysed diagnostic success in mediastinal lymph node staging (cN2) using CT and PET. Bivariate and multivariate analyses were performed of the factors involved in this success. The risk of unexpected pN2 disease was analysed for cases in which an invasive testing is recommended: cN1, the tumour centrally located or the tumour diameter >3cm.
ResultsThe overall success of CT together with PET was 82.9% with a positive predictive value of 0.21 and negative predictive value of 0.93. If the tumour was larger than 3cm and for each unit increase in mediastinal SUVmax, the probability of success was lower with OR 0.59 (0.44–0.79) and 0.71 (0.66–0.75), respectively. In the video-assisted thoracic surgery (VATS) approach, the probability of success was higher with OR 2.04 (1.52–2.73). The risk of unexpected pN2 increased with the risk factors cN1, the tumour centrally located or the tumour diameter >3cm: from 4.5% (0 factors) to 18.8% (3 factors) but did not differ significantly as a function of whether invasive testing was performed.
ConclusionsCT and PET together have a high negative predictive value. The overall success of the staging is lower in the case of tumours >3cm and high mediastinal SUVmax, and it is higher when VATS is performed. The risk of unexpected pN2 is higher if the disease is cN1, the tumour centrally located or the tumour diameter >3cm but does not vary significantly as a function of whether patients have undergone invasive testing.
La estadificación clínica ganglionar mediastínica (cN2) es un elemento clave en el proceso de diagnóstico del cáncer de pulmón. Cuando la estadificación clínica ganglionar es cN0 o cN1, habitualmente el tratamiento inicial es la cirugía1.
En la actualidad, las pruebas iniciales en la estadificación mediastínica son la tomografía computarizada (TC) y la tomografía por emisión de positrones (PET). En función de su resultado, se decide si es necesario realizar pruebas invasivas como la ecobroncoscopia (EBUS) o la mediastinoscopia2.
La combinación de la TC y PET ha supuesto una mejora en la estadificación, ya que ambas tienen limitaciones de manera inidivual3. Existen circunstancias que pueden alterar su valor predictivo negativo (VPN) como un tumor central, una afectación cN1 o un tamaño tumoral mayor de 3cm4–8. En una de las guías de referencia para el manejo de la estadificación mediastínica, publicada por la Sociedad Europea de Cirugía Torácica (ESTS) en el año 20071, y actualizada posteriormente en 20149, se recomienda realizar una prueba invasiva en esas circunstancias.
El objetivo de este estudio es valorar el rendimiento diagnóstico de la TC y PET en conjunto en la estadificación clínica mediastínica del cáncer pulmonar quirúrgico según los datos obtenidos de la cohorte prospectiva del Grupo Español de Cirugía Torácica Videoasistida (GEVATS)10.
MétodosPacientesEl proyecto GEVATS de la Sociedad Española de Cirugía Torácica (SECT) fue fundado en mayo de 2015, con la idea de estudiar la implementación del abordaje quirúrgico VATS en nuestro país. Se diseñó un estudio prospectivo multicéntrico de cohorte para incluir todas las resecciones pulmonares anatómicas (independientemente del abordaje quirúrgico) realizadas en los 33 centros que participaron en 15 meses (20/12/2016 – 20/03/2018). El proyecto de investigación fue aprobado por todos los comités de ética de los centros participantes y se obtuvo el consentimiento informado de los pacientes reclutados para la utilización de los datos clínicos con fines científicos. Todos los detalles sobre las características de la base de datos, los métodos de auditoría y las variables están explicados en la publicación general del estudio GEVATS10.
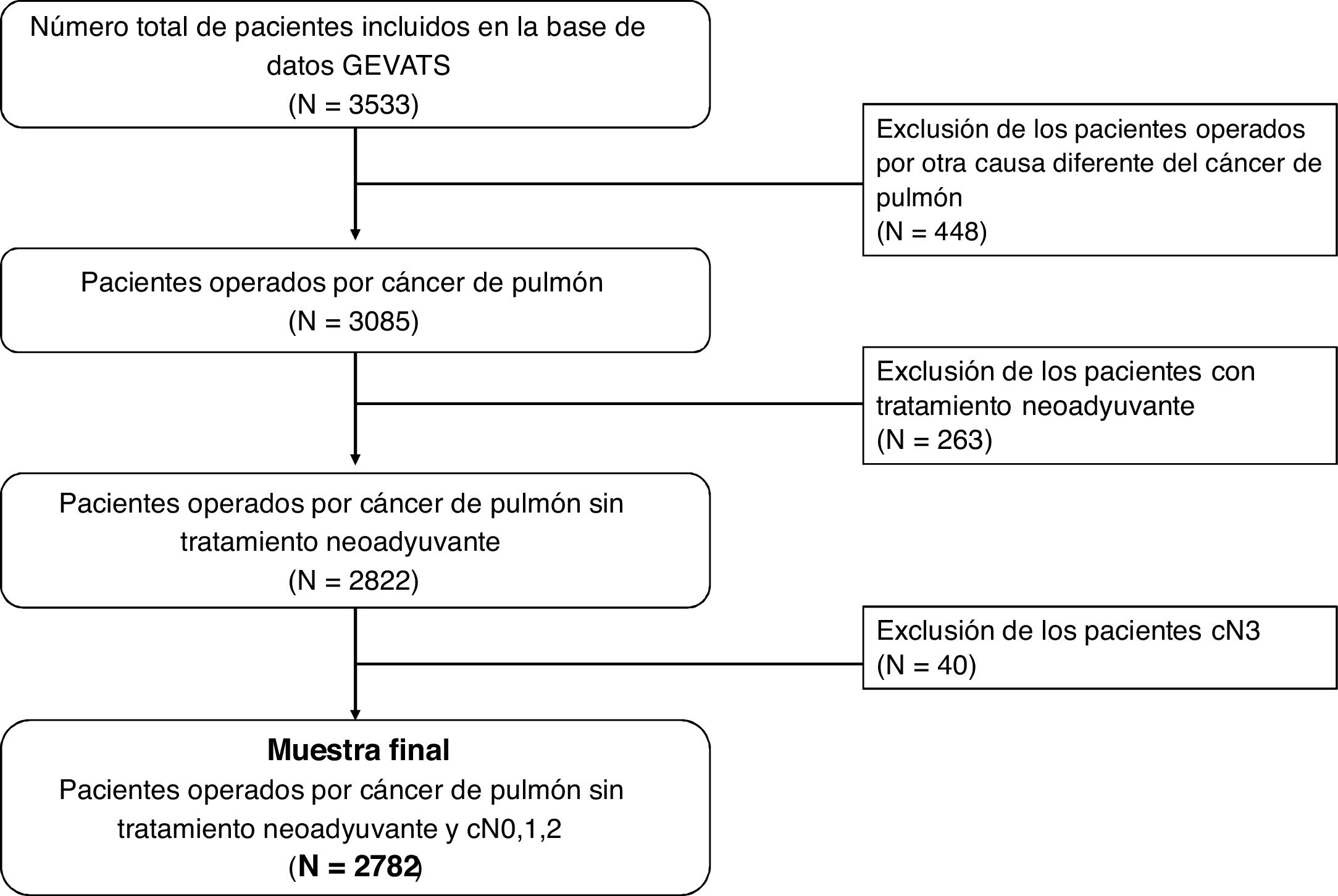
En la base de datos hay un total de 3.533 pacientes, de los cuales 3.085 (87,3%) fueron intervenidos por carcinoma pulmonar (fig. 1). Excluimos a aquellos que recibieron tratamiento neoadyuvante, por ser imposible en esos casos distinguir si los cambios entre la estadificación clínica y patológica se deben a errores en las pruebas diagnósticas o a efectos del tratamiento. Excluimos también a los pacientes con una estadificación cN3 por ser áreas ganglionares no exploradas habitualmente en la cirugía.
VariablesLa TC y la PET se consideraron positivas si en la prueba se había detectado algún ganglio mediastínico afectado (cN2). En la TC se consideró positivo un ganglio mayor de 1cm y en la PET la positividad la determinó cada investigador en función de los valores de referencia de su centro. Se definió la variable N2clínico (cN2) combinando el resultado de la TC y PET. Esta variable es positiva si alguna de las dos pruebas es positiva, y negativa si las dos pruebas son negativas. En los casos en los que no se realizó PET, se ha tenido en cuenta únicamente el resultado de la TC para la variable cN2. Se definió la variable acierto comparando la estadificación clínica mediastínica cN2 y el patológico (pN2).
Para la valoración del estándar de oro con el que se compara el diagnóstico con TC y PET, la linfadenectomía realizada en la intervención quirúrgica, se muestran el número de ganglios totales extirpados y el número de estaciones exploradas.
Para valorar el grado de cumplimiento de la guía clínica de la ESTS se elaboró la variable cumplimiento. Los criterios para elaborarla fueron los expuestos en la publicación de 20149. Si TC o PET son positivos, se exige la realización de una prueba invasiva para confirmación histológica. Si son negativos y es cN0, tumor periférico y tamaño menor de 3cm, no debe realizarse prueba invasiva. En caso de presencia de uno de estos tres factores, a pesar de ser negativos TC y PET, debe tener una prueba invasiva.
ResultadosSe analizaron el acierto y rendimiento diagnóstico de la TC y PET en conjunto y los factores que influyen en este acierto. Se calculó el porcentaje de cumplimiento de la guía de la ESTS. Se realizó un estudio detallado de los tres factores en los que la guía de la ESTS recomienda prueba invasiva. Se analizó el riesgo de pN2 inesperado (cN2 negativo y pN2 positivo) en estos casos, comparando en función de la realización de prueba invasiva.
Análisis estadísticoSe realizó inicialmente un análisis descriptivo. Para las variables cuantitativas se calculó la media y desviación estándar (DE) o mediana y rango intercuartílico. Para las variables cualitativas se calcularon frecuencias absolutas y relativas en porcentaje.
Realizamos el test de chi cuadrado o el test de Fisher para comparar la distribución de las variables cualitativas. De manera análoga empleamos la t de Student o la U de Mann Whitney, o la ANOVA o Kruskall Wallis, para comparar las variables cuantitativas. Se realizó un análisis bivariante para determinar las variables relacionadas con el acierto. Aquellas variables con un p-valor < 0,20 se incorporaron en un modelo de regresión logística multivariante.
Para evaluar el rendimiento diagnóstico de la TC y PET frente al estándar de oro se calculó la sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y el VPN mediante estimación puntual e intervalos de confianza al 95%.
Los cálculos se realizaron con el programa STATA 16.18 (1985-2019 StataCorp LLC. Texas, EE. UU.).
ResultadosLas principales variables demográficas y clínicas de la muestra de pacientes estudiada se muestran en la tabla 1.
Características demográficas y clínicas de la muestra de pacientes estudiada
| Edad (años) | 65,8 (9,6) |
| Género | |
| Hombre | 1.977 (71,1) |
| Mujer | 804 (28,9) |
| IMC | 26,9 (4,6) |
| Tabaco | |
| Nunca | 360 (12,9) |
| Ex-fumamdor 1-12 meses | 1.177 (42,3) |
| Ex-fumador > 12 meses | 358 (12,9) |
| Fumador | 844 (30,4) |
| Desconocido | 41 (1,5) |
| DM | 543 (19,5) |
| Abordaje quirúrgico | |
| Abierto | 1.216 (43,7) |
| VATS | 1.566 (56,3) |
| 3 o más puertos | 418 (26,7) |
| Biportal | 1.005 (64,2) |
| Uniportal | 140 (8,9) |
| Otros | 3 (0,2) |
| Tipo de resección | |
| Segmentectomía | 163 (5,9) |
| Lobectomía | 2.446 (87,9) |
| Neumonectomía | 173 (6,2) |
| Tipo lobectomía | |
| LSD | 855 (36,5) |
| LM | 138 (5,9) |
| LID | 420 (17,9) |
| LSI | 561 (23,9) |
| LII | 369 (15,7) |
| Histología tumor | |
| ADC | 1.520 (54,7) |
| ESC | 855 (30,8) |
| CT | 152 (5,5) |
| CA | 38 (1,4) |
| CNCG | 89 (3,2) |
| CPCP | 17 (0,6) |
| Indiferenciado | 43 (1,5) |
| Otros | 63 (2,3) |
Los datos se muestran como media (DE) o número absoluto (porcentaje).
ADC: adenocarcinoma; CA: carcinoide atípico; CNCG: carcinoma neuroendocrino de célula grande; CPCP: carcinoma pulmonar de célula pequeña; CT: carcinoide típico; DM: diabetes mellitus; ESC: carcinoma escamoso; IMC: índice de masa corporal; LID: lóbulo inferior derecho; LII: lóbulo inferior izquierdo; LM: lóbulo medio; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; VATS: cirugía torácica videoasistida.
Se detectó un cN2 positivo en 381 (13,7%) pacientes y un pN2 en 253 (9,2%) (tabla 2). El acierto global de la TC y PET en conjunto fue del 82,9%, siendo más habitual el error en el caso de ser cN2 positivo (78,5%) (tabla 2). Los valores de S, E, VPP y VPN son de 0,32, 0,88, 0,21 y 0,93, respectivamente.
Descripción de la estadificación mediastínica clínico-patológica
| TC | |
| Negativo (cN0 / cN1) | 2.578 (92,7) |
| Positivo (cN2) | 203 (7,3) |
| PET | |
| Negativo (cN0 / cN1) | 2.298 (88,6) |
| Positivo (cN2) | 296 (11,4) |
| cN2 (TC + PET) | |
| Negativo (cN0 / cN1) | 2.400 (86,3) |
| Positivo (cN2) | 381 (13,7) |
| pN2 | |
| Negativo (pN0 / pN1) | 2.489 (90,8) |
| Positivo (pN2) | 253 (9,2) |
| Acierto en cN2a | 2.273 (82,9) |
| Acierto | |
| pN2 + / cN2 + | 81 (21,5) |
| pN2 - / cN2 - | 2.192 (92,7) |
| No acierto | |
| pN2 - / cN2 + | 296 (78,5) |
| pN2 + / cN2 - | 172 (7,3) |
Los datos se muestran como media (DE) o número absoluto (porcentaje).
PET: tomografía por emisión de positrones; TC: tomografía computarizada.
En la linfadenectomía se observó una media de ganglios totales extirpados y estaciones ganglionares totales exploradas de 8,7 (DE 6,1) y 2,5 (DE 1,1).
Los factores que influyen significativamente en el acierto en el análisis bivariante se muestran en las tablas 3 y 4. En el análisis multivariante, mantuvieron la significación estadística el tamaño del tumor, el SUVmax del mediastino y el abordaje quirúrgico (tabla 5).
Análisis univariante de los factores (variables cualitativas) que influyen en el acierto diagnóstico de la estadificación ganglionar mediastínica de la TC y PET en conjunto
| Variable | Acierto diagnósticoa | Valor P |
|---|---|---|
| Tabaquismo | 0,070 | |
| Nunca | 308 (86,8) | |
| Ex-fumador | 1.238 (81,7) | |
| Fumador activo | 694 (83,3) | |
| DM | 0,042 | |
| NO DM | 1.841 (83,6) | |
| SI DM | 431 (79,9) | |
| Tamaño tumor | < 0,001 | |
| ≤ 3 cm | 1.491 (87,8) | |
| > 3 cm | 777 (75,1) | |
| Densidad tumor TC | < 0,001 | |
| Sólido | 1.877 (81,5) | |
| Mixto | 286 (87,7) | |
| Vidrio deslustrado | 95 (97,9) | |
| Localización del tumor | < 0,001 | |
| Central | 793 (77,8) | |
| Periférico | 1.480 (85,9) | |
| Tipo de resección | < 0,001 | |
| Segmentectomía | 145 (91,8) | |
| Lobectomía | 2.015 (83,4) | |
| Neumonectomía | 113 (67,7) | |
| Tipo de lobectomía | 0,320 | |
| LSD | 701 (82,9) | |
| LM | 117 (87,9) | |
| LID | 357 (85,8) | |
| LSI | 459 (82,7) | |
| LII | 312 (85,5) | |
| Abordaje quirúrgico | < 0,001 | |
| Toracotomía | 901 (76,1) | |
| VATS | 1.369 (88,1) |
El acierto diagnóstico se muestra como número absoluto (porcentaje).
Valor P < 0,05 en negrita.
DM: diabetes mellitus; LID: lóbulo inferior derecho; LII: lóbulo inferior izquierdo; LM: lóbulo medio; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; PET: tomografía por emisión de positrones; TC: tomografía computarizada; VATS: cirugía torácica videoasistida.
Análisis univariante de los factores (variables cuantitativas) que influyen en el acierto diagnóstico de la estadificación ganglionar mediastínica de la TC y PET en conjunto
| Variable | Acierto diagnósticoa | No acierto diagnósticoa | P-valueb |
|---|---|---|---|
| Tamaño tumor (mm) | 28,3 (19,7) | 38,7 (22,9) | < 0,001 |
| SUVmax tumor | 8,7 (6,8) | 12,3 (8,4) | < 0,001 |
| SUVmax mediastino | 1,1 (2,2) | 3,4 (3,1) | < 0,001 |
| Estaciones ganglionares | 2,5 (1,1) | 2,6 (1,2) | 0,042 |
| Número de ganglios | 8,4 (5.,9) | 10,3 (7,1) | < 0,001 |
Análisis multivariante de los factores que influyen en el acierto diagnóstico de la estadificación ganglionar mediastínica de la TC y PET en conjunto
| Variablea | OR | 95% IC | P-value |
|---|---|---|---|
| Tamaño tumor(> 3cm vs. ≤ 3 cm) | 0,59 | 0,44 – 0,79 | < 0,001 |
| SUVmax mediastino | 0,71 | 0,66 – 0,75 | < 0,001 |
| Abordaje quirúrgico(VATS vs. toracotomía) | 2,04 | 1,52 – 2,73 | < 0,001 |
Se muestra el OR y el IC 95% de las variables que finalmente han quedado en el modelo tras el análisis multivariante por pasos hacia atrás.
IC: intervalo de confianza; OR: razón de odds; PET: tomografía por emisión de positrones; SUVmax: valor máximo de captación estandarizado; TC: tomografía computarizada; VATS: cirugía torácica videoasistida.
Se cumplió la guía de estadificación ganglionar de la ESTS en 1.561 casos (56,1%). Los casos de menor cumplimiento fueron aquellos con TC y PET negativas y alguno de los tres factores en los que se recomienda realizar prueba invasiva.
Cuando el cN2 fue positivo, se realizó prueba invasiva en el 77,2% de los pacientes, frente al 13,5% en los negativos (tabla 6). En los casos de cN2 negativo, se observó una relación entre el número de los tres factores y la frecuencia de realización de prueba invasiva: 0 (5,6%), 1 (12,4%), 2 (26,6%) y 3 (49,5%), diferencia estadísticamente significativa (p < 0,001). La frecuencia de pN2 inesperado fue mayor si se presenta alguno de estos 3 factores (tabla 6). Se observó, así mismo, una relación entre el número de factores y la frecuencia de pN2 inesperado: 0 (4,5%), 1 (7,7%), 2 (10,5%) y 3 (18,8%), diferencia estadísticamente significativa (p < 0,001). No se observaron diferencias estadísticamente significativas en la frecuencia de pN2 inesperado en estos factores entre los pacientes con y sin prueba invasiva (tabla 6).
Realización de prueba invasiva y pN2 en función del cN2 y los tres factores en los que se recomienda realizar prueba invasiva con cN2 negativo
| Prueba invasiva (PI) | pN2 | pN2sin PI | pN2con PI | Valor P | |
|---|---|---|---|---|---|
| cN2 - | 323 (13,5) | 172 (7,3) | 143 (7) | 29 (8,9) | 0,208 |
| cN2 + | 294 (77,2) | 81 (21,5) | |||
| cN2 - y cN0, tumor periférico y ≤ 3 cm | 60 (5,6) | 47 (4,5) | |||
| cN2 - y cN1 | 119 (39) | 50 (16,6) | 32 (17,5) | 18 (15,1) | 0,590 |
| cN2 - y tumor central | 182 (21,5) | 76 (9,1) | 58 (8,9) | 18 (9,9) | 0,689 |
| cN2 - y tumor > 3 cm | 179 (21,7) | 82 (10,1) | 68 (10,7) | 14 (7,8) | 0,252 |
Los datos se muestran como número absoluto (porcentaje).
Valor P de la comparación del pN2 inesperado con PI y sin PI.
cN1: N1 clínico; cN2: N2 clínico (variable con TC y PET); PI: prueba invasiva; pN2: N2 patológico.
En el presente estudio analizamos el rendimiento diagnóstico de la TC y PET en conjunto en la estadificación ganglionar mediastínica del cáncer pulmonar quirúrgico. La probabilidad de acierto global fue del 82,9%. El error es más frecuente cuando estas pruebas son positivas para afectación del mediastino. Cuando el cN2 fue positivo, se detectó un 21,5% de pN2, y cuando fue negativo un 7,3%. Los valores de VPP y VPN fueron de 0,21 y 0,93, respectivamente. A la vista de los datos, reafirmamos que un valor positivo en la TC o PET para un ganglio mediastínico exige un estudio más exhaustivo mediante pruebas invasivas. No obstante, la baja sensibilidad observada está distorsionada por tratarse de una cohorte quirúrgica.
El rendimiento diagnóstico de la TC y PET por separado es inferior, como muestran Verhagen et al., con un VPN de 0,834. Individualmente, parece ser más precisa la PET11, pero cuando se utilizan ambas técnicas en conjunto el rendimiento mejora12. Wang et al., publicaron un meta-análisis con 10 estudios y 1.122 pacientes en el que estimaron un VPN de 0,93 y un 7% de pN2 inesperado en estadios cT1-2N07. Uno de esos estudios, realizado únicamente con pacientes quirúrgicos, observaron un VPN y pN2 inesperado de 0,92 y 7,6% en estadios cIA, que cambia a 0,85 y 14,8% en estadios cIB8.
En estos estudios se suele mencionar la prueba de referencia para el acierto diagnóstico, pero no su calidad4,5,7,8,11,12. Sería interesante tener una descripción lo más detallada posible de esa prueba, como proponen Detterbeck et al.13. Algunos autores han observado un aumento en la detección de pN2 cuando la extensión de la disección ganglionar es mayor14. El Grupo Cooperativo de Carcinoma Broncogénico de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y otras guías internacionales recomiendan realizar una disección ganglionar sistemática con una extracción mínima de seis ganglios en total y por lo menos tres estaciones mediastínicas exploradas15–17. En nuestra serie, la media de ganglios extirpados fue de 8,7 y 2,5 estaciones ganglionares exploradas.
En cuanto a los factores que influyen en el acierto de la TC y PET, si el tumor es mayor de 3cm y cuanto mayor SUVmax del mediastino, la probabilidad de acierto es menor y en los casos de abordaje VATS la probabilidad de acierto es mayor. Estos resultados están influenciados por el menor grado de acierto en el cN2 positivo. El 21,7% de tumores mayores de 3cm tienen un cN2 positivo, frente al 8,6% en los de tamaño igual o menor a 3cm, y el SUVmax del mediastino en los casos de cN2 positivo es 3,5 puntos mayor (datos no presentados en los resultados). Por el contrario, el 19,3% de los casos operados por toracotomía tienen un cN2 positivo, frente al 9,4% en los casos VATS. Así mismo, podría tener influencia en el mayor acierto de la VATS el hecho de que en esta vía de abordaje la exhaustividad de la linfadenectomía es menor, como demuestran Obiols et al., en un estudio recientemente publicado utilizando la misma serie del GEVATS18.
El menor acierto ante un resultado positivo en la TC o PET, hace que la realización de pruebas invasivas sea mayor en ese caso. En los casos de negatividad, la variabilidad de actuación se incrementa. En nuestra serie, la guía de práctica clínica de la ESTS solo se ha cumplido estrictamente en el 56,1% de los casos. Las situaciones de menor cumplimiento han sido con cN2 negativo y cN1, tumor central o mayor de 3cm. En estos casos, la guía de la ESTS recomienda realizar una prueba invasiva, y en nuestro caso solo se ha realizado en el 39%, 21,5% y 21,7% de los casos, respectivamente. La razón de indicar una prueba invasiva es que la frecuencia de pN2 inesperado en esas situaciones es mayor. Pero incluso con exploración quirúrgica del mediastino en el 75% de los pacientes, como en el trabajo de Obiols et al., el pN2 inesperado fue 5,5%19, ligeramente inferior al 7,3% observado en nuestro estudio.
Uno de los factores de riesgo de pN2 inesperado con mayor consistencia en las publicaciones es el tamaño del tumor7,20–24. Otro factor que ha demostrado influencia es la localización central del tumor20; sin embargo, la consistencia de este factor es menor7,8. El cN1 también ha demostrado una mayor frecuencia de pN2 inesperado23,24. Hishida et al. hallaron un 28% de pacientes con pN2 con cN1 diagnosticado por TC24.
Al margen del riesgo individual de estos factores, es importante valorar el riesgo de pN2 inesperado cuando se combinan varios de ellos. En el trabajo de Farjah, diseñaron un modelo predictivo con seis factores con un VPN de 100%23. En nuestra serie hemos observado que el porcentaje de pN2 inesperado es mayor cuanto mayor número de los tres factores de riesgo estudiados, pasando del 4,5% en el caso de que no haya ninguno, al 18,8% cuando están presentes los tres. Por lo tanto, deberíamos tenerlo en cuenta para decidir la realización de prueba invasiva.
La realización de estas pruebas en la estadificación del cáncer de pulmón quirúrgico es el punto de mayor variabilidad. Thornblade et al. observaron grandes diferencias en la estadificación invasiva entre diferentes centros, no explicada por el estadio tumoral25. Es importante identificar los casos en los que la prueba invasiva no es necesaria y podemos ahorrar morbilidad y tiempo de estudio. En un modelo combinando varios factores, estiman que se podría reducir el número de pruebas invasivas del 77% al 55%23. En otro estudio de coste-efectividad, concluyen que por debajo de 2,5% de pN2 es coste-efectivo no realizar prueba invasiva, y entre 2,5 y 10% hay que valorar individualmente cada caso26. En nuestra serie, con prevalencia de pN2 de 18,8% con la presencia de los tres factores de riesgo, solo se ha realizado prueba invasiva en el 49,5% de los casos. Sin embargo, la realización de prueba invasiva no ha disminuido significativamente el riesgo de pN2 inesperado.
Los criterios utilizados en las publicaciones para recomendar la realización de estudio invasivo del mediastino no tienen en cuenta la supervivencia27. En dos estudios con modelos teóricos de decisión clínica, basan la ganancia de años ajustados por calidad en datos de supervivencia publicados en la literatura y no en efectos directos de una estrategia de estadificación26,28. Por otra parte, Decaluwé et al. reflexionan que habría que saber el beneficio en supervivencia de administrar tratamiento neoadyuvante en un N2 previo a la cirugía, frente a administrar tratamiento adyuvante tras hallar un pN2 inesperado29. Basado en datos de la literatura, estima que serían necesarias entre 580 y 2.900 pruebas invasivas para salvar una vida a los cinco años. En nuestra cohorte, que está actualmente en seguimiento, podremos ver la repercusión en la supervivencia a los cinco años del hallazgo inesperado de un pN2 cuando no se ha realizado prueba invasiva, frente a aquellos pacientes que en el mismo tiempo han recibido tratamiento neoadyuvante por un cN2.
En nuestro estudio se pueden observar varias limitaciones. En primer lugar, al tratarse de un registro voluntario podemos dudar de la calidad de los datos. Sin embargo, la auditoría y control de calidad realizados en este registro han permitido comprobar un reclutamiento medio del 83% y una exactitud de los datos del 98%, lo que aporta confiabilidad a la información obtenida10. Por otra parte, como todos los estudios que analizan este tema, contamos con la limitación de tener un estándar de oro variable y sin unos criterios de calidad exactos y consensuados. Hemos mostrado el número de ganglios y estaciones como valoración del estándar de oro. En cualquier caso, nuestros datos muestran el rendimiento de la estadificación clínica no invasiva en la práctica clínica habitual con los tipos y extensiones de linfadenectomía que habitualmente se realizan en nuestro medio.
ConclusionesLa TC y PET, en conjunto, tienen un elevado rendimiento diagnóstico en la estadificación ganglionar mediastínico en el cáncer de pulmón quirúrgico en los casos de resultado negativo para cN2. Su acierto global es menor en el caso de tumores mayores de 3cm y SUVmax del mediastino elevado, y es mayor en el caso de abordaje quirúrgico VATS.
Cuando la TC y PET son negativas para cN2, pero presenta cN1, tumor central o mayor de 3cm, el riesgo de pN2 inesperado es mayor y se incrementa con el número de esos factores, aunque no hay variación significativa con la realización de prueba invasiva.
FinanciaciónTodos los gastos relacionados con la puesta en marcha y el mantenimiento de la base de datos GEVATS fueron cubiertos por Ethicon, Johnson & Johnson. Los autores tuvieron libertad de investigación y control total del diseño del estudio, los métodos utilizados, los parámetros de resultado y los resultados, el análisis de datos y la producción del informe escrito. El GEVATS fue galardonado con el premio de la SECT al mejor proyecto nacional de investigación de 2015.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.
Agradecemos a Johnson & Johnson su colaboración en el desarrollo del Grupo Español de VATS. Agradecemos también a todos los responsables de los servicios de documentación clínica de cada hospital por participar activamente en la auditoría de nuestro estudio.