Conocer los cambios que ha experimentado el perfil de paciente candidato a prostatectomía radical a lo largo de las últimas 2 décadas en nuestra institución.
Material y métodosAnalizamos retrospectivamente una serie de 1.132 pacientes con cáncer de próstata estadio T1-T2, sometidos a prostatectomía radical durante el periodo 1989-2009. La serie se divide en 5 grupos homogéneos en cuanto al número de pacientes y ordenados cronológicamente. Se emplea la supervivencia libre de progresión bioquímica (SLPB) como criterio pronóstico principal.
ResultadosA pesar de los cambios en el diagnóstico y tratamiento de la enfermedad, desde el punto de vista del pronóstico (SLPB) apreciamos 2 grupos diferentes de pacientes: los primeros 250 intervenidos y el resto. El punto de corte cronológico se sitúa en esta serie en 1999. Encontramos diferencias significativas en la mayoría de las variables clínico-patológicas como nivel de PSA al diagnóstico (p < 0,001), porcentaje de tumores palpables (p < 0,001), estadio clínico (p < 0,001), Gleason en la biopsia prostática (p = 0,004), grupos de riesgo de D’Amico (p < 0,001), estadio patológico (p < 0,001) y porcentaje de pacientes con afectación ganglionar (p < 0,001). No obstante, no se detectan diferencias de significación estadística en el Gleason del espécimen de prostatectomía (p = 0,06) y en el porcentaje de márgenes quirúrgicos (p = 0,6).
ConclusionesEste estudio analiza una muestra amplia de pacientes procedente de toda la geografía española y presenta algunos datos importantes que reflejan la evolución que ha sufrido el cáncer de próstata localizado, tanto en lo que respecta al diagnóstico como al pronóstico, en nuestro país en los últimos 20 años.
To know the changes that there has experienced the profile of patient candidate to prostatectomía radically throughout last 2 decades in our institution.
Material and methodsWe analyze retrospectively a series of 1.132 patients with prostate cancer stadium T1-T2, submitted to radical prostatectomy during the period 1989-2009. The series divides in five homogeneous groups as for the number of patients and arranged chronologically. There uses the free survival of biochemical progression (SLPB) as criterion principal forecast.
ResultsIn spite of the changes in the diagnosis and treatment of the disease, from the point of view of the forecast (SLPB) we estimate two groups different from patients: the first 250 controlled ones and the rest. The point of chronological cut places in this series in 1.999. We find significant differences in the majority of the clinical - pathological variables as PSA's level to the diagnosis (P <0,001), percentage of palpable tumors (P <0,001), clinical stadium (P <0,001), Gleason in the prostate biopsy (P =0,004), groups at risk of D’Amico (P <0,001), pathological stadium (P <0,001) and percentage of patients mincingly ganglionar (P <0,001). Nevertheless, there are not detected differences of statistical significance in the Gleason of the specimen of prostatectomy (P =0,06) and in the percentage of surgical margins (P =0,6).
ConclusionsThis study analyzes a patients’ wide proceeding sample from the whole Spanish geography and presents some important information that reflect the evolution that has suffered the cancer of prostate located, so much regarding the diagnosis as to the forecast, in our country in the last 20 years.
El descubrimiento del antígeno prostático específico (PSA) en los años 1980 hizo posible el diagnóstico precoz de cáncer de próstata y la prostatectomía radical como tratamiento de intención curativa, momento histórico del tratamiento del cáncer de próstata en el que aún hoy estamos. Sabemos que el tipo de paciente tratado con cirugía ha evolucionado en los últimos 25 años porque se ha mejorado con la experiencia en sutileza diagnóstica y en las indicaciones, gracias al conocimiento de los factores clínicos con influencia en el pronóstico. Además, se ha producido una progresiva sensibilización social en la clase médica y en la sociedad civil, que han producido un aumento del número de pacientes diagnosticados y una marcada migración clínico-patológica de los estadios de esta enfermedad1–4.
Pretendemos determinar los cambios que ha experimentado el perfil de paciente candidato a esta cirugía a lo largo de 2 décadas y para ello revisamos la experiencia de nuestra institución con 1.132 pacientes diagnosticados de cáncer de próstata clínicamente localizado y tratados consecutivamente mediante prostatectomía radical en nuestro centro.
Material y métodosAnalizamos retrospectivamente la serie de pacientes con cáncer de próstata estadio T1-T2 intervenidos quirúrgicamente mediante prostatectomía radical en nuestro centro entre 1989 y 2009. Previamente a la cirugía, a todos los pacientes se les realizó historia clínica detallada con exploración física y tacto rectal, PSA y biopsia prostática. La estadificación clínica se completó con tomografía computarizada (TC) y a partir del año 2000 con resonancia magnética (RM). En los casos con PSA superior a 20 ng/ml o Gleason 8-10 o Gleason 7 junto con PSA > 10 ng/ml se realizó gammagrafía ósea para completar la estadificación.
El abordaje abierto se corresponde con la técnica descrita por Walsh5 en 1982. Hasta el año 2007 se practicó también linfadenectomía ilioobturatriz bilateral y posteriormente en aquellos pacientes con PSA > 15 y/o Gleason > 6. El abordaje laparoscópico se realizó en nuestro centro por primera vez en el año 2005. Desde entonces se ha realizado cirugía laparoscópica o abierta de acuerdo con las preferencias de los cirujanos y con el objetivo docente de que los residentes puedan aprender ambas técnicas.
Posteriormente a la cirugía el seguimiento se realizó mediante determinaciones de PSA a los 3, 6 y 12 meses. Después cada 6 meses hasta un total de 3 años y, posteriormente, cada año. Definimos la recidiva bioquímica de PSA como una determinación de PSA ≥ 0,4 ng/ml (Hybritech®) obtenida al menos 30 días tras la cirugía, y confirmada posteriormente con un valor igual o superior.
Para estudiar la evolución del tipo de paciente intervenido nos proponemos descubrir: a) si hay grupos de pacientes diferentes; b) cuántos grupos diferentes de pacientes fueron tratados, y c) dónde se sitúan el punto o los puntos de corte cronológicos. A tal fin los pacientes tratados fueron divididos en tramos cronológicos definidos por un número de paciente equiparable en cada grupo, que a la par supone el mínimo de pacientes para poder ser tratado estadísticamente.
El criterio principal elegido para valorar la diferencia en el tipo de paciente intervenido es la supervivencia libre de progresión bioquímica (SLPB), de modo que las diferencias en este parámetro determinan la definición de los grupos. Se valoran además las características clínico-patológicas de los grupos resultantes.
Para el cálculo de variables cualitativas y comparación de proporciones se han utilizado tablas de contingencia (ji al cuadrado o prueba de Fisher), para la comparación de medias en variables cuantitativas la prueba t de Student, para el estudio de supervivencia actuarial el modelo de Kaplan-Meier y para la comparación de curvas de supervivencia la prueba de igualdad de distribuciones de supervivencia log-rank. Todos los análisis estadísticos han sido realizados con el programa SPSS (SPSS Inc., Chicago, Illinois, EE. UU.). Los datos se presentan como medias ± desviación estándar. Se ha exigido un valor de p < 0,05 para determinar la significación estadística.
ResultadosEn el periodo 1989-2009 se han practicado 1.132 prostatectomías radicales a pacientes en estadio clínico T1-T2 en la Clínica Universidad de Navarra, 990 (87,5%) mediante abordaje abierto y 142 (12,5%) vía laparoscópica. La distribución por Gleason total en la pieza fue 611 (55,1%) Gleason 6, 276 (24,9%) Gleason 7, 222 (20%) Gleason 8-10. La distribución por estadio patológico fue 773 (68,3%) pT2 (181 [16%] pT2a, 176 [15,5%] pT2b, 416 [36,7%] pT2c), 355 (31,3%) pT3 (228 [20,1%] pT3a, 127 [11,2%] pT3b) y 4 (0,4%) pT4. Un total de 50 (4,4%) pacientes presentaron enfermedad ganglionar positiva.
Los pacientes han sido divididos en 5 grupos: 250 pacientes operados en el periodo 1990-1999 componen el primer grupo; el segundo está formado por otros 250 operados entre 1999 y 2002; el tercero por otros 250 intervenidos entre 2002 y 2004; un cuarto compuesto por otros 250 operados en 2004-2007; y un quinto y último grupo que incluye 132 pacientes cuya intervención se practicó entre 2007 y 2009. Estos grupos se distribuyen de forma equitativa en términos numéricos y con un evidente ordenamiento temporal que puede reflejar cambios en el comportamiento médico o en las características inherentes al tipo de paciente.
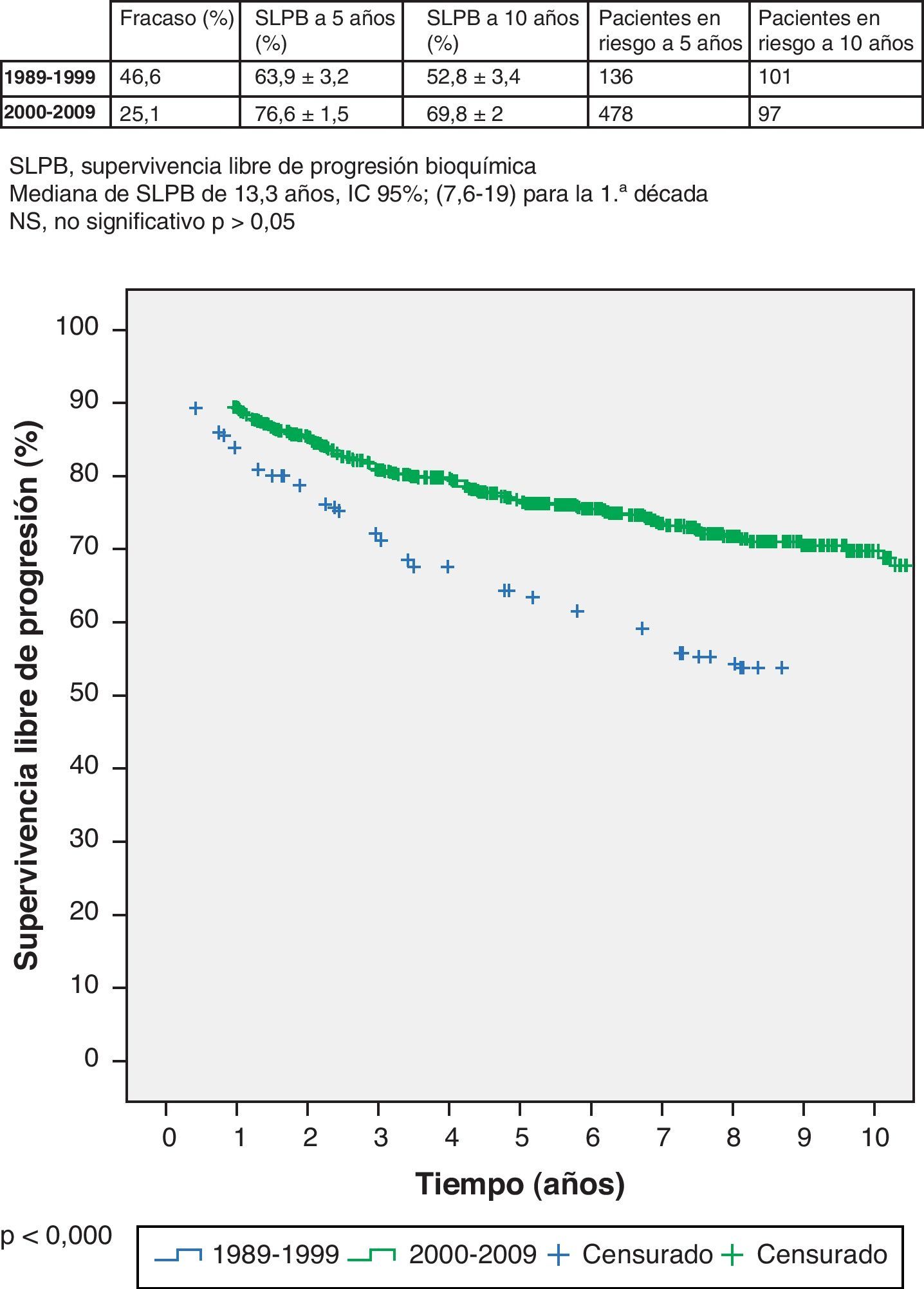
Cuando se analiza la SLPB de cada grupo y se compara con los demás se ponen en evidencia varias observaciones. Por un lado el grupo primero evidencia diferencias significativas con todos y cada uno de los 4 grupos restantes al tener peor tasa de SLPB (p < 0,05). Entre los grupos segundo, tercero, cuarto y quinto no se evidencias diferencias significativas (p > 0,05). Por ello, desde el punto de vista del pronóstico en términos de progresión bioquímica hay solamente 2 grupos diferentes (los primeros 250 pacientes intervenidos y el resto) y el punto de corte cronológico establecido es abril de 1999.
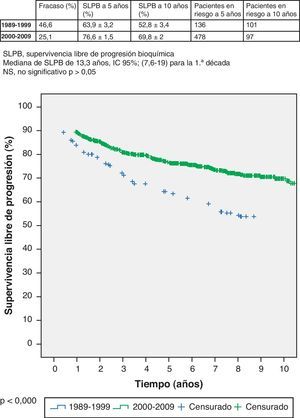
Si profundizamos en el estudio de estos 2 grupos apreciamos que la mediana de seguimiento es de 13 años para el primero y de 6,6 años para el resto. Lógicamente estos datos determinan distinto porcentaje de pacientes con fracaso bioquímico en cada grupo: 46,6% en el primero y 25,1% en el segundo. La SLPB del primer grupo (1989-1999) es 63,9% (IC 95% 60,7-67,1%) a 5 años, con 136 pacientes en riesgo, y 52,8% (IC 95% 49,4-56,2) a 10 años, con 101 pacientes en riesgo; respectivamente. La SLPB del segundo grupo (2000-2009) a 5 años es 76,6% (IC 95% 75,1-78,1%), con 478 pacientes en riesgo, y 69,8% (IC 95% 67,8-71,8%) a 5 años, con 97 pacientes en riesgo (log-rank, p < 0,000) (fig. 1).
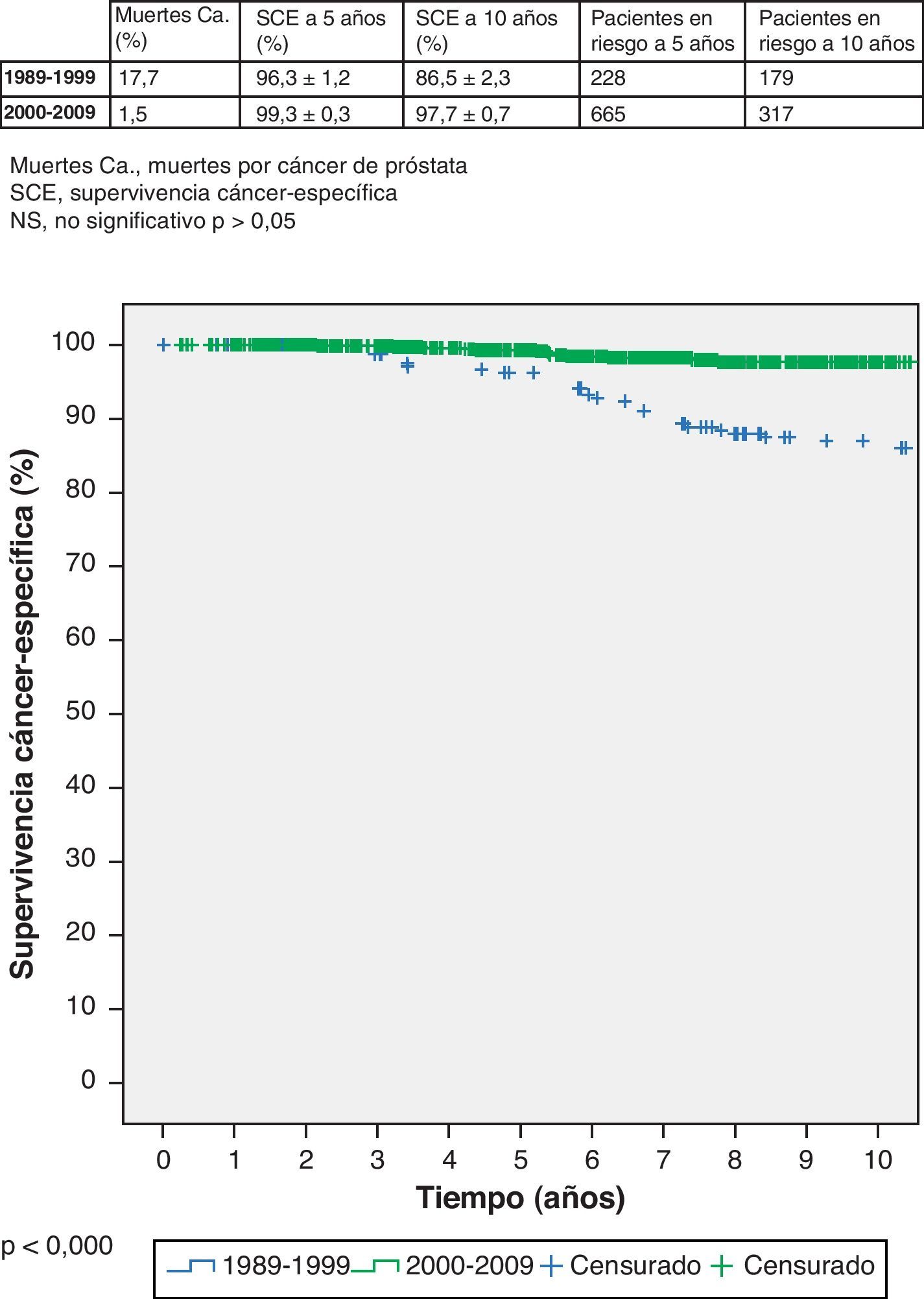
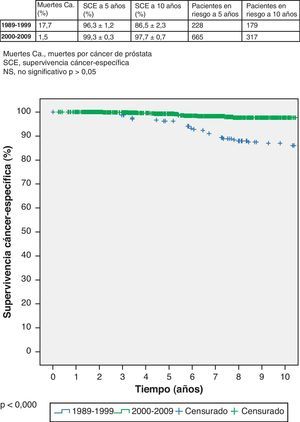
Aunque no se trate del objetivo principal de este trabajo, también se comprueba que la supervivencia es también significativamente peor en el primer grupo con 17,7% de fallecimientos por cáncer de próstata frente a 1,5% de fallecimientos en el segundo grupo. La supervivencia cáncer específica (SCE) del primer grupo (1989-1999) es 96,3% (IC 95% 95,1-97,5%) a 5 años, con 228 pacientes en riesgo, y 86,5% (IC 95% 84,2-88,8%) a 10 años, con 179 pacientes en riesgo; respectivamente. La SCE del segundo grupo (2000-2009) a 5 años es 99,3% (IC 95% 99,0-99,6%), con 665 pacientes en riesgo, y 97,7% (IC 95% 97,0-98,4) a 10 años, con 317 pacientes en riesgo (log-rank, p < 0,000) (fig. 2).
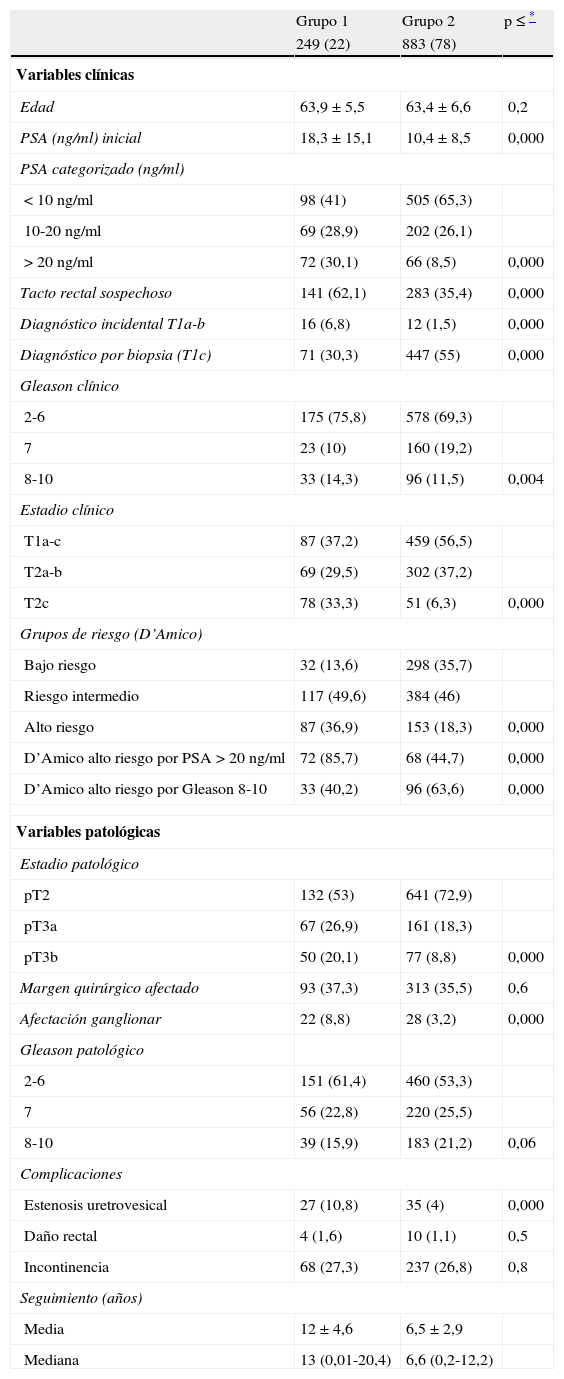
Las características clínico-patológicas de ambos grupos se resumen en la tabla 1. El primero de ellos está compuesto por pacientes con datos clínicos e histopatológicos que justifican peor pronóstico. Se evidencian diferencias significativas en todas las variables comparadas, que incluyen nivel de PSA al diagnóstico, porcentaje de pacientes con tacto rectal sospechoso, Gleason en la biopsia prostática, estadio clínico, grupos de riesgo de D’Amico, estadio patológico y porcentaje de pacientes con afectación ganglionar (tabla 1). En lo que respecta a Gleason en la pieza de prostatectomía se detectan diferencias aunque a punto de alcanzar significación estadística (p = 0,06). No existen diferencias entre grupos en el porcentaje de pacientes con afectación de márgenes (p = 0,6), lo que posiblemente implique un mismo rigor metodológico en lo que respecta a la realización de la técnica a lo largo del tiempo. En lo que respecta a porcentaje de complicaciones, se detecta menor tasa de estenosis uretrovesical en los pacientes de la década 2000-2009 que en los de 1989-1999, pero no se detectan diferencias en lo que respecta a lesión rectal o incontinencia. Estos datos se detallan también en la tabla 1.
Características clínico-patológicas de ambos grupos (n = 1.132)
| Grupo 1 | Grupo 2 | p ≤ * | |
| 249 (22) | 883 (78) | ||
| Variables clínicas | |||
| Edad | 63,9 ± 5,5 | 63,4 ± 6,6 | 0,2 |
| PSA (ng/ml) inicial | 18,3 ± 15,1 | 10,4 ± 8,5 | 0,000 |
| PSA categorizado (ng/ml) | |||
| < 10 ng/ml | 98 (41) | 505 (65,3) | |
| 10-20 ng/ml | 69 (28,9) | 202 (26,1) | |
| > 20 ng/ml | 72 (30,1) | 66 (8,5) | 0,000 |
| Tacto rectal sospechoso | 141 (62,1) | 283 (35,4) | 0,000 |
| Diagnóstico incidental T1a-b | 16 (6,8) | 12 (1,5) | 0,000 |
| Diagnóstico por biopsia (T1c) | 71 (30,3) | 447 (55) | 0,000 |
| Gleason clínico | |||
| 2-6 | 175 (75,8) | 578 (69,3) | |
| 7 | 23 (10) | 160 (19,2) | |
| 8-10 | 33 (14,3) | 96 (11,5) | 0,004 |
| Estadio clínico | |||
| T1a-c | 87 (37,2) | 459 (56,5) | |
| T2a-b | 69 (29,5) | 302 (37,2) | |
| T2c | 78 (33,3) | 51 (6,3) | 0,000 |
| Grupos de riesgo (D’Amico) | |||
| Bajo riesgo | 32 (13,6) | 298 (35,7) | |
| Riesgo intermedio | 117 (49,6) | 384 (46) | |
| Alto riesgo | 87 (36,9) | 153 (18,3) | 0,000 |
| D’Amico alto riesgo por PSA > 20 ng/ml | 72 (85,7) | 68 (44,7) | 0,000 |
| D’Amico alto riesgo por Gleason 8-10 | 33 (40,2) | 96 (63,6) | 0,000 |
| Variables patológicas | |||
| Estadio patológico | |||
| pT2 | 132 (53) | 641 (72,9) | |
| pT3a | 67 (26,9) | 161 (18,3) | |
| pT3b | 50 (20,1) | 77 (8,8) | 0,000 |
| Margen quirúrgico afectado | 93 (37,3) | 313 (35,5) | 0,6 |
| Afectación ganglionar | 22 (8,8) | 28 (3,2) | 0,000 |
| Gleason patológico | |||
| 2-6 | 151 (61,4) | 460 (53,3) | |
| 7 | 56 (22,8) | 220 (25,5) | |
| 8-10 | 39 (15,9) | 183 (21,2) | 0,06 |
| Complicaciones | |||
| Estenosis uretrovesical | 27 (10,8) | 35 (4) | 0,000 |
| Daño rectal | 4 (1,6) | 10 (1,1) | 0,5 |
| Incontinencia | 68 (27,3) | 237 (26,8) | 0,8 |
| Seguimiento (años) | |||
| Media | 12 ± 4,6 | 6,5 ± 2,9 | |
| Mediana | 13 (0,01-20,4) | 6,6 (0,2-12,2) | |
Datos presentados como media ± DE o número (%) de 249 pacientes en grupo 1.
Datos presentados como media ± DE o número (%) de 883 pacientes en grupo 2.
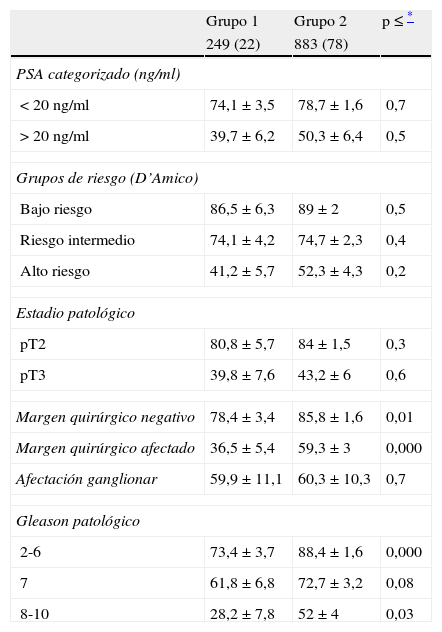
Cuando se compara la SLPB de ambos grupos estratificando según diferentes variables clínico-patológicas no se detentan diferencias significativas en la SLPB a lo largo del tiempo para los diferentes grupos de riesgo de D’Amico (bajo, intermedio, alto) o para grupos categorizados según PSA (< o > 20 ng/ml) o estadio patológico pormenorizado (pT2, pT3) (tabla 2). Ahora bien, sí se observan diferencias significativas en la SLPB entre pacientes intervenidos antes o después de 1999 según el Gleason en el espécimen de prostatectomía (Gleason 2-6, p < 0,000; Gleason 7, p = 0,08; Gleason 8-10, p = 0,03) y según el estado de los márgenes quirúrgicos (negativos, p = 0,01; positivos, p < 0,000) (tabla 2).
Supervivencia libre de progresión bioquímica de las cohortes estratificada por diferentes variables (n = 1.132)
| Grupo 1 | Grupo 2 | p ≤ * | |
| 249 (22) | 883 (78) | ||
| PSA categorizado (ng/ml) | |||
| < 20 ng/ml | 74,1 ± 3,5 | 78,7 ± 1,6 | 0,7 |
| > 20 ng/ml | 39,7 ± 6,2 | 50,3 ± 6,4 | 0,5 |
| Grupos de riesgo (D’Amico) | |||
| Bajo riesgo | 86,5 ± 6,3 | 89 ± 2 | 0,5 |
| Riesgo intermedio | 74,1 ± 4,2 | 74,7 ± 2,3 | 0,4 |
| Alto riesgo | 41,2 ± 5,7 | 52,3 ± 4,3 | 0,2 |
| Estadio patológico | |||
| pT2 | 80,8 ± 5,7 | 84 ± 1,5 | 0,3 |
| pT3 | 39,8 ± 7,6 | 43,2 ± 6 | 0,6 |
| Margen quirúrgico negativo | 78,4 ± 3,4 | 85,8 ± 1,6 | 0,01 |
| Margen quirúrgico afectado | 36,5 ± 5,4 | 59,3 ± 3 | 0,000 |
| Afectación ganglionar | 59,9 ± 11,1 | 60,3 ± 10,3 | 0,7 |
| Gleason patológico | |||
| 2-6 | 73,4 ± 3,7 | 88,4 ± 1,6 | 0,000 |
| 7 | 61,8 ± 6,8 | 72,7 ± 3,2 | 0,08 |
| 8-10 | 28,2 ± 7,8 | 52 ± 4 | 0,03 |
Datos presentados como media ± DE o número (%) de 249 pacientes en grupo 1.
Datos presentados como media ± DE o número (%) de 883 pacientes en grupo 2.
Se han presentado los datos de supervivencia libre de progresión a 5 años.
En los últimos años se ha producido un cambio significativo en las características preoperatorias de los pacientes con cáncer de próstata tratados con prostatectomía radical. El resultado de este cambio ha sido la aparición de un nuevo perfil de paciente caracterizado por ser más joven, con enfermedad localizada y con niveles más bajos de PSA, lo que se traduce en términos pronósticos en un mejor control local de la enfermedad y de mejores tasas de supervivencia libre de progresión y cáncer-específica6–11.
Sin duda el PSA está en el origen de estos cambios. Su descubrimiento hizo posible el diagnóstico precoz y la posibilidad de tratamiento curativo que supusieron una progresiva universalización del método, un mayor número de pacientes diagnosticados, una aumento de la experiencia quirúrgica, la publicación de resultados, la mejoría en la sutileza diagnóstica y un claro aumento de la sensibilidad de la sociedad frente a la enfermedad. El resultado ha sido una progresiva migración hacia el diagnóstico en estadios clínico-patológicos más precoces6–11. La proporción de los tumores de alto riesgo ha disminuido significativamente. En un estudio con 8.600 pacientes la proporción de bajo riesgo era del 30% en 1.989-1.992 frente al 45% en 1.999-2.001. Además también han cambiado sus características. El determinante ha dejado de ser el PSA o el tacto rectal T3 y ha pasado a ser el índice de Gleason4,8–10. Simultáneamente ha habido un progresivo cambio de los criterios de gradación del Gleason hacia estadios más elevados12.
Todas estas observaciones se ponen en evidencia en la serie aquí analizada. Ahora bien, aunque a lo largo de 20 años ha ido cambiando el tipo de paciente intervenido solo se evidencian dos grupos si se utiliza como criterio de segregación la SLPB. La línea de separación confirma que son los 250 primeros (aquellos operados entre 1989 y 1999) los que presentan características significativamente, o en el límite de la significación estadística, peores en las principales variables clínico-patológicas. Este hecho ha sido puesto en evidencia igualmente en otras series4,8–10.
Se ha comprobado también una disminución en el diagnóstico de cáncer de próstata incidental (T1a, T1b), debido por un lado al control con tratamiento médico de los síntomas derivados del tracto urinario inferior en pacientes con hiperplasia de próstata y al mayor número de determinaciones de PSA realizadas en los pacientes con este tipo de sintomatología9,13. Estos hechos implican un crecimiento proporcional de los casos diagnosticados por elevación de PSA (T1c)14. Nuestra casuística muestra también una disminución del 6,8 al 1,5% en el diagnóstico de cáncer T1a-b entre ambas décadas. (p < 0,000). También se evidencia un fenómeno de migración patológica con tendencia hacia pT2, en consonancia con los resultados publicados por otros autores6,15–21. Este hecho implica una evidente mejora también en la expectativa global de supervivencia.
Resulta bastante llamativo el hecho de que tanto el Gleason patológico como los márgenes no sean significativamente diferentes entre los 2 grupos de nuestro estudio. Suponemos que se debe a la evolución en los criterios de calificación patológica con una tendencia a aumentar el Gleason, de manera que en la segunda época se califican como Gleason 7 pacientes que en la primera habrían sido calificados como Gleason 2-6. Este fenómeno de migración de grupos con trascendencia pronóstica, conocido como fenómeno de Will Rogers22, podría explicar el hecho de que la SLPB sea significativamente peor en los pacientes Gleason 2-6 del primer grupo frente a los pacientes Gleason 2-6 del segundo (p < 0,000). Otros autores tampoco encuentran diferencias en relación con el Gleason7. Sucede lo mismo cuando estudiamos los márgenes, puesto que no encontramos diferencias entre los 2 grupos (p = 0,6). De nuevo, la supervivencia de los pacientes con márgenes libres del primer grupo es significativamente peor que la de los mismos pacientes del segundo grupo (p < 0,000). Este hecho seguramente implique que los patólogos hayan afinado en el análisis de la pieza, por lo que resulta menos probable que pacientes con márgenes afectados sean hoy calificados como negativos.
Podemos decir entonces que nuestra práctica refleja solo 2 periodos con diferencias en el tipo de paciente tratado con prostatectomía radical. No ha sucedido un cambio lento y paulatino, porque en este caso probablemente habríamos encontrado más grupos diferentes o mayor heterogeneidad entre grupos. La explicación más razonable supone que hubo un cambio cualitativo en torno a 1999-2000, época en la que se produce una auténtica explosión en nuestro país en la determinación de PSA, tanto en medicina general como en análisis de empresa, y un aumento muy significativo en el número de pacientes diagnosticados8–10. De hecho, para completar el primer grupo de 250 pacientes operados fueron necesarios 10 años y solo 5 años para los 500 siguientes, manteniéndose a partir de entonces el ritmo constante, sin cambios.
El presente estudio analiza un número importante de pacientes y tiene un notable interés sociológico y médico porque en cierto modo refleja cómo se ha manejado el diagnóstico y tratamiento del cáncer de próstata localizado en los últimos 20 años en una institución que trata pacientes de toda la geografía española. En este sentido estos datos pueden suponer una aproximación al manejo de esta enfermedad en nuestro entorno cultural23, posiblemente diferente al de los países anglosajones o del norte de Europa.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.