Analizar las sobreinfecciones intrahospitalarias y su relación con la mortalidad en pacientes obesos o diabéticos con COVID-19 críticamente enfermos.
DiseñoAnalítico correlacional en una unidad de cuidados intensivos de la red pública de Barranquilla (Colombia) entre enero y diciembre de 2021.
PacientesPacientes con obesidad o diabetes mellitus tipo2 y neumonía por SARS-CoV-2 grave con requerimiento de cultivos de secreción bronquial, hemocultivos y urocultivos 48horas tras el ingreso.
MedicionesComparamos la presencia y la ausencia de sobreinfección mediante las pruebas U de Mann-Whitney, chi-cuadrado y Fischer. Para la evaluación de la mortalidad se empleó el método de Kaplan-Meier y se determinaron los riesgos de cocientes instantáneos.
ResultadosSe incluyeron 78 pacientes con edad mediana de 61años (51,5-67,8). La sobreinfección en obesos fue del 51,6% (n=16), y en diabéticos, del 61,3% (n=19). Al quinto día intrahospitalario incrementaron las sobreinfecciones intrahospitalarias. Un total de 31 microrganismos aislados: 16,1% grampositivos, 80,6% gramnegativos y 3,2% levaduras. La mortalidad general fue del 85,9% (n=67). La sobreinfección se asoció con un aumento en la mortalidad durante la estancia hospitalaria (HR: 1,89; IC95%: 1,13-3,15; p=0,015) y en la unidad de cuidados intensivos (HR: 1,72; IC95%: 1,02-2,89; p=0,040).
ConclusionesEn obesos o diabéticos críticamente enfermos la presencia de sobreinfecciones intrahospitalarias representa una complicación mortal durante la estancia hospitalaria; sin embargo, no se encontraron diferencias estadísticamente significativas entre la mortalidad asociada a la presencia o ausencia de sobreinfección.
To analyze hospital-acquired superinfections and their relationship with mortality in critically ill obese or diabetic patients with COVID-19.
DesignCorrelational analysis in an intensive care unit of the public network of Barranquilla (Colombia) between January and December 2021.
PatientsPatients with obesity or type2 diabetes mellitus and severe SARS-CoV-2 pneumonia requiring cultures of bronchial secretion, blood cultures, and urine cultures 48h after admission.
MeasurementsWe compared the presence and absence of superinfection using the Mann-Whitney U, Chi-square, and Fischer tests. To evaluate mortality, it was evaluated using the Kaplan-Meier method, and instantaneous ratio risks were determined.
ResultsSeventy-eight patients with a median age of 61years (51.5-67.8) were included. Superinfection in obese people was 51.6% (n=16) and diabetics 61.3% (n=19). On the fifth in-hospital day, in-hospital superinfections increased. A total of 31 microorganisms isolated: 16.1% gram-positive, 80.6% gram-negative and 3.2% yeast. Overall mortality was 85.9% (n=67). Superinfection was associated with an increase in mortality during the hospital stay (HR: 1.89; 95%CI: 1.13-3.15; P=.015) and in the intensive care unit (HR: 1.72; 95%CI: 1.02-2.89; P=.040).
ConclusionsIn critically ill obese or diabetic patients, the presence of in-hospital superinfections represents a fatal complication during the hospital stay; however, no statistically significant differences were found between mortality associated with the presence or absence of superinfection.
La pandemia causada por enfermedad por coronavirus 2019 (COVID-19) ha tenido un impacto inmediato y devastador en los sistemas de salud, generando una alta morbimortalidad en Latinoamérica1. Según la Organización Mundial de la Salud (OMS), se han notificado más de 91 millones de casos de COVID-19 en Latinoamérica y se han registrado 1.700.000 muertes aproximadamente2. En Colombia, hasta la revisión de este manuscrito (diciembre de 2023), según el Instituto Nacional de Salud, se han notificado 6.500.000 casos de COVID-19 y 142.000 muertes3. Los pacientes críticos con la COVID-19 requirieron una atención especial y recursos sanitarios adicionales4. Esto generó un cambio en la organización hospitalaria con sobrecarga de trabajo y personal de trabajo inexperto en la unidad de cuidados intensivos (UCI) que impactó en una respuesta eficaz y el riesgo de infecciones intrahospitalarias5.
Los pacientes hospitalizados con COVID-19 grave pueden experimentar infecciones adquiridas en el hospital6. Esto se debe a la capacidad deteriorada del huésped para eliminar patógenos microbianos debido a la respuesta excesiva de citocinas proinflamatorias, deterioro del sistema innato y ciertos mecanismos, independientemente de los fagocitos, que facilitan la sobreinfección7,8. Además, se genera un mayor consumo de terapia antimicrobiana que favorece la proliferación de microorganismos multi-drogorresistentes, lo que se asocia a una estancia hospitalaria prolongada y a una mayor mortalidad9,10.
Investigaciones en Colombia de pacientes COVID-19 críticamente enfermos han reportado que la incidencia de sobreinfección desarrollada después de las 48horas se sitúa entre el 10,7% y el 49,6%10,11. Sin embargo, en pacientes obesos o diabéticos existe poca evidencia de sobreinfección y se desconocen los desenlaces clínicos asociados en esta población infectada por SARS-CoV-2. Por lo anterior, nuestro objetivo fue analizar la presencia y la ausencia de sobreinfecciones intrahospitalarias y su relación con la mortalidad en pacientes obesos o diabéticos con COVID-19 críticamente enfermos.
Materiales y métodosDiseño de estudioRealizamos un estudio analítico correlacional en pacientes obesos o diabéticos con COVID-19 ingresados a una UCI de la red pública de Barranquilla (Colombia) con y sin sobreinfección intrahospitalaria (48horas posterior al ingreso hospitalario) entre enero y diciembre de 2021. Este estudio fue aprobado por el comité de ética de la institución (No. 10-2022; fecha: 16-10-2022). El consentimiento informado no se consideró necesario al ser el estudio de carácter retrospectivo.
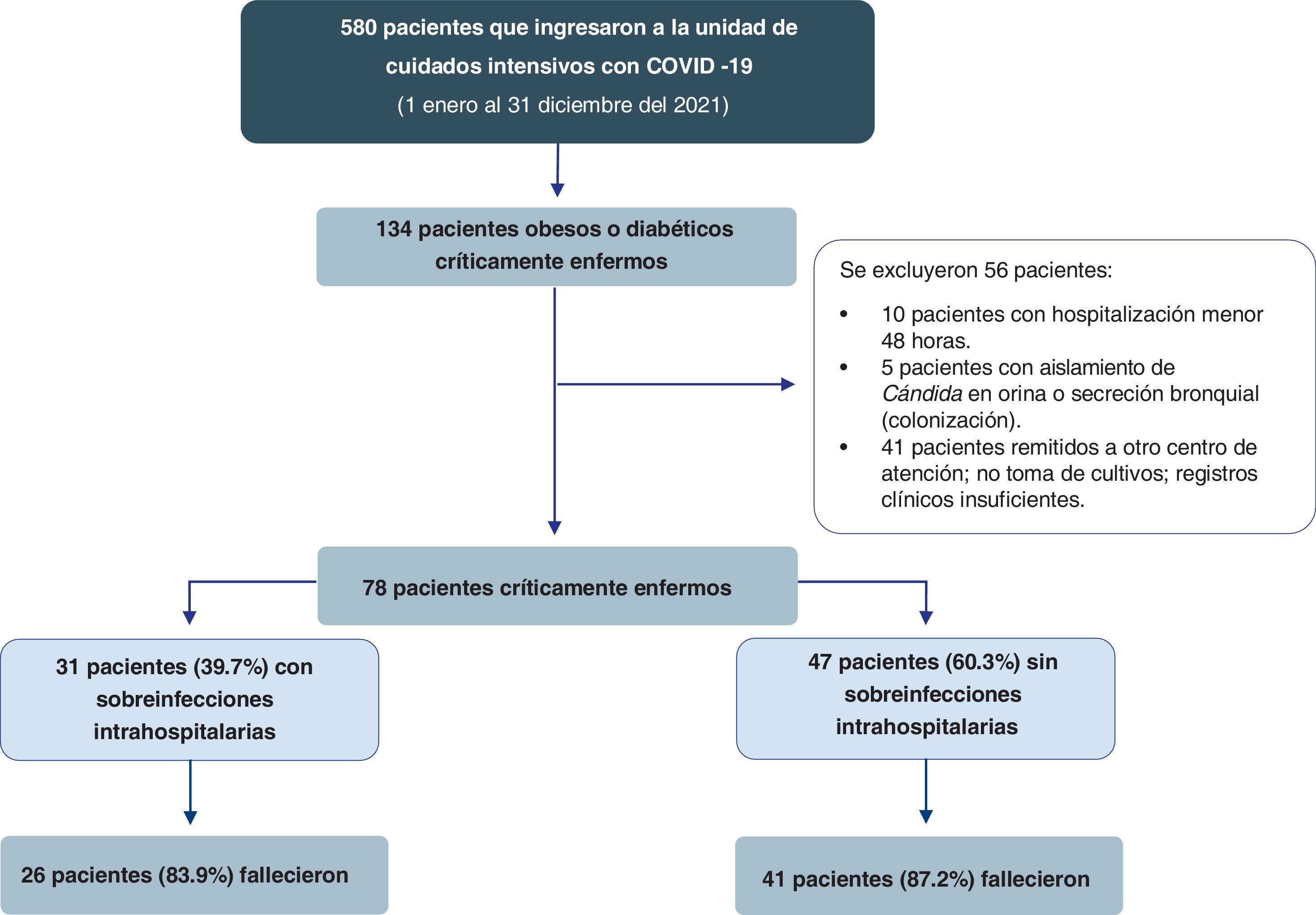
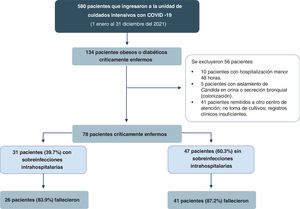
ParticipantesSe incluyeron pacientes con obesidad (índice de masa corporal [IMC] ≥30kg/m2) y diabetes mellitus tipo2 (antecedente clínico o reciente diagnóstico intrahospitalario según los criterios de la American Diabetes Association de 2021)12 con neumonía por SARS-CoV-2 grave en los que se realizaron muestras de cultivos de secreción bronquial, hemocultivos y urocultivos 48horas después del ingreso hospitalario a la UCI. Se excluyeron los pacientes con hospitalización menor a las 48horas, aislamiento de Candida en orina y secreción bronquial (colonización), remitidos a otro centro de atención y pacientes con registros clínicos insuficientes.
Una vez obtenidos nuestros pacientes, dividimos nuestra población en dos grupos teniendo en cuenta la presencia de sobreinfección (n=31) y no sobreinfección (n=47) según los reportes de las muestras de cultivos de secreción bronquial, hemocultivos y urocultivos.
VariablesLa información fue extraída del reporte microbiológico otorgado por el laboratorio institucional y las historias clínicas electrónicas de los pacientes después de la admisión. La información incluyó el reporte microbiológico de los cultivos (secreción bronquial, hemocultivo y urocultivo) acompañado del antibiograma, variables demográficas (edad, género, puntuación del Simplified Therapeutic Intervention Score System [TISS-28], Quick SOFA [qSOFA] y Acute Physiology And Chronic Health EvaluationII [APACHEII] en la admisión), antecedentes clínicos (pacientes con diabetes mellitus tipo2 con obesidad, hipertensión arterial crónica, enfermedad pulmonar obstructiva crónica [EPOC]), intervenciones (uso de vasopresor, oxígeno de alto flujo y ventilación mecánica invasiva), condiciones clínicas (eventos cardiovascular [infarto agudo de miocardio y accidente cerebrovascular] y lesión renal aguda) y desenlaces clínicos (días de estancia hospitalaria, ventilación mecánica invasiva [VMI], necesidad de terapia de reemplazo renal [TRR] y mortalidad).
Dentro de las variables de laboratorio al ingreso a la UCI se evaluaron los niveles de lactato deshidrogenasa (U/l), los de ferritina (ng/ml) y el índice neutrófilos-linfocitos y dímeroD (ng/ml). También se incluyó el uso de terapia antibiótica y corticoides, con sus respectivos tiempos de consumo.
Aspectos microbiológicosLa infección por SARS-CoV-2 se confirmó con el reporte positivo mediante la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) realizada de un hisopo nasofaríngeo o secreciones del tracto respiratorio inferior si el paciente se encontraba en VMI. Las sobreinfecciones que ocurrieron 48horas después de la admisión se clasificaron como neumonía asociada al ventilador (NAV), infección del tracto urinario asociada al catéter (ITUc) e infección del torrente sanguíneo (ITS), de acuerdo con las definiciones de Centers for Disease Control and Prevention13-15. En todos nuestros pacientes se aplicó el paquete de medidas intrahospitalarias para la prevención de infecciones asociadas a la atención en salud (tabla suplementaria 1).
Los cultivos fueron tomados cuando existía sospecha clínica de sobreinfección bacteriana y fúngica (SOFA>2 puntos, aumento de marcadores inflamatorios, deterioro ventilatorio, cambios imagenológicos sugestivos de infección pulmonar [patrón no característico de COVID-19, asociado a consolidados, nódulos y derrame pleural]). Las muestras respiratorias de aspirado, secreción bronquial y muestras urinarias se consideraron positivas si presentaban aislamiento microbiano de al menos un microorganismo con un recuento mayor a 100.000UFC/ml. La bacteriemia se definió por el crecimiento de una flora comensal no cutánea en uno o más hemocultivos; en las causadas por microorganismos colonizadores comunes de la piel se definió si presentaban dos o más hemocultivos extraídos de diferentes sitios. Las infecciones fúngicas incluidas en el estudio fueron las reportadas en cultivos hematológicos. Los resultados de los cultivos fueron revisados por un intensivista y un microbiólogo para excluir resultados con contaminación o colonización. Todas las muestras de cultivos fueron tomadas después de las primeras 48horas de ingreso a la UCI.
Análisis estadísticoPara el análisis de las variables cuantitativas se aplicó la prueba de Shapiro Wilk y se describieron como medianas y rangos intercuartílicos (RIQ). Con respecto a las variables categóricas, se expresaron en distribución porcentual y frecuencias absolutas. Para la comparación entre grupos (sobreinfección vs no sobreinfección) se analizaron mediante la prueba U de Mann-Whitney para comparar las variables continuas, y mediante la prueba de chi-cuadrado o exacta de Fischer para las variables categóricas. El análisis bivariado del resultado principal (mortalidad) se realizó mediante el método de Kaplan-Meier, y las comparaciones se realizaron mediante la prueba de rango logarítmico. Se calcularon los cocientes de riesgos instantáneos (HR) ajustados y sus intervalos de confianza (IC) del 95%. Todos los análisis se realizaron con software jamovi 2.2.5 solid y el software GraphPad Prism versión 8.0.0 para Windows (GraphPad Software, San Diego, California, EE.UU.). Un valor de p menor 0,05 se consideró estadísticamente significativo.
ResultadosEntre enero y diciembre del 2021 se identificó un total de 580 pacientes con COVID-19 críticamente enfermos que ingresaron a la UCI. Se encontraron 134 pacientes obesos o diabéticos críticamente, y luego de aplicar los criterios de exclusión se tomaron finalmente 78 pacientes, de los cuales el 39,7% (n=31) adquirieron una sobreinfección intrahospitalaria durante la estancia en la UCI (fig. 1).
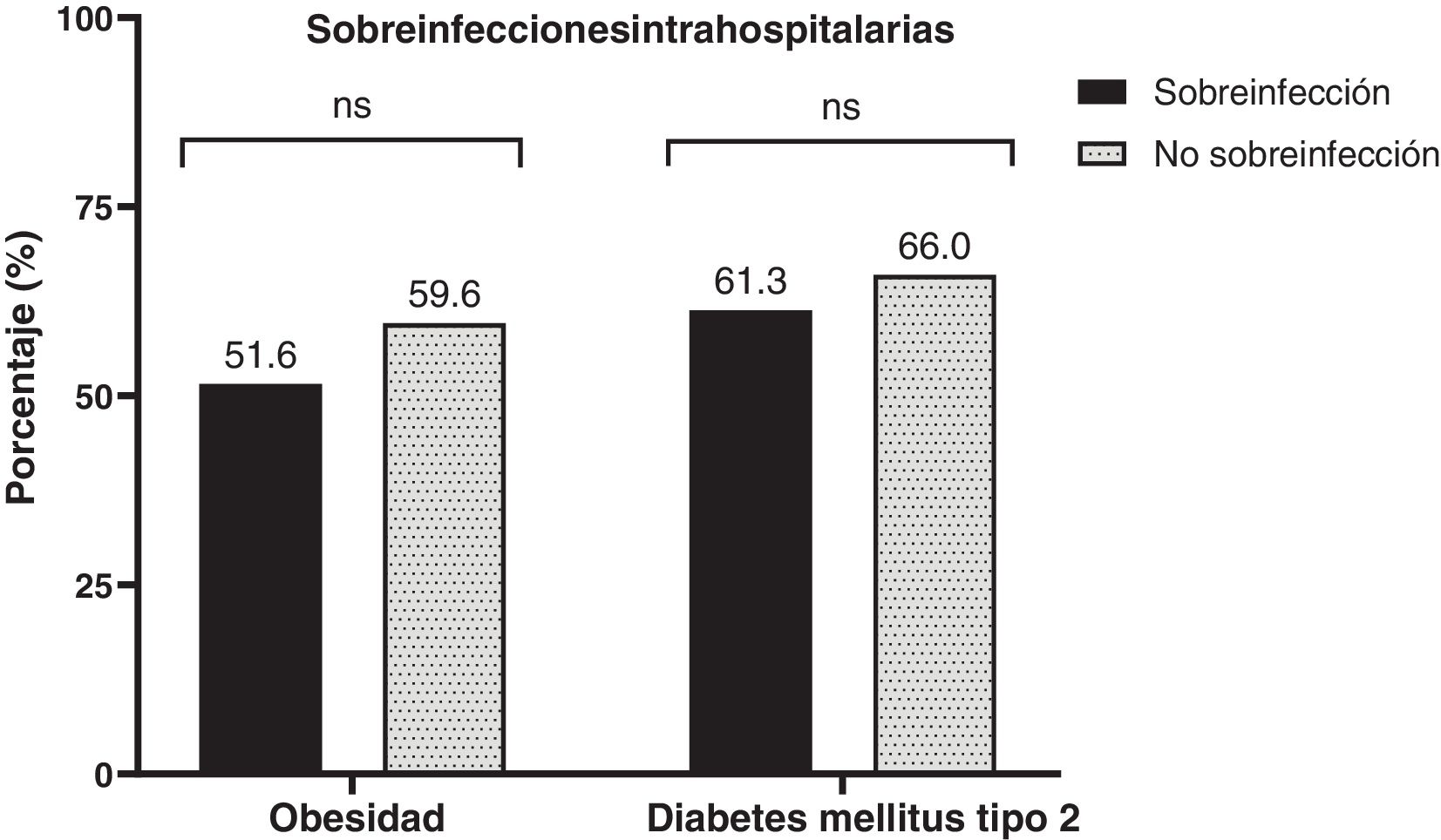
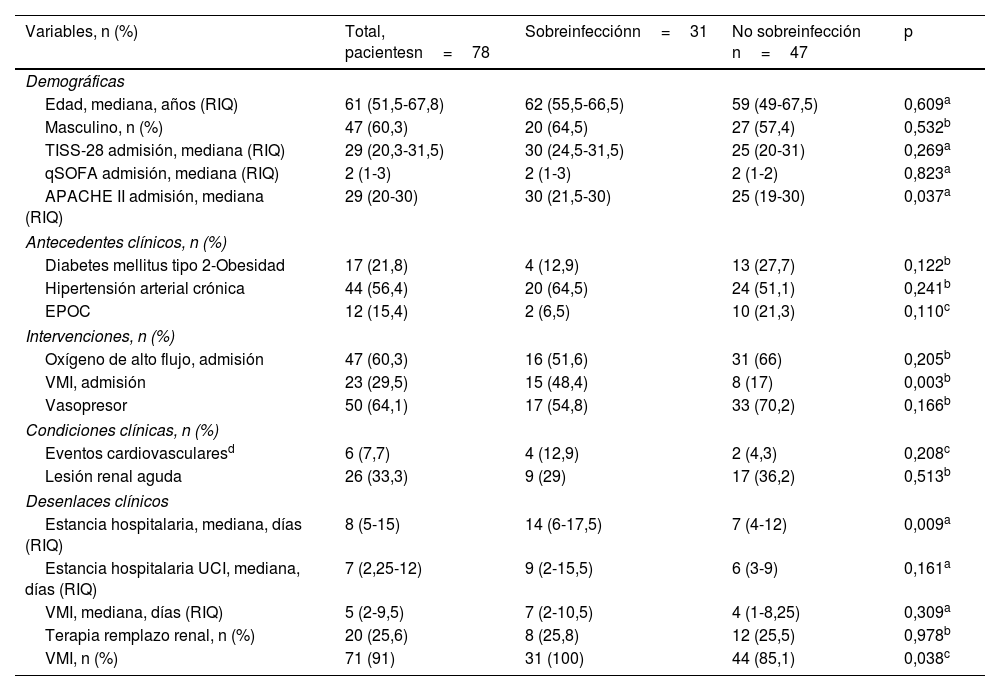
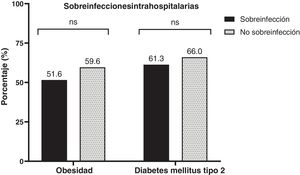
En la tabla 1 se describen las características iniciales de ambos grupos (sobreinfección vs no sobreinfección). En nuestra población la mediana de edad fue de 61 (51,5-67,8) años, con predominio masculino 60,3% (n=47). La puntuación del APACHEII fue más alta en pacientes con sobreinfección (30 [RIQ: 21,5-30] puntos vs 25 [RIQ: 19-30] puntos; p=0,037). El antecedente de hipertensión arterial crónica fue más frecuente (56,4% [n=44]). La frecuencia de sobreinfección en pacientes obesos es del 51,6% (n=16), y en los diabéticos, del 61,3% (n=19) (fig. 2). Al ingreso, los sobreinfectados tenían mayor necesidad de VMI dentro de las primeras 24horas (15/31 [58,4%] pacientes vs 8/47 [17%] pacientes; p=0,003) y de mayor estancia hospitalaria (14 [RIQ: 6-17,5] días vs 7 [RIQ: 4-12] días; p=0,009). No encontramos cambios significativos entre los grupos en los valores de estancia hospitalaria en UCI, días de VMI y necesidad de TRR (tabla 1).
Características demográficas y clínicas de los pacientes con o sin sobreinfecciones intrahospitalarias
| Variables, n (%) | Total, pacientesn=78 | Sobreinfecciónn=31 | No sobreinfección n=47 | p |
|---|---|---|---|---|
| Demográficas | ||||
| Edad, mediana, años (RIQ) | 61 (51,5-67,8) | 62 (55,5-66,5) | 59 (49-67,5) | 0,609a |
| Masculino, n (%) | 47 (60,3) | 20 (64,5) | 27 (57,4) | 0,532b |
| TISS-28 admisión, mediana (RIQ) | 29 (20,3-31,5) | 30 (24,5-31,5) | 25 (20-31) | 0,269a |
| qSOFA admisión, mediana (RIQ) | 2 (1-3) | 2 (1-3) | 2 (1-2) | 0,823a |
| APACHE II admisión, mediana (RIQ) | 29 (20-30) | 30 (21,5-30) | 25 (19-30) | 0,037a |
| Antecedentes clínicos, n (%) | ||||
| Diabetes mellitus tipo 2-Obesidad | 17 (21,8) | 4 (12,9) | 13 (27,7) | 0,122b |
| Hipertensión arterial crónica | 44 (56,4) | 20 (64,5) | 24 (51,1) | 0,241b |
| EPOC | 12 (15,4) | 2 (6,5) | 10 (21,3) | 0,110c |
| Intervenciones, n (%) | ||||
| Oxígeno de alto flujo, admisión | 47 (60,3) | 16 (51,6) | 31 (66) | 0,205b |
| VMI, admisión | 23 (29,5) | 15 (48,4) | 8 (17) | 0,003b |
| Vasopresor | 50 (64,1) | 17 (54,8) | 33 (70,2) | 0,166b |
| Condiciones clínicas, n (%) | ||||
| Eventos cardiovascularesd | 6 (7,7) | 4 (12,9) | 2 (4,3) | 0,208c |
| Lesión renal aguda | 26 (33,3) | 9 (29) | 17 (36,2) | 0,513b |
| Desenlaces clínicos | ||||
| Estancia hospitalaria, mediana, días (RIQ) | 8 (5-15) | 14 (6-17,5) | 7 (4-12) | 0,009a |
| Estancia hospitalaria UCI, mediana, días (RIQ) | 7 (2,25-12) | 9 (2-15,5) | 6 (3-9) | 0,161a |
| VMI, mediana, días (RIQ) | 5 (2-9,5) | 7 (2-10,5) | 4 (1-8,25) | 0,309a |
| Terapia remplazo renal, n (%) | 20 (25,6) | 8 (25,8) | 12 (25,5) | 0,978b |
| VMI, n (%) | 71 (91) | 31 (100) | 44 (85,1) | 0,038c |
APACHE II: Acute Physiology And Chronic Health EvaluationII; EPOC: enfermedad pulmonar obstructiva crónica; qSOFA: Quick SOFA; RIQ: rango intercuartílico; TISS-28: Simplified Therapeutic Intervention Score System; VMI: ventilación mecánica invasiva.
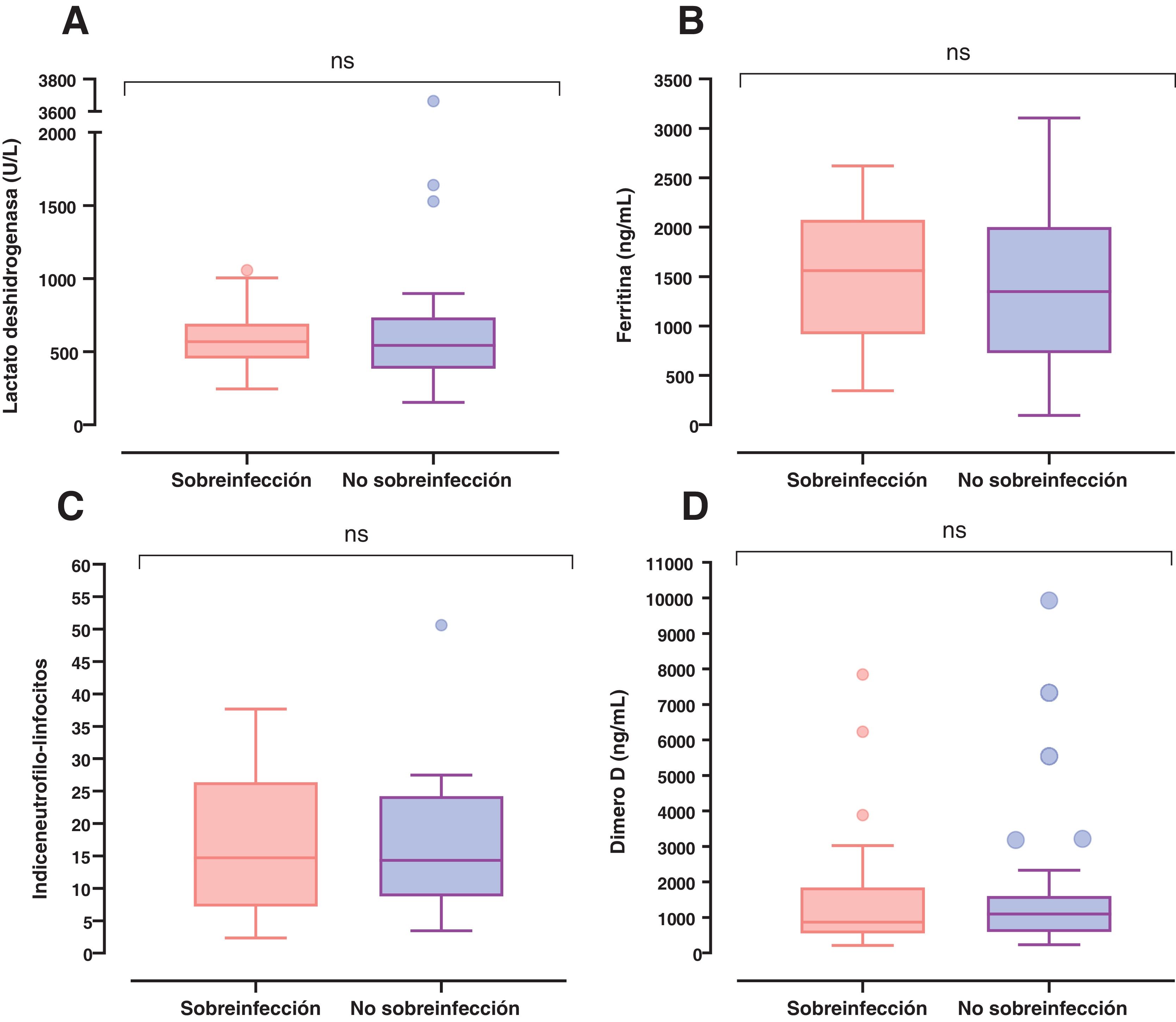
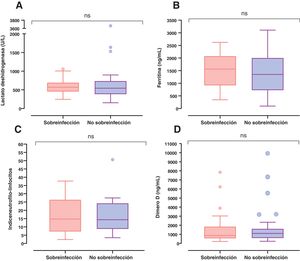
Después del día 5 de estancia hospitalaria se presentó un incremento del número de sobreinfecciones adquiridas en el hospital asociadas a NAV e ITS, teniendo un pico máximo los días 25 y 18, respectivamente (figura suplementaria 1). Al ingreso a la UCI los sobreinfectados tenían niveles más elevados de lactato deshidrogenasa, de ferritina y de la relación índice neutrófilos-linfocitos. Sin embargo, no se encontraron diferencias significativas entre estos grupos (fig. 3).
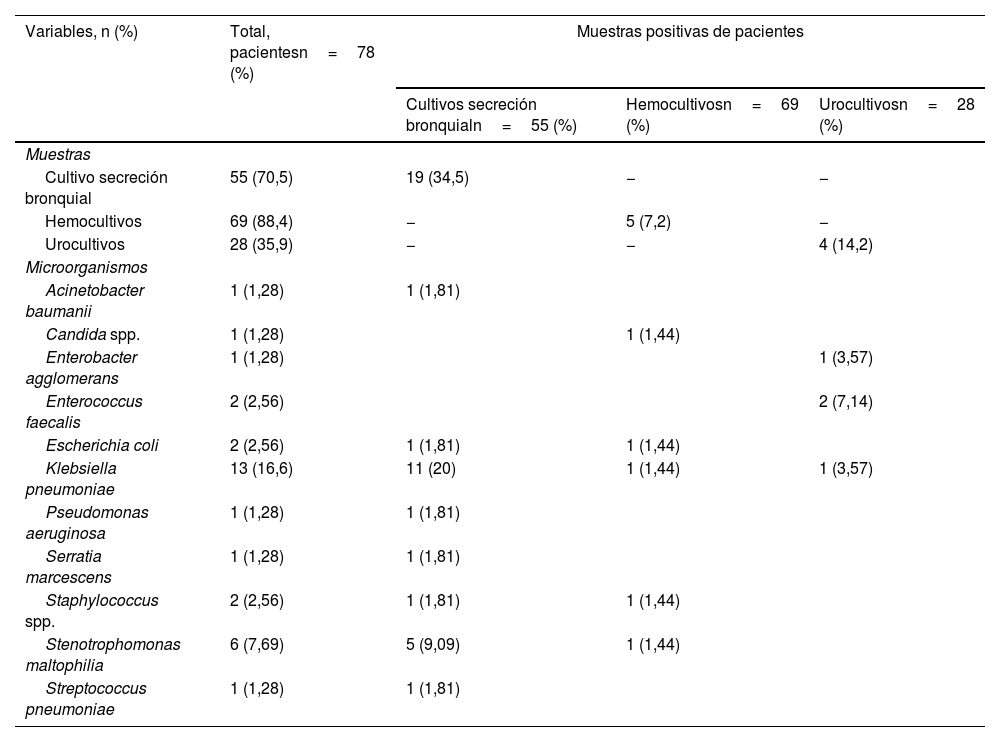
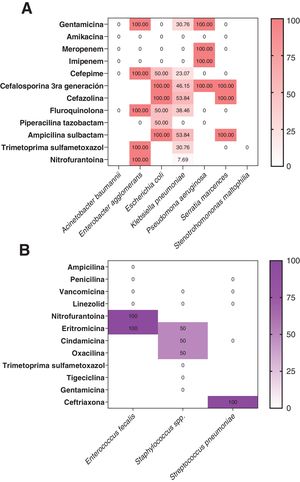
La proporción de patógenos fue significativamente mayor en NAV (34,5% [n=19]) e ITUc (14,2% [n=4]), como se evidencia en la tabla 2. Se identificaron un total de 31 microrganismos (5/31 [16,1%] grampositivos, 25/31 [80,6%] gramnegativos y 1/31 [3,2%] hongos) aislados como patógenos causantes de sobreinfecciones intrahospitalarias. Los patógenos grampositivos más comunes aislados fueron Staphylococcus spp. (6,45% [n=2]) y Enterococcus faecalis (6,45% [n=2]). Los patógenos gramnegativos identificados más frecuentes fueron Klebsiella pneumoniae (41,9% [n=13]) y Stenotrophomonas maltophilia (19,3% [n=6]) (tabla 2).
Descripción de los aislamientos microbianos en cultivos de secreción bronquial, hemocultivos y urocultivos en pacientes obesos y diabéticos con COVID-19
| Variables, n (%) | Total, pacientesn=78 (%) | Muestras positivas de pacientes | ||
|---|---|---|---|---|
| Cultivos secreción bronquialn=55 (%) | Hemocultivosn=69 (%) | Urocultivosn=28 (%) | ||
| Muestras | ||||
| Cultivo secreción bronquial | 55 (70,5) | 19 (34,5) | − | − |
| Hemocultivos | 69 (88,4) | − | 5 (7,2) | − |
| Urocultivos | 28 (35,9) | − | − | 4 (14,2) |
| Microorganismos | ||||
| Acinetobacter baumanii | 1 (1,28) | 1 (1,81) | ||
| Candida spp. | 1 (1,28) | 1 (1,44) | ||
| Enterobacter agglomerans | 1 (1,28) | 1 (3,57) | ||
| Enterococcus faecalis | 2 (2,56) | 2 (7,14) | ||
| Escherichia coli | 2 (2,56) | 1 (1,81) | 1 (1,44) | |
| Klebsiella pneumoniae | 13 (16,6) | 11 (20) | 1 (1,44) | 1 (3,57) |
| Pseudomonas aeruginosa | 1 (1,28) | 1 (1,81) | ||
| Serratia marcescens | 1 (1,28) | 1 (1,81) | ||
| Staphylococcus spp. | 2 (2,56) | 1 (1,81) | 1 (1,44) | |
| Stenotrophomonas maltophilia | 6 (7,69) | 5 (9,09) | 1 (1,44) | |
| Streptococcus pneumoniae | 1 (1,28) | 1 (1,81) | ||
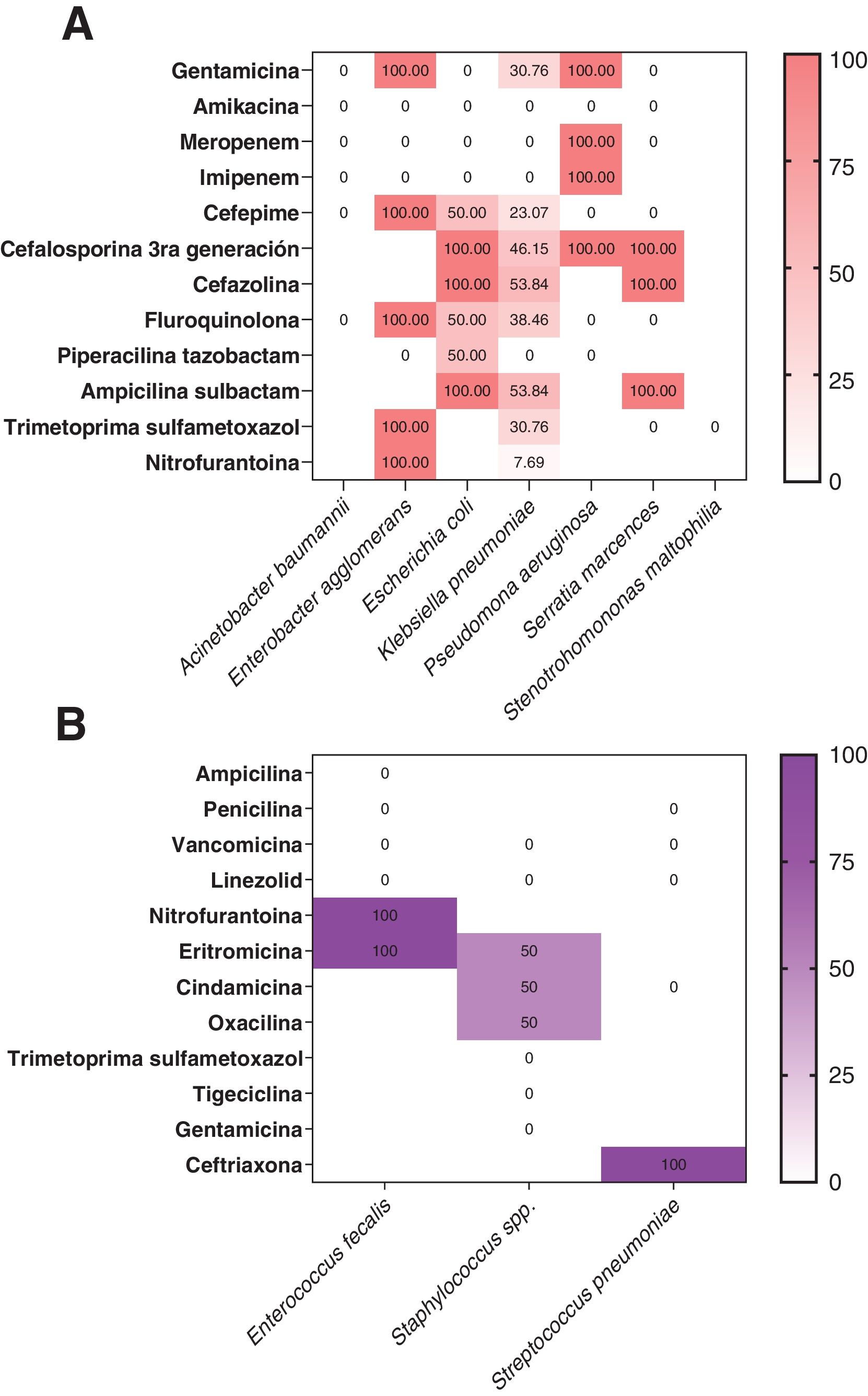
En la figura 4 se observa que el porcentaje de resistencia a los antimicrobianos fue mayor en microorganismos gramnegativos que en aquellos pacientes con aislamientos de microorganismos grampositivos. La tendencia de los datos evidenció que las cefalosporinas de tercera generación y otras cefalosporinas fueron los grupos de fármacos con más resistencia entre los microorganismos (fig. 4A).
Frecuencia relativa (%) de resistencia a los antimicrobianos de los patógenos bacterianos identificados según la evaluación de las pruebas de susceptibilidad de rutina. A)Identificación de patógenos gramnegativos y su resistencia antibiótica según reporte de antibiograma. B)Identificación de patógenos grampositivos y su resistencia antibiótica según reporte de antibiograma.
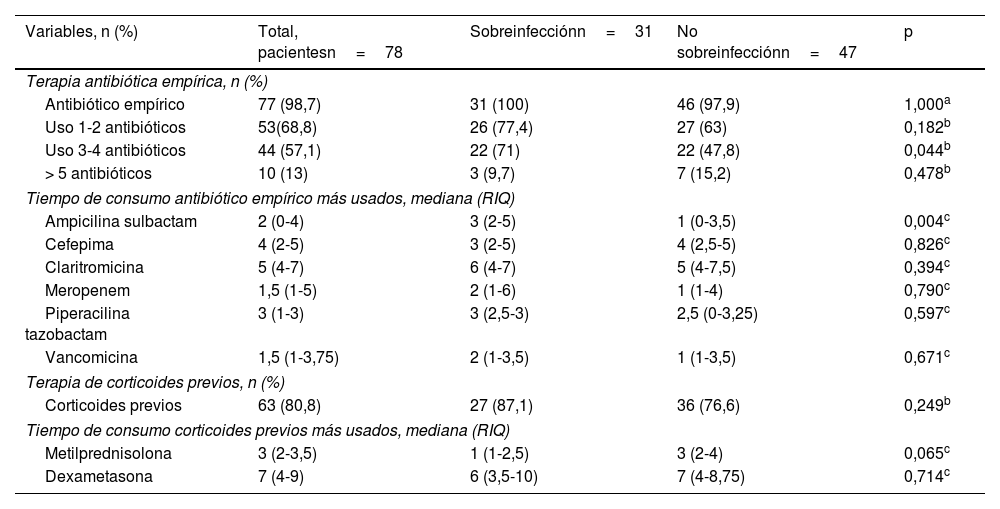
En la tabla 3 se observa que la frecuencia de uso antibiótico empírico en la población fue del 98,7% (n=77). La proporción del uso de 3 a 4 antibióticos fue mayor en los pacientes sobreinfectados (22/31 [71%] pacientes vs 22/47 [47,8%] pacientes; p=0,044). La mediana del tiempo de consumo de terapia antibiótica empírica fue mayor con la claritromicina (5 [RIQ: 4-7] días); sin embargo, no se encontraron diferencias significativas. En los sobreinfectados el tiempo de consumo de ampicilina sulbactam fue elevado (3 [RIQ: 2-5] días vs 1 [RIQ: 0-3,5] días; p=0,004). No encontramos cambios significativos entre grupos con respecto al uso y al tiempo de consumo de corticoides previos al aislamiento microbiano (tabla 3).
Uso de terapia antimicrobiana empírica y corticoides previos asociada a la presencia de sobreinfecciones intrahospitalarias
| Variables, n (%) | Total, pacientesn=78 | Sobreinfecciónn=31 | No sobreinfecciónn=47 | p |
|---|---|---|---|---|
| Terapia antibiótica empírica, n (%) | ||||
| Antibiótico empírico | 77 (98,7) | 31 (100) | 46 (97,9) | 1,000a |
| Uso 1-2 antibióticos | 53(68,8) | 26 (77,4) | 27 (63) | 0,182b |
| Uso 3-4 antibióticos | 44 (57,1) | 22 (71) | 22 (47,8) | 0,044b |
| > 5 antibióticos | 10 (13) | 3 (9,7) | 7 (15,2) | 0,478b |
| Tiempo de consumo antibiótico empírico más usados, mediana (RIQ) | ||||
| Ampicilina sulbactam | 2 (0-4) | 3 (2-5) | 1 (0-3,5) | 0,004c |
| Cefepima | 4 (2-5) | 3 (2-5) | 4 (2,5-5) | 0,826c |
| Claritromicina | 5 (4-7) | 6 (4-7) | 5 (4-7,5) | 0,394c |
| Meropenem | 1,5 (1-5) | 2 (1-6) | 1 (1-4) | 0,790c |
| Piperacilina tazobactam | 3 (1-3) | 3 (2,5-3) | 2,5 (0-3,25) | 0,597c |
| Vancomicina | 1,5 (1-3,75) | 2 (1-3,5) | 1 (1-3,5) | 0,671c |
| Terapia de corticoides previos, n (%) | ||||
| Corticoides previos | 63 (80,8) | 27 (87,1) | 36 (76,6) | 0,249b |
| Tiempo de consumo corticoides previos más usados, mediana (RIQ) | ||||
| Metilprednisolona | 3 (2-3,5) | 1 (1-2,5) | 3 (2-4) | 0,065c |
| Dexametasona | 7 (4-9) | 6 (3,5-10) | 7 (4-8,75) | 0,714c |
RIQ: rango intercuartílico.
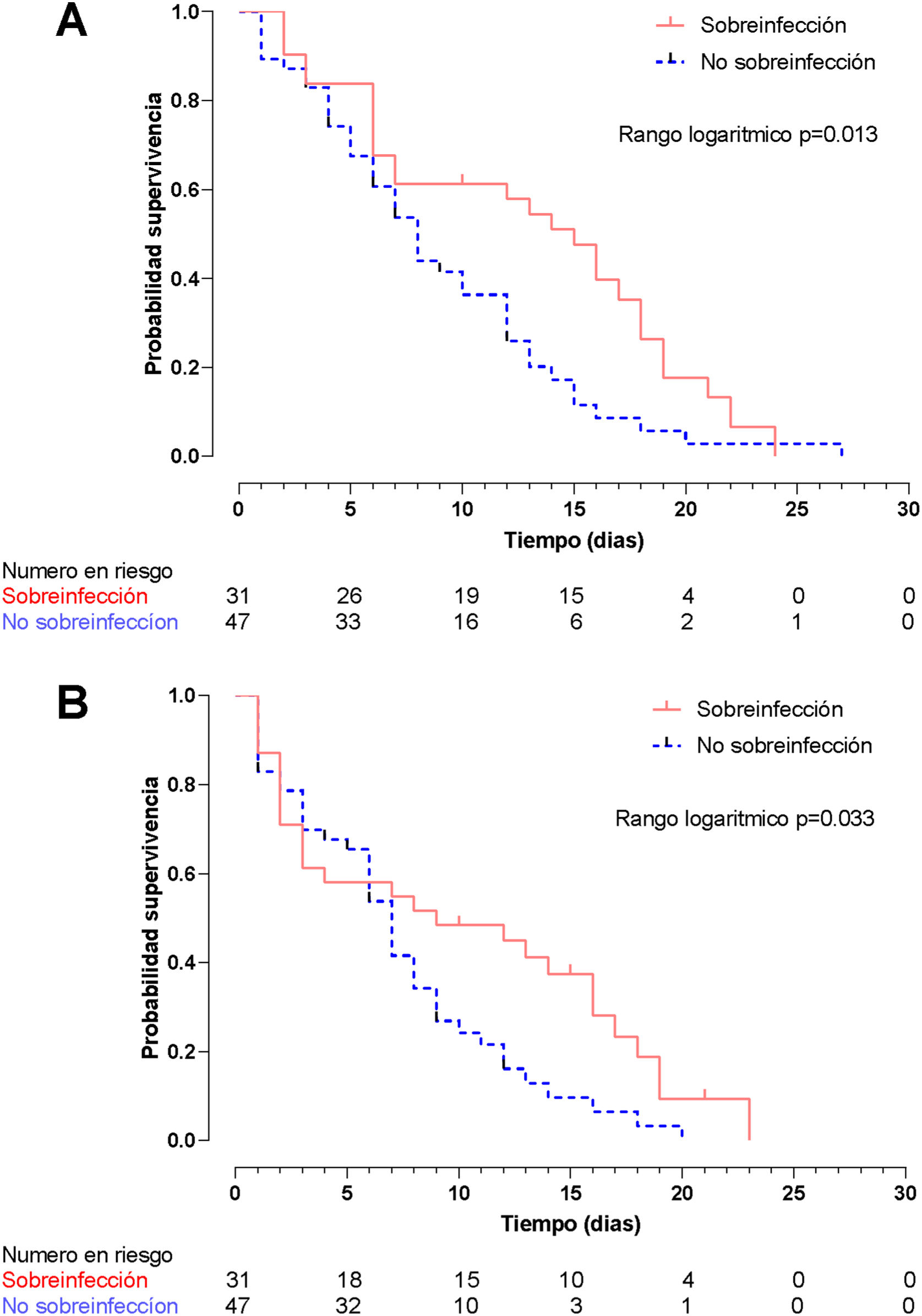
La muerte hospitalaria fue del 85,9% (n=67); sin embargo, no se encontraron diferencias estadísticamente significativas entre la presencia o la ausencia de sobreinfección (26/31 [83,9%] pacientes vs 41/47 [87,2%] pacientes; p=0,676). En pacientes sobreinfectados la mortalidad al día 7 fue del 45,2% (n=14), al día 14 del 16,1% (n=5) y al día 28 del 22,6% (n=7).
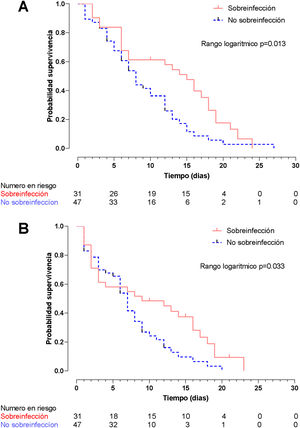
El método de Kaplan-Meier mediante la prueba de rangos logarítmicos encontró una diferencia significativa en la supervivencia hospitalaria (fig. 5A) y la supervivencia en la UCI (fig. 5B) entre pacientes sobreinfectados y no sobreinfectados (p=0,013 y p=0,033, respectivamente). En el análisis univariado la sobreinfección se asoció con un aumento en la mortalidad durante la estancia hospitalaria (HR: 1,89; IC95%: 1,13-3,15; p=0,015) y de la UCI (HR: 1,72; IC95%: 1,02-2,89; p=0,040).
DiscusiónNuestros resultados reportaron que la prevalencia de sobreinfección intrahospitalaria fue baja en pacientes obesos y diabéticos críticamente enfermos. Además, la sobreinfección intrahospitalaria se asoció con un aumento en la mortalidad durante la estancia hospitalaria y de la UCI. Sin embargo, no se encontraron diferencias estadísticamente significativas entre la mortalidad asociada a la presencia o ausencia de sobreinfección. Por otro lado, algunos hallazgos clínicos, como el APACHEII en la admisión, la necesidad de VMI, la estancia hospitalaria prolongada y un mayor tiempo de consumo de ampicilina sulbactam, se relacionan con la presencia de sobreinfección.
La tasa de sobreinfección intrahospitalaria en el estudio fue heterogénea comparada con la literatura. En un metaanálisis de pacientes con COVID-19 en estado crítico publicado por Musuuza et al.16 se encontró una prevalencia de sobreinfección del 41%, con una mayor tasa de VMI y de comorbilidades. Huang et al.6, Yoon et al.17 y Novacescu et al.18 encontraron una prevalencia de sobreinfección baja en pacientes obesos y diabéticos en comparación con nuestros datos. Sin embargo, en el estudio publicado por Iacovelli et al.19 las pacientes con diabetes mellitus tuvieron una mayor tasa de sobreinfección. Esta variabilidad en las tasas puede explicarse por la gravedad de las enfermedades subyacentes, el número de muestras tomadas y la estancia hospitalaria. Por otro lado, Solís et al.20 reportaron que la presencia de obesidad, pero no la diabetes, se asoció de forma independiente con la presencia de infecciones intrahospitalarias. De manera similar, la obesidad y la diabetes mellitus se asociaron con un mayor riesgo de infección secundaria en pacientes con COVID-1921. Estos resultados contrastan con lo hallado en nuestra cohorte. No obstante, los estudios que examinan los datos de sobreinfecciones y comorbilidades como la obesidad y la diabetes en pacientes con COVID-19 críticamente enfermos son limitados. Por lo tanto, se recomienda el fortalecimiento de la epidemiología en Latinoamérica y la realización de estudios analíticos.
La gravedad de la COVID-19 se podría explicar en parte por la asociación entre las condiciones críticas y la presencia de sobreinfección19. Algunos estudios han documentado que los pacientes con sobreinfección presentan un score APACHEII en la admisión superior a 20puntos17,22. No obstante, en estudios realizados en Corea del Sur17 y en Italia23 sobre los niveles de APACHEII en la admisión no se encontró diferencia significativa con la presencia o ausencia de sobreinfección. Esto difiere a lo encontrado en nuestros hallazgos, donde niveles de APACHEII superior a 30puntos se relacionan con la presencia de sobreinfección en pacientes obesos o diabéticos.
Entre los distintos tipos de sobreinfecciones adquiridas en el hospital de nuestro trabajo, la NAV fue la más común en pacientes diabéticos y obesos con COVID-19. Los aislamientos microbianos más frecuentes fueron de K.pneumoniae, lo que es similar a lo informado en cohortes de Latinoamérica11,24. No obstante, en un metaanálisis donde incluyeron 25 estudios difieren de nuestros resultados, debido que el desarrollo de NAV fue más frecuente por Staphylococcus aureus y Pseudomonas aeruginosa25. Por otro lado, S.maltophilia fue el segundo microorganismo más frecuente asociado a NAV. Estos hallazgos son consistentes por Huang et al.6 y Algarín et al.11. Además, la presencia de S.maltophilia puede exhibir múltiples fenotipos de resistencia antimicrobiana, limitando la efectividad de la terapia antibiótica existente, con el riesgo de muerte26-28. Aunque en nuestro trabajo no se informó de la duración de la VMI con la presencia de NAV, algunos autores en pacientes con COVID-19 encontraron valores que varían entre 8 a 12días después de la intubación5,29. Por lo tanto, se recomienda la realización de estudios prospectivos para analizar la duración en la región.
En general, las bacterias gramnegativas representaron los agentes causales más frecuentes de las infecciones en nuestros pacientes, y particularmente por K.pneumoniae. Curiosamente, K.pneumoniae mostró un alto perfil de resistencia a cefalosporinas de tercera y cuarta generación. Ergen et al.30 detectaron la presencia de betalactamasas acompañadas de cepas resistentes a carbapenémicos, lo que restringía las opciones terapéuticas. La detección de estas cepas resistentes no solo afecta el pronóstico de los pacientes, sino que también aumenta los costos de hospitalización y el riesgo de mortalidad31. En una revisión realizada por García-Vidal et al.32 se demostró que P.aeruginosa y Escherichia coli fueron los patógenos bacterianos causantes de sobreinfección más frecuentes. Además, este mismo informe reportó un tiempo promedio desde el ingreso hospitalario al momento de la presencia de sobreinfección de 10,6 (6,6) días32, muy inferior al de nuestros hallazgos.
Se han propuesto varios factores para explicar la presencia de sobreinfecciones adquiridas en el hospital, incluidos la enfermedad y el deterioro inmunitario inducido por la VMI prolongada, uso de terapia empírica de amplio espectro y no adherencia del paquete para la prevención de infecciones asociadas a la atención en salud33. El uso de esteroides sistémicos en pacientes con COVID-19 moderado y grave mejoran la supervivencia1,34. Sin embargo, algunos estudios han encontrado que el uso de terapia inmunosupresora (dexametasona) aumenta el riesgo de sobreinfección pulmonar bacteriana y NAV11,35. En un estudio realizado en Taiwán por Huang et al.6 el uso de esteroides demostró ser un factor predictivo de infecciones adquiridas en el hospital. Esto difiere a lo publicado en una cohorte de Rumania18, Italia19 y lo encontrado en nuestro trabajo en pacientes con obesidad y diabetes. Por otro lado, muchos sistemas de salud carecían de personal suficiente y no podían dar una respuesta eficaz a la pandemia5. Schwab et al.36 detectaron una asociación negativa lineal entre la proporción enfermera-paciente ventilado y el riesgo de aparición de infecciones nosocomiales.
En pacientes con neumonía grave por SARS-CoV-2 la OMS37 y la Surviving Sepsis Campaign38 recomiendan el uso de terapia empírica con antimicrobianos. Sin embargo, la brecha entre la prevalencia de sobreinfección y la frecuencia de prescripción de antimicrobianos resalta la posibilidad de un uso excesivo de antibióticos en los pacientes críticamente enfermos con COVID-1939. En nuestra cohorte, en más del 90% de los pacientes se prescribió terapia antibiótica empírica. Estos hallazgos son consistentes con lo publicado por Langford et al.39 y Musuuza et al.16, donde la tasa de prescripción de antibiótico reportadas fue desproporcionadamente alta en comparación con la prevalencia de sobreinfección en la UCI. Rawson et al.40 reportaron que el 72% de los pacientes hospitalizados con COVID-19 recibieron terapia antibiótica empírica para prevenir sobreinfecciones bacterianas. Este uso excesivo ha generado una menor eficacia de los programas de administración de antimicrobianos y un impacto adicional en la resistencia de antibióticos41. Por lo tanto, nuestros hallazgos resaltan la importancia de discernir en la práctica médica la administración racional de antimicrobianos para la prevención y el control de sobreinfección en pacientes críticamente enfermos.
Las sobreinfecciones secundarias en pacientes con COVID-19 y su relación con la mortalidad también han sido una consideración relevante desde el inicio de la pandemia. Publicaciones recientes han encontrado que el aumento de la tasa de sobreinfección se asoció con mayores probabilidades de muerte6,16,18,19. La prevalencia de las sobreinfecciones puede alcanzar hasta el 50% en pacientes que no sobreviven20. Esta premisa es similar a nuestros datos, donde se encontró una alta tasa de mortalidad en pacientes con sobreinfección intrahospitalaria en diabetes y obesos críticamente enfermos. Además, en nuestra cohorte la estancia hospitalaria general y en la UCI en pacientes coinfectados se asoció con una menor probabilidad de supervivencia. Sin embargo, es difícil identificar la verdadera causa de muerte, debido a que puede ser multifactorial, asociada a la gravedad del COVID-19, el uso de dispositivos médicos, las enfermedades subyacentes y estancia prolongada, que podrían desempeñar un papel significativo en el riesgo de mortalidad30.
Este estudio tiene algunas limitaciones, que incluyen la naturaleza retrospectiva y la recopilación de información de un centro de atención con un número limitado de pacientes que puede afectar el análisis de los resultados. Además, los análisis microbiológicos no se realizaron de forma sistemática sino en pacientes con sospecha clínica de infección a criterios médicos. Sin embargo, dentro de las fortalezas, este estudio contribuirá a llenar un vacío de datos en la región norte de Colombia de sobreinfecciones intrahospitalarias en pacientes obesos y diabéticos críticamente enfermos.
ConclusiónEn pacientes obesos y diabéticos la presencia de sobreinfecciones adquiridas en el hospital representa una complicación mortal durante la estancia hospitalaria. Por lo tanto, se deben fortalecer los programas de prevención de infecciones intrahospitalarias para minimizar el riesgo de estas infecciones y evitar desenlaces graves, principalmente en pacientes con APACHEII elevado, VMI y estancia hospitalaria prolongada. Además, se debe contar con programas de contingencia para manejar eventos de salud pública que impactan a nivel local, nacional e internacional que garanticen el recurso humano y tecnológico idóneo para la aplicación de las medidas de prevención y manejo en las sobreinfecciones intrahospitalarias.
Disponibilidad de datosLos datos utilizados y/o analizados durante el presente estudio están disponibles en el autor para correspondencia, previa solicitud razonable.
FinanciaciónEste manuscrito no tuvo financiación externa.
Contribución de los autoresEOR, MAR y HAL contribuyeron a la conceptualización; JJPP, LAM, LPI, JDAR y EOR asumieron la responsabilidad de la recolección y la integralidad de los datos. EOR contribuyó al análisis de los datos. EOR, MAR, RRV, JJPP, HAL y ABM interpretaron los datos. Todos los autores contribuyeron a la revisión crítica y a la aprobación del manuscrito final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.