El conocimiento sobre las manifestaciones neurológicas secundarias a la infección por síndrome respiratorio agudo grave por coronavirus 2 (SARS-CoV-2) en pacientes pediátricos sigue siendo limitado por la escasez de casos reportados. Sin embargo, se ha documentado la relación entre la infección por SARS-CoV-2 y el síndrome desmielinizante de Guillain-Barré en pacientes escolares y adolescentes. Presentamos un caso clínico de lactante con manifestaciones clínicas de síndrome axonal de Guillain-Barré asociado a serología para SARS-CoV-2 positiva, que requirió ventilación mecánica invasiva y que presentó mejoría posterior a la administración de inmunoglobulina y corticoides sistémicos.
Knowledge of neurological manifestations secondary to infection with severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) in paediatric patients continues to be limited by the scarcity of reported cases, however, the relationship between SARS-CoV-2 infection and Guillain-Barré demyelinating syndrome has been documented in school patients and adolescents. We present a clinical case of an infant with clinical manifestations of Guillain-Barré axonal syndrome associated with a positive serology report for SARS-CoV-2, which required invasive mechanical ventilation, and who showed improvement after the administration of immunoglobulin and systemic corticosteroids.
La enfermedad causada por el nuevo coronavirus conocido como SARS-CoV-2 (COVID-19), que apareció en China a finales del año 2019, se ha propagado rápidamente por todo el mundo, con más de 500 millones de casos confirmados hasta la fecha. Las principales manifestaciones reportadas de la enfermedad COVID-19 van desde fiebre, malestar general y síntomas respiratorios superiores e inferiores leves hasta neumonía grave y síndrome de dificultad respiratoria aguda1. Desde el inicio de esta pandemia, se hizo evidente que los niños infectados con SARS-CoV-2 permanecen en su mayoría asintomáticos o levemente sintomáticos, con lo que es probable que la verdadera prevalencia de la infección en pacientes pediátricos esté subestimada. En general, los síntomas respiratorios son menos específicos y la anosmia no es frecuente en niños, pero es el predictor más fuerte de una prueba SARS-CoV-2 positiva. En contraste, las manifestaciones postinfecciosas en la edad pediátrica se han reportado más graves, como es el caso del síndrome inflamatorio multisistémico, o las complicaciones neurológicas, como encefalomielitis diseminada y mielitis transversa aguda. Estas, inicialmente, son poco frecuentes, pero en el tiempo se ha reportado aumento de la incidencia en niños2,3.
El síndrome de Guillain-Barré (SGB) se caracteriza por una parálisis monofásica, ascendente y simétrica con arreflexia, que progresa durante días o semanas. Por lo general, es un proceso autoinmune postinfeccioso que conduce a la destrucción de la mielina4. Sus manifestaciones clásicas son polirradiculoneuropatía aguda con entumecimiento, parestesia, debilidad y dolor en extremidades. Sin embargo, existen diversos subtipos de la enfermedad, dentro de los cuales se documenta polineuritis craneal, que es más común en pacientes jóvenes, la cual se caracteriza por la afectación bilateral aguda de varios nervios craneales con pérdida sensorial periférica grave y que requeriría mayor necesidad de ventilación mecánica que la presentación típica de la enfermedad5,6.
La evidencia actual reporta más casos de SGB asociado a infección aguda por SARS-CoV-2, pero reportes como el de Maher Khalifa et al. en un niño de 11 años palestino que presentó clínica característica de SGB agudo 3semanas después de un episodio de infección del tracto respiratorio superior nos debe hacer pensar en esta entidad también como una manifestación postinfecciosa7.
En este documento, nuestro objetivo es reportar un caso clínico en un lactante con clínica de SGB atípico asociado a infección previa por SARS-CoV-2.
Caso clínicoPresentamos el caso de una paciente de 13 meses de vida, producto de un segundo embarazo, sin antecedentes prenatales relevantes, que nació por parto vaginal, a término, con peso y talla adecuados para su edad gestacional. Recibió lactancia materna y alimentación complementaria, sin antecedentes patológicos conocidos, con neurodesarrollo adecuado para la edad y esquema vacunal completo. Ingresó al servicio de urgencias por cuadro clínico de 24 h de evolución, con ptosis palpebral derecha, asimetría en apertura bucal durante el llanto, sialorrea y limitación para la deglución de alimentos sólidos. Los familiares negaron fiebre, síntomas respiratorios y gastrointestinales previos; sin embargo, documentaron en los 3 días previos al cuadro actual un traumatismo craneoencefálico parietal derecho con posterior hematoma subgaleal ipsilateral, sin alteración del estado de conciencia, ni convulsiones, ni vómitos. Los padres habían resultado positivos para infección por SARS-CoV-2 20 días antes y reportaron verbalmente 2 muestras de PCR para SARS-CoV-2 negativa de la paciente.
Al ingreso, los signos vitales estaban dentro de la normalidad, la paciente estaba alerta, activa, reactiva, con llanto consolable en brazos de su madre, con marcha normal, sensibilidad conservada, reflejos osteotendinosos presentes, Glasgow 14/15, ptosis palpebral derecha, desviación de la comisura labial ipsilateral y sialorrea, sin signos de dificultad respiratoria ni otros hallazgos patológicos.
En principio, el servicio de pediatría decidió hospitalizarla para hacer una tomografía de cráneo simple y evaluar el medio interno y para que neurología pediátrica la valorara. Se indicaron líquidos intravenosos de mantenimiento y vigilancia neurológica horaria.
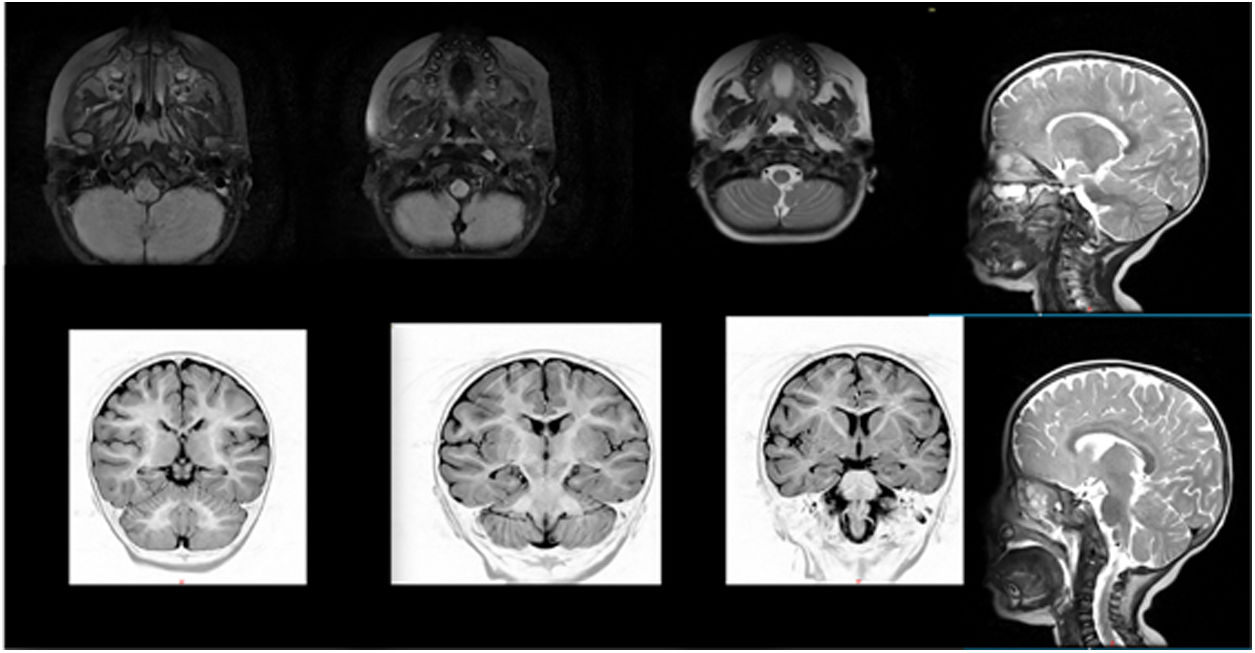
En su primer día de hospitalización, aumentó la sialorrea y la escala de Glasgow fue de 12/15. A pesar de estar afebril, plantearon diagnóstico de encefalitis vs. meningitis infecciosa. Por riesgo de deterioro hemodinámico, decidieron traslado a unidad de cuidados intensivos pediátricos, donde realizaron punción lumbar para toma de citoquímico, gram y cultivo de líquido cefalorraquídeo (LCR). Se inició manejo antibiótico con ceftriaxona, vancomicina y aciclovir además de dexametasona, previa 2 tomas para hemocultivo y urocultivo. Fue evaluada por neurología pediátrica, que indicó complementar los estudios con filmarray de LCR y anticuerpos antirreceptores de acetilcolina, que fueron en su totalidad normales. La resonancia magnética nuclear de cerebro contrastada reveló aparente alteración mínima en unión bulbo-medular, sin descartar artificio (fig. 1).
En su segundo día de hospitalización, la paciente estaba somnolienta, con ptosis palpebral derecha acentuada, sialorrea abundante, llanto disfónico e hipotonía de las 4extremidades. Fue de nuevo evaluada por neurología pediátrica, que planteó diagnóstico de miastenia gravis, por lo que se ordenó electromiografía facial con test de estimulación repetitiva, ecocardiograma doppler color, que no reportó alteraciones estructurales ni funcionales. Después se realizó prueba de neostigmina, que también resultó negativa. El reporte del citoquímico de LCR indicó: color incoloro, aspecto transparente, densidad 1.008, recuento de leucocitos 0,0, recuento de glóbulos rojos 0,0, no se observaron bacterias, glucosa de 52,6mg/dl y proteínas de 22,9mg/dL. El gram y el filmarray de LCR fueron negativos. No se realizó PCR de SARS-CoV-2 en LCR, pero sí por hisopado faríngeo, que fue negativa. Ante los resultados obtenidos, se decidió suspender la dexametasona e iniciar prednisolona a dosis de 0,5mg/kg por vía oral cada 8 h. Horas después, la paciente presentó aumento del trabajo respiratorio y desaturación de oxígeno intermitente, por lo que se realizó radiografía de tórax con reforzamiento parahiliar derecho, sin otros hallazgos patológicos. Ante el deterioro progresivo y rápido que comprometía la mecánica ventilatoria, se consideró SGB atípico, por lo que se ordenó oxígeno por cánula a alto flujo, con gammaglobulina intravenosa a dosis de 1g/kg al día durante 2 días y metilprednisolona en dosis de 30mg/kg al día por vía intravenosa durante 3 días. Al día siguiente la paciente ya no presentaba reflejos osteotendinosos y empeoró la dificultad respiratoria, por lo que se decidió hacer intubación orotraqueal y ventilar, ante el riesgo de falla ventilatoria inminente.
Al quinto día de estancia hospitalaria, la paciente continuaba en ventilación mecánica, con poca respuesta al tratamiento instaurado. Se recibió reporte de anticuerpos IgM para SARS-CoV-2 en 5,06 uA/ml (positivo), anticuerpos totales (nucleocápside) 47,02 uA/ml, anticuerpos totales (spike) mayor de 250 uA/ml, por lo que se planteó en ese momento SGB postinfección por SARS-CoV-2. Se ordenó, en conjunto con reumatología e infectología pediátrica, el inicio de segunda dosis de gammaglobulina (1g/kg al día, 2 días) y continuar con metilprednisolona (2mg/kg al día hasta 5 días).
Al séptimo día de estancia hospitalaria, la paciente presentó mejoría del automatismo respiratorio y mayor movilidad en extremidades, aunque persistía con sialorrea. Se decidió extubar y continuar con cánula a alto flujo, que fue bien tolerada, con resolución de la dificultad respiratoria. Por persistencia del trastorno de deglución, se solicitó apoyo a fonoaudiología, que inició terapia multimodal que incluyó terapia láser para la estimulación del proceso deglutorio.
Pasados 11 días de estancia en la unidad pediátrica, la paciente estaba sin oxígeno suplementario, alerta, sin ptosis palpebral, con la movilidad de extremidades conservada, con sialorrea en escasa cantidad y recibiendo alimentación enteral por sonda nasogástrica. Se decidió entonces su traslado a la sala de hospitalización pediátrica, donde continuaron las terapias físicas y fonoaudiológicas. El reporte de electromiografía confirmó el compromiso de la motoneurona periférica, compatible con polineuropatía motora de tipo axonal severa de los 4miembros, con predominio de los miembros inferiores, lo que reforzó el diagnóstico de SGB. Al día 16 de estancia hospitalaria se decidió egreso, ante la estabilidad clínica, la sialorrea resuelta, la tolerancia de aportes enterales sin sonda nasogástrica, con deambulación con apoyo y con mayor movilidad en las extremidades. El egreso se produjo con orden de terapia de lenguaje, láser de deglución, terapia física y seguimiento por neuropediatría y fisiatría. Hasta el día de hoy, la paciente continúa sin nuevo deterioro neurológico y sin alteración en su neurodesarrollo.
DiscusiónSe conoce, hasta el momento, que el SARS-CoV-2 y otros coronavirus tienen naturaleza neurotrópica y conducen a enfermedades del sistema nervioso central y periférico, pero los mecanismos y la naturaleza exacta de estos fenómenos aún no se han determinado8. Cada vez hay más evidencia de que los coronavirus pueden invadir primero las terminales nerviosas periféricas para luego obtener acceso al sistema nervioso central a través de una ruta conectada con la sinapsis, pero también se cree que existe una respuesta inmune anormal que causa daño neurológico8,9.
Algunas revisiones sistemáticas publicadas recientemente revelan que, si bien son raras, las manifestaciones neurológicas en la infección por SARS-CoV-2 pueden presentarse desde síntomas específicos como cefalea y fatiga muscular hasta clínica más grave, como meningitis o SGB5. La asociación entre SARS-CoV-2 y SGB se ha descrito anteriormente en informes de casos adultos con un amplio espectro de variantes de SGB, incluyendo desmielinizante, axonal, Miller-Fisher; se han visto presentaciones tanto parainfecciosas como postinfecciosas4 y ya se empiezan a reportar casos de SGB asociado a COVID-19 en escolares y adolescentes, pero no en lactantes, como el caso de nuestra paciente.
Las características clínicas y electrofisiológicas comunes del SGB asociadas con la infección por SARS-CoV-2 se definen como la presencia de disociación albuminocitológica, SGB desmielinizante y resultados favorables al alta. Si bien nuestra paciente no presentaba las manifestaciones anteriores, su cuadro comenzó como polineuritis craneal y el reporte de electromiografía confirmó la polineuropatía motora axonal severa, que se categorizó como una variante atípica de la enfermedad. No se realizó PCR para SARS-CoV-2 en el LCR, que hubiese sido relevante para determinar la etapa de la enfermedad, teniendo en cuenta que en un metaanálisis de 73 pacientes con COVID-19 y posterior clínica de SGB se reportó que la mayoría de los pacientes tuvieron ARN del virus en LCR negativo, lo que puede indicar un mecanismo prominente postinfeccioso en lugar de uno parainfeccioso9. En cuanto al diagnóstico de COVID-19, la prueba de oro hasta el momento es PCR para SARS-CoV-2, que en nuestra paciente resultó negativa, pero se obtuvieron anticuerpos contra el virus que fueron positivos. Esto, al obtener positividad para proteína Spike y nucleocápside, es indicativo de infección previa, mas no de vacunación, además, por edad, la paciente no había recibido esquema vacunal contra la COVID-1910.
Con respecto al tratamiento, basado en el manejo habitual de SGB, los pacientes requieren vigilancia estricta de función motora, autonómica y respiratoria en ambiente hospitalario. La inmunoterapia con inmunoglobulina intravenosa (IVIG) o plasmaféresis es la preferida, pero debe reservarse para pacientes con cuadro severo, como debilidad muscular progresiva o compromiso respiratorio, como el caso de nuestra paciente. La dosis total de IVIG en niños es de 2g/kg, administrada como 1g/kg durante 2 días o 400mg/kg durante 5 días, sin superioridad entre una dosis u otra, generalmente como ciclo único. El mecanismo de acción propuesto de IVIG es la supresión de la respuesta inflamatoria11. El uso de corticoides no está recomendado en el manejo del paciente con SGB, pero si la actividad de la enfermedad progresa rápidamente o excede un periodo de 4-8 semanas, se beneficia de corticoides u otro tipo de terapia inmunomoduladora ante la probabilidad de una polineuropatía desmielinizante inflamatoria crónica12.
Por esto, se hacen necesarias mayores investigaciones y recopilación de datos en niños con enfermedad similar para entender adecuadamente el curso de la enfermedad y brindar de forma oportuna el manejo integral que requiere.
Conflicto de interesesNinguno.