Avaliar a taxa de melhoria imediata da tosse irritativa em pacientes tratados com associação do extrato do Ananas comosus em mel de abelha (Bromelin®) e compará‐la com a de uso do mel isolado (grupo placebo).
MétodosEstudo pragmático da vida real, duplo‐cego, randômico, de grupos paralelos, em crianças, entre dois e 15 anos, com tosse irritativa havia pelo menos 24 horas. A avaliação da tosse foi duplo‐cega foi feita por meio da avaliação do número de episódios observáveis e do escore de intensidade de tosse durante o período de 10 minutos de observação. A redução de um ponto na média do escore total foi considerada como efeito terapêutico.
ResultadosEm ambos os grupos houve redução do número de episódios de tosse, assim como do escore de tosse após 30 minutos de administração do medicamento ou do mel. A mudança de escore clínico superior a dois, que poderia indicar melhoria acentuada, ocorreu em cinco pacientes do grupo com bromelina e em apenas um do placebo, mas sem diferença significante. Não ocorreram eventos adversos.
ConclusõesA taxa de melhoria imediata da tosse irritativa foi similar entre pacientes tratados com associação do extrato do Ananas comosus em mel de abelha (Bromelin®) e com o uso do mel isolado (grupo placebo). É possível que haja um efeito terapêutico do mel nas características do muco e da tosse (Clinical Trials: NCT01356693).
To evaluate the immediate improvement rate of irritative cough in patients treated with the combination of Ananas comosus extract and honey (Bromelin®) compared with the use of honey alone (placebo group).
MethodsPragmatic, double‐blind, randomized, parallel‐group study with children aged between 2 and 15 years, with irritative cough for at least 24hours. The double‐blind assessment of cough was through the number of observed coughing episodes and intensity score for a period of 10minutes of observation. The decrease of one point in the mean total score was considered as a therapeutic effect.
ResultsThere was a reduction in coughing episodes in both groups, as well as in the cough score after 30minutes of drug or honey administration. The change in clinical score above two points, which could indicate marked improvement, occurred in five patients in the bromelin group and only in one in the placebo group, but without significant difference. There were no adverse events.
ConclusionsThe immediate improvement rate of irritative cough was similar in patients treated with combination of Ananas comosus extract and honey (Bromelin®) compared with the use of honey alone (placebo group). It is possible that honey has a therapeutic effect on mucus and cough characteristics (Clinical Trials: NCT01356693).
Os processos virais de vias aéreas, em geral, são autolimitados e caracterizados principalmente por febre e tosse, que são dois preditores independentes da presença de vírus e tendem a desaparecer em torno de uma semana. Entretanto, a tosse é o sintoma mais comum de atendimento nos consultórios de médicos de assistência primária e é causa frequente de procura por atendimento de urgência, chega muitas vezes a ser tão intensa que leva à exaustão o paciente e os parentes.1–3
Nesses casos, medicamentos sintomáticos frequentemente são usados por iniciativa dos próprios pacientes, muitas vezes em resposta ao estímulo da propaganda e por não necessitar de prescrição médica. Disponíveis nas farmácias, em combinações as mais variadas, as substâncias para alívio da tosse podem causar riscos, especialmente na faixa etária pediátrica.3,4
O dextrometorfano e a difenidramina são frequentemente usados como agentes antitussígenos, sobretudo em crianças.5 Estudo clínico comparou esses dois princípios terapêuticos com o mel de abelha, no controle da tosse noturna e na qualidade do sono de crianças com tosse irritativa, e verificou‐se que o mel (2,5 mL), administrado antes de dormir, mostrou melhor resultado no alívio do sintoma, quando em comparação com essas duas drogas.6 Revisão recente da Cochrane Library, feita com estudos clínicos com padrões de qualidade metodológica aceitáveis, não documentou evidências a favor ou contra da eficácia desses medicamentos no alívio sintomático de pacientes com tosse.4 Assim, permanece incerta até hoje uma estratégia terapêutica ideal para controle sintomático da tosse.3–5
Dessa forma, o indivíduo e os parentes aflitos pela tosse buscam medidas que pensam ser seguras para seu alívio, quando esse sintoma é intenso. Nesse aspecto, a terapêutica empírica, baseada em produtos naturais e/ou fitoterápicos, tem sido cada vez mais empregada e muitas pessoas a usam livremente com ou sem prescrição médica secundária à sugestão dos parentes e/ou a crenças do próprio paciente.3
Nesse contexto, produtos do extrato de Ananas comosus (rico em Bromelina) e mel de abelha têm se mostrado promissores por conter enzimas proteolíticas, tais como a tripsina, a quimiotripsina e a bromelina.7 Bromelina é a denominação genérica para a família de enzimas proteolíticas que contêm o radical sulfidril, obtidas a partir do Ananas comosus, planta do abacaxi, que tem também enzimas não proteolíticas com importante ação tópica na mucosa respiratória.7,8 Isentos de efeitos tóxicos, esses produtos derivados do abacaxi têm demonstrado, em estudos in vitro, propriedades promissoras: interferem no crescimento de células malignas, inibem a agregação plaquetária e a coagulação e têm, principalmente, ação anti‐inflamatória e mucolítica. Trata‐se de ações potencialmente benéficas, há demonstração de a atividade da bromelina ser significativa na dissolução de secreção brônquica e com a vantagem de, por ser constituinte própria de alimento, tratar‐se de substância segura para uso em crianças.9–13
A Organização Mundial de Saúde aponta o mel de abelha como tratamento potencial da tosse nas infecções do trato respiratório superior em crianças, é considerado um tratamento sintomático, barato, popular e seguro. Estudos atribuem ao mel ações antioxidante, antibacteriana, antifúngica, antiviral, anti‐inflamatória, antitumoral, além de propriedades imunomoduladoras.14–16 Estudo duplo‐cego, randômico avaliou a eficácia de três tipos de mel (eucalipto, citrus e labiata) no controle da tosse noturna e da qualidade do sono em crianças com infecção do trato respiratório superior e comparou‐os com placebo. Nos três esquemas de tratamento ativo com o mel houve melhoria significativa dos parâmetros avaliados em relação à noite anterior.15
A combinação do extrato de Ananas comosus com o mel de abelha pode representar um avanço no tratamento sintomático, possivelmente por bloquear os mecanismos deflagradores da tosse decorrente de quadros virais ou irritativos. Assim, foi objetivo deste estudo avaliar a eficácia na inibição imediata da tosse irritativa em pacientes tratados com associação Ananas comosus (abacaxi) e mel de abelha (Bromelin®) e compará‐los com aos tratados com mel de abelha isolado (placebo) no ambiente de pronto‐atendimento pediátrico.
MétodoEsse estudo, pragmático da vida real, duplo‐cego, randômico e de grupos paralelos foi feito no setor de pediatria da Clínica Amaury Coutinho, vinculada à Prefeitura da Cidade do Recife. Os pacientes do Grupo Ativo (letra A) receberam a combinação mel de abelha e extrato de Ananas comosus HBS 19820501 (rico em Bromelina) em xarope e as do Grupo Placebo (letra B) receberam apenas mel de abelha. A qualidade do mel foi certificada nos dois grupos e aprovada pelos órgãos reguladores e pela Agência Nacional de Vigilância Sanitária (Anvisa) para venda, o mel era de produção recente e com rigoroso controle bacteriológico. A randomização foi feita segundo tabela gerada pelo programa Excel. Apenas após a análise dos resultados da pesquisa é que o duplo‐cegamento foi quebrado e os grupos de tratamento foram revelados.
Participaram crianças com entre dois e 15 anos, com tosse irritativa havia pelo menos 24 horas e que motivou a procura por consulta médica. Foram excluídos os pacientes com história prévia de doença pulmonar obstrutiva, fibrose cística, neuropatias, cardiopatias, diabetes e imunodeficiências primárias ou secundárias identificáveis. Os pacientes deveriam apresentar tosse aguda em decorrência de infecção viral de vias aéreas superiores, assim considerada pela presença de febrícula ou febre associada à coriza hialina ou catarral, com duração inferior a 72 horas, sem apresentar quadro clínico associado de broncoespasmo. Após preenchimento dos critérios de inclusão, os pacientes foram alocados em um grupo de tratamento (Bromelin® ou Mel) de forma randômica. Os responsáveis pelos pacientes incluídos concordaram e assinaram o termo de consentimento livre e esclarecido. Os dois esquemas de tratamento foram administrados da seguinte forma: a) crianças com até 20 quilos receberam 5 mL; b) para aqueles com peso superior, foram administrados 1mL para cada cinco quilos de peso adicional. Antes da randomização, para os pacientes com broncoespasmo detectável, foram prescritos β‐2 adrenérgico e, se necessária, dose única de esteroide oral, o paciente era considerado não elegível para o estudo. As características organolépticas do Bromelin® e do mel são semelhantes.
Dados clínicos e de evolução dos pacientes após tratamento foram anotados em ficha clínica padronizada. A avaliação da tosse foi feita de forma duplo‐cega por um dos pesquisadores por meio da contagem do número de episódios observáveis e do escore de intensidade de tosse durante 10 minutos de observação. O escore de intensidade de tosse inicial e final foi classificado segundo instrumento usado em 0=ausente; 1=leve, 2=moderada; 3=intensa; 4=muito intensa, conforme pesquisa anterior.5 Segundo esse instrumento, a redução de um ponto na média do escore total é considerada como efeito terapêutico. Após esperar 30 minutos depois da administração do medicamento, a resposta terapêutica foi avaliada durante 10 minutos de observação, que foi escolhido por ser factível e satisfatório no cenário clínico real de um serviço de pronto‐atendimento.
Assim, após serem quantificados os acessos de tosse observáveis pelo pesquisador nos 10 minutos que antecederam a administração do tratamento, foi repetida a observação padronizada 30 minutos depois da sua administração, novamente de forma duplo‐cega. Todas as avaliações antes e após o medicamento ou placebo foram feitas por um mesmo e único pesquisador (médico) de forma duplo‐cega (nem o avaliador nem o paciente nem os parentes sabiam que produto usava), com a finalidade de promover robustez aos resultados.
A segurança da medicação foi avaliada pela frequência de eventos adversos referidos, tais como episódios de vômitos, epigastralgia, dor abdominal, entre outros. Não foi feito monitoramento de evento adverso posterior.
Para o cálculo amostral considerou‐se: poder do teste de 90%, taxa de melhoria da tosse no grupo ativo de 40%, e no grupo placebo de 10%, teste da hipótese bicaudal e nível de significância de 5%. Assim, foram necessários 60 pacientes para avaliar o possível efeito terapêutico do tratamento ativo. Esse cálculo encontra‐se de acordo com o ensaio clínico de Muller et al., que estudaram em torno de 30 pacientes por grupo para avaliar o possível efeito da Bromelina nos marcadores inflamatórios, mas com a consequente repercussão na melhoria clínica da tosse.8
Na análise estatística levou‐se em conta a natureza das variáveis estudadas. As numéricas foram expressas em média e desvio padrão ou, quando necessário, em mediana e percentis 25‐75, e as categóricas na forma de valores percentuais. As variáveis numéricas foram comparadas com o teste t de Student e para as categóricas o teste do qui‐quadrado. O valor foi considerado significante quando p<5%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Centro de Ciências da Saúde da Universidade Federal de Pernambuco com CAAE n° 0311.0.172.000‐10 e a pesquisa foi registrada no Clinical Trials sob o n° NCT01356693 (ClinialTrials.gov Identifier).
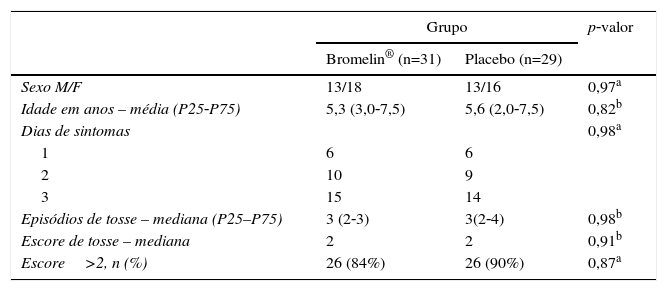
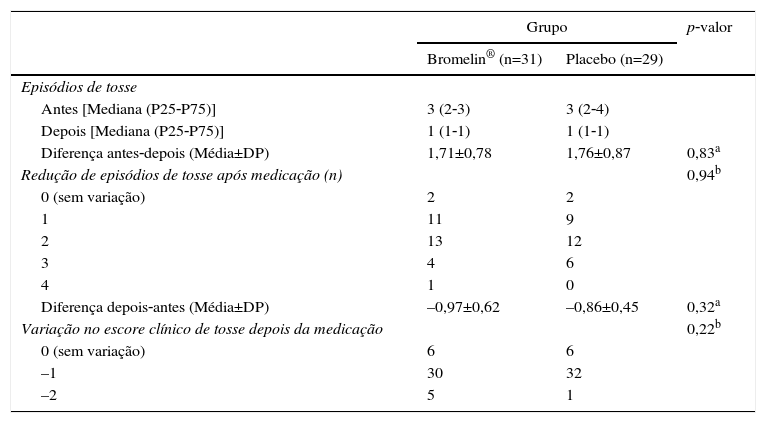
ResultadosA tabela 1 demonstra que os dois grupos de pacientes foram semelhantes quanto a idade, sexo, dias de tosse e média de escore clínico dos episódios de tosse. Na tabela 2, verifica‐se que em ambos os grupos houve redução do número de episódios de tosse, assim como do escore de tosse após 30 minutos de administração do medicamento ou do mel. Todavia, na análise da mudança de escore clínico superior a dois pontos, o que poderia indicar melhoria mais acentuada, esse ocorrido em cinco pacientes do grupo ativo e em um do placebo. Não ocorreram eventos adversos imediatos.
Características gerais basais grupos de estudo Bromelin e Placebo (mel) quanto a sexo, média de idade, dias de persistência dos sintomas e escore inicial de gravidade de tosse
| Grupo | p‐valor | ||
|---|---|---|---|
| Bromelin® (n=31) | Placebo (n=29) | ||
| Sexo M/F | 13/18 | 13/16 | 0,97a |
| Idade em anos – média (P25‐P75) | 5,3 (3,0‐7,5) | 5,6 (2,0‐7,5) | 0,82b |
| Dias de sintomas | 0,98a | ||
| 1 | 6 | 6 | |
| 2 | 10 | 9 | |
| 3 | 15 | 14 | |
| Episódios de tosse – mediana (P25–P75) | 3 (2‐3) | 3(2‐4) | 0,98b |
| Escore de tosse – mediana | 2 | 2 | 0,91b |
| Escore>2, n (%) | 26 (84%) | 26 (90%) | 0,87a |
Dias de sintomas, número de dias com sintomas de tosse antes da consulta; Episódios de tosse – mediana (P25‐P75), número de episódios de tosse durante os 10 minutos de observação inicial pelo médico; Escore tosse – mediana, escore de tosse inicial observado pelo médico (0=ausente; 1=leve, 2=moderada, 3=intensa, 4=muito intensa).
Mudança no número de episódios de tosse e do escore de tosse entre os períodos de observação (10 minutos) antes e 30 minutos depois da administração do esquema de tratamento em 60 pacientes avaliados
| Grupo | p‐valor | ||
|---|---|---|---|
| Bromelin® (n=31) | Placebo (n=29) | ||
| Episódios de tosse | |||
| Antes [Mediana (P25‐P75)] | 3 (2‐3) | 3 (2‐4) | |
| Depois [Mediana (P25‐P75)] | 1 (1‐1) | 1 (1‐1) | |
| Diferença antes‐depois (Média±DP) | 1,71±0,78 | 1,76±0,87 | 0,83a |
| Redução de episódios de tosse após medicação (n) | 0,94b | ||
| 0 (sem variação) | 2 | 2 | |
| 1 | 11 | 9 | |
| 2 | 13 | 12 | |
| 3 | 4 | 6 | |
| 4 | 1 | 0 | |
| Diferença depois‐antes (Média±DP) | –0,97±0,62 | –0,86±0,45 | 0,32a |
| Variação no escore clínico de tosse depois da medicação | 0,22b | ||
| 0 (sem variação) | 6 | 6 | |
| –1 | 30 | 32 | |
| –2 | 5 | 1 | |
A mucosa brônquica, ao ser agredida por agentes químicos, físicos ou infecciosos, responde com um processo inflamatório no qual as células do epitélio passam a produzir quantidade excessiva de muco.17 Após infecção viral, ocorre liberação reforçada de citocinas, neurotransmissores e leucotrienos que induzem o aumento dos níveis de receptores neurais, com estímulo transitório da atividade neural aferente, hipersecreção de muco e, possivelmente, exacerbação de efeitos das vias motoras colinérgicas. A sensação de irritação que precede o ato motor de tosse permite inferir o conceito de síndrome de tosse por hipersensibilidade após infecção respiratória viral aguda, a qual, em alguns pacientes, torna‐se uma tosse refratária e exaustiva decorrente da inflamação e do excesso de muco.17 Embora a difenidramina e o dextrometorfano sejam os fármacos mais usados no manejo da tosse irritativa, eles não se mostram superiores ao placebo no controle desse sintoma.18 Por outro lado, estudo comparativo entre o dextrometorfano e o mel de trigo sarraceno mostrou equivalência de ambos, com superioridade do mel quando comparado com os pacientes tratados com placebo.15
A ação mucolítica de certos fármacos pode promover a diminuição da viscosidade do muco e facilitar a sua eliminação pela tosse e pelos batimentos ciliares do epitélio brônquico. Isso é possível graças à quebra das mucoproteínas, que as fraciona em polipeptídios. Aliada a isso, a ação anti‐inflamatória de uma determinada droga pode contribuir para redução do muco espesso produzido.7,17,19 O extrato de Ananas comosus, presente no produto em estudo, contém enzimas proteolíticas (bromelina, ribonuclease, glucose‐oxidase, invertase e diástase) e cátions bivalentes de oligoelementos (magnésio, manganês, zinco, ferro e cálcio) que atuam como cofatores nas funções das referidas enzimas. As enzimas catalisam a quebra de ligações peptídicas por incorporar moléculas de água e facilitam, assim, a fluidificação do muco espesso.7,19
Estudos in vitro apontam ser a atividade anti‐inflamatória da bromelina, em parte, resultante da inibição da formação de bradicinina no local da inflamação, pela depleção de calicreína plasmática, bem como da redução de intermediários da cascata da coagulação, o que limita a formação de fibrina. Além disso, a bromelina reduz a migração leucocitária, bem como a expressão de moléculas de adesão (CD128) aos vasos sanguíneos.7,19,20 O possível efeito benéfico da bromelina pode ser decorrente de uma série integrada de ações sobre células e citocinas, tais como: ativação de células natural killer (NK), aumento da produção de fator de necrose tumoral alfa, bem como de Interferon gama (INF‐g), de várias interleucinas (IL 1, IL‐2, IL‐6) e do fator estimulador de crescimento de colônia de granulócitos e macrófagos e parece poder interromper a ativação contínua de linfócitos CD4+ mantenedores do processo inflamatório.21
Além disso, em humanos saudáveis, a ingestão oral de bromelina promove mudança no ciclo circadiano de INF‐g, IL‐5 e IL‐10, o que sugere ação imunomoduladora sobre linfócitos T.21 Tal observação tem sido a justificativa para o uso da bromelina, isolada ou associada a outros produtos naturais, no tratamento de doenças autoimunes e inflamatórias como a colite ulcerativa, a esclerose múltipla e as afecções do aparelho respiratório.21,22 Em crianças com sinusite aguda, a bromelina foi adicionada a tratamento padrão e houve redução significante da duração dos sintomas e do tempo de recuperação, quando comparado com os que receberam apenas o tratamento convencional, é extremamente segura com apenas reação alérgica leve e autolimitada em paciente alérgico a abacaxi.13
O mel de abelha foi o constituinte comum às duas formas de tratamento, o que nos faz acreditar terem sido as suas propriedades mucolíticas e sedativas da tosse as responsáveis pela redução do escore de tosse, assim como pela redução no número de acessos de tosse apresentados nos dois grupos de pacientes estudados.15,23 A literatura tem sugerido que o mel pode ser indicado como uma medida racional no tratamento da tosse, pois é de baixo custo, com raros eventos adversos e alguma evidência de possível ação terapêutica.16,24
Este ensaio clínico sugere que, pela melhoria acentuada em ambos os grupos, existe provavelmente um efeito terapêutico do mel nas características do muco e da tosse, o que pode ter dificultado a identificação de diferenças, quando o mel é associado a uma eventual ação farmacológica adicional e favorável da bromelina. A hipótese sugerida é que a própria doçura do mel promova um reflexo de salivação e produção de secreção das vias aéreas e leve à liquefação do muco, com redução da tosse pela menor irritação na laringe e na faringe e, o mais importante, sem efeitos colaterais, pode ser usado com segurança nas crianças acima de um ano, quando o microbioma intestinal encontra‐se estruturado e definido e com adequada imunidade contra Clostridium botulinum, um possível contaminante do mel.16,25,26 Em ensaio multicêntrico na Europa, o mel foi usado em crianças de 1‐18 anos, sem quaisquer efeitos colaterais e com possível benefício terapêutico.27
Este estudo, conforme mencionado, é um ensaio clinico pragmático feito na realidade de um pronto‐atendimento, o que pode ter originado algumas limitações, como a necessidade de uso de indicadores mais objetivos e reprodutíveis para avaliar a melhoria da tosse, principalmente frente a uma população de crianças de faixa etária tão ampla para a análise de um sinal clínico causado por tão diversas patologias. Contudo, todos os pacientes do estudo apresentavam tosse aguda e associada à infecção de vias aéreas superiores e, além disso, todas as avaliações foram feitas de forma duplo‐cega e padronizada por um único pesquisador, o que permite uma validação interna do estudo. Um método de avaliação com vídeo e um maior tempo de duração do período de observação e um delineamento mais definido das doenças existentes seriam o ideal, mas comprometeria o funcionamento da avaliação no cenário clínico realista de um pronto‐atendimento.
A adição da bromelina ao mel não resultou em efeito adicional no tratamento da tosse irritativa. Parece que um eventual efeito da bromelina, se existente, seria mais bem avaliado ao usar‐se outra substância como placebo, pois o mel pode ser uma substância ativa farmacologicamente na tosse.25–27 Da mesma forma, novos ensaios clínicos com outros desfechos para avaliar esse possível efeito terapêutico do mel isolado ou associado na tosse irritativa, com um período de observação mais prolongado, são necessários. Na prática clínica diária, pais, parentes e pacientes estão interessados nesse esclarecimento com certa urgência, diante da segurança e inocuidade dos mesmos e da possibilidade de alívio do incômodo que a tosse irritante ocasiona aos pacientes.16,25,26
FinanciamentoHebron Indústrias Químicas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.