El objetivo de este estudio fue evaluar el grado de conocimiento y las necesidades de formación sobre fármacos biosimilares en los médicos de Atención Primaria (AP).
Material y métodosEstudio observacional, descriptivo y transversal mediante encuesta con cuestionario de 34 preguntas cumplimentado electrónicamente por médicos de familia a través de la página web de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN). Las áreas de conocimiento incluidas en la encuesta fueron: definición de biosimilar, marco regulatorio, prescripción de biosimilares, trazabilidad, intercambiabilidad, farmacovigilancia, biosimilares autorizados en AP y contribución a la sostenibilidad. El programa utilizado para el análisis y proceso de los datos fue el Barbwin 7.5.
ResultadosSe analizaron 701 encuestas; el 57% fueron cumplimentadas por mujeres y el 60,9% eran procedentes del ámbito urbano. El 58% de los respondedores desconoce la definición de biosimilar y el 73% no sabe que el manejo de biosimilares no es equiparable al del genérico. La mayoría de los respondedores (84%) desconoce que el desarrollo requerido para la autorización de biosimilares es distinto del de los biológicos de referencia, el 66% no conoce ningún biosimilar en el ámbito de AP en España y el 94% desconoce el marco legal para el manejo de los biosimilares.
ConclusionesEl conocimiento de los médicos de AP sobre biosimilares es bajo. Es necesaria la formación específica sobre biosimilares en AP y sobre los aspectos legales de su prescripción, intercambiabilidad y farmacovigilancia. Seis de cada 10 médicos no conocen ningún biosimilar utilizado en AP en España.
The objective of this study was to evaluate the awareness and training needs on biosimilar drugs in Primary Care (PC) physicians.
Material and methodsDescriptive cross-sectional study based on an on-line questionnaire with a total of 34 multiple choice questions, published on the SEMERGEN website. The main Knowledge areas were: biosimilar definition; regulatory and legal framework; prescription, traceability, interchangeability and pharmacovigilance; availability of biosimilars in the PC setting, and the biosimilars contribution to sustainability. The software used for the analysis and data processing was the Barbwin 7.5.
ResultsAn analysis was performed on the responses from 701 questionnaires completed. There was a slight majority (57%) of women participants. The majority of participant worked in urban centres (60.91%). The definition of biosimilar was not known by 58% of those that responded, and 73% were unaware that the management of biosimilars and generics was not comparable. Most (84%) of those that responded were not aware that the studies required for the approval of biosimilars is different from reference biological medicines. Around two-thirds (66%) those that responded did not know of any biosimilars available in PC setting, and the 94% were also unaware of the Spanish legal framework for the management of biosimilar medicines.
ConclusionsThe current knowledge about biosimilars among PC physicians is low. The critical areas in need of further training include specific information on biosimilars currently available in PC setting, as well as key aspects regarding prescription, interchangeability and pharmacovigilance requirements. Six out of ten doctors do not know of any biosimilar used in PC in Spain.
La incorporación de medicamentos biológicos al arsenal terapéutico ha supuesto un punto de inflexión en el pronóstico y tratamiento de muchas enfermedades crónicas, inflamatorias y oncológicas. Los medicamentos biológicos pueden definirse como aquellos que son producidos por, o a partir de, seres vivos. La Directiva 2003/63/CE define el medicamento biológico como aquel «cuyo principio activo es biológico», siendo sustancia biológica «la que se produce o se extrae a partir de una fuente biológica y que necesita, para su caracterización y determinación de su calidad, una combinación de ensayos físico-químicos y biológicos junto con el proceso de producción y su control». La caducidad de las patentes de los medicamentos biológicos permite que aparezcan copias o nuevas versiones de la sustancia biológica del medicamento original. Estas versiones, fabricadas por compañías distintas, se autorizan en la Unión Europea (UE) como medicamentos llamados biosimilares1.
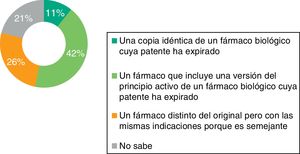
De acuerdo con la definición de la Agencia Europea del Medicamento (EMA), un biosimilar es un fármaco biológico que contiene una versión del principio activo de un medicamento biológico, el producto de referencia, previamente autorizado en el área económica europea, cuya patente ha expirado2. La similitud entre el biosimilar y el producto de referencia debe ser establecida mediante un exhaustivo ejercicio de comparabilidad de las características de calidad, actividad biológica, seguridad y eficacia.
Los medicamentos biosimilares son de naturaleza biológica, y por lo general incluyen proteínas como principio activo (biológicos biotecnológicos), aunque también pueden contener productos de extracción, como es el caso de las heparinas de bajo peso molecular (biológico no biotecnológico). Como todo producto biológico, los biosimilares presentan una estructura molecular altamente compleja y de gran tamaño, y se obtienen asimismo mediante procesos complejos basados en la expresión de secuencias de ADN por células en cultivo (biosimilares biotecnológicos), o bien por procesos de extracción, purificación y fraccionamiento a partir de fuentes biológicas naturales (biosimilares no biotecnológicos). El producto final no puede ser caracterizado totalmente, aunque sí de forma exhaustiva, y depende en gran medida del proceso de producción empleado en su generación3.
Actualmente en la UE se encuentran autorizados más de 30 medicamentos biosimilares, entre ellos algunos propios de Atención Primaria (AP), tales como la insulina glargina o la enoxaparina, y hay 13 biosimilares bajo evaluación de la EMA4. En España tenemos comercializados actualmente un número importante de ellos5, que incluyen tanto la insulina glargina como otros medicamentos para patologías reumatológicas, psoriasis y otras que, aunque prescritos por distintos especialistas, acaban formando parte del tratamiento mantenido de pacientes atendidos en AP. Así, tras la autorización del biosimilar de infliximab en la UE en 2014, han aparecido biosimilares de anticuerpos monoclonales como, adalimumab o rituximab y biosimilares de proteínas de fusión como etanercept. La sucesiva caducidad de patentes de otros biológicos en los próximos años y el espacio para la competencia entre biosimilares de una misma sustancia activa hacen prever que el número de biosimilares disponibles en el mercado aumente considerablemente.
La inclusión de medicamentos biosimilares en el Sistema Nacional de Salud (SNS) constituye una herramienta útil en el manejo eficiente de los recursos disponibles6, y los médicos prescriptores tienen un papel esencial para que su introducción se realice de forma correcta.
Han transcurrido muchos años desde que se introdujo el concepto de medicamento genérico para los principios activos de origen químico y, en este momento, los médicos de AP tienen amplia experiencia en su manejo y conocen los aspectos técnicos que respaldan su uso. Sin embargo, las particularidades de los medicamentos biológicos y el concepto de biosimilar que se aplica a las copias de los medicamentos de origen biológico presentan grandes diferencias con la situación de los medicamentos genéricos de origen químico. Por ello es esencial que los médicos conozcan los aspectos técnicos de la autorización, prescripción, trazabilidad, intercambiabilidad y farmacovigilancia de los biosimilares7-9.
Hasta la fecha, según nuestra información, no disponemos de estudios que valoren el conocimiento y manejo de los fármacos biosimilares por parte del médico de familia en el ámbito de la AP de España.
Por este motivo se diseñó una encuesta que tenía como objetivo evaluar el grado de conocimiento y las necesidades de formación sobre fármacos biosimilares en los médicos de AP.
Material y métodosDiseño, ámbito y variables del estudioSe diseñó un estudio observacional, descriptivo y transversal con recogida de datos a través de una encuesta con un cuestionario de 34 preguntas cumplimentado electrónicamente por médicos de familia a través de la página web de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN). La encuesta fue elaborada por el grupo de expertos en investigación de SEMERGEN y se publicó online en la página de SEMERGEN (http://www.semergen.es/área de socios), estando disponible desde el 19/05/2016 hasta el 11/09/2016. Cada médico, perteneciente al ámbito de la AP, solo podía cumplimentar la encuesta una vez.
La encuesta se estructuró con preguntas tipo test, cerradas, con opción múltiple de respuesta, atendiendo a la siguiente clasificación: definición y diferencias de medicamentos biológicos y biosimilares, desarrollo de biosimilares y marco regulatorio, prescripción de biosimilares, trazabilidad, intercambiabilidad y farmacovigilancia, biosimilares autorizados en el ámbito de AP y contribución a la sostenibilidad del SNS.
Se recogieron las características demográficas (edad y sexo) y profesionales (años de ejercicio, localización geográfica, número de pacientes/día, cupo de pacientes) de los participantes y dos preguntas sobre formación específica recibida y conocimiento sobre biosimilares.
En el anexo disponible en la versión electrónica se expone una copia de la encuesta con las variables incluidas en la misma.
Manejo y análisis de los datosPara un total de 12.458 usuarios registrados, con acceso a la página web, se calculó un tamaño muestral de 1.000 encuestas, ajustado a pérdidas de hasta un 30% (IC 95%, precisión 4%).
Los datos obtenidos se han tratado de forma agregada. El análisis de los mismos ha sido descriptivo, utilizando frecuencias y porcentajes para las variables categóricas y mediante la media y desviación estándar (variables normales) o la mediana, rango y cuartiles Q1 y Q3 (variables con distribución no normal) para las variables continuas. Las variables categóricas se compararon mediante el test exacto de Fisher y las variables continuas mediante el T-test o el test de U de Mann-Whitney. La significación estadística se estableció en p<0,05. El programa usado para el proceso y análisis de datos fue Barbwin 7.5
Confidencialidad de los datosLa encuesta se hizo de acuerdo con la legislación vigente en materia de protección de datos (Directiva 95/46 CE, Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal y normas complementarias). Los datos se recopilaron de forma anónima.
ResultadosSe recibieron 1.011 encuestas, de las que 310 se rechazaron por estar incompletas. Por consiguiente se consideraron válidas para el análisis 701 encuestas.
Características sociodemográficas de los médicos de Atención Primaria que respondieron a la encuestaParticiparon 701 médicos de todas las comunidades autónomas, de los que el 57% eran mujeres. La franja de edad más participativa correspondió a los menores de 35 años (33,81%), seguido de los mayores de 55 años (30,81%). La mayoría trabaja en centros urbanos (60,91%), con cupos por médico promedio de 1.500 pacientes (67%), con un elevado porcentaje de población mayor de 65 años (52%) y asistencia diaria entre 30 y 50 pacientes/día (68%). En la tabla 1 se recogen las características demográficas y profesionales de los participantes.
Características demográficas y profesionales de los participantes
| Zona geográficaa | |
| Norte | 24% |
| Noreste | 7% |
| Levante | 16% |
| Sur | 27% |
| Centro | 26% |
| Sexo | |
| Mujer | 57% |
| Hombre | 43% |
| Edad | |
| <35 | 34% |
| 35-45 | 16% |
| 45-55 | 19% |
| >55 | 31% |
| Años de ejercicio | |
| <10 | 40% |
| 10-25 | 25% |
| >25 | 35% |
| Ámbito de ejercicio | |
| Rural | 15% |
| Semiurbano | 23% |
| Urbano | 61% |
| Otros | 1% |
| Pacientes/día | |
| <30 | 20% |
| 30-50 | 68% |
| >50 | 12% |
| Cupo actual | |
| <1.200 | 18% |
| 1.200-1.500 | 35% |
| 1.500-1.800 | 32% |
| >1.800 | 15% |
| Pacientes >65 años en cupo | |
| <300 | 14% |
| 300-500 | 52% |
| >500 | 34% |
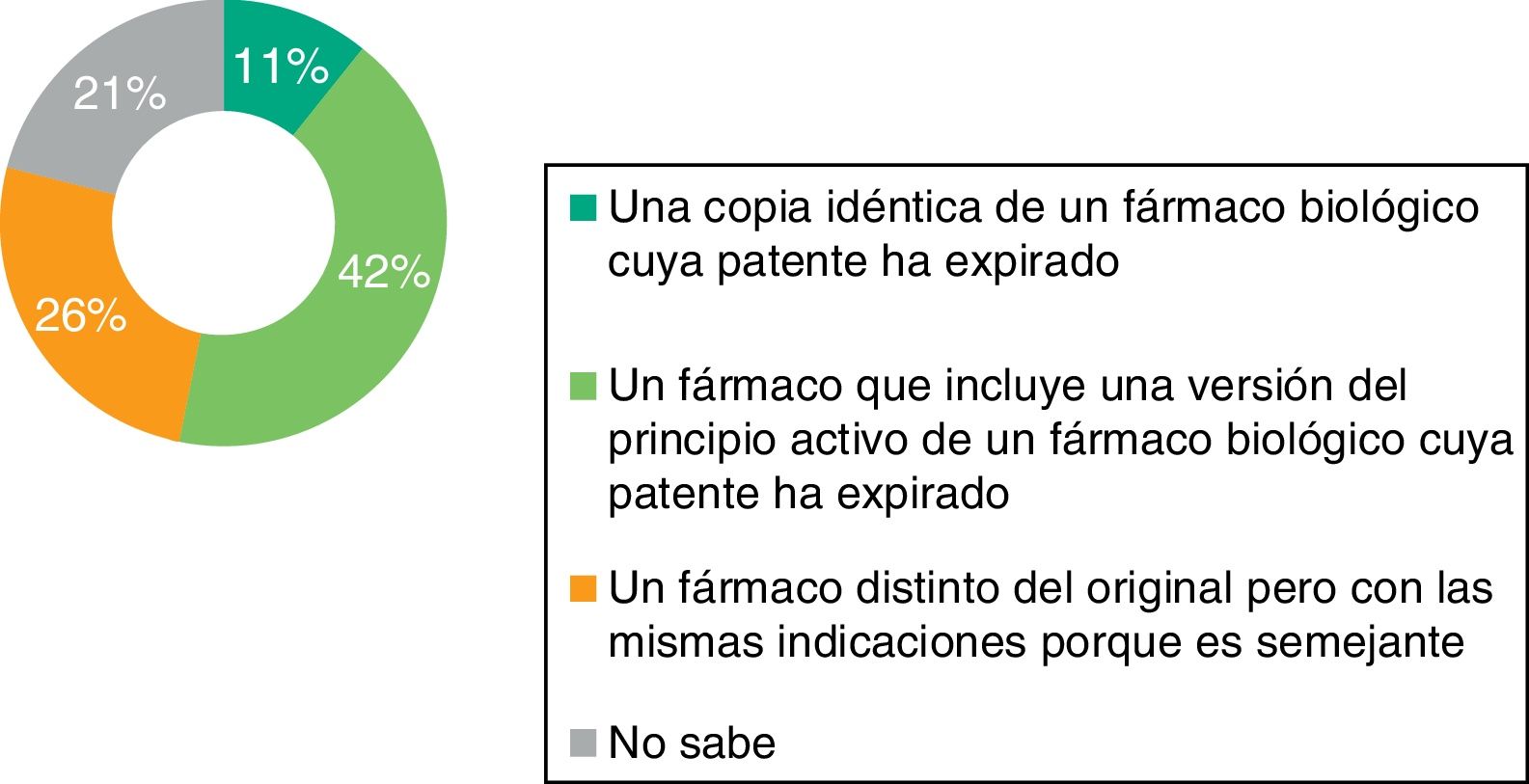
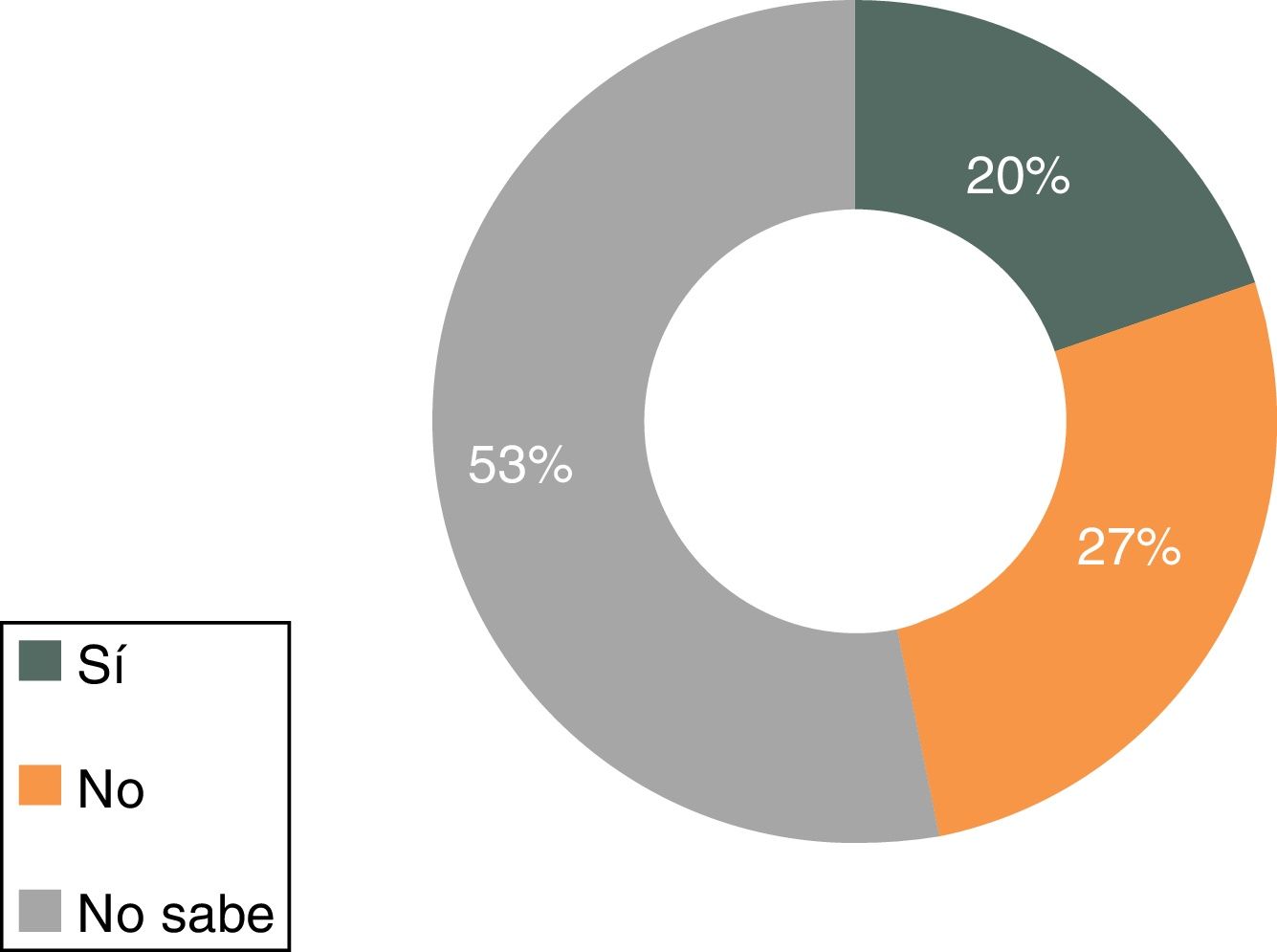
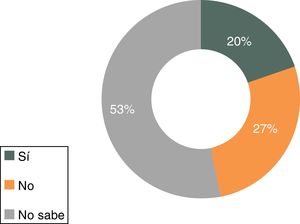
Solo el 42% de los médicos de AP que respondieron a la encuesta conoce la definición correcta de medicamento biosimilar (fig. 1); el 46% afirma saber qué diferencias existen entre el biosimilar y el medicamento biológico original o de referencia. Asimismo, solo el 27% sabe que el manejo de biosimilares no es equiparable al manejo del genérico y el 53% admite no saberlo (fig. 2).
Conocimientos sobre las diferencias entre biológicos y biosimilares. Desarrollo de biosimilaresLa gran mayoría de los médicos que respondieron a la encuesta (84%) desconoce que el programa clínico de desarrollo de biosimilares y biológicos de referencia es distinto. Más de la mitad de los respondedores desconoce el objetivo principal del desarrollo clínico de biosimilares y aproximadamente el 40% afirma correctamente que el desarrollo clínico de biosimilares está dirigido a demostrar comparabilidad, no a demostrar eficacia y seguridad.
Con respecto a la extrapolación de indicaciones, el 85% de los respondedores desconoce que el biosimilar puede tener alguna de las indicaciones del original mediante extrapolación, sin datos clínicos de eficacia y seguridad en esas indicaciones.
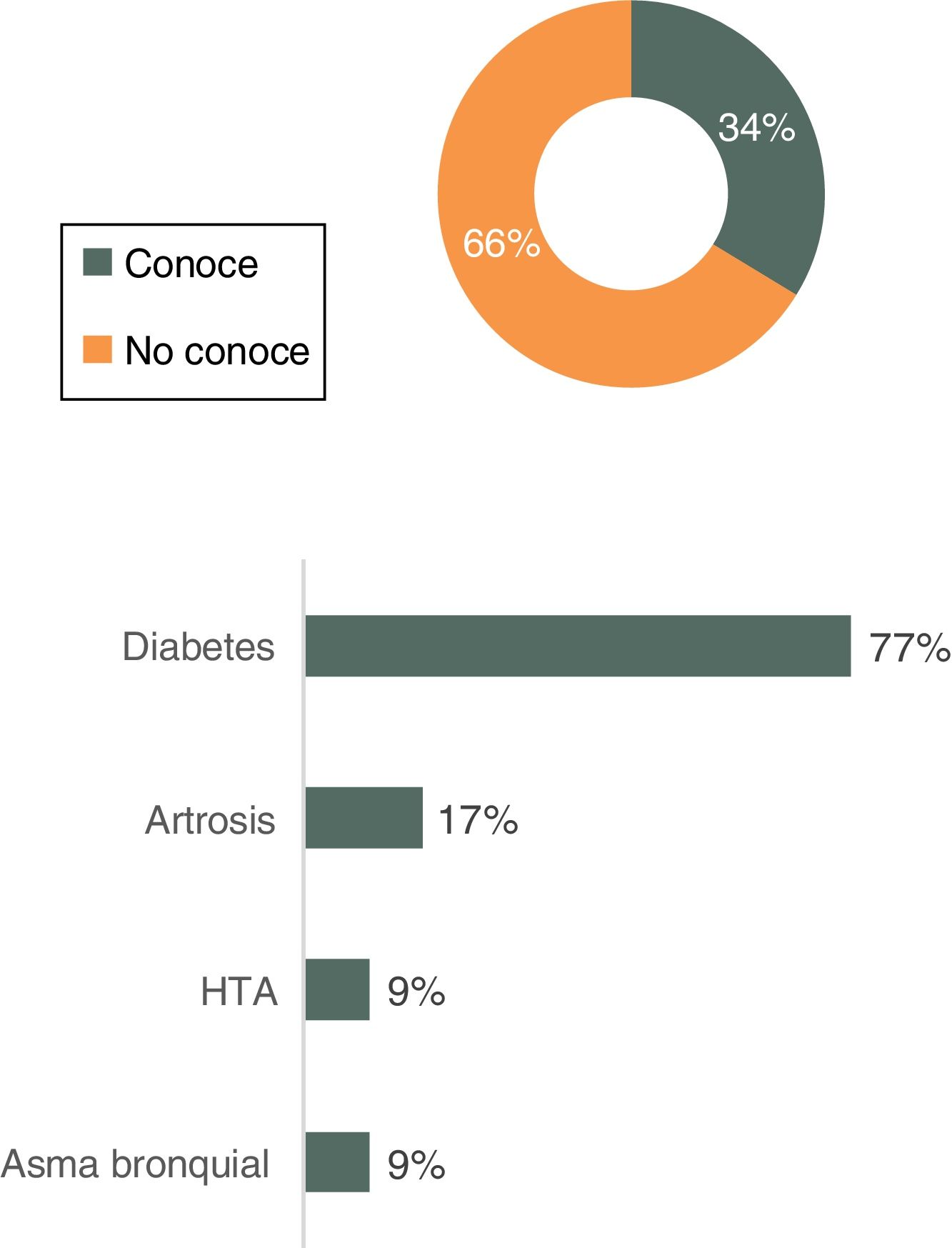
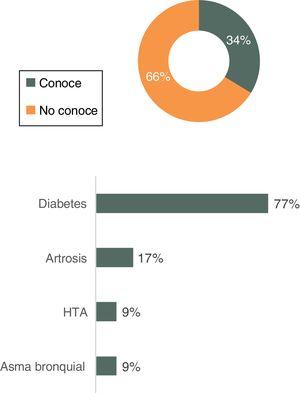
Comercialización de biosimilares en Atención PrimariaEl 66% de los médicos no conoce ningún biosimilar comercializado en el ámbito de la AP, mientras que el 26% sí conoce alguno e identifica correctamente el área terapéutica correspondiente al tratamiento de la diabetes (fig. 3).
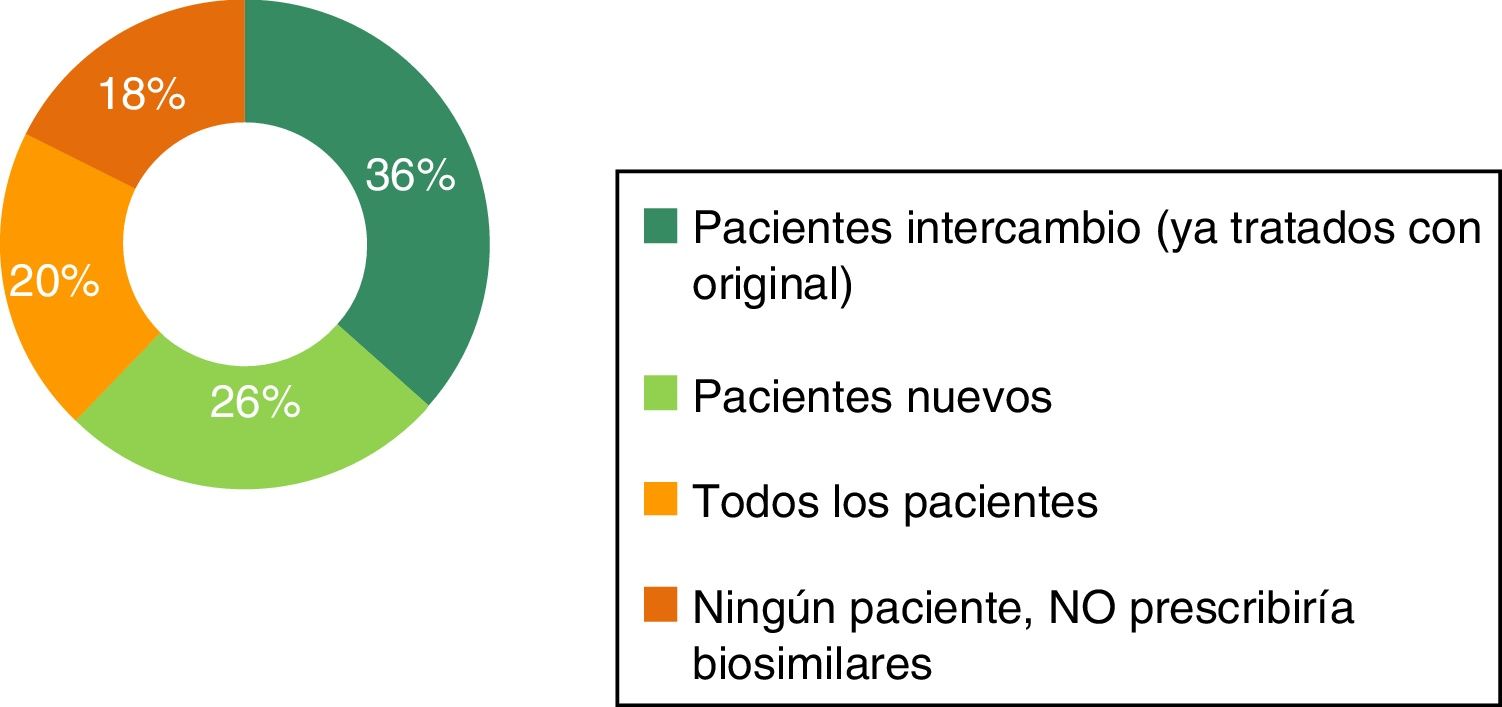
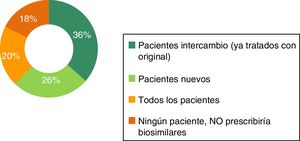
Prescripción de biosimilaresLa mayoría de los respondedores (86%) no tiene experiencia en la prescripción de biosimilares. Con respecto al perfil de pacientes en los que prescribir biosimilares, se observan diferencias entre los médicos con experiencia en la prescripción y los que no tienen experiencia (figs. 4 y 5). Entre los médicos con experiencia (n=98), el 50% prescribiría en todos los pacientes, el 34% prescribiría en pacientes nuevos y el 13% prescribiría en pacientes ya tratados con el original de referencia (intercambio). Entre los médicos sin experiencia en el uso de biosimilares, el 36% prescribiría en pacientes ya tratados con el original de referencia (intercambio), el 26% prescribiría en pacientes nuevos y el 20% prescribiría biosimilares en todos los pacientes.
El porcentaje de médicos que no prescribiría biosimilares a ningún paciente es en general bajo, siendo mayor entre los médicos sin experiencia en el uso de biosimilares (18%, en comparación con el 3% entre los médicos con experiencia).
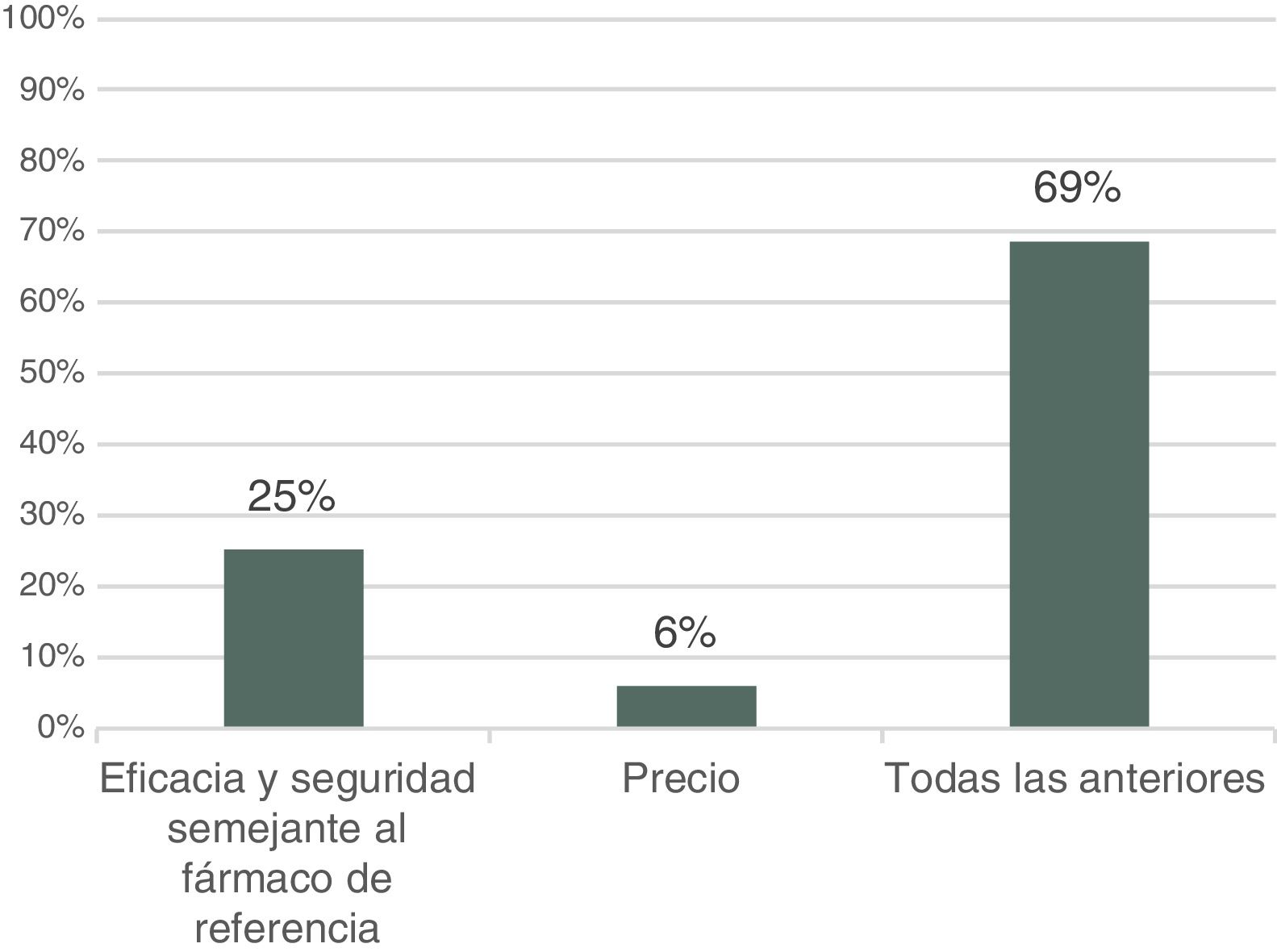
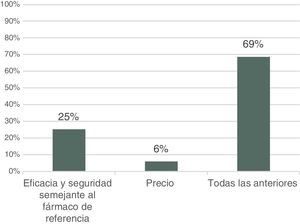
Entre las razones que justificarían el uso de biosimilares, el 69% de respondedores afirma que tanto el perfil de eficacia y seguridad (similar al del biológico original) como el precio son la principal motivación para su uso, mientras que un 25% lo justificaría solo en el perfil de eficacia y seguridad similar, y un 6% exclusivamente en su precio (fig. 6).
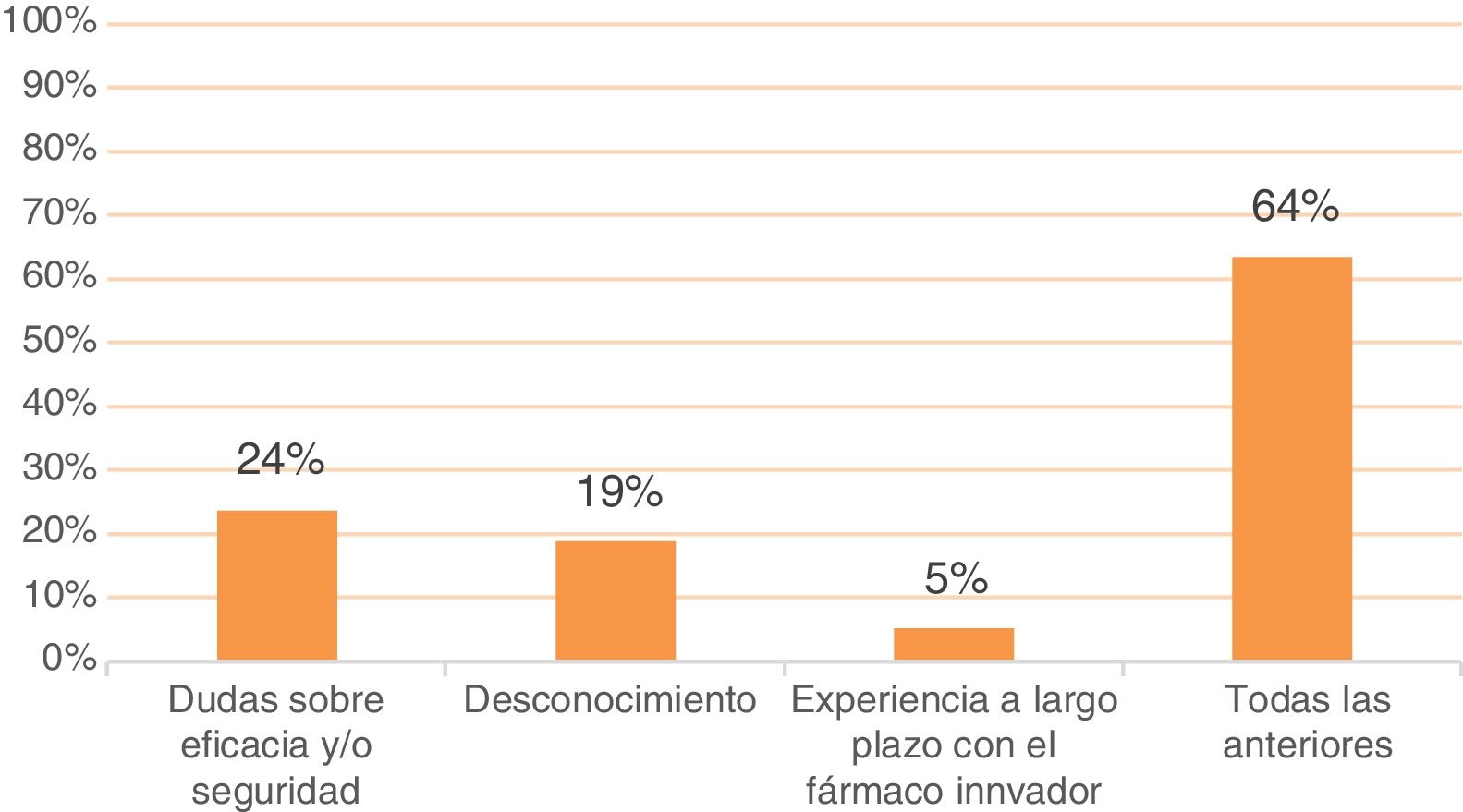
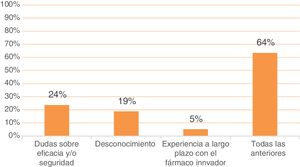
Entre las principales limitaciones para su uso, destaca que un 64% de los médicos de AP afirma que las dudas sobre eficacia y seguridad, el desconocimiento y la experiencia a largo plazo acumulada con el biológico original son los principales frenos para el uso de biosimilares. Adicionalmente, el 24% de médicos de AP justificaría la no prescripción de biosimilares solo por dudas sobre eficacia y/o seguridad, el 19% solo por desconocimiento y el 5% solo por la experiencia con el biológico original (fig. 7).
Trazabilidad y farmacovigilanciaEl 75% de los respondedores está de acuerdo con que la trazabilidad puede verse comprometida por la intercambiabilidad y la sustitución automática de biosimilares y sus biológicos originales.
El 68% de los médicos de AP sabe que los biosimilares están sometidos a un seguimiento especial de farmacovigilancia tras su autorización. Sin embargo, el 88% de los respondedores desconoce en qué consiste este seguimiento.
Conocimientos sobre sostenibilidadEl 35% de los médicos de AP respondedores considera que los biosimilares contribuyen a la sostenibilidad del SNS, mientras que un 8% considera que no contribuyen y un 57% no lo sabe.
Con respecto al precio de biosimilares y al sistema de precios de referencia, solo el 25% de los médicos de AP sabe que los biosimilares forman conjunto de referencia y que tienen a partir de ese momento el mismo precio que el biológico original.
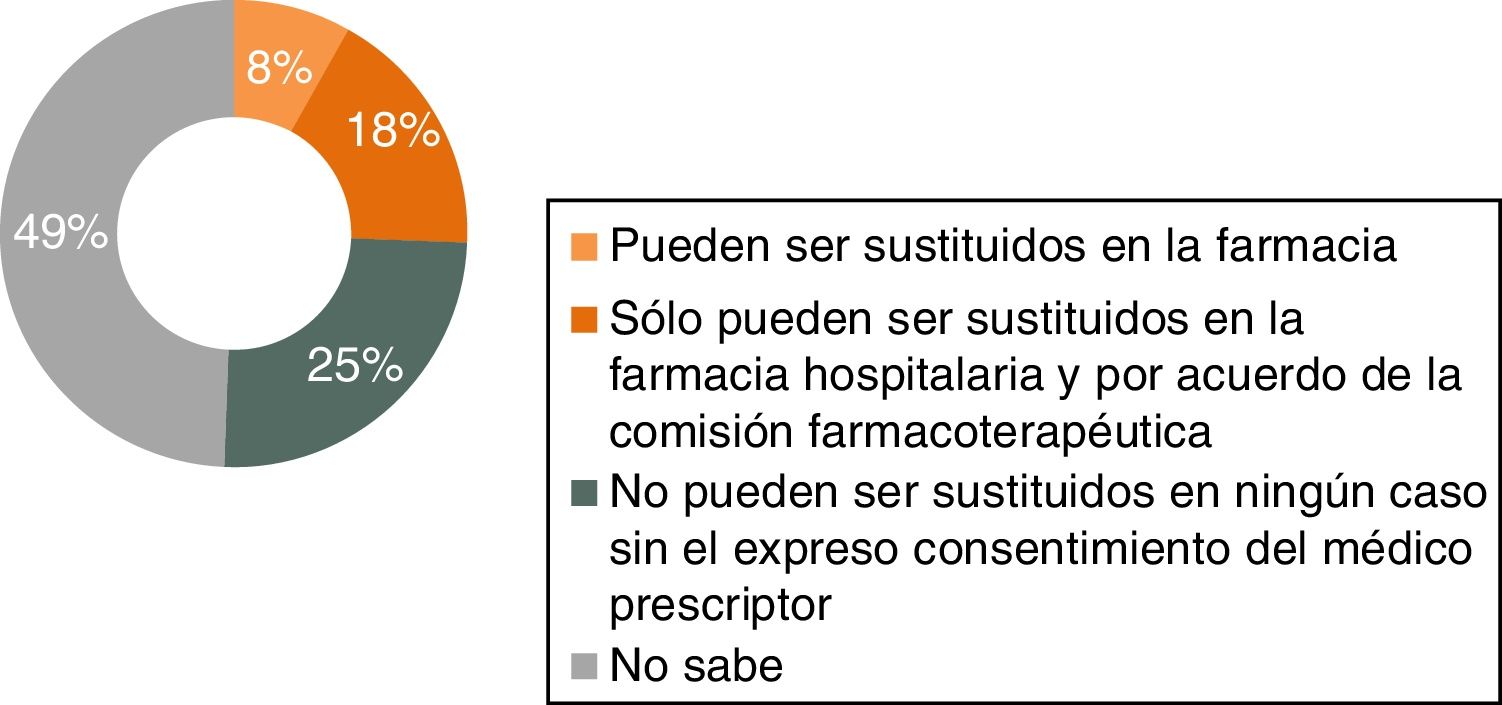
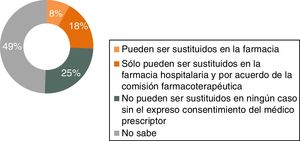
Conocimientos sobre el marco legalEl 94% de los médicos de AP respondedores afirma desconocer el marco legal en España para el manejo de biológicos originales y biosimilares. Este alto porcentaje de desconocimiento también se refleja en el conocimiento sobre la regulación de la intercambiabilidad (71%) y en el relacionado con los procedimientos relativos a prescripción y sustitución automática: el 85% de los médicos de AP desconoce que los biológicos (biosimilares y originales) deben recetarse siempre por marca comercial, y solo el 25% sabe que no pueden ser sustituidos sin consentimiento expreso del médico prescriptor (fig. 8).
Formación del médicoLa mayoría de los respondedores afirma que en su área de trabajo no existen actividades formativas sobre biológicos/biosimilares promovidas por la Administración Pública o por otras entidades ajenas a la misma (95% y 82%, respectivamente). El 5% de médicos declara haber recibido formación promovida por la Administración Pública; los tipos más frecuentes son sesiones informativas o charlas y presentaciones. Un 18% de los respondedores afirma haber recibido información sobre biosimilares por parte de entidades ajenas a la Administración Pública, principalmente compañías farmacéuticas, seguido de sociedades científicas, prensa especializada, cursos/congresos, y otras fuentes.
Con respecto a la formación en biológicos y biosimilares, se solicitaba valorarla empleando la siguiente escala: inexistente (0), muy mala (1-2), mala (3-4), normal (5-6), buena (7-8), excelente (9-10). La mayoría de médicos respondedores (aproximadamente un 70%) considera tener una formación inexistente o mala, un 22% considera su nivel como «normal» y solo el 8,5% considera que su formación es buena.
En términos de demanda de formación, prácticamente a la totalidad de médicos respondedores (92%) les gustaría recibir formación, siendo el canal preferido la formación online (42%), seguido de las jornadas/congresos (26%), a través del Centro de Salud (24%) y otros (3%).
DiscusiónLa encuesta de SEMERGEN sobre conocimiento de los fármacos biosimilares por parte del médico de AP se realizó como una estrategia para profundizar en el conocimiento y detectar las posibles necesidades formativas de los médicos de familia sobre este grupo de medicamentos. Se seleccionó como muestra para el estudio a un amplio número de médicos de AP socios de SEMERGEN por resultar representativos del conocimiento que de esta materia tienen los médicos de familia en España.
Las características sociodemográficas y profesionales de los respondedores se ajustan a las características socioprofesionales de los socios de SEMERGEN (datos no publicados).
Los resultados de la encuesta dejan patente que el conocimiento existente en los médicos de AP sobre biológicos (originales o biosimilares) es bastante deficitario, ya que existe un elevado porcentaje de respondedores que no sabían definir de forma correcta un medicamento biosimilar o que desconocían las diferencias existentes entre medicamentos biológicos originales y biosimilares. Otros aspectos en relación con el desarrollo clínico de estos medicamentos o con el objetivo de este desarrollo también se mostraron desconocidos para la inmensa mayoría de respondedores.
El término «biosimilar» es un término técnico que hace referencia al tipo de autorización de este tipo de medicamentos, que aparece una vez vencida la patente del medicamento biológico original. Debido a la importancia que en los medicamentos biológicos tiene su proceso de obtención, la utilización de un nuevo proceso por otra compañía resulta en una copia no idéntica del medicamento biológico original. Se considera que el biosimilar es una nueva «versión» de la sustancia biológica original, que ha demostrado su similitud mediante un ejercicio exhaustivo de comparabilidad1,8. Esta diferencia entre los biosimilares y los genéricos de origen químico, que sí son considerados «la misma sustancia» que su medicamento de referencia, es un concepto fundamental para el buen manejo de biosimilares.
Es importante entender que la autorización del medicamento biosimilar se basa en un ejercicio de comparabilidad extenso con el medicamento original tanto a nivel básico (de estructura química, actividad biológica y farmacocinética) como en términos de inmunogenicidad y, en algunas ocasiones, de aspectos de eficacia y seguridad clínicas, que permiten concluir que el biosimilar tiene los mismos efectos terapéuticos que el medicamento original7,10. El objetivo del desarrollo de los medicamentos biosimilares no es demostrar eficacia o seguridad, sino comparabilidad con el medicamento original de referencia. El biosimilar no debe demostrar por tanto sus datos propios de eficacia ni tampoco se deben realizar ensayos clínicos en cada una de las indicaciones aprobadas para el biológico original. Cada indicación se valora individualmente durante la evaluación del biosimilar por parte de la EMA, teniendo en cuenta la similitud demostrada en aquellos aspectos que determinan la eficacia y seguridad en cada indicación. Tras esta evaluación se concluye, sobre las indicaciones y pautas posológicas aprobadas para el biosimilar, que excepcionalmente podrían ser no todas las del biológico original si existiera alguna incertidumbre que requiriera estudios adicionales.
La mayoría de los médicos respondedores desconoce los biosimilares comercializados en el ámbito de AP.
Debe señalarse que el conocimiento de los médicos de AP sobre biosimilares es clave no solo para los medicamentos propios de AP (insulinas, heparinas), sino también para medicamentos biológicos y biosimilares prescritos por otros especialistas, porque cada vez más estos medicamentos forman parte de tratamientos crónicos de pacientes que son atendidos por el médico de AP. Los resultados de la encuesta ponen de manifiesto que los médicos de AP tienen un gran desconocimiento sobre las cuestiones relacionadas con la intercambiabilidad, prescripción (por marca) y sustitución de biosimilares. La mayoría de los respondedores también afirma que desconoce por completo la legislación específica para biosimilares/biológicos en estos aspectos. El 94% afirma desconocer el marco legal en España para el manejo de biológicos originales y biosimilares. Este desconocimiento no exime de la responsabilidad que tenemos en la prescripción propia ni en la inducida por médicos de otras especialidades.
En relación con los aspectos legales en la prescripción de medicamentos biológicos, cabe destacar que el marco aplicable tiene un doble origen —la normativa comunitaria y la legislación estatal española— que traspone las directivas comunitarias. Estas directivas que se ocupan de biosimilares arrancan en 2001 (Directiva 2001/83/CE) y siempre han estado orientadas a garantizar a todos los ciudadanos comunitarios la calidad, la seguridad y la eficacia de estos medicamentos. La EMA ha ido aprobando desde 2006 directrices específicas a modo de recomendaciones vinculantes para el desarrollo y aprobación de este tipo de medicamentos.
Posteriormente, las autoridades comunitarias han completado el marco regulatorio con otras directrices y reglamentos que son de obligada observancia en todos los Estados miembros de la UE. Dichas normas establecen la obligatoriedad de la prescripción por marca para medicamentos de origen biológico y estrictas reglas de farmacovigilancia.
A la primera de estas cuestiones, a la prescripción por marca, se dedica la Directiva de asistencia sanitaria transfronteriza (2011/24/EU), que ha sido incorporada a nuestra legislación a través del Real Decreto 81/2014, de 7 de febrero, que fija el contenido a expresar en las recetas, para lo cual modifica el Real Decreto 1718/2010.
En materia de farmacovigilancia, las Directivas 2010/84/EU y 2012/26/UE, y los Reglamentos 1235/2010 y 1027/2012, han sido incorporados a nuestro ordenamiento jurídico a través de la llamada Ley de Farmacovigilancia (Ley 10/2013 de 24 de julio) y el Real Decreto 577/2013, que recogen la necesidad de un seguimiento especial de farmacovigilancia para medicamentos biológicos nuevos —incluyendo biosimilares— durante un periodo de al menos 5 años tras la comercialización, así como la obligación de incluir en fichas técnicas y en los materiales de acondicionamiento y promoción del medicamento un símbolo o pictograma (triángulo negro invertido) alertando de este seguimiento.
La intercambiabilidad y la sustitución (automática por el farmacéutico) de biológicos son materias cuya regulación corresponde en exclusiva a los Estados miembros; en este caso, a España. En este sentido, la Ley de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios reconoce en su artículo 45 el carácter de medicamentos especiales de los medicamentos biológicos y establece en su artículo 89.5 que los biosimilares se regirán por sus «reglas específicas de sustitución e intercambiabilidad». En desarrollo de lo dispuesto en la Ley de Garantías se aprobó la Orden SCO/2874/2007, de 28 de septiembre, que establece que los medicamentos biológicos no son sustituibles, sin diferenciar su condición de originales o biosimilares.
Hay que señalar que el concepto de intercambiabilidad en Europa, a diferencia de Estados Unidos, no se refiere a un atributo del medicamento, sino a una actuación médica según la cual se cambiaría un medicamento por otro del que se espera el efecto clínico semejante1. La intercambiabilidad es una facultad del médico prescriptor11, quien, una vez valoradas desde el punto de vista clínico y económico las distintas opciones terapéuticas, decide, esto es, prescribe el biológico original o biosimilar que, a su juicio, sea el más adecuado para un paciente determinado12,13. Una vez iniciado el tratamiento en un paciente concreto con una marca determinada, si la respuesta es adecuada, lo razonable es no hacer cambios que no estén basados en motivos clínicos.
La trazabilidad es un aspecto estrechamente ligado al compromiso de farmacovigilancia, cuyo respeto estricto supone una de las garantías para la correcta introducción de biosimilares. La encuesta ha puesto de manifiesto que los médicos de AP afirman tener escaso conocimiento sobre estos aspectos esenciales de farmacovigilancia. La farmacovigilancia en biosimilares se realiza ligada al medicamento concreto, no al principio activo. Para ello es imprescindible identificar claramente el medicamento administrado al paciente a lo largo de todo el circuito, desde su fabricación y transporte hasta su administración. Teniendo en cuenta que biosimilar y original de referencia tienen la misma denominación común internacional, es de vital importancia que se respete la legislación vigente y que los medicamentos biológicos se prescriban por marca comercial y nunca solo por principio activo. El biosimilar y biológico original de referencia, aunque incluyan versiones de un mismo principio activo, no pueden considerarse idénticos y deben ser diferenciados desde el punto de vista de notificación de reacciones adversas, lo que permite poder asignar correctamente estas reacciones a cada biológico concreto. En el caso de los biosimilares, al igual que si se tratara de un nuevo principio activo biológico que sale al mercado, y a diferencia de los genéricos, durante los primeros años de comercialización, los profesionales deben notificar las sospechas de reacciones adversas identificando marca y lote, incluso aunque se trate de reacciones ya recogidas en la ficha técnica. Esto se debe a que, aunque se espera que el perfil de seguridad del biosimilar sea semejante al del original de referencia, podrían producirse diferencias en las reacciones adversas aparecidas o en la frecuencia de aparición de las mismas.
Los respondedores afirman tener una percepción limitada sobre la contribución de los biosimilares a la sostenibilidad y un notable desconocimiento sobre el precio de los biosimilares. La incorporación de un biosimilar al SNS se realiza con una disminución de precio sobre el original que puede oscilar alrededor del 20-25%. Al cabo de unos meses, si el original no ha bajado antes el precio de forma voluntaria, lo hará el sistema de precios de referencia, que iguala los precios de biosimilares y original para el SNS. En ocasiones, la competencia entre las distintas marcas permite al sistema obtener descuentos adicionales.
La mayoría de los médicos que han respondido a la encuesta afirma tener una escasa o mala formación y disponer de pocas posibilidades de formación, pública o privada. Asimismo, la práctica totalidad de respondedores afirma estar interesado en recibir más formación, preferiblemente en formato online.
El 95% de los respondedores afirma que no existen en su zona de trabajo actividades formativas sobre biológicos/biosimilares promovidas por la Administración Pública.
La mayoría de los médicos no ha recibido la formación adecuada y esto es una oportunidad para la Administración Pública. En esta época de recomendaciones de la UE (directriz 55/2013), SEMERGEN, como sociedad científica, tiende la mano a la Administración para que los profesionales médicos mantengan actualizados sus conocimientos14 e incorporen los conceptos de seguridad del paciente, corresponsabilidad y sostenibilidad del sistema.
ConclusionesLas encuestas de conocimientos, actitudes y práctica dan un aporte importante, no solo a la comprensión, sino que permiten establecer las deficiencias y necesidades de formación e información que tienen los profesionales sanitarios. En este sentido, podemos afirmar que el conocimiento de los médicos de AP sobre biosimilares es bajo. La encuesta pone de manifiesto las necesidades de formación de los médicos de AP sobre los biosimilares, así como sobre aspectos legales de su prescripción, intercambiabilidad y obligaciones de farmacovigilancia.
En previsión del esperado incremento de biosimilares en el ámbito de AP en los próximos años, y teniendo en cuenta el papel esencial de los médicos de familia en el manejo de pacientes tratados con biosimilares (y biológicos) desde el ámbito hospitalario, deberían implantarse iniciativas de formación sobre biosimilares con el objetivo de garantizar que la incorporación de los mismos al sistema se realice de forma adecuada para el SNS, manteniendo el correcto tratamiento de los pacientes y cumpliendo con las normas sobre el manejo y la farmacovigilancia de estos medicamentos.
FinanciaciónEste trabajo ha sido posible gracias a una beca no condicionada de laboratorios Sanofi-Aventis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todos los médicos de familia su colaboración en la cumplimentación de la encuesta. La realización de este trabajo se la debemos a ellos.