El cáncer hepático, ya sea primario o secundario, representa uno de los más frecuentes en México. La realización de procedimientos quirúrgicos con fines terapéuticos y paliativos se ha vuelto cada vez más frecuente y precisa, con una morbimortalidad decreciente de manera exponencial a medida que los mecanismos fisiopatológicos asociados al procedimiento se hacen evidentes. El manejo anestésico del paciente oncológico sometido a hepatectomía representa un reto diagnóstico y terapéutico importante e involucra al anestesiólogo de manera activa en el proceso completo, desde la selección de los pacientes y la estadificación de la disfunción hepática y las morbilidades asociadas directa e indirectamente a la enfermedad subyacente, hasta el manejo activo en el periodo transoperatorio, concluyendo con un adecuado manejo postoperatorio del paciente. Se hace, por tanto, necesaria una revisión de las implicaciones que esto conlleva, tanto de enfermedades asociadas como de aquellas modificaciones orgánicas inherentes a la enfermedad y su tratamiento.
Hepatic cancer, either primary or secondary, is one of the most common cancer types in Mexico. Surgical procedures with palliative or therapeutic purpose have become more frequent and precise, with exponentially decreasing morbidity and mortality as procedure-related pathophysiological mechanisms become clear. Anaesthetic management of the oncological patient undergoing hepatectomy is now a diagnostic and therapeutic challenge, actively involving the anaesthesiologist in all aspects of care, from patient screening, and assessment of liver function and underlying disease related morbidities, to an active peri-operative approach, ending with the appropriate post-operative patient management. Thus, a wider review about the related diseases, their organic changes, as well as their treatment, becomes necessary.
La hepatectomía constituye uno de los pilares para el tratamiento del cáncer hepático, tanto primario como secundario; sin embargo, a pesar de los esfuerzos realizados por mejorar el pronóstico de los pacientes sometidos a esta intervención, se continúa teniendo una morbimortalidad perioperatoria elevada.
El manejo anestésico requiere un conocimiento amplio, no solo de las implicaciones quirúrgicas, sino de las alteraciones orgánicas pre, trans y postoperatorias. En el caso específico del paciente con cáncer, es de vital importancia prestar atención a las implicaciones de la terapéutica asociada.
El papel del anestesiólogo no debe limitarse a la atención dentro del quirófano, sino que debe adoptar un enfoque verdaderamente perioperatorio, iniciando con una adecuada valoración preanestésica, una selección de pacientes con base en criterios clínicos específicos, conocimiento de la técnica quirúrgica y de las modificaciones de la fisiología hepática derivadas de la manipulación quirúrgica, implicaciones farmacológicas y orgánicas de los agentes quimioterápicos, así como de radioterapia, balance hidroelectrolítico, equilibrio ácido-base, además de un adecuado control del dolor postoperatorio, entre otros.
GeneralidadesEl cáncer hepático ocupa el quinto lugar en incidencia a nivel mundial, la tercera causa de muerte relacionada con el cáncer y supone un 7% del total de cánceres1. El carcinoma hepatocelular (CHC) representa más del 90% de los cánceres primarios de hígado, constituyendo un problema de salud mundial. La incidencia de CHC aumenta progresivamente con el avance de la edad en todas las poblaciones, y alcanza un máximo a los 70 años2. Predomina en el sexo masculino, con una relación de hombre a mujer de 2 a 41.
Aproximadamente el 90% de los CHC se asocian a factores de riesgo subyacente conocidos. Los factores más frecuentes son la hepatitis vírica crónica (tipos B y C), el consumo de alcohol y la exposición a aflatoxina3.
La clasificación del cáncer pretende establecer un pronóstico y promover la selección de un tratamiento adecuado para los mejores candidatos. Adicionalmente, permite un intercambio de información, así como el diseño de ensayos clínicos con criterios comparables. En los pacientes con CHC, a diferencia de la mayoría de los que tienen tumores sólidos, la coexistencia de 2 condiciones que amenazan directamente la vida, a saber, cáncer y cirrosis, complica la evaluación pronóstica4.
Con base en datos reportados acerca de la historia natural de la enfermedad, los principales factores pronósticos en pacientes con CHC se relacionan directamente con el estado del tumor (número y tamaño de nódulos, presencia de invasión vascular y diseminación extrahepática), la función hepática (clasificación de Child-Pugh, bilirrubina, albúmina, hipertensión portal y ascitis) y el estado físico general (ECOG, Karnofsky y presencia de sintomatología). La etiología aún no ha sido identificada como un factor pronóstico5.
Las guías de práctica clínica vigentes de la Asociación Europea para el Estudio del Hígado en conjunto con la Organización Europea para Investigación y Tratamiento del Cáncer respaldan la clasificación de la Clínica de Cáncer Hepático de Barcelona5,6, puesto que incluyen algunas variables pronósticas, como estado tumoral, función hepática y estado general de salud, junto con variables dependientes del tratamiento, las cuales han sido obtenidas de estudios de cohorte y ensayos clínicos aleatorizados, además de haber sido validadas de manera externa en diversos escenarios clínicos7,8.
En estos momentos, la cirugía constituye el eje principal del tratamiento del CHC; la resección y el trasplante logran los mejores resultados en candidatos sometidos a una rigurosa selección, con una supervivencia a 5 años del 60-80%, compitiendo como la primer opción en pacientes con tumores tempranos en una perspectiva terapéutica9.
La resección hepática es el tratamiento de elección en CHC en pacientes no cirróticos10 en quienes las resecciones mayores se pueden realizar con menor índice de complicaciones, así como con un resultado clínico aceptable, representando una supervivencia de entre un 30 y un 50% a 5 años11. Los estándares actuales para la resección del CHC en pacientes cirróticos se definen de acuerdo con el panel de expertos de la siguiente manera: índices de supervivencia esperada a 5 años de un 60%, con una mortalidad perioperatoria del 2-3% y requerimientos de hemotransfusión menores de un 10%12–14.
Valoración preanestésicaDebido a la falta de estudios prospectivos de gran tamaño, la determinación fidedigna del riesgo de este tipo de pacientes tiene poca exactitud. El pronóstico se ve afectado de manera directa tanto por la severidad y la naturaleza de la hepatopatía subyacente como por el tipo y la extensión de la cirugía prevista15,16.
La presencia de ictericia obstructiva incrementa de manera importante la mortalidad perioperatoria; numerosos estudios han reportado factores de riesgo en pacientes con esta condición, los cuales incluyen hematocrito inicial>30%, bilirrubina total>11mg/dl, presencia de malignidad, creatinina sérica>1.4mg/dl, concentración de albúmina>3.0g/dl, edad mayor a 65 años, concentración de AST>90UI/l y nitrógeno ureico>19mg/dl17–19.
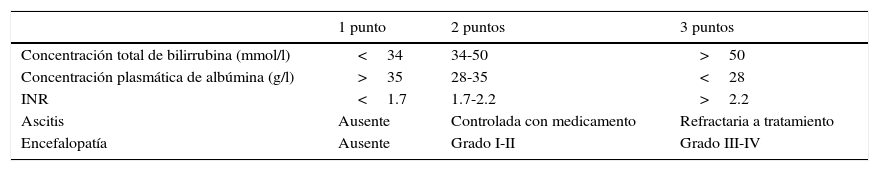
Una evaluación precisa de la extensión y la severidad de la hepatopatía subyacente provee una determinación efectiva del riesgo perioperatorio. La escala de Child-Turcotte-Pugh (tabla 1) y la escala Model for End-stage Liver Disease (MELD) (tabla 2) han sido ampliamente utilizadas para este propósito20.
Clasificación Child-Turcotte-Pugh
| 1 punto | 2 puntos | 3 puntos | |
|---|---|---|---|
| Concentración total de bilirrubina (mmol/l) | <34 | 34-50 | >50 |
| Concentración plasmática de albúmina (g/l) | >35 | 28-35 | <28 |
| INR | <1.7 | 1.7-2.2 | >2.2 |
| Ascitis | Ausente | Controlada con medicamento | Refractaria a tratamiento |
| Encefalopatía | Ausente | Grado I-II | Grado III-IV |
Clase A=5-6 puntos; clase B=7-9 puntos; clase C=10-15 puntos. En pacientes con enfermedad colestásica, agregar un punto por concentración de bilirrubina de hasta 68mmol/l, 2 puntos si está entre 68-170mmol/l, y 3 puntos si es>170mmol/l.
Fuente: Adaptada de Selzner et al.32.
Una ventaja de la escala MELD es que provee una escala continua que puede ser adecuada según el tipo de cirugía que será realizada. Un paciente con un puntaje MELD<10 puede ingresar generalmente a cirugía; si el puntaje se localiza entre 10-15 deben ser tomadas ciertas precauciones; por último, con un puntaje MELD>15 se debe considerar reprogramar el procedimiento electivo y considerar al paciente como candidato a trasplante hepático21.
La hipertensión portal constituye un predictor superior para resultados adversos en pacientes cirróticos en quienes se realizará resección hepática si se compara con la clasificación de Child-Turcotte-Pugh. Se ha propuesto la medición de la presión portal en pacientes cirróticos durante la evaluación para la resección de CHC22; sin embargo, esta medida no es realizada de manera rutinaria. Clínicamente, la presencia de hipertensión portal subyacente puede ser asociada con la presencia de varices, ascitis o recuento plaquetario menor de 100,000/mm3 en presencia de esplenomegalia.
Estos hallazgos pueden obviar la necesidad de medición invasiva del gradiente de presión de la vena hepática previo a la cirugía. Una revisión retrospectiva de 587 pacientes en quienes se realizó resección de lesiones hepáticas múltiples evaluó el valor predictivo de la escala MELD en relación con los resultados, y si bien no existió una asociación significativa entre la escala MELD y la morbimortalidad posterior a la resección hepática, el 91% de los pacientes en estas series tuvieron poca o ninguna evidencia de disfunción hepática23.
La selección de pacientes es cada vez más refinada; el énfasis en el diagnóstico oportuno y la mejora en las técnicas quirúrgicas han conducido a una disminución en la mortalidad a 5 años24. Un gradiente de presión portal<10mmHg y una concentración sérica total normal de bilirrubina han demostrado ser predictores superiores en los resultados posquirúrgicos, con unas tasas de supervivencia a 5 años superiores al 70%. En contraste, un gradiente venoso aumentado a la par que la concentración sérica total de bilirrubina (>1mg/dl) se asocian con tasas de supervivencia a 5 años menores a un 30%, independientemente de la clasificación de Child-Turcotte-Pugh del paciente25.
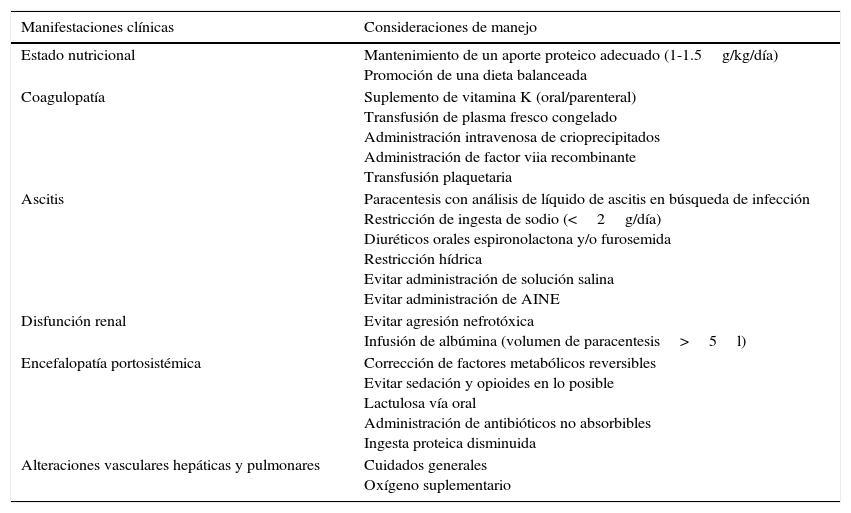
Las consideraciones específicas en el manejo perioperatorio del paciente cirrótico se resumen en la tabla 326.
Manejo perioperatorio de las complicaciones en la enfermedad hepática avanzada
| Manifestaciones clínicas | Consideraciones de manejo |
|---|---|
| Estado nutricional | Mantenimiento de un aporte proteico adecuado (1-1.5g/kg/día) Promoción de una dieta balanceada |
| Coagulopatía | Suplemento de vitamina K (oral/parenteral) Transfusión de plasma fresco congelado Administración intravenosa de crioprecipitados Administración de factor viia recombinante Transfusión plaquetaria |
| Ascitis | Paracentesis con análisis de líquido de ascitis en búsqueda de infección Restricción de ingesta de sodio (<2g/día) Diuréticos orales espironolactona y/o furosemida Restricción hídrica Evitar administración de solución salina Evitar administración de AINE |
| Disfunción renal | Evitar agresión nefrotóxica Infusión de albúmina (volumen de paracentesis>5l) |
| Encefalopatía portosistémica | Corrección de factores metabólicos reversibles Evitar sedación y opioides en lo posible Lactulosa vía oral Administración de antibióticos no absorbibles Ingesta proteica disminuida |
| Alteraciones vasculares hepáticas y pulmonares | Cuidados generales Oxígeno suplementario |
Es de vital importancia puntualizar en el uso de agentes quimioterápicos en el paciente sometido a hepatectomía, ya que las opciones terapéuticas no se limitan únicamente a CHC, sino que dependen en muchas ocasiones del tumor primario que haya dado origen al metastásico en hígado, aumentando así la complejidad y la variabilidad entre uno y otro paciente, quienes aparentemente serán sometidos al mismo procedimiento.
Los efectos de los agentes quimioterápicos se resumen por sistema orgánico afectado en la tabla 422.
Toxicidad orgánica asociada a quimioterapia
| Sistema orgánico | Agentes quimioterápicos asociados |
| Toxicidad pulmonar | Alcaloides (vincristina, vinblastina, etopósido), antibióticos citotóxicos (bleomicina, mitomicina-C, doxorrubicina), agentes alquilantes (ciclofosfamida, melfalán), antimetabolitos (metotrexato, azatioprina), modificadores de respuesta biológica (interleucina-2, interferón, sargramostim), taxanos |
| Toxicidad cardiaca | Citotóxicos, alcaloides, agentes alquilantes, platinos, modificadores de respuesta biológica |
| Toxicidad hepática | Nitrosureas, antimetabolitos, citotóxicos, alcaloides |
| Toxicidad renal | Nitrosureas, platinos, citotóxicos, antimetabolitos |
Los efectos orgánicos observados en el paciente dependerán principalmente del porcentaje de cuerpo irradiado, así como de la cantidad total de radiación administrada. Los efectos más importantes se observan en aquellos tumores en que es necesaria la radiación de segmentos corporales importantes. La sintomatología observada es, generalmente, variada y dependerá del órgano u órganos afectados; se pueden presentar náuseas y vómitos, diarrea intensa, despulimiento de la mucosa intestina, modificaciones del flujo renal e intestinal por alteración vascular y alteraciones en el sistema nervioso central, generalmente solo observadas en dosis masivas; dentro de las enfermedades tratables con radioterapia se encuentran el cáncer de mama, el cervicouterino, el de pulmón, ovario, senos paranasales, glándula salival, laringe y laringofaringe extensos, riñón, tiroides, tumores de cuerpo carotídeo y tumores testiculares no seminoma23.
Específicamente en el hígado, la radioterapia puede inducir hepatitis, generalmente a partir de dosis que rondan los 3,000cGy. Durante la fase aguda se puede observar una alteración de las enzimas hepáticas; alrededor del tercer mes se produce degeneración lipídica, acidofilia periportal e inflamación de los tabiques interlobulillares. Como cuadro clínico es común observar distensión abdominal, hepatomegalia y dolor hepático. Se recomienda de manera rutinaria evitar agentes hepatotóxicos24.
Consideraciones quirúrgicasEs importante recalcar que la morbimortalidad presenta una relación directa tanto con el número de segmentos a resecar como con el volumen sangrado, además de con otros factores propiamente quirúrgicos, como la duración de las exclusiones vasculares, totales o parciales, y la utilización de técnicas como la coagulación por argón27.
Según describe Spolverato, la resección hepática puede ser clasificada como mayor (3 o más segmentos resecados) o menor (resección menor de 3 segmentos).
Según las guías de práctica clínica de la International Hepato-Pacreato-Biliary Association, la clasificación de Brisbane (tablas 5-8) es actualmente aceptada para hacer referencia al tipo de hepatectomía a realizar28.
De igual manera, es de vital importancia para el anestesiólogo tomar en cuenta las generalidades para llevar a cabo este tipo de procedimientos, ya que de ello depende directamente el éxito o no de este y, por tanto, el resultado del tratamiento.
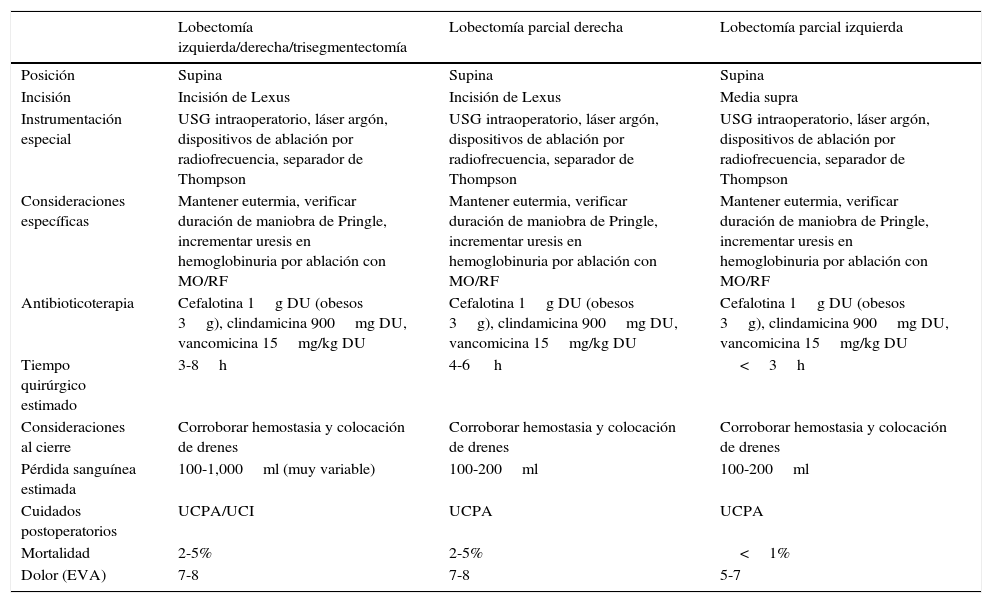
En la tabla 5 se resumen algunos de los puntos relevantes durante la planeación del acto quirúrgico.
Generalidades de técnica quirúrgica
| Lobectomía izquierda/derecha/trisegmentectomía | Lobectomía parcial derecha | Lobectomía parcial izquierda | |
|---|---|---|---|
| Posición | Supina | Supina | Supina |
| Incisión | Incisión de Lexus | Incisión de Lexus | Media supra |
| Instrumentación especial | USG intraoperatorio, láser argón, dispositivos de ablación por radiofrecuencia, separador de Thompson | USG intraoperatorio, láser argón, dispositivos de ablación por radiofrecuencia, separador de Thompson | USG intraoperatorio, láser argón, dispositivos de ablación por radiofrecuencia, separador de Thompson |
| Consideraciones específicas | Mantener eutermia, verificar duración de maniobra de Pringle, incrementar uresis en hemoglobinuria por ablación con MO/RF | Mantener eutermia, verificar duración de maniobra de Pringle, incrementar uresis en hemoglobinuria por ablación con MO/RF | Mantener eutermia, verificar duración de maniobra de Pringle, incrementar uresis en hemoglobinuria por ablación con MO/RF |
| Antibioticoterapia | Cefalotina 1g DU (obesos 3g), clindamicina 900mg DU, vancomicina 15mg/kg DU | Cefalotina 1g DU (obesos 3g), clindamicina 900mg DU, vancomicina 15mg/kg DU | Cefalotina 1g DU (obesos 3g), clindamicina 900mg DU, vancomicina 15mg/kg DU |
| Tiempo quirúrgico estimado | 3-8h | 4-6 h | <3h |
| Consideraciones al cierre | Corroborar hemostasia y colocación de drenes | Corroborar hemostasia y colocación de drenes | Corroborar hemostasia y colocación de drenes |
| Pérdida sanguínea estimada | 100-1,000ml (muy variable) | 100-200ml | 100-200ml |
| Cuidados postoperatorios | UCPA/UCI | UCPA | UCPA |
| Mortalidad | 2-5% | 2-5% | <1% |
| Dolor (EVA) | 7-8 | 7-8 | 5-7 |
El procedimiento quirúrgico puede dividirse en 3 fases principales: fase inicial, resección propiamente dicha y hemostasia/cierre de la herida.
Durante la fase inicial se liberan medios de sostén peritoneales, se realiza la colecistectomía (si está indicada) y se efectúa la exposición vascular.
En la segunda fase, o resección propiamente dicha, es importante tomar en cuenta diversos factores. La pérdida sanguínea se puede reducir al utilizar técnicas intermitentes de oclusión vascular, que pueden implicar la oclusión total de flujo tanto de la vena porta como de la arteria hepática (maniobra de Pringle), condicionando una disminución de alrededor del 10% en el gasto cardiaco y un incremento en la poscarga de hasta un 20-30%29.
Otra opción viable es la oclusión vascular selectiva, la cual conlleva una menor afectación cardiovascular. De manera excepcional debe realizarse la exclusión hepática total mediante oclusión del pedículo hepático, pudiendo condicionar una disminución de hasta el 60% del gasto cardiaco y por tanto comprometer la hemodinamia de manera importante30.
Es importante considerar que las maniobras de pinzamiento para reducir la pérdida sanguínea condicionan isquemia y, subsecuentemente, una lesión por isquemia-reperfusión, contribuyendo a la falla hepática en el postoperatorio31. El preacondicionamiento isquémico, en conjunto con pinzamiento intermitente, han demostrado brindar una protección efectiva contra la lesión por isquemia-reperfusión; sin embargo, los mecanismos celulares precisos que la desencadenan aún no han sido del todo aclarados. La isquemia continua de hasta 60min y la isquemia intermitente con un lapso total de 90min parecen ser bien toleradas en pacientes sin hepatopatía32.
Por último, debe confirmarse la hemostasia, siendo conveniente prestar atención al uso excesivo de láser argón, ya que pueden desencadenarse hemoglobinuria y lesión renal aguda32.
Manejo anestésicoComo metas en el manejo anestésico, se debe buscar: reducir la hemorragia perioperatoria, mantener una adecuada estabilidad hemodinámica, principalmente presión de llenado venoso y perfusión a órganos vitales, así como diagnosticar y tratar el embolismo aéreo (EA), permitiendo llevar a cabo una mejor técnica quirúrgica33.
La elección de la técnica anestésica dependerá de las circunstancias particulares de cada paciente, la estabilidad hemodinámica, el grado de disfunción hepática, la vía de metabolización farmacológica, buscando, desde luego, la mínima repercusión sobre las resistencias vasculares33.
Como parte de las estrategias ventilatorias que permiten modificaciones en el flujo sanguíneo hepático, existe la creencia generalizada de que la reducción del volumen corriente o hipoventilación conduce a una PVC más baja y a un menor sangrado operatorio. Pero, al mismo tiempo, importa considerar que la hipoventilación se acompaña de hipercapnia de similar magnitud y que, entre otras manifestaciones, cursa con taquicardia e hipertensión arterial, contraproducentes para el objetivo de mermar el sangrado34.
Con el fin de limitar los efectos cardiovasculares que siguen a una presión elevada en la vía aérea también se recurre a la ventilación controlada por presión en vez de por volumen, pero el caso es que los conocimientos actuales sobre las consecuencias ventilatorias, hemodinámicas o posibles complicaciones de una u otra opción son exiguos35. En cuanto a la reducción de la presión positiva espiratoria, se sabe que la técnica conlleva un impacto negativo sobre el retorno venoso, aunque reste por demostrar que incremente el sangrado operatorio.
En resumen, aunque se ha probado sobradamente el efecto adverso que sobre el retorno venoso ejercen las modalidades ventilatorias que elevan la PIT, no existen evidencias concluyentes que demuestren que aquellas que menos lo hacen reduzcan el sangrado operatorio36.
Finalmente, la ventilación hiperóxica es una estrategia demostrada para retrasar la necesidad de transfusión sanguínea e incrementar la tolerancia del organismo a la anemia. La terapia de rescate con ventilación hiperóxica, incluso a niveles moderados como la FiO2 de 0.6, se ha demostrado eficaz para moderar la tasa de mortalidad por anemia aguda36.
Se trata de una estrategia habitualmente empleada en la cirugía hepática y que consiste en mantener un estado de hipovolemia relativa, bajando la PVC a menos de 5mmHg, mediante una combinación de abordajes que incluyen la restricción de volumen, técnicas farmacológicas (vasodilatadores, diuréticos y anestésicos) y postura (Trendelenburg de −15°), manteniendo la presión arterial sistólica en torno a los 90mmHg y la diuresis a un mínimo de 0,5ml/kg/h. Con estas medidas se ha observado que descienden las pérdidas sanguíneas intraoperatorias, e incluso la morbilidad y la estancia hospitalaria; aunque se constata disfunción renal transitoria, no se desarrolla insuficiencia renal37. Algunos autores reducen la PVC al 40% de la basal mediante restricción de volumen y flebotomía de entre 400 y 800ml, sin obtener efectos adversos38.
En suma, tales resultados han ido fundamentando durante años el concepto de que en la cirugía hepática resulta obligado disminuir la PVC al nivel más bajo posible, con el fin de minimizar las pérdidas hemáticas. Pese a ello, recientemente diferentes autores han comunicado resultados contrarios, pues no observan que mantener la PVC por debajo de 5mmHg se asocie con menores pérdidas sanguíneas38.
La hemodilución normovolémica aguda (HNA) reduce la pérdida de hematíes durante la intervención al disminuir la masa eritrocitaria del paciente inmediatamente antes de la intervención. El primer paso es la extracción controlada aguda de sangre completa, a través de una vía venosa de grueso calibre o una arteria. El volumen intravascular se mantiene con soluciones acelulares (coloides, cristaloides o ambos) durante la venotomía; así, el procedimiento quirúrgico se realiza en un paciente hemodiluido.
Normalmente se hace tras la inducción anestésica, para asegurar la estabilidad hemodinámica. Con la HNA se pierden menos eritrocitos y otros elementos formes durante la cirugía, porque el hematocrito es más bajo. La sangre autógena obtenida se reinfunde en el momento en que se necesite, durante el periodo perioperatorio. El sangrado quirúrgico no cambia por el uso de la HNA, pero se pierden menos hematíes debido a la anemia aguda del paciente.
Uno de los conceptos claves para esta técnica es definir el límite inferior de hematocrito «seguro» para el paciente. Con la HNA los pacientes pierden hematíes de 2 formas: por la hemodilución y por la hemorragia intraoperatoria, por lo que cabe esperar una anemia importante.
La HNA se ha utilizado con éxito en diversos tipos de cirugía: cardiaca, ortopédica, urológica y hepática.
En diversas revisiones sistemáticas y metaanálisis no se ha probado la eficacia y seguridad de la HNA. En suma, hasta que todo esto haya sido convenientemente probado, no se justifica el uso generalizado de la HNA, quedando reservada para pacientes quirúrgicos con una contraindicación absoluta para la transfusión alogénica39.
Diversos fármacos antifibrinolíticos, como la aprotinina y los ácidos epsilonaminocaproico y tranexámico, han sido utilizados sistemáticamente en el trasplante hepático, demostrando que reducen el consumo de hemoderivados. Sin embargo, en la cirugía hepática las publicaciones son escasas y con resultados inciertos. Tampoco ha podido probarse la eficacia de la desmopresina o el factor vii; en consecuencia, estos fármacos deben reservarse para casos puntuales y hemorragias muy copiosas; también pueden ser de utilidad en el paciente cirrótico40.
Estrategias para mantener la estabilidad hemodinámicaSe utilice un parámetro estático (PVC) o, mejor, uno dinámico (variación del volumen sistólico)41, el objetivo es conseguir un volumen circulante moderadamente bajo. Para ello se recurre a una fluidoterapia restrictiva intensiva seguida de nitroglicerina. Una vez concluida la fase de transección hepática40, se va aumentando la volemia con coloides o solución de albumina al 5%, si el paciente es cirrótico.
El pinzamiento del pedículo hepático suele ser bien tolerado, pese a la depleción de volumen. Es cierto que supone una caída del retorno venoso y, por tanto, del gasto cardiaco, pero la inmediata respuesta vasopresora es de la suficiente magnitud para que la presión arterial se vea poco afectada.
Cuando se precisa una EVT el compromiso hemodinámico es mayor. En efecto, el pinzamiento de la vena cava inferior reduce el retorno venoso en más del 50%, con la consiguiente caída del gasto cardiaco. Dado que el paciente está hipovolémico, puede que la respuesta vasopresora, con ser importante, no sea suficiente para compensar la caída del gasto cardiaco y se produzca hipotensión arterial, comprometiéndose la perfusión de muchos órganos y, particularmente, del hígado.
En el paciente al que se va a realizar una EVT, la monitorización hemodinámica con un catéter de fracción de eyección en la arteria pulmonar es mandatoria. Con él es posible conocer la precarga, la poscarga y la contractilidad cardiaca de forma prácticamente continua, cada minuto. Una vez hecho el diagnóstico hemodinámico, se recurrirá a la indicación precisa de: aumentar la precarga mediante coloides o albúmina; mejorar la contractilidad con dobutamina; o incrementar la poscarga con noradrenalina. Todo ello con el objetivo de conseguir un IC>2.5L/min/m2 y una PAM>65mmHg41.
El síndrome de reperfusión es un problema capital en el trasplante hepático y también puede observarse, aunque más menguado en su expresión, en la cirugía hepática. En efecto, la reperfusión del hígado tras el pinzamiento pedicular o con la EVT puede acompañarse de considerables alteraciones hemodinámicas. Principalmente se advierten: bradicardia, hipotensión arterial y aumento de las presiones de llenado cardiaco.
El tratamiento consiste en bolos de atropina, cloruro cálcico y efedrina. El fenómeno no suele durar mucho y pronto se restablece el equilibrio hemodinámico. El cuadro hemodinámico está producido por una vasodilatación esplácnica, básicamente por hiperemia hepática, consecuencia de la isquemia-reperfusión por el pinzamiento vascular42.
El riesgo de EA es especialmente alto durante la disección de la vena cava, las anastomosis vasculares y la reperfusión hepática. Se sospecha un EA cuando cae de forma brusca el CO2 espirado, que se puede acompañar de hipotensión arterial y aumento de las presiones pulmonares.
La ecocardiografía transesofágica resulta una monitorización insuperable en este caso, bien para el diagnóstico del EA, bien como guía de la eficacia del tratamiento aplicado.
El tratamiento, en función de la repercusión hemodinámica, consiste en infusión rápida de volumen e inotropos (efedrina y dobutamina). Otras medidas son la administración de oxígeno al 100% y la posición de Trendelenburg43.
DiscusiónLa hepatectomía en el paciente oncológico implica un reto diagnóstico y terapéutico importante; es necesario un conocimiento amplio de las implicaciones orgánicas específicamente en el paciente oncológico, ya que, a diferencia de otro tipo de pacientes, el conjunto de afecciones asociadas al cáncer representan una mayor complejidad y, por ende, una mayor probabilidad de complicaciones asociadas a los procedimientos quirúrgicos realizados. El rol del anestesiólogo frente al paciente oncológico sometido a una cirugía de esta naturaleza es de vital importancia para mejorar de manera directa tanto la evolución a corto plazo como el pronóstico a largo plazo.
El abanico de posibilidades de que se dispone actualmente ha permitido implementar nuevas técnicas anestésicas; la disponibilidad de ellas depende de la unidad hospitalaria donde se lleve a cabo el procedimiento. En el Instituto Nacional de Cancerología se han implementado activamente estrategias que permiten reducir la cantidad de fármacos utilizados para lograr el estado anestésico, tales como anestesia combinada, anestesia inhalatoria con flujos metabólicos, anestesia total intravenosa, analgesia multimodal, analgesia controlada por el paciente, así como seguimiento de protocolos perioperatorios tales como ERAS y PROSPECT, que permiten un abordaje multidisciplinario y, en consecuencia, mejorar el pronóstico del paciente sometido a cirugía de alta complejidad.
FinanciaciónAmbos autores declaran no contar con apoyo de beca o ayuda de ninguna institución.
Conflicto de interesesAmbos autores declaran no tener conflicto de interés alguno con respecto a este manuscrito.