En esta revisión resumimos las principales publicaciones que informan sobre las potenciales manifestaciones oculares de la enfermedad por el nuevo coronavirus (COVID-19). La evidencia científica se basa en cartas al editor, casos clínicos aislados y series de casos, principalmente de corte transversal. Hasta la fecha, incluimos la conjuntivitis viral, una conjuntivitis inmunomediada y parálisis oculomotoras (POM). Se discute la posibilidad de retinopatía. La conjuntivitis viral puede aparecer aislada o asociada al cuadro sistémico, principalmente pulmonar, antes o después del inicio de los síntomas respiratorios. Puede ser tanto unilateral como bilateral, es típica la presencia de folículos, y presenta una duración variable entre 5 y 20 días. La conjuntivitis inmunomediada consiste en un enrojecimiento ocular acompañada de eritrodermia y febrícula. Aparece más frecuentemente en los niños y se ha asociado a un cuadro «Kawasaki-like» y síndrome del shock tóxico. Las POM pueden presentarse de forma aislada, o formando parte de un síndrome de Miller-Fisher, junto con ataxia e hiporreflexia. Los oftalmólogos presentamos un riesgo considerable de contraer la COVID-19 debido a un contacto estrecho con el paciente, exposición a las lágrimas y a las secreciones oculares y al uso de multitud de equipos y aparatos susceptibles de contaminarse.
In this review, a summary is presented of the main reports regarding the potential ocular manifestations of the new coronavirus disease (COVID-19). Scientific evidence is based on letters to the editor, clinical cases and case series, cross-sectional, and a few longitudinal studies. To date, it includes viral conjunctivitis, immune conjunctivitis, and oculomotor palsies (OCP) due to the novel coronavirus. Retinopathy is discussed. A viral conjunctivitis outbreak can be isolated or associated with the systemic picture, mainly pulmonary, before or after the onset of respiratory symptoms. It can be both unilateral and bilateral, follicles are typical, and duration is variable between 5 and 21 days. Immune-mediated conjunctivitis consists of eye redness, together with erythroderma and fever. It appears more frequently in children, and has been associated with a «Kawasaki-like» disease and toxic shock syndrome. OCP can present on its own, or as part of Miller-Fisher syndrome, along with ataxia, and hyporeflexia. Ophthalmologists have a considerable risk of developing COVID-19 due to close contact with the patient, exposure to tears and eye secretions, and the use of various pieces of equipment and devices susceptible to contamination.
En diciembre de 2019 se identificaron los primeros pacientes diagnosticados con la enfermedad causada por el nuevo coronavirus (SARS-CoV-2), denominada COVID-19, en Wuhan, China1,2. El doctor Li Wenliang, un oftalmólogo chino, fue uno de los primeros médicos en advertir acerca de los efectos del virus y, consecuentemente, reprimido e investigado por su gobierno. Desde entonces se han comunicado múltiples contagios, llegando a ser declarada una enfermedad pandémica por la Organización Mundial de la Salud el 11 de marzo de 20203. Hasta la fecha en la que se escribe el presente artículo, existen más de 14 millones de infectados y más de 600.000 fallecidos en todo el mundo4. La vía de contagio principal es la respiratoria. También puede ser transmitida por fómites mediante el contacto humano a través de las manos y de superficies contaminadas5. La principal manifestación clínica de la enfermedad es la neumonía4,5, habiéndose descrito cuadros diversos como gastroenteritis6, coagulación intravascular diseminada (CID)7, daño hepático, infarto renal y esplénico7–9, síndrome de distrés respiratorio agudo4,5 y cuadros neurológicos como anosmia, ageusia, polineuropatía, miopatía e ictus10. En esta revisión, hemos recogido la evidencia científica existente hasta el momento para resumir las manifestaciones oftalmológicas producidas por el virus y su capacidad para transmitirse por vía ocular. Preferimos utilizar las siglas anglosajonas «COVID-19» y «SARS-CoV-2», dada la extensa difusión de estos términos en la literatura divulgativa.
MetodologíaSe realizó una búsqueda en Pubmed hasta el 21/07/2020 en la que se incluyeron las siguientes publicaciones en inglés: cartas al editor, casos clínicos, revisiones bibliográficas y estudios clínicos. En el campo de búsqueda se incluyó tanto el resumen (abstract) como el título de la publicación. Se procedió a la combinación de diferentes palabras clave, tales como «SARS-Cov-2», «COVID 19», «2019-nCoV», «coronavirus 2019», y (término «AND» en el proceso de búsqueda avanzada) «ophthalmology», «eye disease», «conjunctivitis», «ocular surface», «glaucoma», «orbit», «tears», «uveitis», «retina», «vasculitis», «ophthalmoparesis», «palsy», «optic nerve», «anterior ischemic optic neuropathy» (AION), «retinal venous occlusion» (RVO), «retinal artery occlusion» (RAO).
ResultadosSe obtuvo un total de 97 publicaciones. La mayoría de ellas fueron cartas al editor, casos clínicos aislados, series de casos clínicos, artículos de opinión y guías de recomendaciones generales. Se hallaron 2 metaanálisis de series de casos de conjuntivitis. Debido a la reiteración del contenido entre muchos artículos, se seleccionaron 45 para su discusión en la presente revisión.
DiscusiónLa única complicación oftalmológica confirmada por el SARS-CoV-2, publicada hasta la fecha, ha sido la conjuntivitis. Se han descrito series de casos de parálisis oculomotoras (POM) y una posible retinopatía.
Han surgido múltiples comparaciones con otros coronavirus, principalmente el SARS-CoV-1, que produce el síndrome respiratorio agudo severo (SRAS), y con el virus del síndrome respiratorio del Medio Oriente (MERS-CoV). Ambos se han hallado en las secreciones lagrimales, células conjuntivales y corneales11, pero no está descrita la conjuntivitis en humanos12,13. Solo fue descrita cierta congestión conjuntival sin excesivo enrojecimiento y leve aumento de la secreción lagrimal, de pocos días de duración, en casos aislados14. El genoma del SARS-CoV-2 es un 75-80% similar al del SARS-CoV-1 y un 40% similar al del MERS15, por lo que cabría esperar el mismo tipo de infección ocular. De hecho, la capacidad patogénica para producir conjuntivitis por otros coronavirus es mucho mayor, si bien apenas tienen repercusión en la práctica clínica por su escasa prevalencia y ausencia de tratamiento específico. El coronavirus NL 63 (HCoV-NL63), por ejemplo, se aisló por vez primera en un bebé con conjuntivitis y bronquiolitis16. El mecanismo de entrada de los coronavirus en las células se produce mediante el receptor de la enzima convertidora de la angiotensina 2 (ECA-2)17. Esta no solo está presente en el epitelio alveolar, sino también en la conjuntiva y en la córnea18.
A diferencia de sus predecesores, el SARS-CoV-2 puede ocasionar una conjuntivitis más severa, con marcada hiperemia cilio-conjuntival, queratitis punteada superficial, folículos en la conjuntival tarsal e, incluso, pseudomembranas7,19–26. Puede haber edema del borde palpebral y secreción mucosa19. No se ha publicado el hallazgo de adenopatías, pero, al tratarse de una infección viral, posiblemente puedan estar presentes. El periodo de incubación del virus oscila entre 51,21 y 14 días19. Puede ocurrir de forma aislada20, como pródromo de la infección respiratoria26 e, incluso, aparecer tras el comienzo de la clínica sistémica21. El tiempo de evolución de la clínica ocular también es variable, habiéndose descrito remisiones entre 521 y 20 días7,22. No existe un tratamiento específico. Chen et al.21 emplearon colirio de rivabirina 4 veces al día durante 6 días en un hombre de 30 años que ya había sido diagnosticado con COVID-19 14 días antes. Observaron una remisión completa de los síntomas oculares al quinto día de tratamiento. Shetty et al.24 comentan la posibilidad de emplear hidroxicloroquina tópica (0,03%), dado que ya se ha empleado en el síndrome del ojo seco, sin efectos adversos registrados. En relación con el posible efecto nocivo de su administración oral en pacientes con neumonía, recientemente se publicó una carta al editor en American Journal of Ophthalmology25. En ella, Marmor defiende que no es necesario realizar un cribado oftalmológico, dado el corto periodo de tiempo del tratamiento. No hallamos ninguna publicación que hiciese alusión a las potenciales complicaciones oculares de los fármacos más empleados para la COVID-19 (corticoides, antivirales, azitromicina, hidroxicloroquina, inmunoglobulinas, anticuerpos monoclonales, etc.). El uso tan extendido de la corticoterapia en pacientes graves podría aumentar el riesgo de hipertensión ocular y cataratas, si bien, al igual que ocurre con la hidroxicloroquina, es poco probable dado el corto periodo de su administración.
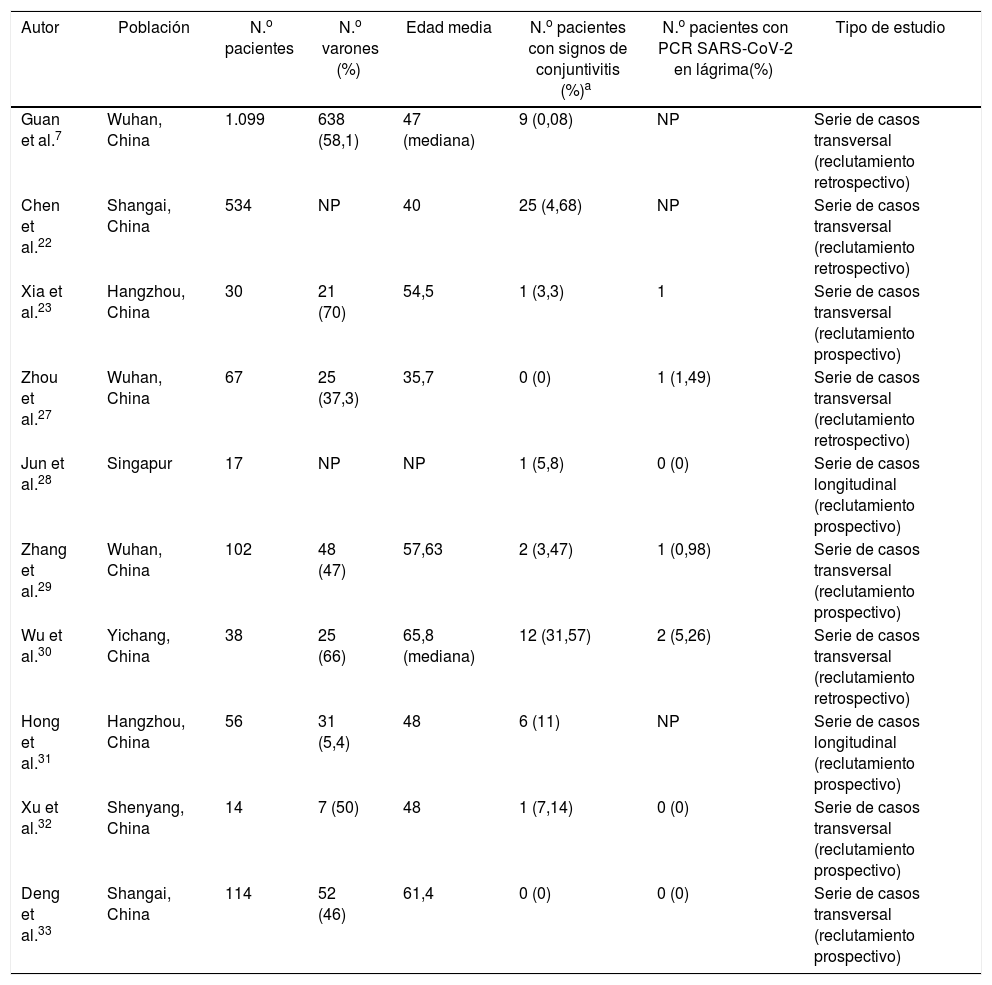
La primera referencia de conjuntivitis por SARS-CoV-2 figura en una carta al editor, publicada en la revista The Lancet26, en la que se describe el cuadro de enrojecimiento ocular unilateral en un experto neumólogo (ataviado con su equipo de protección y una mascarilla N95, pero sin gafas protectoras), días después de haber visitado un hospital de Wuhan. Posteriormente desarrolló una neumonía. Desde entonces, se han publicado numerosos casos clínicos y series de casos, la mayoría por autores chinos7,22,23,27–33(tabla 1). En todos ellos, la prevalencia de la infección ocular es baja. En la serie más larga publicada, solamente 9 (0,8%) de 1.099 pacientes desarrollaron congestión ocular7. En un estudio de 534 pacientes, Chen et al.22 solo observaron conjuntivitis en 25 de ellos (4,68%). Xia et al.23 estudiaron una cohorte de 30 pacientes con COVID-19 y solo hallaron el virus en uno de los ojos de un paciente sin complicaciones. En una serie retrospectiva de 67 pacientes, Zhou et al.27 no registraron ninguna conjuntivitis. Sin embargo, un paciente presentó un exudado conjuntival positivo. Asimismo, en otro estudio en Singapur con 17 pacientes COVID-19 confirmados, en ninguno se halló el SARS-CoV-2 en la conjuntiva en repetidas tomas, pese a que uno desarrollase enrojecimiento ocular unilateral28. Zhang et al.29 estudiaron a 102 pacientes con COVID-19, de los cuales solo 2 presentaron conjuntivitis y, de nuevo, solo en uno pudo hallarse el virus en la superficie ocular. Wu et al.30 describieron hasta un 31% de complicaciones oculares (12 pacientes con congestión ocular), en una serie de 38 pacientes COVID-19. Aun así, solo obtuvieron PCR positivas en las muestras oculares en 2 de ellos. En este estudio sí se halló una correlación positiva entre la severidad de la infección sistémica y la ocular. Los autores concluyen que la conjuntivitis podría suponer un factor de mal pronóstico de la enfermedad sistémica cuando aparece en fases intermedias de la misma. Hong et al.31 estudiaron a 56 sujetos antes y después del desarrollo de la COVID-19; 6 pacientes (11%) tuvieron enrojecimiento ocular antes de comenzar con los síntomas respiratorios. Las puntuaciones en el test de OSDI (Ocular Surface Disease Index) y en el SEEQ (Salisbury Eye Evaluation Questionnaire), que evalúan ambos síntomas de ojo seco, se agravaron significativamente tras pasar la COVID-19, incluso en pacientes sin conjuntivitis.
Principales estudios clínicos que evalúan la conjuntivitis en pacientes COVID
| Autor | Población | N.o pacientes | N.o varones (%) | Edad media | N.o pacientes con signos de conjuntivitis (%)a | N.o pacientes con PCR SARS-CoV-2 en lágrima(%) | Tipo de estudio |
|---|---|---|---|---|---|---|---|
| Guan et al.7 | Wuhan, China | 1.099 | 638 (58,1) | 47 (mediana) | 9 (0,08) | NP | Serie de casos transversal (reclutamiento retrospectivo) |
| Chen et al.22 | Shangai, China | 534 | NP | 40 | 25 (4,68) | NP | Serie de casos transversal (reclutamiento retrospectivo) |
| Xia et al.23 | Hangzhou, China | 30 | 21 (70) | 54,5 | 1 (3,3) | 1 | Serie de casos transversal (reclutamiento prospectivo) |
| Zhou et al.27 | Wuhan, China | 67 | 25 (37,3) | 35,7 | 0 (0) | 1 (1,49) | Serie de casos transversal (reclutamiento retrospectivo) |
| Jun et al.28 | Singapur | 17 | NP | NP | 1 (5,8) | 0 (0) | Serie de casos longitudinal (reclutamiento prospectivo) |
| Zhang et al.29 | Wuhan, China | 102 | 48 (47) | 57,63 | 2 (3,47) | 1 (0,98) | Serie de casos transversal (reclutamiento prospectivo) |
| Wu et al.30 | Yichang, China | 38 | 25 (66) | 65,8 (mediana) | 12 (31,57) | 2 (5,26) | Serie de casos transversal (reclutamiento retrospectivo) |
| Hong et al.31 | Hangzhou, China | 56 | 31 (5,4) | 48 | 6 (11) | NP | Serie de casos longitudinal (reclutamiento prospectivo) |
| Xu et al.32 | Shenyang, China | 14 | 7 (50) | 48 | 1 (7,14) | 0 (0) | Serie de casos transversal (reclutamiento prospectivo) |
| Deng et al.33 | Shangai, China | 114 | 52 (46) | 61,4 | 0 (0) | 0 (0) | Serie de casos transversal (reclutamiento prospectivo) |
NP: no publicado.
Ulhaq y Soraya34 realizaron un metaanálisis en el que incluyeron la mayoría de los presentes estudios. Concluyeron que la prevalencia agregada de conjuntivitis en pacientes COVID-19 era muy baja [5,5% (42/735 sujetos); IC 95% (1,6-9,4%)], siendo la PCR del exudado lagrimal escasamente sensible [0,6%; IC 95% (0,1-5,1)], aunque muy específica [100%; IC 95% (0-100)] comparada con el exudado nasofaríngeo. Otro metaanálisis, en el que se incluyeron 3 de los mencionados estudios, concluye que la conjuntivitis puede estar asociada a una forma más grave de enfermedad35.
La transmisión del virus a través de la superficie ocular es factible ya que se trata de un microambiente expuesto y conectado con la vía respiratoria a través del conducto nasolacrimal. Además, el drenaje linfático de la mucosa ocular es el mismo que el de la fosa nasal y la nasofaringe36,37. Sin embargo, como hemos visto, pocos son los pacientes que desarrollan conjuntivitis. Probablemente la replicación viral sea más limitada en la conjuntiva debido a un «turn over» mayor que las células del epitelio respiratorio12. La baja sensibilidad de la PCR en la lágrima puede deberse a varios factores: 1) un periodo ventana corto porque el virus se «lava» rápidamente hacia la fosa nasal; 2) una menor carga viral y por lo tanto menor capacidad de obtener una muestra representativa, a diferencia del exudado nasofaríngeo; 3) toma de muestra en diferentes horas del día; 4) empleo de diferentes métodos diagnósticos con diferentes sensibilidades y especificidades. Además, no existe una definición unánime de «conjuntivitis». Mientras que en algunas series incluyen a pacientes con un mínimo enrojecimiento ocular, en otras hay un cuadro infeccioso claro. En cualquier caso, existe un riesgo evidente de contagio por el oftalmólogo, debido al contacto estrecho con el paciente, exposición a las lágrimas y a las secreciones oculares y al uso de multitud de equipos y aparatos susceptibles de contaminarse.
Estos pacientes suponen un foco de contagio principalmente por tener las manos contaminadas después de haberse tocado la cara o frotarse los ojos, al igual que ocurre en las conjuntivitis adenovíricas, ya que no existe un «mecanismo expulsivo», como la tos, el estornudo o el habla, como ocurre en la vía respiratoria. Aunque se haya aislado el virus en secreciones lagrimales de pacientes sin conjuntivitis27, el riesgo de transmisión por vía ocular en estos sujetos parece despreciable, ya que la carga viral sería mucho menor. Aun así, en estos momentos de incertidumbre en los que no sabemos enteramente el comportamiento de la infección y conociendo los errores iniciales en la gestión del brote, parece aconsejable apelar a la prudencia y considerar el riesgo, por mínimo que parezca. Por ello, además de las ya multirrecomendadas medidas de seguridad (como el uso de la mascarilla, el lavado frecuente de las manos, pantallas en las lámparas de hendidura, uso de medicación tópica unidosis, etc.), la inmensa mayoría de los autores aconsejan emplear gafas protectoras en la práctica clínica24.
Los niños padecen la COVID-19 de forma más leve38. Esto parece ser debido, principalmente, a una respuesta inmunológica más eficaz. Otra posibilidad radica en la presencia de un mayor número de virus respiratorios en la mucosa nasofaríngea del niño, lo que podría limitar la replicación y el crecimiento del SARS-CoV-2 mediante interacciones o competiciones directas entre ellos38 o a una menor expresión de la ECA-2 en las células epiteliales39. La prevalencia de conjuntivitis en niños infectados es baja (1-5%)37. Sin embargo, recientemente la Sociedad Española de Pediatría emitió un comunicado, en el que advertían de la publicación de casos de niños con COVID-19 que presentaban fiebre elevada, eritrodermia e inyección conjuntival40,41. Este cuadro se solapa con la enfermedad de Kawasaki, una rara enfermedad muco-cutánea, poco conocida por los oftalmólogos, consistente en una vasculitis de pequeño y mediano vaso que produce fiebre, adenopatías, eritema cutáneo y palmo-plantar, conjuntivitis, edemas en miembros y, menos frecuentemente, aneurismas coronarios41. Si bien la mayoría mejoraba en pocos días, algunos (0,5-5%) evolucionaban desfavorablemente hasta presentar un shock tóxico37,41. La mayoría ocurre en niños de edad avanzada, algunos ya adolescentes. Aun así, también está descrito el caso de un bebé de 6 meses con eritema generalizado y conjuntivitis, que se recuperó por completo con inmunoglobulinas (IG) por vía intravenosa en 48h42. En este caso, lejos de parecer una infección directa por el virus (ausencia de folículos, adenopatías, secreciones oculares), la conjuntivitis parece claramente inmunomediada. También se ha descrito un cuadro abdominal con diarrea y vómitos, con aceptable estado general, que en pocas horas evolucionan hacia un shock con taquicardia e hipotensión40.
Verdoni et al.43 realizaron un estudio comparativo en Bérgamo (uno de los focos de la epidemia italiana) entre dos grupos: 1) 19 niños con debut de enfermedad de «Kawasaki-like» antes del inicio del brote por SARS-CoV-2; 2) 10 niños con el debut del cuadro después del inicio del brote. Observaron que el segundo grupo tenía una mayor edad media (7,5 años vs. 3 años), la mayoría presentaban anticuerpos AC frente al virus (8 de 10) y padecían una forma más severa de enfermedad: mayor afectación cardiaca (6 de 10 vs. 2 de 19), síndrome de shock tóxico (5 de 10 vs. 0 de 19) y síndrome de activación macrofágica (5 de 10 vs. 0 de 19). El SARS-CoV-2 podría suponer un fuerte estímulo en el huésped capaz de desencadenar una respuesta inmune desproporcionada. Los factores predictores de dicha respuesta son aún desconocidos.
Se ha cuestionado la retinopatía por SARS-CoV-2. El ya conocido cuadro de CID y la afectación vascular de diferentes órganos, como el pulmón, el riñón o el cerebro7,10, podrían sugerirnos algún tipo de vasculopatía retiniana. Hay evidencia de que existe una mayor concentración de ECA-2 en el epitelio pigmentario de la retina y retina neurosensorial que en las células conjuntivales y corneales44. Además, en estudios experimentales con modelos animales de infección por coronavirus, se han observado alteraciones retinianas como vasculitis y degeneraciones45. Recientemente se ha publicado en The Lancet una serie de 12 casos de COVID (9 confirmados por PCR nasofaríngea, 2 por serología; 6 varones, 6 mujeres; edad: 25-69 años) con lesiones retinianas, detectadas de forma incidental al realizar sistemáticamente un estudio oftalmológico a pacientes infectados46. Todos presentaron fiebre, astenia y disnea y 11 de los 12 pacientes presentaron anosmia. Ninguno tuvo clínica oftalmológica. En los 12 pacientes se hallaron, en la tomografía de coherencia óptica (TCO), focos hiperreflectivos en la capa de células ganglionares y plexiforme interna en ambos ojos, principalmente a nivel del haz papilo-macular. La angio-TCO y el análisis cuantitativo del grosor de la capa de células ganglionares fueron normales. Cuatro pacientes presentaron exudados algodonosos y microhemorragias en las arcadas vasculares temporales. Solo se ha publicado un caso clínico en el que se relaciona la oclusión de la arteria central de la retina (OACR) con la COVID-1947. Se trató de un varón de 60 años con hipertensión arterial, dislipemia, enfermedad coronaria estable y enfermedad pulmonar obstructiva crónica, que en el décimo segundo día de ingreso hospitalario por COVID-19 (confirmada mediante PCR nasofaríngea) presentó una disminución brusca e indolora de la visión de su ojo derecho. Los autores relacionan el estado de hipercoagulabilidad del paciente, producido por la inflamación atribuible al SARS-CoV-2, con la complicación oftalmológica, siendo coherente con otras complicaciones vasculares descritas en la literatura, tales como el ictus o la embolia pulmonar7,10. Paradójicamente, no hallamos ningún caso publicado de oclusión venosa retiniana. Es probable que durante los próximos meses veamos alguna publicación al respecto. Se han descrito también, en una carta al editor reciente, 2 casos clínicos de maculopatía aguda con escotoma paracentral en 2 pacientes confirmados con la COVID-1948: una mujer de 37 años con exploración oftalmológica normal en la que se vio en la TCO un área focal hiperreflectiva en las capas plexiformes con pérdida de volumen de la capa nuclear interna (maculopatía aguda paracentral); y un varón de 32 años, también con una exploración normal, con los siguientes hallazgos en la TCO: área hiperreflectiva en la capa plexiforme externa con interrupción de la banda de unión de los segmentos internos y externos de los fotorreceptores (neurorretinopatía macular aguda).
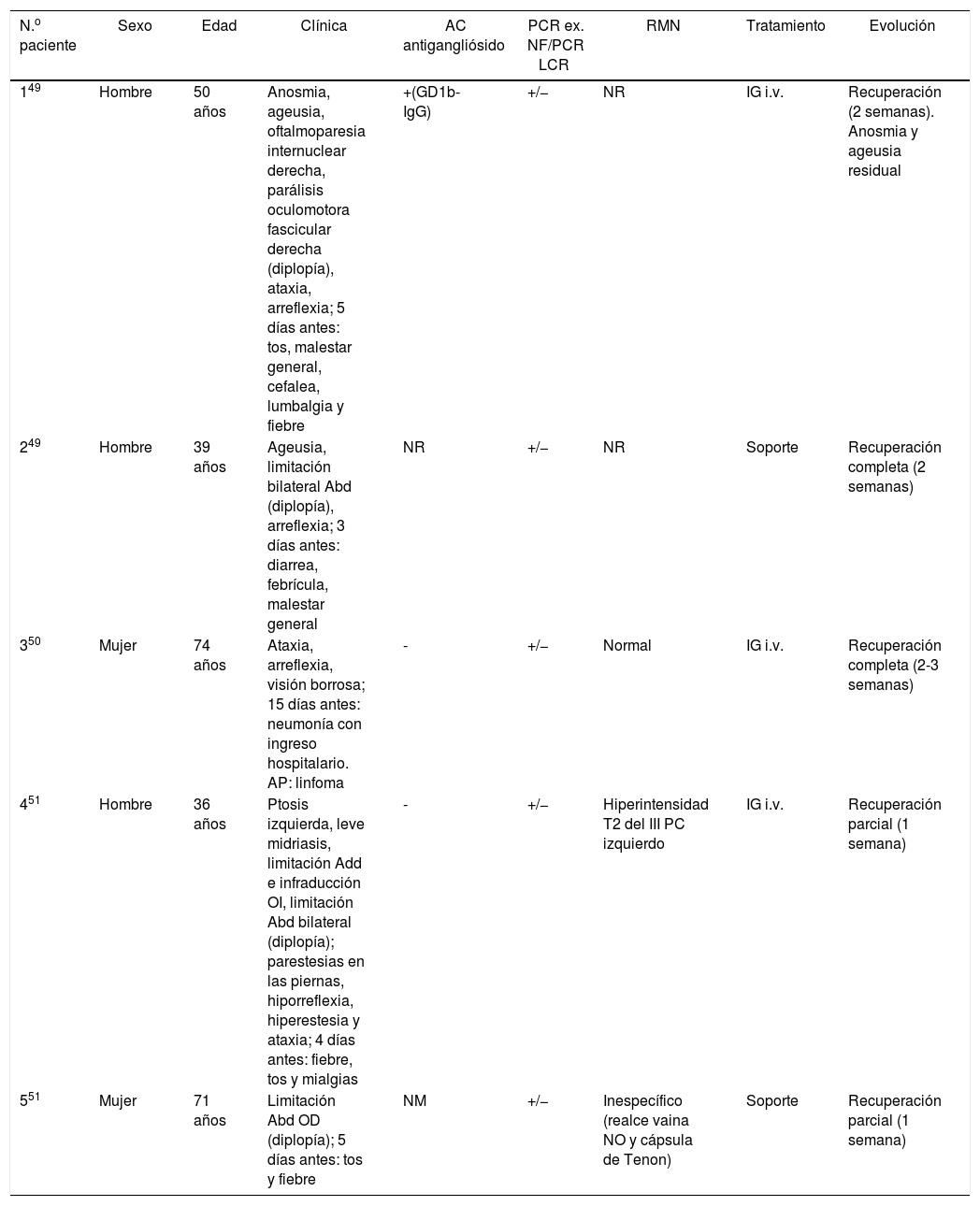
Se han publicado 3 artículos en los que se describen 5 casos de pacientes con COVID-19 y POM (tabla 2)49–51. El patrón más repetido es el de una limitación de la abducción [parálisis del VI par craneal (PC)], seguido de la afectación incompleta del III PC. Fueron 3 hombres y 2 mujeres. El rango de edad fue variable (36-74 años). En 4 de los 5 pacientes, el cuadro se acompañaba de ataxia e hiporreflexia, por lo que fueron diagnosticados de un síndrome de Miller-Fisher (variante oftalmológica del síndrome de Guillain-Barré). Este cuadro es típico tras una infección del tracto respiratorio superior y/o gastrointestinal (virus herpes y bacterias como Haemophilus influenzae, Campylobacter jejuni, Clamidia, Salmonella, y micoplasma)49. Todos ellos presentaron el cuadro de diplopía y/o visión borrosa días después de presentar síntomas sistémicos de la COVID-19. La presencia de anticuerpos antigangliósido (ACG), especialmente anti-GD1b, apoya firmemente el diagnóstico. Solamente se encontró en uno de los 5 pacientes citados. Los autores se cuestionan el mecanismo patogénico por el que el SARS-CoV-2 induce oftalmoplejía (neuropático directo vs. reacción inmune aberrante). De hecho, se ha descrito cierto neurotropismo en varios coronavirus52. Gutiérrez-Ortiz et al.49 concluyen que probablemente se deba a una reacción metainfecciosa autoinmune, debido a varios factores: la ausencia de detección del virus en el líquido cefalorraquídeo en ningún paciente, el efecto de la ya conocida «tormenta citoquímica» proinflamatoria del SARS-CoV-253, el tratamiento satisfactorio con IG en varios pacientes y la presencia de ACG en el primero. El estado protrombótico que genera la infección también puede ser un mecanismo causal, a través de miroembolias en los nervios oculomotores. Solo se ha descrito un cuadro de parálisis facial asociado a COVID-19, aunque sin lagoftalmos ni otras complicaciones oculares54.
Pacientes COVID con POM
| N.o paciente | Sexo | Edad | Clínica | AC antigangliósido | PCR ex. NF/PCR LCR | RMN | Tratamiento | Evolución |
|---|---|---|---|---|---|---|---|---|
| 149 | Hombre | 50 años | Anosmia, ageusia, oftalmoparesia internuclear derecha, parálisis oculomotora fascicular derecha (diplopía), ataxia, arreflexia; 5 días antes: tos, malestar general, cefalea, lumbalgia y fiebre | +(GD1b-IgG) | +/− | NR | IG i.v. | Recuperación (2 semanas). Anosmia y ageusia residual |
| 249 | Hombre | 39 años | Ageusia, limitación bilateral Abd (diplopía), arreflexia; 3 días antes: diarrea, febrícula, malestar general | NR | +/− | NR | Soporte | Recuperación completa (2 semanas) |
| 350 | Mujer | 74 años | Ataxia, arreflexia, visión borrosa; 15 días antes: neumonía con ingreso hospitalario. AP: linfoma | - | +/− | Normal | IG i.v. | Recuperación completa (2-3 semanas) |
| 451 | Hombre | 36 años | Ptosis izquierda, leve midriasis, limitación Add e infraducción OI, limitación Abd bilateral (diplopía); parestesias en las piernas, hiporreflexia, hiperestesia y ataxia; 4 días antes: fiebre, tos y mialgias | - | +/− | Hiperintensidad T2 del III PC izquierdo | IG i.v. | Recuperación parcial (1 semana) |
| 551 | Mujer | 71 años | Limitación Abd OD (diplopía); 5 días antes: tos y fiebre | NM | +/− | Inespecífico (realce vaina NO y cápsula de Tenon) | Soporte | Recuperación parcial (1 semana) |
Abd: abducción; Add: aducción; AP: antecedentes personales; ex.: exudado; IG: inmunoglobulinas; i.v: vía intravenosa; LCR: líquido cefalorraquídeo; NF: nasofaríngeo; NM: no mencionado; NO: nervio óptico; NR: no realizado; OD: ojo derecho; OI: ojo izquierdo; PC: par craneal; PCR: reacción en cadena de la polimerasa; POM: parálisis oculomotora; RMN: resonancia magnética nuclear.
En comités de expertos se ha comentado la posibilidad de un aumento del riesgo de padecer neuropatía óptica isquémica por la posición en prono durante el ingreso hospitalario y estancia en UCI de los pacientes con COVID-19. Esta postura mejora la oxigenación arterial hacia áreas dorsales del pulmón no ventiladas pero, debido a la redistribución del flujo, podría favorecer fenómenos isquémicos. Aun así, parece una técnica bastante segura, efectiva y con un bajo índice de complicaciones55.
La limitación principal de la presente revisión es la calidad de los artículos referenciados en la misma. Como se ha comentado, la mayoría son series de casos clínicos y, por tanto, tienen una baja evidencia científica. Es difícil establecer la causalidad del virus en todas las manifestaciones oftalmológicas mencionadas, especialmente ante fenómenos protrombóticos o autoinmunes. Además, la alteración tan importante de la epidemiología clínica ha podido generar falsas asociaciones. La situación tan excepcional que hemos vivido ha propiciado la publicación de trabajos sin doble revisión (revisión por pares o «peer review») para generar información rápidamente. Ello también ocasiona, invariablemente, confusión. Y, a menudo, es más difícil salir de la confusión que del error.
ConclusionesPodemos concluir que la conjuntivitis por SARS-CoV-2 es poco frecuente en relación con la magnitud y prevalencia del resto de manifestaciones provocadas por el virus. Podría estar relacionada con una forma más grave de enfermedad. La vía de transmisión oftálmica es posible, pero poco relevante en comparación con la vía aérea y por contacto de manos y superficies contaminadas. La neumonía adquirida por una transmisión vía oftálmica directa es poco probable. La repercusión principal de padecer una conjuntivitis aislada es el control epidemiológico de la enfermedad, más que las repercusiones oculares. Aun así, nos sumamos a las recomendaciones generales del resto de autores, aconsejando el uso de gafas protectoras (además de los equipos de protección y mascarilla), dada la ya evidenciada posibilidad de contraer la infección por vía ocular. Los niños y adolescentes pueden presentar una conjuntivitis inmunomediada, acompañada de eritrodermia y fiebre, que suele tener buena evolución, pero en algunos puede agravarse incluso con un shock tóxico. Los factores que determinan ese empeoramiento están aún por dilucidar. La vigilancia estrecha de estos pacientes es, por lo tanto, fundamental. Las POM por COVID parecen ser debidas también a una respuesta inmune aberrante y, por lo general, tienen buen pronóstico. Solo se ha descrito un único caso clínico de OACR atribuible al SARS-CoV-2. No hallamos ningún caso clínico ni ningún estudio que hiciese alusión a la patología vascular del nervio óptico. La publicación de más estudios y de una mayor calidad arrojará un mayor entendimiento sobre el manejo y prevención de las complicaciones oculares del SARS-CoV-2.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.