Análisis comparativo del coste del tratamiento del linfedema de miembro superior secundario a cáncer de mama, aplicando un modelo tradicional versus un modelo de vigilancia prospectiva. Cuantificar el ahorro derivado del abordaje prospectivo poscirugía.
Pacientes y métodosEstudio retrospectivo de costes asociados al tratamiento del linfedema en el Hospital Ramón y Cajal y centros concertados. Se valoran 1.400 pacientes en consulta durante el año 2014; de ellos, 212 precisaron terapia física compleja o de mantenimiento. Las variables analizadas son los costes directos, los costes indirectos y el ahorro estimado.
ResultadosEl coste anual por paciente del tratamiento tradicional en el linfedema, a base de terapia física compleja en estadios, avanzados es 2.500 euros aproximadamente.
En el modelo prospectivo todos los pacientes acuden a la Escuela de Linfedema y son evaluados posquirúrgicamente. No suelen requerir terapia descongestiva, ni vendajes continuados y permite usar mangas prefabricadas menos costosas. Se evitan consultas y costes indirectos. Se incluye el coste del cribado y de la intervención en estadios iniciales. El coste anual es aproximadamente el 25% de la cantidad estimada en el enfoque tradicional, unos 700 euros aproximadamente.
ConclusionesLa vigilancia prospectiva en el linfedema puede reducir la necesidad de rehabilitación intensiva y es coste-efectiva. Supone un ahorro potencial del 75% del coste asociado al modelo tradicional vigente.
To conduct a comparative analysis of the cost of treatment of upper limb lymphoedema secondary to breast cancer, using a traditional model versus a prospective surveillance model. To quantify the savings from a prospective postoperative approach.
Patients and methodsRetrospective study of the costs associated with lymphoedema treatment at the Ramon y Cajal Hospital and private centres. A total of 1,400 patients were assessed in medical consultations in 2014; of these, 212 were treated with complex decongestive therapy or maintenance therapy. The variables analysed were direct costs, indirect costs and estimated savings.
ResultsThe annual cost per patient of traditional lymphoedema treatment, based on complex physical therapy in advanced stages, was approximately €2,500.
In the prospective model, all patients attended the Lymphoedema Clinic and were also evaluated postsurgically. They did not usually require decongestive therapy or bandages and containment systems and were able to use prefabricated sleeves, which are considerably cheaper. Consultations and indirect costs were avoided. The cost of screening and intervention in the early stages was included. The annual cost was about 25% of the estimated amount with the traditional approach, approximately €700.
ConclusionsProspective lymphoedema surveillance can reduce the need for intensive rehabilitation and is cost-effective. It represents a potential saving of 75% of the cost associated with the traditional model.
Las secuelas relacionadas con los tratamientos del cáncer de mama (CM) cobran especial importancia debido a la elevada incidencia en nuestro medio de esta enfermedad y a la alta supervivencia actual de las pacientes que lo padecen. Estos tratamientos se asocian con efectos adversos sustanciales.
El linfedema (LF) es una de las secuelas en la extremidad superior, producida por el acúmulo de fluido en el espacio intersticial debido a un desequilibrio entre la tasa de filtración microvascular de capilares y vénulas y la del sistema de drenaje linfático1–3.
El LF se manifiesta clínicamente en la extremidad afecta en forma de hinchazón, a veces asociado a deformidad, dolor y deterioro funcional4–6. Puede afectar a la esfera psicosocial y a la calidad de vida de la paciente.
Esta ganancia de volumen puede desembocar en severas complicaciones, especialmente fibrosis, infecciones y pérdida de movilidad del miembro superior.
El modelo de tratamiento rehabilitador tradicional del LF es el comúnmente utilizado en pacientes con LF ya instaurado.
Son LF que se encuentran en estadios avanzados, es decir en estadio ii o más alto de la clasificación del LF de la Sociedad Internacional de Linfología (ISL)1 (tabla 1), donde el edema es visible, palpable y requiere una actuación cualificada para su tratamiento.
Clasificación del linfedema de la Sociedad Internacional de Linfología
| Estadio | Signos y síntomas |
|---|---|
| ISL estadio 0 | Estado de inflamación subclínica no evidente a pesar de transporte linfático deteriorado. Esta etapa puede existir durante meses o años antes de que el edema se haga evidente |
| ISL estadio i | Representa el inicio precoz de la enfermedad en la que hay acumulación de tejido líquido que disminuye/desaparece con la elevación de la extremidad afecta. El edema puede ser depresible en este momento |
| ISL estadio ii | IIa: La elevación de un miembro por sí sola rara vez reduce el linfedema y la depresión del edema con fóvea todavía es manifiesta IIb: Consistencia tisular duro-elástica. No deja fóvea ya que la fibrosis del tejido es cada vez más evidente |
| ISL estadio iii | El tejido es duro (fibrosis) y la depresión con fóvea está ausente. Aparecen cambios tróficos en la piel como engrosamiento, hiperpigmentación, aumento de pliegue, depósitos grasos y papilomatosis |
Se basa en la terapia física descongestiva compleja que actualmente constituye el protocolo óptimo de tratamiento para los pacientes con LF e implica el uso de drenaje linfático manual, vendajes diarios, cuidado de la piel, ejercicio y compresión externa. La terapia física descongestiva compleja consta de 2 fases:
La fase i, de tratamiento de choque o agudo en un entorno ambulatorio, tiene una duración media de 4 semanas y consta de un programa de drenaje linfático manual, vendaje, ejercicio y cuidado de la piel7–10.
La fase ii, o fase de mantenimiento, que consiste en la autogestión domiciliaria por parte del paciente o de su familia e implica un continuo cuidado de la piel, ejercicio, automasaje y el uso de una manga de compresión con o sin guante durante el día. A veces se asocia el autovendaje nocturno. Esta fase es crucial para mantener la reducción de volumen obtenida en la fase intensiva1,11–14.
Si el LF se diagnostica de forma precoz, en sus primeras etapas, en estadio 0 o i de la clasificación de la Sociedad Internacional de Linfología (tabla 1) es susceptible de tratamiento conservador1,2.
Los estudios demuestran que el LF puede revertir en estadios iniciales y se puede prevenir la progresión utilizando un modelo de prevención secundaria con asesoramiento preoperatorio y vigilancia posterior sobre todo en el primer año posquirúrgico, permitiendo identificar y tratar el LF en su inicio, evitando estadios avanzados y con ello tratamientos más costosos.
Este abordaje precoz no suele requerir terapia descongestiva, ni vendajes continuados y permite usar mangas prefabricadas menos costosas, disminuir el número de consultas y los costes indirectos derivados de los gastos de medicación por complicaciones, desplazamientos, etc.10,15,16
Nuestra área de cobertura asistencial abarca 558.373 habitantes, unas 300.000 son mujeres y de ellas aproximadamente un 10% desarrollará un CM a lo largo de su vida. De estas 30.000 pacientes, alrededor del 30% presentará LF, es decir, 10.000 mujeres, ya que, conforme a la incidencia en la bibliografía existente, se estima que un tercio de las mujeres intervenidas de CM desarrollará un LF.
Aunque la enfermedad tiende a empeorar, la prevención es un elemento clave. Las medidas principales son la educación continua a los profesionales de la salud y a los pacientes y la adopción de comportamientos preventivos autogestionados.
El objetivo de nuestro trabajo es realizar un análisis comparativo del coste del tratamiento del LF de miembro superior secundario a CM, aplicando un modelo tradicional versus un modelo de vigilancia prospectiva; y cuantificar, además, el ahorro derivado del abordaje prospectivo poscirugía.
MétodoLlevamos a cabo un estudio retrospectivo de costes asociados al LF durante el año 2014 en el Hospital Ramón y Cajal y en centros concertados de derivación para el tratamiento de este proceso en el miembro superior afecto, como consecuencia del tratamiento del CM.
El tratamiento consistió en terapia física compleja descongestiva intensiva diaria durante un ciclo de 15-20 sesiones, para posteriormente pasar a la terapia de mantenimiento de por vida. Esta terapia física descongestiva compleja incluyó el drenaje linfático manual y requirió materiales complejos para la contención de la reducción del volumen de la extremidad como la compresión mediante vendajes inelásticos, manga, guante, diversos tipos de relleno y de vendas y otros materiales para vendar el miembro.
Se realizaron controles cada 6 meses y ciclos de terapia en ocasiones con periodicidad anual.
El modelo de vigilancia prospectiva se basó en la vigilancia estrecha posquirúrgica en todas las pacientes tratadas de CM, independientemente de la técnica quirúrgica empleada tanto en la axila como en la mama y de los tratamientos posquirúrgicos empleados (radioterapia, quimioterapia, hormonoterapia).
El paciente fue remitido al Servicio de Rehabilitación, se realizó un examen físico del miembro en el postoperatorio, se impartió educación terapéutica mediante la «Escuela de Linfedema» con contenidos teórico-prácticos sobre los efectos secundarios de los tratamientos del CM, se monitorizó el seguimiento durante un año, se realizó una identificación precoz del LF y una rápida intervención cuando apareció desde los estadios más iniciales.
Como variables analizadas se incluyeron los costes –tanto directos como indirectos– del tratamiento convencional que se viene aplicando de forma tradicional en todos los centros donde se trata el LF ya instaurado. Por otro lado, hicimos una estimación de estos mismos costes en el caso de aplicación de un sistema prospectivo para el abordaje del LF, propuesta de nuestro trabajo.
Con los datos obtenidos realizamos un estudio económico comparativo de ambos modelos y del ahorro estimado tras la aplicación del modelo prospectivo.
ResultadosLos resultados obtenidos del cálculo de costes del proceso de rehabilitación tradicional en el Hospital Universitario Ramón y Cajal, por paciente y año, para el tratamiento del LF están detallados en la tabla 2. De nuestras pacientes con CM un 28,5% desarrolló LF.
Costes del tratamiento tradicional del linfedema (estadios avanzados). Datos recogidos del Servicio de Rehabilitación del Hospital Ramón y Cajal durante el año 2014
| Costes directos | Costes indirectos |
|---|---|
| Consultas médicas cada 6 meses (primera consulta: 284,68 € y revisión: 170,81 €) | Desplazamiento para tratamientos diarios |
| Fisioterapia cada 6 meses (concierto de derivación de drenaje linfático –15 sesiones de tratamiento–: 430 €) | Incapacidad laboral |
| Gasto en vendas de autodrenaje, cremas, presoterapia (80 €/2 meses) | Gastos de medicación |
| Sistemas de contención cada 6 meses (manga 200 € y guante 250 €) | |
| Costes del tratamiento antibiótico en caso de infección/ingresos | |
| Coste final por paciente/año: 2.500 € aprox. (sin tener en cuenta los costes indirectos ni los directos por infección/ingreso) |
Un total de 1.400 pacientes son valoradas en la consulta de Rehabilitación durante el año 2014, de las cuales 212 precisaron terapia física intensiva o de mantenimiento (15,14%). Este porcentaje corresponden a los LF en estadios avanzados o mal controlados.
El coste final del tratamiento tradicional en euros por paciente/año en estadios avanzados es aproximadamente 2.500 € (sin tener en cuenta los costes indirectos ni los directos por infección/ingreso). En él se incluyen costes directos como consultas médicas, fisioterapia (concierto de derivación –15 sesiones de tratamiento–) y otros gastos que incluyen vendas de autodrenaje, cremas, sistema de presoterapia y medidas de contención cada 6 meses tipo manga y guante
Hay que tener en cuenta también que existen costes del tratamiento antibiótico en caso de infección/ingresos (1/3 desarrollan infecciones); y costes indirectos: desplazamiento para tratamientos diarios, incapacidad laboral y gastos de medicación que están incluidos en la tabla 2.
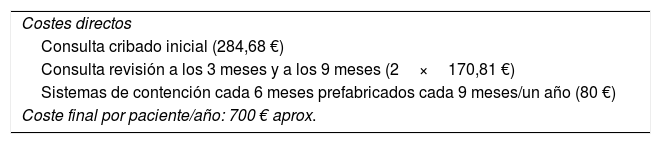
Por otro lado, hacemos una estimación de estos mismos costes en el caso de aplicación de un sistema prospectivo para el abordaje del LF, que incluye solo la consulta, las revisiones y el sistema de contención en caso de estadios iniciales del LF mediante manga y guante (tabla 3).
Estimación de costes del tratamiento del linfedema siguiendo el modelo de vigilancia prospectiva de Stout
| Costes directos |
| Consulta cribado inicial (284,68 €) |
| Consulta revisión a los 3 meses y a los 9 meses (2×170,81 €) |
| Sistemas de contención cada 6 meses prefabricados cada 9 meses/un año (80 €) |
| Coste final por paciente/año: 700 € aprox. |
En este sistema prospectivo todos los pacientes acuden a la escuela de linfedema y son evaluados posquirúrgicamente. Esto incluye el coste del cribado y el coste de intervención en estadios iniciales del LF. Así se evitan consultas y costes indirectos siendo aproximadamente un 25% de la cantidad estimada en el enfoque tradicional con coste anual/paciente de 700 €.
El LF es un problema de salud importante para los pacientes que sobreviven a un CM17,18. Entre el 10% y el 64% de las mujeres presentan síntomas de LF entre 6 y 36 meses después del tratamiento del CM19. A pesar de los resultados adversos asociados a esta enfermedad, menos del 30% de estos pacientes buscan atención médica para el manejo de los síntomas derivados del LF que pueden afectar a la calidad de vida de forma severa. Existen pocos estudios en España para conocer el coste y la efectividad del tratamiento del LF.
González Viejo et al., en el año 200120, evaluó a 258 pacientes con una edad media de 57 años, afectas de LF secundario a intervención quirúrgica por CM, a las que se había realizado una linfadenectomía axilar, que se trataron mediante drenaje linfático manual y otras técnicas de terapia física, con el objeto de conocer el coste y la efectividad del tratamiento. Se determinaron todos los gastos generados por la atención sanitaria: gastos de personal (médicos, fisioterapeutas, auxiliares de clínica), gastos variables correspondientes al material fungible utilizado (material fungible, fármacos, presoterapia), gastos del uso del servicio de rehabilitación y gastos de los análisis clínicos. El coste medio del proceso resultó ser de 113.235 ptas (680 €), de las cuales 98.455 ptas correspondían a la terapia y significaban el 85% del gasto sanitario del proceso, precisándose 2.333 ptas para reducir cada centímetro del LF.
En el 2011 el Instituto Nacional de la Salud de Quebec realizó un análisis preliminar del impacto presupuestario en la fase de tratamiento intensivo del LF, que resultó ser de promedio 422 $ por paciente. Este coste tiene en cuenta el coste medio de vendas elásticas de compresión del miembro superior (55 $), el coste de la evaluación de un fisioterapeuta (37 $) y el coste de la aplicación de vendaje (330 $) durante un período de 15 sesiones de tratamiento. Esto se elevaría a 440 $ si se alcanza la meseta en 20 sesiones. El coste total anual promedio para el tratamiento de choque o intensivo, en los primeros 5 años de un programa de gestión de LF público sería entre 219.700 y 329.500 $. Estos costes se calculan a partir del coste total medio por paciente (422 $). El tratamiento de la fase de mantenimiento podría costar anualmente unos 1.217 $ en promedio por paciente. Este coste incluye el coste anual equivalente promedio de 2 juegos de prendas de compresión (el guante y la manga) de 1,166 $ por año y de los servicios profesionales de 51 $.
Los pacientes que tienen LF no solo generan mayores costes de tratamiento, sino que también tienen más ingresos hospitalarios por celulitis21.
En 2012, Stout et al.22 presentaron un modelo de vigilancia prospectiva para la rehabilitación y la identificación precoz del LF en las mujeres con CM. Stout comparó los costes directos del tratamiento de LF de inicio precoz con los costes del tratamiento tradicional mediante terapia física descongestiva compleja y encontró un ahorro potencial de más de 2.400 $ por paciente/año, cuando se utiliza el modelo de vigilancia prospectiva23.
Este modelo promueve la vigilancia de los problemas físicos que se asocian con los tratamientos del CM. Proporciona oportunidades para la educación y reducción de riesgos y facilita la identificación precoz del LF, que a su vez permite la intervención precoz con programas de gestión de la actividad física y el peso. Además, ha demostrado eficacia clínica en la identificación temprana y en el tratamiento del LF 15,24 y en la gestión de los síntomas del LF durante toda la vida2,25. También reduce el impacto en los resultados funcionales y mejora la calidad de vida.
La vigilancia prospectiva proporciona además una importante medida de ahorro26, reduciendo los costes asociados al tratamiento21.
Aunque se precisan más análisis económicos, un enfoque prospectivo de vigilancia puede reducir el impacto financiero de esta enfermedad tan prevalente para así poder conservar recursos sanitarios.
La evidencia muestra que la rehabilitación y el ejercicio son eficaces en la prevención de los efectos secundarios físicos del tratamiento del CM. La integración del ejercicio como un componente del modelo beneficia a los pacientes en cada fase de su enfermedad, destacando la importante contribución del ejercicio para la salud global y la supervivencia. El acceso a tiempo a rehabilitación reduce la incidencia de los efectos secundarios a través de la identificación y del tratamiento precoz del LF.
Así se pueden satisfacer las evidentes necesidades, a menudo expresadas por las pacientes, de información, orientación e intervención para abordar y potencialmente mejorar la calidad de vida de las pacientes con CM.
Un modelo de vigilancia prospectiva de este tipo se debería ofertar como prestación para la atención integral a los pacientes con CM, con la finalidad de mejorar los parámetros de salud en esta población27–29.
Como limitaciones del estudio, ha de tenerse en cuenta que el cálculo de los gastos en los diferentes estudios de distintos países está sujeto a las diferencias en los gastos directos e indirectos acorde con el sistema sanitario y coberturas correspondientes a cada país, lo que dificulta hacer valoraciones comparativas.
En conclusión, la vigilancia prospectiva en el LF puede reducir la necesidad de rehabilitación intensiva y es coste-efectiva. Es, por tanto, un modelo clínicamente eficaz para identificar y gestionar las primeras etapas del LF asociado al CM. En nuestro estudio obtuvimos un ahorro potencial del 75% del coste asociado al modelo tradicional vigente. Por ello, recomendamos la evaluación y seguimiento prospectivos de todas las pacientes con CM, independientemente del tratamiento específico al que sean sometidas, con la finalidad de proporcionar educación terapéutica, seguimiento y tratamiento precoz, para evitar las repercusiones tanto físicas como sobre la calidad de vida. Por tanto, nuestros resultados indican que un modelo de vigilancia prospectivo disminuye potencialmente los costes de los tratamientos tanto directos como indirectos asociados a la gestión del LF.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.