La neuralgia del trigémino es uno de los síndromes de dolor facial más graves. La incidencia anual varía entre el 4-13% y altera de forma significativa la calidad de vida de los afectados.
El tratamiento inicial de la neuralgia del trigémino es el farmacológico, y la carbamacepina es el único fármaco con suficiente nivel de evidencia, si bien otros fármacos han demostrado eficacia, aunque de forma más limitada. Cuando falla el tratamiento médico debe considerarse la cirugía y se puede optar por la intervención abierta o por técnicas percutáneas mínimamente invasivas.
Este artículo revisa las opciones terapéuticas médicas y quirúrgicas para el tratamiento de la neuralgia del trigémino, basado en la evidencia actual disponible.
Trigeminal neuralgia is one of the most severe facial pain syndromes. The annual incidence varies between 4-13% and has a significant effect on patient quality of life.
The initial treatment of trigeminal neuralgia is pharmacological, and although other drugs have demonstrated efficacy, albeit in more limited form, carbamazepine is the only drug with sufficient level of evidence. When medical treatment fails, surgery should be considered and can opt for open surgery or minimally invasive percutaneous techniques.
This paper reviews the medical and surgical therapeutic options for the treatment of trigeminal neuralgia, based on current available evidence.
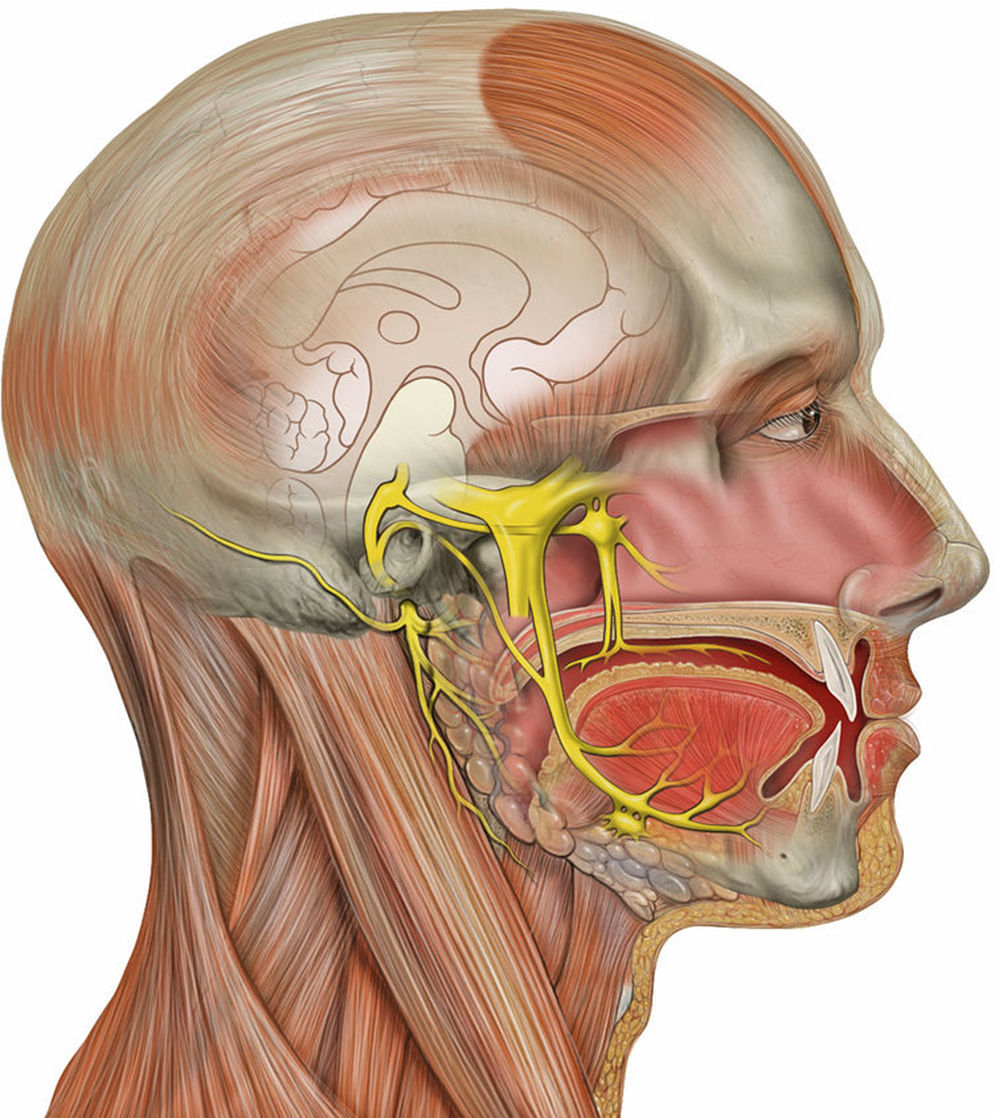
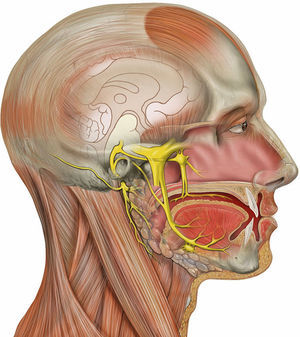
El nervio trigémino o nervio trigeminal, también conocido como quinto par craneal o V par, es un nervio con función mixta, motora y sensitiva, teniendo predominio de función sensitiva. Controla principalmente la musculatura de la masticación y la sensibilidad facial. La función sensitiva del trigémino se conforma por fibras aferentes somáticas que conducen impulsos exteroceptivos, como sensaciones táctiles, de propiocepción y dolor, de los dos tercios anteriores de la lengua, dientes, la conjuntiva ocular, la duramadre y de la parte ectodérmica de la mucosa bucal, nariz y senos paranasales. Las ramas motoras del nervio trigémino están en el nervio mandibular. Estas fibras se originan en el núcleo motor del quinto nervio que se localiza cerca del núcleo trigémino. La parte motora está formada por fibras que pertenecen al ramo mandibular, inervando así los músculos masticadores, como el temporal, el masetero, pterigoideos, además del tensor del tímpano, el milohioideo y el digástrico. El nervio trigémino emerge en la superficie medio-lateral de la protuberancia como una raíz sensitiva grande y una raíz motora pequeña. Su ganglio sensitivo (el ganglio semilunar, trigeminal o de Gasser) se asienta en una depresión, la caverna trigeminal (cavum de Meckel), en el piso de la fosa craneana media (fig. 1)1.
Nervio trigémino, vista lateral derecha.
Fuente: Wikipedia1.
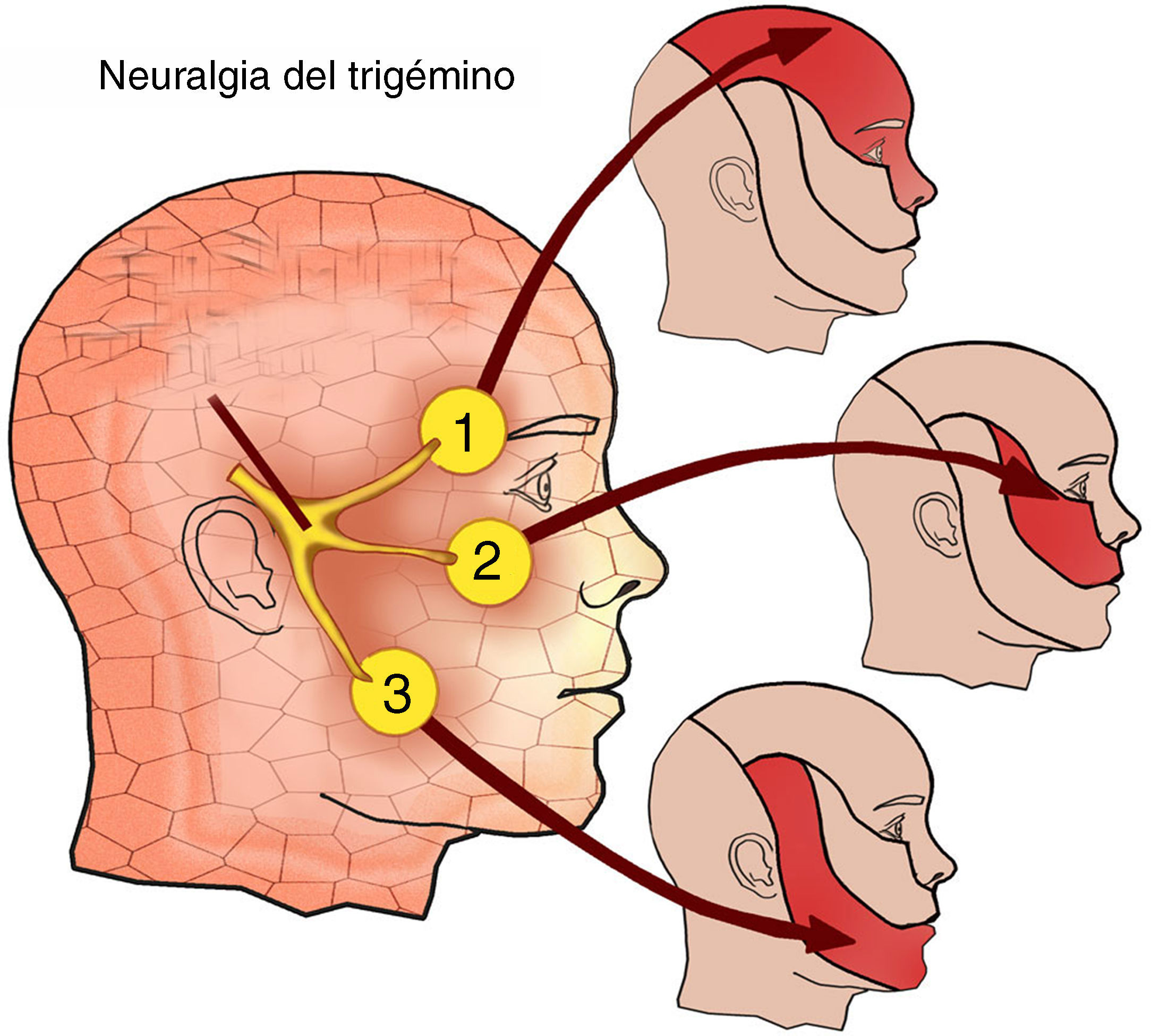
Este nervio se divide en 3 ramas principales1 (fig. 2):
- •
El nervio oftálmico o V1, que sale del cráneo por la fisura orbitaria superior y discurre por el techo de la órbita donde dan sus ramas (nasal, frontal y lagrimal). Conduce información sensitiva del cuero cabelludo y la frente, el párpado superior, la córnea, la nariz, la mucosa nasal, los senos frontales y partes de las meninges.
- •
El nervio maxilar o V2, que atraviesa el agujero redondo mayor para pasar a la fosa pterigopalatina, en la que se divide. Conduce información sensitiva del párpado inferior y la mejilla, el dorso y la punta de la nariz, el labio superior, los dientes superiores, la mucosa nasal, el paladar y el techo de la faringe, y los senos maxilar etmoidal y esfenoidal.
- •
El nervio mandibular o V3, que atraviesa el agujero oval para llegar a la fosa cigomática y dividirse. Conduce información sensitiva del labio inferior, los dientes inferiores, las alas de la nariz y la barbilla, y de dolor y temperatura de la boca. La sensibilidad de los dos tercios anteriores de la lengua acompaña a una rama de este nervio, la lingual, aunque estos tipos de fibras nerviosas luego se desvían para formar parte del par vii.
La neuralgia del trigémino (NT) es el tipo de dolor facial más frecuente y tiene una prevalencia de 4-13 casos por 100.000 habitantes, según diferentes estudios epidemiológicos2–4. La NT afecta en general a pacientes mayores de 50 años y con una frecuencia moderadamente superior en las mujeres, en una proporción de 1,5 a 1.
Esta enfermedad es más habitual entre los pacientes con diagnóstico de esclerosis múltiple (incidencia del 1-2%), se asocia a una disminución de la calidad de vida y supone un impacto sobre la capacidad laboral en un 34% de los pacientes5. Con frecuencia, estos pacientes presentan síndromes depresivos reactivos al dolor refractario.
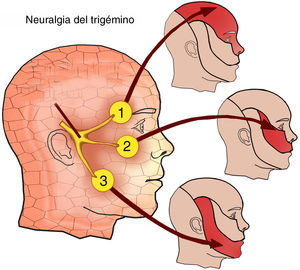
Neuralgia del trigémino: clínica, fisiopatología y diagnósticoLa NT se define como un cuadro de dolor paroxístico, lancinante y de breve duración, generalmente de 5-20s de duración, generalmente unilateral y localizado en el territorio de una o más ramas del nervio trigémino. Afecta con mayor frecuencia a las ramas ii (maxilar) o iii (mandibular), si bien en su evolución la neuralgia puede extenderse a otra/s rama/s. El dolor puede aparecer de forma espontánea o ser desencadenado por estímulos externos sobre determinadas zonas sensibles (puntos gatillos) en el territorio de alguna de las ramas del v par. Otras actividades que pueden desencadenar el dolor son la masticación, hablar, lavarse los dientes o la aplicación de cosméticos faciales. No suele acompañarse de déficit neurológico en los casos idiopáticos y la detección de anomalías sensitivas debe indicar la presencia de una neuralgia sintomática.
Hay 2 tipos principales de NT, la primaria o idiopática, y la secundaria. En las formas secundarias es evidente que una compresión extrínseca de la estructura nerviosa es la que desencadena el dolor. Respecto a la fisiopatología de la NT primaria, existen diversas hipótesis6. Entre las más aceptadas se encuentra la compresión de la raíz dorsal del trigémino en su entrada en el tronco encefálico causada por bucles vasculares7. Otras teorías proponen que la desmielinización de fibras gruesas ocasionada por diversos procesos etiológicos8, al producirse en el ganglio de Gasser o en la raíz dorsal del trigémino, provocaría la formación de cortocircuitos anómalos causantes del dolor9. Estos cortocircuitos estarían formados por fibras nerviosas de conducción lenta, las cuales, al encontrarse en zonas de desmielinización, pueden transmitir a través de axones mielíticos cercanos por el mecanismo de efapsis (punto de contacto lateral entre las fibras nerviosas a través del que los impulsos pueden transmitirse directamente a través de las membranas celulares en vez de a través de la sinapsis). No obstante, la teoría fisiopatológica que puede englobar a la mayoría de las teorías expuestas es la descrita por Fromm et al.10, denominada «teoría epileptógena», en la cual una irritación crónica de las terminaciones nerviosas del trigémino produciría una alteración en los sistemas inhibitorios segmentarios de los núcleos sensitivos del trigémino y, en consecuencia, el aumento de la actividad de estos núcleos por la aparición de potenciales de acción ectópicos. La actividad aumentada de las fibras aferentes primarias, junto con el deterioro de los mecanismos inhibitorios de los núcleos sensitivos, es lo que llevaría a la producción de descargas paroxísticas de las interneuronas de dichos núcleos en respuesta a estímulos táctiles (trigger) y, como resultado, a las crisis dolorosas11. Por este mecanismo se puede explicar la efectividad de los fármacos antiepilépticos utilizados en el tratamiento farmacológico de la NT.
La evidencia demuestra que la irritación crónica más frecuente que desencadena los procesos fisiopatológicos descritos para la NT primaria es la compresión vascular del nervio en su salida del tronco encefálico12. No obstante, no en todos los casos se observa una compresión vascular del nervio, por lo cual, hoy en día permanece como una cuestión controvertida, y estos casos se siguen considerando como NT primaria o idiopática. La Sociedad Internacional de Cefaleas IHS (Headache Classification Committee of the International Headache Society) engloba estos casos en el término «neuralgia del trigémino clásica», con los siguientes criterios diagnósticos13:
- A.
Por lo menos 3 ataques de dolor facial unilateral que cumplan los criterios B y C.
- B.
Que ocurra en una o más ramas del nervio trigémino, sin radiación más allá de la distribución de dicho nervio.
- C.
El dolor tiene al menos 3 de las siguientes 4 características:
- -
Crisis de dolor de tipo paroxístico de duración entre un segundo y 2min.
- -
Intensidad severa.
- -
Superficial, eléctrico o lancinante.
- -
Desencadenado en zonas gatillo o por factores externos (masticación, habla, etc.).
- -
- D.
Sin evidencia de déficits neurológicos asociados.
- E.
No atribuible a otro diagnóstico incluido en la clasificación ICHD-3 (Classification of Headache Disorders, 3rd edition)”.
Respecto a la NT secundaria, en la que existe una dolencia inicial que es el origen de la lesión estructural o funcional del nervio trigémino, las causas más frecuentes son la esclerosis múltiple, que provoca desmielinización de las fibras que forman el nervio, o algunos tumores cerebrales, que pueden comprimir el nervio y provocar una NT sintomática. Así, en comparación con la población general, los pacientes con esclerosis múltiple tienen 20 veces mayor riesgo de desarrollar una NT, con una prevalencia del 2 al 5%14,15. La NT primaria o idiopática suele ser siempre (97%) unilateral; sin embargo, la NT asociada a esclerosis múltiple puede ser bilateral en hasta el 30% de los pacientes14,16. Por lo tanto, es importante tener en cuenta un diagnóstico de la esclerosis múltiple en el paciente que presenta una NT bilateral, particularmente si el enfermo es relativamente joven o tiene otros signos o síntomas neurológicos.
Característicamente, la NT clásica suele cursar con episodios de varias semanas o meses de duración seguidos de periodos libres de dolor, aunque algunos pacientes pueden tener dolor residual continuo, mientras que en la NT secundaria no hay estos periodos ausentes de dolor y suele haber un dolor basal constante, acompañado de paroxismos.
El diagnóstico de la NT es fundamentalmente clínico y se basa, sobre todo, en la anamnesis, donde la exacta localización del dolor, los intervalos libres, los puntos sensitivos bucofaciales, desencadenantes al masticar, etc., son orientativos. En la exploración física hay que tener presente la distribución anatómica de las 3 ramas del v par (oftálmica, maxilar y mandibular) y la evaluación sensitiva facial y del reflejo corneal con examen de los músculos masticadores, que adquieren una particular relevancia. El examen complementario por excelencia, ante la duda, es la resonancia magnética. Ello nos permitirá una selección mejor de los pacientes que serían beneficiarios de la descompresión microvascular17.
Neuralgia del trigémino: tratamiento farmacológicoEn el tratamiento de los pacientes con NT primaria o idiopática se considera el manejo conservador con fármacos como la primera línea de actuación. El fármaco más utilizado durante décadas ha sido y todavía es la carbamacepina. Diversos estudios han demostrado su eficacia, y también tiene utilidad diagnóstica, ya que los pacientes con NT idiopática suelen responder positivamente a ella6. Los pacientes con NT secundaria o con neuralgias faciales atípicas no responden tan adecuadamente. Las dosis oscilan en un rango de 200-1.200mg/día. Su NNT es de 1,8 (rango 1,3-2,2)18. La carbamacepina, por tanto, es el tratamiento de elección en la NT (grado de recomendación A)6, y hace más de 40 años se estudió, en 3 ensayos controlados con placebo, su efecto en la frecuencia y la intensidad de las crisis paroxísticas19. Su uso se complica por los factores farmacocinéticos y por los efectos adversos que produce20.
Una revisión sistemática de la American Academy of Neurology (AAN) publicada en 2008 determinaba que la respuesta al tratamiento en los diferentes estudios realizados, con resolución del dolor completa o casi completa, oscilaba en torno al 58-100%, mientras que con placebo es del 0-40%21. La carbamacepina puede tolerarse mal en ocasiones y desencadenar efectos adversos.
Los efectos adversos sobre el SNC, como mareos, ataxia y diplopía, dependen de las dosis iniciales del fármaco, por ello se recomienda iniciar el tratamiento siempre con dosis bajas. El efecto colateral más precoz es la somnolencia, que aparece a las 24-48h de iniciado el tratamiento. También hay que tener en cuenta las alteraciones hematológicas que pueden aparecer con su administración a largo plazo; las más frecuentes son: anemia aplásica, agranulocitosis, pancitopenia y trombocitopenia. Antes del inicio del tratamiento es recomendable la realización de un estudio de la función hepática del paciente y de un hemograma, que es conveniente monitorizar de forma periódica mientras dure el tratamiento con carbamacepina. Se debe suspender el tratamiento en todos los casos en los que se observe un descenso de alguna de las series hematológicas o cuando se detecte un empeoramiento de la función hepática17.
La oxcarbacepina también se ha mostrado eficaz en el tratamiento de la NT primaria. Puede usarse como tratamiento inicial de la NT22 y estudios en grupos pequeños de pacientes han demostrado que es igual de efectiva que la carbamacepina, y es bien tolerada y eficaz en pacientes epilépticos ancianos17. Tres estudios a doble ciego comparan la oxcarbacepina (dosis media de 1.038mg/día) con la carbamacepina (dosis media de 734mg/día), si bien solo uno de ellos se ha publicado23. En un estudio aleatorizado incluido en la revisión de la American Academy of Neurology de 2008 se comparaba la oxcarbacepina con la carbamacepina en 178 pacientes con NT idiopática. Ambas mostraron una eficacia similar, con más del 50% de reducción de crisis de dolor en el 88% de los casos21. El rango terapéutico es de 600-1.800mg/día. En algunos estudios, la oxcarbacepina muestra una mejor tolerabilidad con una menor frecuencia de efectos adversos frente a la carbamacepina; no obstante, el grado de evidencia es algo inferior (grado de recomendación B), y se considera un fármaco indicado en pacientes que no responden o no toleran la carbamacepina6.
Además de los 2 anteriores, existen otros fármacos que también han demostrado eficacia, aunque de forma más limitada (grado de recomendación C):
- -
Lamotrigina: en un estudio aleatorizado doble ciego se trataron 14 casos de NT refractaria a carbamacepina frente a placebo, y se obtuvo beneficio en 11 de ellos con la dosis de 400mg24,25. La limitación principal es que la dosis inicial es de 25mg/día y se debe ir incrementado con 50mg cada semana, por lo que se tarda varias semanas en alcanzar la dosis efectiva de 400mg.
- -
Baclofeno: la evidencia se limita a un estudio doble ciego en 10 pacientes con NT en los que se administra baclofeno (dosis de 40-80mg) frente a placebo en otros 10 pacientes con NT, en el cual se obtuvo beneficio clínico significativo en 7 de los pacientes tratados con baclofeno26. También ha demostrado un efecto sinérgico con la carbamacepina, pero en este caso se aconseja disminuir la dosis de carbamacepina27.
- -
Topiramato: en un estudio en 8 pacientes con NT clásica, topiramato fue eficaz en el 75% de los pacientes en dosis de 100-400mg/día28. Un metaanálisis evaluó la eficacia y seguridad de topiramato y carbamacepina en el tratamiento de la NT clásica. En este análisis se incluyeron 6 ensayos clínicos aleatorizados con 354 pacientes. Un metaanálisis de estos estudios mostró que la eficacia general y la tolerabilidad de topiramato no parecían diferir de las de carbamacepina en el tratamiento de la NT clásica, aunque este análisis era muy limitado debido a la baja calidad metodológica de estos ensayos clínicos aleatorizados29.
- -
Levetiracetam: su experiencia en NT es escasa. Dos estudios piloto abiertos han investigado la eficacia y la tolerabilidad de levetiracetam en pacientes con NT. Un estudio con 10 pacientes informó de una mejoría del 50-90%30. Otro estudio, con 23 pacientes, reportó una reducción del 62% en el número de ataques diarios en pacientes con NT refractaria a otros tratamientos que recibieron levetiracetam31. El rango de dosis efectiva de levetiracetam en NT es 1.000-4.000mg/día.
- -
Recientemente se ha utilizado un nuevo fármaco antiepiléptico, lacosamida, que se ha mostrado eficaz por vía intravenosa en casos de crisis aguda de dolor por NT32, y en estudios observacionales en casos de pacientes con dolor neuropático refractario, incluyendo series con NT33,34. No obstante, el grado de evidencia para el tratamiento con lacosamida en la NT está por determinar.
Otros fármacos, como fenitoína, ácido valproico, gabapentina y pregabalina, se han utilizado y se sugiere su efectividad, pero no hay estudios controlados que los avalen, y el grado de evidencia resulta bajo17,35–37. Varios estudios han objetivado que la inyección intradérmica de toxina botulínica tipo A puede ser eficaz a corto plazo en el tratamiento de la NT38,39.
Algunos de estos fármacos mencionados anteriormente, como gabapentina, pregabalina o levetiracetam, han mostrado eficacia como coadyuvantes a los fármacos de primera línea. En la mayoría de los pacientes deberían utilizarse 2 o más fármacos, incluyendo carbamacepina, antes de considerar las opciones quirúrgicas6,17.
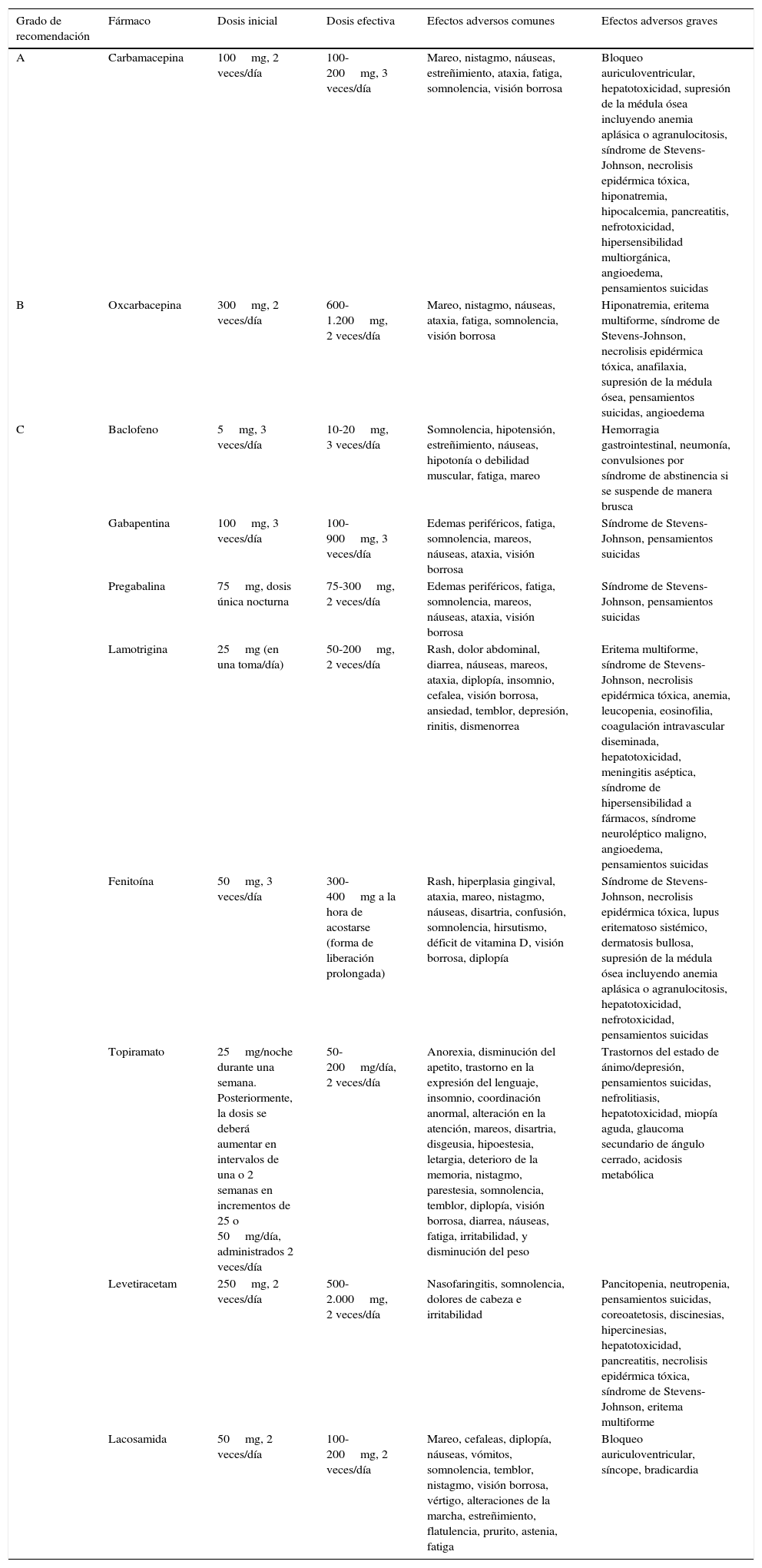
En la tabla 1 se muestran los principales fármacos utilizados en la NT, con las dosis iniciales, las dosis efectivas o terapéuticas, los efectos adversos comunes y graves, así como los grados de recomendación en el tratamiento de la NT.
Tratamiento farmacológico de la neuralgia del trigémino
| Grado de recomendación | Fármaco | Dosis inicial | Dosis efectiva | Efectos adversos comunes | Efectos adversos graves |
|---|---|---|---|---|---|
| A | Carbamacepina | 100mg, 2 veces/día | 100-200mg, 3 veces/día | Mareo, nistagmo, náuseas, estreñimiento, ataxia, fatiga, somnolencia, visión borrosa | Bloqueo auriculoventricular, hepatotoxicidad, supresión de la médula ósea incluyendo anemia aplásica o agranulocitosis, síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, hiponatremia, hipocalcemia, pancreatitis, nefrotoxicidad, hipersensibilidad multiorgánica, angioedema, pensamientos suicidas |
| B | Oxcarbacepina | 300mg, 2 veces/día | 600-1.200mg, 2 veces/día | Mareo, nistagmo, náuseas, ataxia, fatiga, somnolencia, visión borrosa | Hiponatremia, eritema multiforme, síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, anafilaxia, supresión de la médula ósea, pensamientos suicidas, angioedema |
| C | Baclofeno | 5mg, 3 veces/día | 10-20mg, 3 veces/día | Somnolencia, hipotensión, estreñimiento, náuseas, hipotonía o debilidad muscular, fatiga, mareo | Hemorragia gastrointestinal, neumonía, convulsiones por síndrome de abstinencia si se suspende de manera brusca |
| Gabapentina | 100mg, 3 veces/día | 100-900mg, 3 veces/día | Edemas periféricos, fatiga, somnolencia, mareos, náuseas, ataxia, visión borrosa | Síndrome de Stevens-Johnson, pensamientos suicidas | |
| Pregabalina | 75mg, dosis única nocturna | 75-300mg, 2 veces/día | Edemas periféricos, fatiga, somnolencia, mareos, náuseas, ataxia, visión borrosa | Síndrome de Stevens-Johnson, pensamientos suicidas | |
| Lamotrigina | 25mg (en una toma/día) | 50-200mg, 2 veces/día | Rash, dolor abdominal, diarrea, náuseas, mareos, ataxia, diplopía, insomnio, cefalea, visión borrosa, ansiedad, temblor, depresión, rinitis, dismenorrea | Eritema multiforme, síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, anemia, leucopenia, eosinofilia, coagulación intravascular diseminada, hepatotoxicidad, meningitis aséptica, síndrome de hipersensibilidad a fármacos, síndrome neuroléptico maligno, angioedema, pensamientos suicidas | |
| Fenitoína | 50mg, 3 veces/día | 300-400mg a la hora de acostarse (forma de liberación prolongada) | Rash, hiperplasia gingival, ataxia, mareo, nistagmo, náuseas, disartria, confusión, somnolencia, hirsutismo, déficit de vitamina D, visión borrosa, diplopía | Síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, lupus eritematoso sistémico, dermatosis bullosa, supresión de la médula ósea incluyendo anemia aplásica o agranulocitosis, hepatotoxicidad, nefrotoxicidad, pensamientos suicidas | |
| Topiramato | 25mg/noche durante una semana. Posteriormente, la dosis se deberá aumentar en intervalos de una o 2 semanas en incrementos de 25 o 50mg/día, administrados 2 veces/día | 50-200mg/día, 2 veces/día | Anorexia, disminución del apetito, trastorno en la expresión del lenguaje, insomnio, coordinación anormal, alteración en la atención, mareos, disartria, disgeusia, hipoestesia, letargia, deterioro de la memoria, nistagmo, parestesia, somnolencia, temblor, diplopía, visión borrosa, diarrea, náuseas, fatiga, irritabilidad, y disminución del peso | Trastornos del estado de ánimo/depresión, pensamientos suicidas, nefrolitiasis, hepatotoxicidad, miopía aguda, glaucoma secundario de ángulo cerrado, acidosis metabólica | |
| Levetiracetam | 250mg, 2 veces/día | 500-2.000mg, 2 veces/día | Nasofaringitis, somnolencia, dolores de cabeza e irritabilidad | Pancitopenia, neutropenia, pensamientos suicidas, coreoatetosis, discinesias, hipercinesias, hepatotoxicidad, pancreatitis, necrolisis epidérmica tóxica, síndrome de Stevens-Johnson, eritema multiforme | |
| Lacosamida | 50mg, 2 veces/día | 100-200mg, 2 veces/día | Mareo, cefaleas, diplopía, náuseas, vómitos, somnolencia, temblor, nistagmo, visión borrosa, vértigo, alteraciones de la marcha, estreñimiento, flatulencia, prurito, astenia, fatiga | Bloqueo auriculoventricular, síncope, bradicardia |
Cuando falla el tratamiento médico es cuando debe considerarse la cirugía y se puede optar por el procedimiento abierto o por técnicas percutáneas mínimamente invasivas. En la mayoría de los centros, los pacientes jóvenes y en buena condición física con compresión vascular objetivada en pruebas de imagen suelen ser candidatos a microdescompresión vascular, mientras que en los pacientes ancianos o con factores que implican alto riesgo quirúrgico se opta por las técnicas de rizotomía percutáneas5,6.
Microdescompresión vascular y radiocirugía estereotáctica: en el tratamiento quirúrgico se ha usado ampliamente como técnica no ablativa la microdescompresión vascular, basada en la teoría de la compresión del nervio trigémino en su salida del tronco cerebral por una estructura vascular, la más frecuente de las cuales es la arteria cerebelosa superior12. La técnica consiste en realizar una craneotomía retrosigmoidea y separar el nervio trigémino del vaso que lo contacta mediante un material sintético, habitualmente teflón. Se considera una técnica que confiere alivio sintomático a un porcentaje alto de pacientes (>70%) y de forma duradera, con menor necesidad de repetir el procedimiento comparado con las técnicas ablativas percutáneas40. Esta técnica tiene una morbilidad postoperatoria más alta, con una incidencia de complicaciones de un 5%, como la hipoacusia ipsilateral, la fístula del líquido cefalorraquídeo o la hemorragia postquirúrgica41. No obstante, y a pesar de considerarse una técnica quirúrgica de primera elección en muchos centros, la mayoría de los estudios publicados son observacionales o retrospectivos, y no hay evidencia de clase i que determine claramente la superioridad de esta técnica frente a las demás24.
Entre las técnicas ablativas se incluyen la mayoría de las percutáneas y la radiocirugía estereotáctica (gamma knife o acelerador lineal), técnica que se viene utilizando de forma cada vez más frecuente en los últimos años. La diferencia de la radiocirugía respecto a las demás técnicas es que el alivio sintomático no es inmediato, sino que aparece unas 2 semanas después del inicio del tratamiento. Por otro lado, también consigue mejoría en un 80% de los casos y es una de las técnicas más adecuadas en pacientes ancianos o con enfermedad que contraindica el tratamiento quirúrgico, dado el bajo riesgo de complicaciones. En un estudio reciente de 30 pacientes con NT idiopática con contraindicación para cirugía, se realizó radiocirugía mediante acelerador lineal y se obtuvo un 90% de mejoría clínica significativa a los 1,6 meses de tiempo medio tras la cirugía (rango: 1 semana-4 meses), con un tiempo medio sin recurrencia de 62,7 meses42.
En relación con las técnicas percutáneas, que se analizan seguidamente, se han utilizado 3 procedimientos principalmente: la compresión con balón del ganglio de Gasser, la rizolisis con glicerol y la rizotomía o termocoagulación por radiofrecuencia. Estos procedimientos producen un alivio sintomático elevado en el 80-90% de los casos, con unas tasas de recurrencia de dolor mayores que en la microdescompresión vascular, del 20-30% después de un periodo de 2 años5. Entre las complicaciones se describen episodios de bradicardia o asistolia intraoperatoria, hipoestesia facial, paresia del músculo masetero y anestesia dolorosa. Actualmente, la radiofrecuencia es uno de los procedimientos más utilizados, dada su buena tolerancia, especialmente en pacientes ancianos, y el menor riesgo de complicaciones frente a la descompresión microvascular u otras técnicas percutáneas16. No obstante, el principal problema de las técnicas percutáneas, y en especial de la termocoagulación por radiofrecuencia, es la tendencia a la recidiva, que en algunas series llega a ser superior al 60% a los 2 años43.
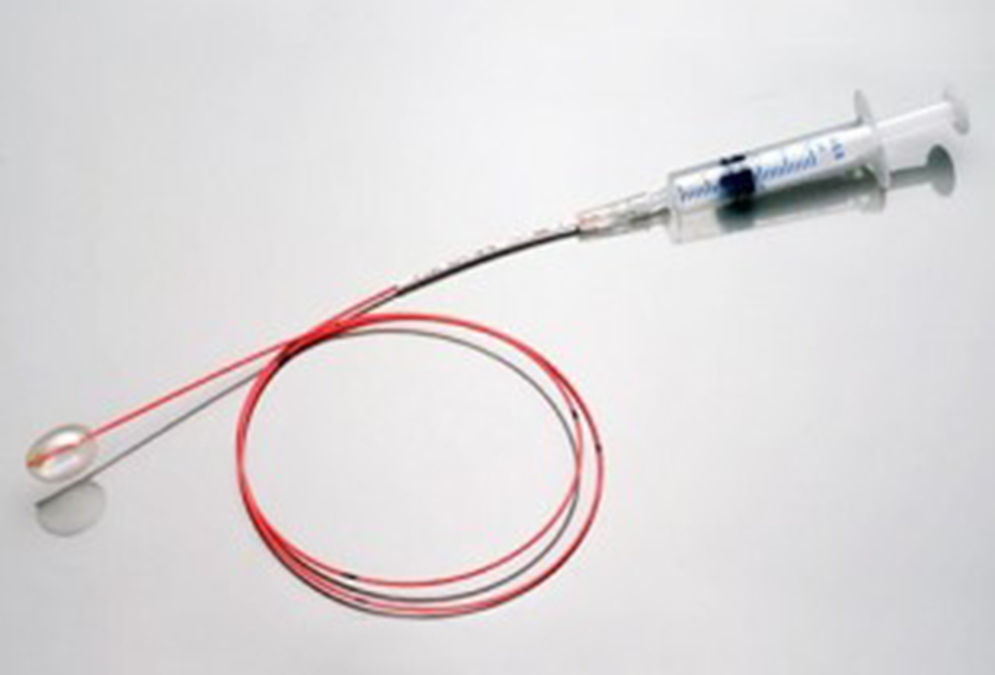
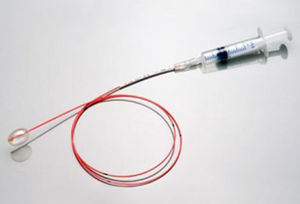
Compresión con balón del ganglio de Gasser: el procedimiento consiste en introducir un catéter de Fogarty (fig. 3) número 4 a través de una aguja canulada tipo Tuohy o una aguja de biopsia. Bajo anestesia general, no requiere la cooperación del paciente, se realiza la punción y se introduce el catéter en el foramen oval. La punta del catéter se deja 1cm por detrás del cavum de Meckel y se insufla el balón con 0,5-1mL de contraste radiológico al 50%, para poder ser visualizado con radioscopia intraoperatoria. El balón debe adquirir una forma de pera una vez hinchado, y se mantiene entre 2 y 3min, aunque este tiempo es muy variable entre diferentes autores6. Proporciona unas tasas de alivio sintomático inicial del 91-94%44, y a los 3 años la recurrencia puede ser hasta del 56%40. En cuanto a los efectos adversos, se notifican complicaciones como disestesias en más del 20% e hipoestesia hasta en el 57%45.
Rizolisis mediante inyección de glicerol: el procedimiento puede realizarse bajo anestesia local o general. Se introduce una aguja en el foramen oval y, a través de ella, primero 1mL de contraste para la visualización por radioscopia de la cisterna del ganglio de Gasser y seguidamente 0,2-0,5mL de glicerol. Los resultados positivos oscilan entre el 75-96%, pero la recidiva es elevada. La recurrencia del dolor a los 6 meses es de un 20% de media, mientras que a los 3 años se encuentra en torno al 50%46. La complicación más frecuente es la hipoestesia facial, en el 20-40% de los casos, que suele asociarse con la disminución del dolor, por lo que se ha indicado como un factor predictivo positivo para mejoría clínica47. Otras complicaciones descritas son la reactivación de herpes labial (12%), disestesias o alodinia (4-11%) y meningitis aséptica (0-7%)46.
Termocoagulación por radiofrecuencia: los primeros intentos confirmaron su efectividad respecto a la mejoría del dolor, pero también se observó el desarrollo de disestesias en un gran número de pacientes tratados. El desarrollo posterior de electrodos más finos y con menor difusión de la temperatura permitió aumentar la selectividad de la lesión. Sin embargo, a medida que se conseguían lesiones menos extensas y se reducían las parestesias, también se observaba una menor efectividad en cuanto a la disminución de dolor, y una mayor recurrencia6,44.
El procedimiento consiste en la termocoagulación mediante radiofrecuencia del ganglio de Gasser a través de una punción percutánea guiada por fluoroscopia. Se coloca al paciente en decúbito supino con la cabeza en ligera extensión y se sitúa el arco de fluoroscopia en una proyección oblicua submentoniana con objeto de visualizar el foramen oval. En el punto situado a 2-3cm de la comisura labial se introduce una cánula (22G), previa instilación de anestesia local, que se dirige hacia una trayectoria situada entre la confluencia de la línea mediopupilar y un punto 3cm anterior al conducto auditivo externo. Se debe situar un dedo en la cavidad oral para evitar que la cánula traspase la mucosa oral, con el consiguiente riesgo de contaminación. Cuando la cánula alcanza el foramen oval, su profundidad en el cavum de Meckel se controla mediante una proyección fluoroscópica lateral, hasta alcanzar como máximo el punto de unión entre el peñasco del temporal y el clivus. En este momento se retira el estilete de la cánula y se introduce el electrodo. Antes de provocar la lesión se debe realizar un test de estimulación, que se suele llevar a cabo con el paciente despierto. Si se hace estimulación motora a una frecuencia de 2Hz y se obtiene contracción del músculo masetero puede confirmarse que la cánula ha traspasado el foramen oval y está en contacto con el nervio mandibular (V3 o tercera rama del trigémino). La estimulación sensitiva se realiza a una frecuencia de 50Hz y a un voltaje de 0,1-0,5V, con lo cual deben obtenerse parestesias en el territorio de la rama del nervio más próxima al electrodo (V1, V2 o V3). Si solo se producen parestesias con un voltaje superior a 0,5V, se considera que el electrodo está demasiado alejado de las raíces del nervio para realizar la lesión, y se debe reposicionar la cánula hasta obtener una respuesta a menor voltaje6,48.
La lesión se puede realizar mediante radiofrecuencia convencional continua, habitualmente con 60°C durante 60s, o utilizando radiofrecuencia pulsada. Esta última es un método menos destructivo de lesión nerviosa con energía transmitida por radiofrecuencia, en contraste con la radiofrecuencia convencional, y transmite impulsos cortos de energía a 42°C o superior, intercalados por pausas, que permiten que el calor se vaya disipando en el tejido que rodea el electrodo. El objetivo de la radiofrecuencia es la lesión de las fibras nerviosas tipo A-δ y C, que son las encargadas de la transmisión del dolor. La radiofrecuencia convencional continua se ha mostrado más efectiva que la radiofrecuencia pulsada en el alivio sintomático del dolor49,50, pero se ha asociado a un mayor número de complicaciones y puede producir lesiones térmicas en las fibras A-β, que transmiten el tacto, más que en las A-δ y C, que son el objetivo primordial de la lesión51. Por otro lado, en cuanto a los resultados de la radiofrecuencia pulsada, se ha observado que la mayor efectividad se consigue en los casos realizados con parámetros de intensidad o voltaje más altos, con los que se obtienen mejores resultados y más prolongados52.
La termocoagulación por radiofrecuencia es un procedimiento muy efectivo en cuanto al alivio inicial del dolor, y se ha descrito mejoría clínica hasta en el 97% de los casos53. Los porcentajes de recurrencia del dolor son difíciles de establecer debido a la variabilidad en cuanto al seguimiento en los diferentes estudios. Se ha descrito recidiva temprana a los 6 meses hasta en el 25%, y persistencia de alivio del dolor sin recurrencia en el 52,3% a los 10 años46. Las complicaciones más frecuentes que se relacionan con la termocoagulación son la hipoestesia facial (1-9%) y la anestesia corneal (0-17%). En una revisión sistemática de 200454, se identificaron 9 estudios observacionales que comparaban las técnicas percutáneas y la radiocirugía estereotáctica. Entre las conclusiones, se indicaba que la termocoagulación por radiofrecuencia puede ofrecer mejores tasas de resolución completa del dolor respecto a la inyección de glicerol, y también en comparación con la radiocirugía. Por otro lado, también se asociaba con un mayor porcentaje de complicaciones6.
ConclusionesLa NT es uno de los síndromes de dolor facial más graves. La incidencia anual varía entre el 4-13% y altera de forma significativa la calidad de vida de los afectados.
El tratamiento inicial de la NT es el farmacológico, y la carbamacepina es el único fármaco con suficiente nivel de evidencia, si bien otros fármacos han demostrado eficacia, aunque de forma más limitada. Cuando falla el tratamiento médico debe considerarse la cirugía y se puede optar por un procedimiento abierto o por técnicas percutáneas mínimamente invasivas.
Las técnicas quirúrgicas percutáneas son efectivas y de fácil aplicación, pero la tendencia a la recidiva conduce a la preferencia por la microdescompresión vascular. Sin embargo, no hay estudios comparativos que determinen la superioridad de alguna técnica con buen nivel de evidencia. La selección de una técnica quirúrgica en la NT no está bien apoyada por ensayos clínicos aleatorizados. Los nuevos procedimientos en la aplicación de la radiofrecuencia pueden mejorar las perspectivas del tratamiento de esta patología.
Conflicto de interesesLos autores declaramos la no existencia de conflicto de intereses.