El objetivo de este estudio es aclarar algunos aspectos relevantes del síndrome RS3PE sobre los que hay discrepancias en la literatura médica actual: los fármacos utilizados para su tratamiento, las dosis más adecuadas y la duración del mismo. Para ello realizamos una revisión bibliográfica recopilando 108 casos.
En un 95% de los casos se trataron con glucocorticoides, siendo el más utilizado la prednisona (68,5%). Aunque no hay unanimidad de criterios en cuanto a posología y duración, el 73,8% de los casos que fueron tratados con prednisona recibieron dosis entre 15 y 20mg/día (dosis media de 18,2mg/día, DE 8,9). Un 66,1% de los casos fueron tratados entre 3 y 6 meses (promedio 5,3 meses, DE 3,8). Presentamos un caso que sirve como hilo conductor de estas observaciones.
The present study was undertaken in order to try to clarify certain aspects of RS3PE syndrome, for which there is no unanimity of opinion in the current literature. An attempt will be made to clarify the best and most suitable drug for treatment, and the dosage duration. In order to do this, a literature search was performed, and a review is presented of the 108 cases collected.
In 95% cases glucocorticoids were the most used, with prednisone in being used in 68.5% of cases. Although there is no unanimity criteria regarding the dosage and duration, 73.8% cases were treated with a prednisone dose from 15 to 20mg/day (median 18.2mg/day, SD 8.9). Two-thirds (66.1%) of cases were treated for 3 to 6 months (median 5.3 months, SD 3.8). A case is presented that serves as a common thread of these observations.
En nuestra consulta del centro de salud hemos diagnosticado un síndrome RS3PE y nos preguntamos: ¿cuál es el fármaco adecuado para tratarlo?, ¿a qué dosis? y ¿durante cuánto tiempo?. El síndrome RS3PE es un cuadro clínico muy poco frecuente cuyas siglas responden a «remitting seronegative symmetrical synovitis with pitting edema» (sinovitis simétrica seronegativa remitente con edema con fóvea o poliartritis aguda edematosa del anciano o polisinovitis edematosa benigna del anciano).
La importancia de conocer su manejo en Atención Primaria se debe a que es fácil de diagnosticar y tratar si se tiene en cuenta dentro del diagnóstico diferencial de una serie de enfermedades altamente prevalentes en la sociedad y que, generalmente, requieren un tratamiento más intensivo y multidisciplinar, así como un seguimiento más exhaustivo, como son la artritis reumatoide clásica, la artritis reumatoide del anciano y la polimialgia reumática1.
Los tratamientos que se proponen en la bibliografía no son homogéneos, constatándose el uso de diversas pautas de fármacos, dosis y duración del tratamiento. Mediante la revisión de la literatura hemos intentado responder a las preguntas que nos formulamos respecto de nuestro paciente. El interés de esta actualización es aportar información científica sobre cuáles son las pautas terapéuticas utilizadas que con más frecuencia son descritas en la bibliografía.
Desarrollo del temaEl síndrome RS3PE es un cuadro reumatológico que puede entenderse como una forma benigna de artritis reumatoide seronegativa en ancianos, de afectación simétrica y asociada a edemas en el dorso de las manos y/o los pies, de etiopatogenia desconocida. Se describió por primera vez por McCarty et al. en 19852 a partir de un estudio realizado con un grupo de pacientes heterogéneos con poliartritis y edad avanzada.
Posteriormente, a raíz de un estudio multicéntrico retrospectivo realizado por Olivo et al.3, se propusieron los criterios diagnóstico de dicho síndrome, que son:
- •
Edad igual o mayor a 65 años.
- •
Factor reumatoide negativo.
- •
Polisinovitis simétrica afectando a muñecas, metacarpofalángicas, interfalángicas proximales y vainas tendinosas de los extensores de las manos.
- •
Edema en «piel de naranja» con fóvea en las zonas afectadas.
- •
Rigidez matutina.
- •
Rápida respuesta al tratamiento esteroideo.
- •
Exclusión de otras enfermedades.
Atendimos a un paciente varón de 74 años diagnosticado de hipertensión arterial, diabetes tipo 2 y fibrilación auricular. Había sido intervenido un año antes de meningioma, sin secuelas neurológicas. En el último año fue diagnosticado de déficit de vitamina B12, causante de anemia megaloblástica y sintomatología neurológica (parestesias en ambas manos y deterioro cognitivo ligero con una puntuación de 22 en el test Mini-Mental de Lobo). Se descartó la gastropatía como causa del déficit, que se corrigió al modificar la medicación, desapareciendo la sintomatología neurológica y la anemia. Seguía tratamiento con vitamina B12, acenocumarol, losartán, furosemida, lercanidipino, diltiazem, atorvastatina y metformina. Acudió al centro de salud en junio de 2012 por dolor en las piernas durante la marcha. Por la clínica y la determinación del índice tobillo-brazo (0,62MII y 0,55IID) se diagnosticó de enfermedad arterial con claudicación intermitente y se prescribió tratamiento con naftidrofurilo 100mg cada 8h.
A la semana de iniciar este tratamiento se le citó para seguimiento evolutivo y comunicó que había mejorado la sintomatología claudicatoria pero que sentía dolor y rigidez en las manos, sobre todo en las articulaciones interfalángicas y metacarpofalángicas de ambas manos, que era peor por las mañanas, y que las manos se le estaban hinchando. A pesar de que las artralgias y los edemas periféricos se han comunicado como efectos secundarios muy poco frecuentes en pacientes tratados con naftidrofurilo (alrededor del 0,5% de los pacientes tratados en ambos casos4,5), se le aconsejó suspender el tratamiento para observar la evolución del cuadro. Una semana después el edema y el dolor en las manos habían aumentado, observándose fóvea a la presión ligera en el dorso de ambas. El edema le impedía cerrar las manos.
La analítica mostró un hemograma y una bioquímica normales, salvo una glucemia basal de 127mg/dl. Otros valores de interés fueron: factor reumatoide de 1,5U/l, proteína C reactiva de 1,5mg/l, TSH de 1,43μU/ml y velocidad de sedimentación globular de 19,0.
Ante la negatividad del factor reumatoide, la presencia de edemas con fóvea en ambas manos y la clínica de rigidez matutina se diagnosticó como síndrome RS3PE y se inició tratamiento con prednisona 5mg cada 12h. Al cabo de una semana tanto los edemas como las molestias en ambas manos cesaron completamente, cumpliéndose con ello los criterios de Olivo para el diagnóstico de dicho síndrome. Se le volvió a indicar naftidrofurilo para el tratamiento de su claudicación intermitente, al descartar que fuera la causa de su problema.
Se le mantuvo el tratamiento con prednisona a dosis de 5mg cada 12h durante un año, pero en julio de 2013 el paciente pidió que se le retirara, si era posible, ese tratamiento, ya que iba a viajar al Golfo de Guinea, en África, y temía que los corticoides le afectaran al sistema inmune. Se le aconsejó que lo suspendiera y que lo retomara si volvían los síntomas. A su vuelta de un mes de viaje, el paciente comunicó que a las 2 semanas de suspender el tratamiento comenzó a sentir la misma sintomatología de nuevo y lo había retomado. Siguió en tratamiento durante 4 meses más y al cabo de ese tiempo se le suspendió, sin que hubiera recidiva. En total, el paciente siguió el tratamiento con prednisona durante 18 meses, salvo un periodo de interrupción de 2 semanas.
Como se ha comentado, el RS3PE es poco frecuente en la práctica clínica. En la bibliografía solo figura un artículo que describa la incidencia de este síndrome, cifrándola en un 0,09% de los pacientes atendidos durante 6 años en un centro de medicina general de un hospital japonés6.
La información sobre la historia natural de la enfermedad y, sobre todo, sobre su tratamiento, es todavía escasa. En esta revisión se incluyeron solo los artículos en los que se describieran los aspectos relativos a comorbilidad y pautas terapéuticas (fármacos utilizados, dosis y duración). De un total de 37 artículos incluidos, el 83,7% son informes de caso clínico que se refieren a un solo caso, y solo 4 aportan información sobre un número de casos comprendido entre 12 y 23 que pudieran añadir un mayor volumen y precisión de la información. En total, se ha encontrado información sobre 108 casos clínicos.
La edad promedio en la que es más frecuente la aparición del RS3PE en los casos descritos en la bibliografía es 72,3 años (DE 8,8), siendo uno de los criterios diagnósticos tener más de 50 años. En nuestro caso se cumplía claramente este criterio. Además, nuestro paciente es un varón, que es el sexo en el que se da con mayor frecuencia el síndrome RS3PE (61% de los casos que se describen en la bibliografía).
En el diagnóstico de RS3PE se han utilizado una gran diversidad de estrategias. En los casos descritos en la bibliografía se han identificado hasta 18 combinaciones de pruebas diagnósticas, como radiografías, resonancia magnética nuclear, gammagrafía, ecografía, tomografía axial computarizada, biopsia sinovial, escintigrafía con gadolinio y ecodoppler. Las pruebas de imagen más utilizadas en el diagnóstico del síndrome RS3PE han sido las radiografías, en un 36% de los casos, y la resonancia magnética nuclear, en un 61%. En nuestro caso no utilizamos pruebas de diagnóstico por imagen, siguiendo un criterio puramente clínico y de eficiencia, ya que no se han descrito signos radiográficos entre los criterios para el diagnóstico de la enfermedad.
Nuestro paciente tenía diabetes tipo 2, fibrilación auricular crónica y claudicación intermitente. Hasta un 20% de los casos descritos en la bibliografía mostraron otras enfermedades asociadas, lo que no es de extrañar, dada la avanzada edad en la que suele iniciarse el RS3PE. Sin embargo, Cantini et al.7, en un estudio de 23 pacientes, descartan la presencia de manifestaciones clínicas de comorbilidad.
En la bibliografía médica no se han encontrado ensayos clínicos que comparen la eficacia de distintos fármacos en el tratamiento del síndrome RS3PE. En el tratamiento de dicho síndrome se han utilizado casi siempre los corticoides (95% de los casos). En algunos de los artículos revisados no se especifica qué glucocorticoides se utilizan para su tratamiento8–13. No obstante, de los diversos corticoides mencionados, el más utilizado ha sido la prednisona, que fue utilizada en un 68,5% de los casos. Algunos pacientes han sido tratados con metilprednisolona14,15, y un solo paciente de la bibliografía revisada fue tratado con dexametasona16. Otros fármacos utilizados han sido alopurinol, cloroquina17, etanercept18 y tocilizumab19, pero, como hemos dicho, ningún ensayo ha comparado la eficacia de unos respecto de otros. Queda claro, por tanto, que nuestra elección de prednisona fue acorde a la más común de las prácticas clínicas en este síndrome.
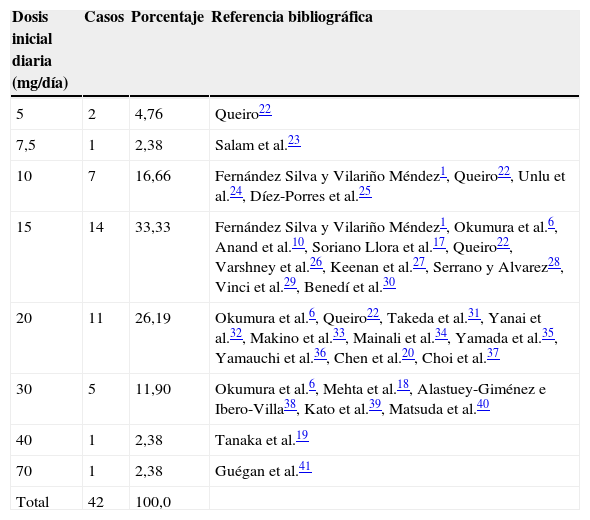
La dosis inicial de prednisona solo figura en un 66% de los casos descritos que fueron tratados con este fármaco. En nuestro caso, prescribimos una dosis inicial de 5mg cada 12h para evaluar la respuesta clínica y minimizar los posibles efectos secundarios, especialmente sobre el control glucémico del paciente. Con esta dosis obtuvimos una rápida desaparición de los síntomas y una mínima repercusión sobre las cifras de glucemia del paciente, que fueron monitorizadas mediante controles de glucemia capilar diarios durante las primeras 2 semanas. Los valores de hemoglobina glicosilada se mantuvieron estables a lo largo del periodo de seguimiento del paciente. Sin embargo, esa dosis solo se utilizó en un 10,4% de los casos descritos en la bibliografía, en los que las dosis más frecuentes fueron de 15mg o más al día (tabla 1).
Pacientes tratados con prednisona
| Dosis inicial diaria (mg/día) | Casos | Porcentaje | Referencia bibliográfica |
|---|---|---|---|
| 5 | 2 | 4,76 | Queiro22 |
| 7,5 | 1 | 2,38 | Salam et al.23 |
| 10 | 7 | 16,66 | Fernández Silva y Vilariño Méndez1, Queiro22, Unlu et al.24, Díez-Porres et al.25 |
| 15 | 14 | 33,33 | Fernández Silva y Vilariño Méndez1, Okumura et al.6, Anand et al.10, Soriano Llora et al.17, Queiro22, Varshney et al.26, Keenan et al.27, Serrano y Alvarez28, Vinci et al.29, Benedí et al.30 |
| 20 | 11 | 26,19 | Okumura et al.6, Queiro22, Takeda et al.31, Yanai et al.32, Makino et al.33, Mainali et al.34, Yamada et al.35, Yamauchi et al.36, Chen et al.20, Choi et al.37 |
| 30 | 5 | 11,90 | Okumura et al.6, Mehta et al.18, Alastuey-Giménez e Ibero-Villa38, Kato et al.39, Matsuda et al.40 |
| 40 | 1 | 2,38 | Tanaka et al.19 |
| 70 | 1 | 2,38 | Guégan et al.41 |
| Total | 42 | 100,0 |
La media de las dosis utilizadas fue 18,2mg/día (DE 8,9), y la mediana, 15mg/día. Dado que las dosis utilizadas en los casos publicados no se expresan por kilos de peso, teniendo en cuenta que en España se comercializa la prednisona en presentaciones de 5 o 10mg y que el 73,8% de los casos publicados fueron tratados con dosis de 15 a 20mg, consideramos que estas 2 pautas pueden ser utilizadas, teniendo en cuenta el peso y la gravedad de los síntomas.
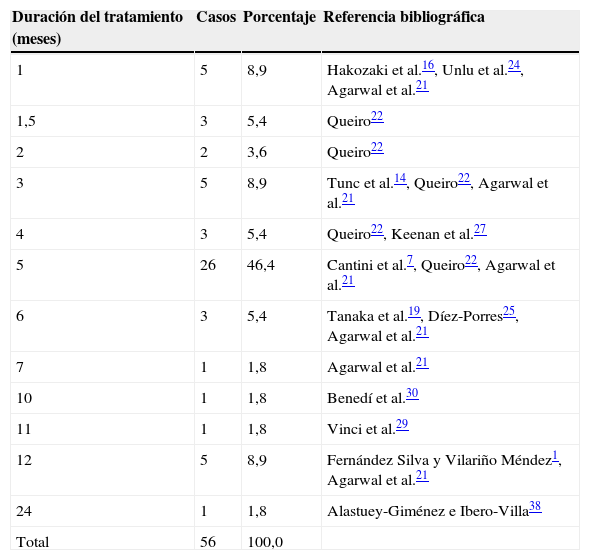
Mientras que el fármaco de elección y la dosis inicial adecuada gozan de un cierto grado de acuerdo en la bibliografía, la duración idónea del tratamiento muestra una importante variabilidad. Aunque la duración promedio del tratamiento fue de 5,3 meses (DE 3,8), como se observa en la tabla 2, algo menos de la mitad de los casos se trataron con esta duración (46,4%). En nuestro caso, el tratamiento fue interrumpido por el paciente cuando llevaba 14 meses, y retomado posteriormente 4 meses más. De los casos descritos en la bibliografía, solo uno fue tratado por un periodo superior al año.
Duración del tratamiento en meses
| Duración del tratamiento (meses) | Casos | Porcentaje | Referencia bibliográfica |
|---|---|---|---|
| 1 | 5 | 8,9 | Hakozaki et al.16, Unlu et al.24, Agarwal et al.21 |
| 1,5 | 3 | 5,4 | Queiro22 |
| 2 | 2 | 3,6 | Queiro22 |
| 3 | 5 | 8,9 | Tunc et al.14, Queiro22, Agarwal et al.21 |
| 4 | 3 | 5,4 | Queiro22, Keenan et al.27 |
| 5 | 26 | 46,4 | Cantini et al.7, Queiro22, Agarwal et al.21 |
| 6 | 3 | 5,4 | Tanaka et al.19, Díez-Porres25, Agarwal et al.21 |
| 7 | 1 | 1,8 | Agarwal et al.21 |
| 10 | 1 | 1,8 | Benedí et al.30 |
| 11 | 1 | 1,8 | Vinci et al.29 |
| 12 | 5 | 8,9 | Fernández Silva y Vilariño Méndez1, Agarwal et al.21 |
| 24 | 1 | 1,8 | Alastuey-Giménez e Ibero-Villa38 |
| Total | 56 | 100,0 |
Nuestro paciente presentó una recidiva por interrupción del tratamiento. En la bibliografía figuran 5 casos de recidiva, aunque solo se describen las características de algunos de ellos9,20. Dos de ellos fueron varones de 73 y 78 años, ambos tratados con corticoides (uno de ellos con 20mg diarios de prednisona como dosis inicial y el otro no lo precisa la publicación), y en ningunos de los 2 casos se describe el tiempo de tratamiento ni la duración del periodo de seguimiento, por lo que no es posible sacar conclusiones sobre el efecto de la duración del tratamiento sobre el riesgo de recidiva. Sin embargo, hay un caso descrito por Agarwal et al.21 que presentó una recidiva a los 5 meses, tras suspender el tratamiento realizado durante 14. Queiro22 describe otros 2 pacientes que recidivaron con los mismos síntomas, uno a los 2 años y otro a los 5, pero volvieron a ser tratados con la misma dosis de prednisona tras haber realizado un tratamiento de 6 meses de duración.
Nosotros hemos seguido al paciente durante un periodo total de 24 meses, sin que haya presentado posteriores recidivas, habiendo cesado definitivamente el tratamiento a los 18 meses de seguimiento.
Consideramos que dada la baja incidencia de este síndrome, la comunicación de nuevos casos y el análisis conjunto de los que se publican suponen un apoyo muy útil a la práctica clínica en su diagnóstico y tratamiento.
Conclusiones más relevantesEl RS3PE es un padecimiento raro (baja incidencia) y, por tanto, poco conocido, lo que hace pensar que su divulgación y la formación de los médicos de Atención Primaria en este tema puede servir para mejorar los diagnósticos y también para acercarse a las cifras reales de incidencia y, con ello, a un mejor conocimiento del cuadro clínico y de su tratamiento.
Aunque se trate de una enfermedad muy infrecuente, es fácil de diagnosticar y tratar en consultas de Medicina de Familia, ya que no son necesarias pruebas complementarias costosas ni difíciles, sino que se trata de un diagnóstico fundamentalmente clínico (edema con fóvea simétrico en ambas manos con o sin dolor), que se apoya, como prueba complementaria esencial, en la determinación de la velocidad de sedimentación globular, la negatividad del factor reumatoide y en la buena respuesta al tratamiento con corticoides orales, estando, por tanto, al alcance de cualquier consulta de Atención Primaria.
En cuanto a la pauta terapéutica de uso más común, el fármaco más utilizado es la prednisona, la dosis más frecuente es entre 15 y 20mg/día (dosis media de 18,2mg/día), siendo el tiempo de tratamiento de entre 3 y 6 meses (promedio 5,3 meses).
La baja incidencia del RS3PE hace que no existan ensayos clínicos para evaluar cuáles pueden ser las mejores pautas terapéuticas, de ahí el interés de la revisión de los casos publicados para que, con su análisis agrupado, se puedan extraer conclusiones sobre las prácticas clínicas más frecuentes en su tratamiento.
Conflicto de interesesAl tratarse de la descripción de un caso clínico, sin haberse realizado ninguna intervención con carácter investigador, los autores declaran que no se han realizado experimentos en seres humanos ni en animales, no se han manejado datos clínicos identificables ni se dan circunstancias que puedan incurrir en conflictos de intereses.