En los últimos años se ha descrito la presencia de microorganismos inusuales en el biofilm subgingival, posibles iniciadores o contribuyentes a la patogenia de la enfermedad periodontal, particularmente en personas que responden mal a la terapia.
ObjetivosEstudiar la invasión de levaduras del género Candida en el tejido conectivo gingival, y su relación con la portación en el biofilm subgingival.
MétodosSe estudiaron 55 pacientes de ambos sexos, entre 21 y 55 años, con enfermedades gingivo-periodontales, inmunocompetentes, no fumadores y sin tratamiento antimicrobiano previo. Se tomaron muestras de tejidos blandos, de placa supragingival y subgingival, y biopsias de las bolsas periodontales. Se llevaron a cabo estudios microscópicos, cultivos, perfiles de asimilación y amplificación de ADN.
ResultadosEn los cultivos realizados, el 35% de las muestras presentaban diferentes especies de Candida, con mayor prevalencia de Candida albicans. Se evidenció la presencia de hifas invadiendo el tejido conectivo en asociación con microorganismos anaerobios (Porphyromonas gingivalis, Prevotella intermedia y Aggregatibacter actinomycetemcomitans) en los pacientes con periodontitis.
ConclusionesLas distintas especies de Candida podrían formar parte de la placa microbiana periodontal y jugar un papel fundamental en la adherencia de la misma a los tejidos, permitiendo la invasión en profundidad. Así también podrían infectar las bolsas de los pacientes con gingivitis, incluso en sitios sanos, cumpliendo un papel de comensal u oportunista.
In the last few years unusual microorganisms have been isolated from subgingival biofilm, as possible initiators or contributors to periodontal disease, especially in patients who show no improvement during treatment.
AimsTo study the Candida invasion of the connective tissue in relation to subgingival biofilm presence.
MethodsA total of 55 immunocompetent patients of both sexes, between 21 and 55 years of age, non-smokers, without previous antimicrobial treatment, suffering periodontal diseases, were studied. Soft tissues, supragingival and subgingival plaque samples, and periodontal pocket biopsies were taken. Microscopic studies, cultures, assimilation profiles, and DNA amplifications were performed.
ResultsIn 35% of the samples, different species of Candida were isolated in cultures, especially Candida albicans. Hyphae invasions in the connective tissue were observed, in association with anaerobic microorganisms (Porphyromonas gingivalis, Prevotella intermedia and Aggregatibacter actinomycetemcomitans) in patients with periodontitis.
ConclusionsDifferent species of Candida could be part of the periodontal plaque and could play an important role in the adherence to soft tissues, allowing deep invasion. They also could infect gingival pockets in patients with gingivitis, even in healthy locations, playing a commensal or opportunist role.
En los últimos años ha crecido el interés por especies microbianas no halladas comúnmente en el biofilm subgingival, que pueden ser iniciadoras o contribuir a la patogenia de la enfermedad periodontal. Estos microorganismos inusuales pueden hallarse particularmente en pacientes que responden mal a la terapia.
Las enfermedades gingivo-periodontales se asocian a una compleja y diversa microbiota, vinculada a bacterias grampositivas, gramnegativas, microorganismos aerobios, anaerobios y posiblemente levaduras. Dichos microorganismos interactúan entre sí y con el hospedero, y sus mecanismos patogénicos no son conocidos íntegramente2.
Candida albicans es la especie de levadura más frecuentemente asociada a estas infecciones. Otras especies emergentes con menor prevalencia pueden encontrarse también en dicha localización4,12.
Para que las levaduras colonizadoras se transformen en patógenas se requieren alteraciones de los mecanismos defensivos del huésped, así como de los factores de virulencia en estos hongos. Las hifas de Candida penetran en los tejidos del huésped y se adhieren a su superficie con mayor habilidad en comparación con las formas levaduriformes.
Reynaud et al.10 postulan que las levaduras actúan en sinergia con bacterias patógenas, muchas de ellas con capacidad de invasión tisular como Aggregatibacter actinomycetemcomitans y Porphyromonas gingivalis. Sin embargo su papel como protagonista en la enfermedad periodontal no está claro. No obstante, su hallazgo en la bolsa gingival y periodontal representa un reservorio favorable para la multiplicación de estos microorganismos que podrían estar implicados en la patogénesis de la destrucción del tejido periodontal. Esto se confirmaría si se pudiera observar penetración de las levaduras en dichos tejidos.
MétodosSe estudiaron 55 pacientes de ambos sexos, entre 21 y 55 años, con enfermedades gingivo-periodontales. Los pacientes participantes en este estudio eran inmunocompetentes, no fumadores, y no habían recibido ningún tratamiento antimicrobiano previo a la toma de la muestra. Se evaluaron los parámetros clínicos y radiográficos para clasificarlos. El grupo control se estableció con pacientes sin enfermedad gingivo-periodontal. Todos los pacientes firmaron el consentimiento informado aprobado por la Comisión de Ética de la Facultad de Odontología de la Universidad de Buenos Aires.
Los indicadores clínicos se determinaron con sonda periodontal de presión controlada, midiéndose la profundidad al sondaje, la pérdida de inserción y la existencia de hemorragia al sondaje (considerando tras 30 segundos el resultado como positivo –1– o negativo –0).
También se calculó el índice de placa, haciendo la siguiente clasificación: 0: ausencia de depósito de placa; 1: placa descubierta tras pasar la sonda a lo largo del margen; 2: placa visible, y 3: placa abundante. El índice gingival también fue clasificado de la siguiente manera: 0: ausencia total de signos visuales de inflamación; 1: ligero cambio de color y textura; 2: inflamación visual y tendencia al sangrado del margen gingival después de pasar la sonda levemente a lo largo del margen gingival, y 3: inflamación manifiesta con tendencia al sangrado espontáneo. Se delimitó a su vez la ubicación del margen gingival y se verificó la movilidad dentaria con pinza de algodón. Se tomaron radiografías seriadas periapicales de ambos maxilares.
Se clasificaron como pacientes sin enfermedad gingivo-periodontal a aquellos sin hemorragia al sondaje, profundidad de sondaje <2mm, pérdida de inserción <2mm, sin movilidad, índice de placa ≤1, e índice gingival ≤1. Los demás pacientes fueron considerados con enfermedad periodontal, que podía ser leve, moderada, o grave de acuerdo con la última clasificación de la Academia de Periodontología1.
Se indicó la realización de un enjuague con solución estéril de cloruro de sodio al 0,98% antes de la toma de la muestra. Con un hisopo se tomaron muestras de los tejidos blandos, el paladar, la mucosa yugal y la lengua. Este se llevó a un tubo de ensayo con 1ml de solución estéril de cloruro de sodio al 0,98%.
Se aisló la zona de toma con rollos de algodón y suctor de alta potencia, y con una parte activa de la cureta de Gracey 7/8 se eliminó la placa supragingival. Con la otra parte activa se tomó la muestra subgingival, que se colocó en tubos Eppendorf con 0,5ml de solución estéril de cloruro de sodio al 0,98% y en medio de transporte VMGA III (Viability Medium Göteborg, preparado en anaerobiosis y esterilizado, que mantiene la viabilidad de los microorganismos sin permitir su multiplicación) 5. Se llevaron a cabo estudios microscópicos en fresco y coloraciones de Giemsa y Gram. Las levaduras se cultivaron en medio cromógeno diferencial (CHROMagar Candida® BD, París, Francia) y se incubaron a 37°C durante una semana. Las diferentes especies se identificaron de acuerdo con el color que desarrollaron en el medio cromógeno, observándose la presencia de una o más especies. Se observó la micromorfología en agar leche 1%-Tween 80 y se realizó una prueba de asimilación de hidratos de carbono por el sistema comercial API® ID 32D. Además, a las especies que desarrollaron color verde en el medio cromógeno se les realizó una prueba de asimilación de xilosa, y crecimiento a 45°C. A los aislamientos con la identificación presuntiva de Candida dubliniensis se les realizó extracción de ADN para, posteriormente, amplificar con iniciadores específicos de especie.
Se sembraron 20μl de las muestras provenientes del VMGA III en agar sangre lacada y otros 20 μl en medio triptona soya vancomicina-bacitracina para evaluar la presencia de A. actinomycetemcomitans. Las placas para anaerobios se incubaron en System Anaerocult®, Merck, durante 7 días a 36+1°C.
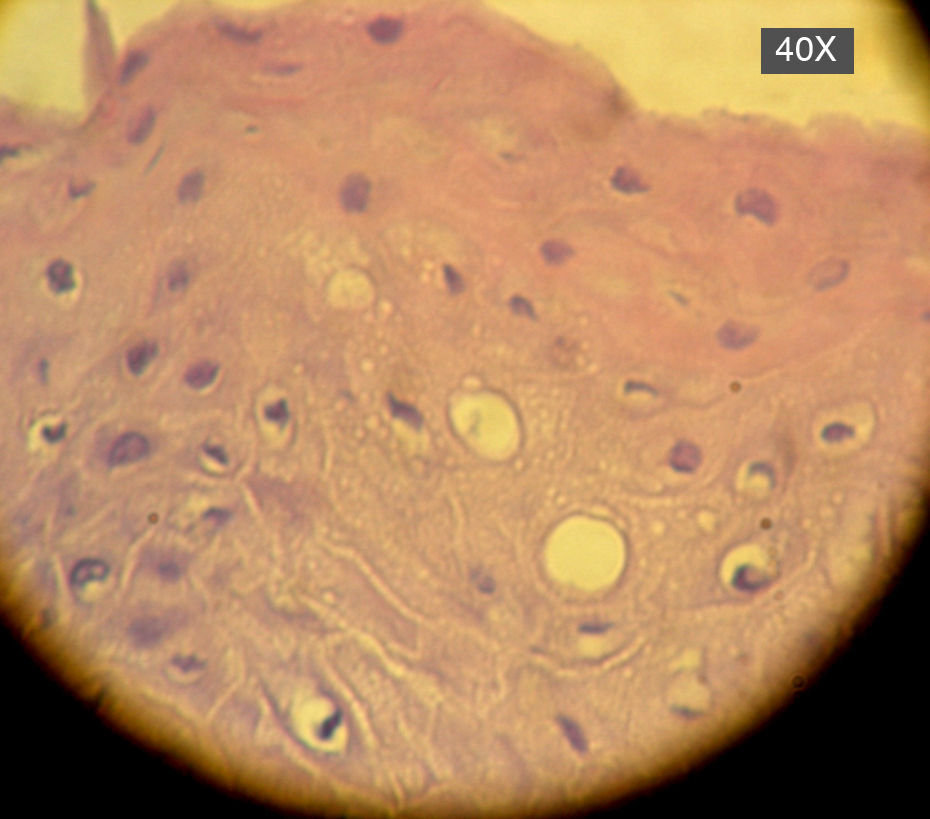
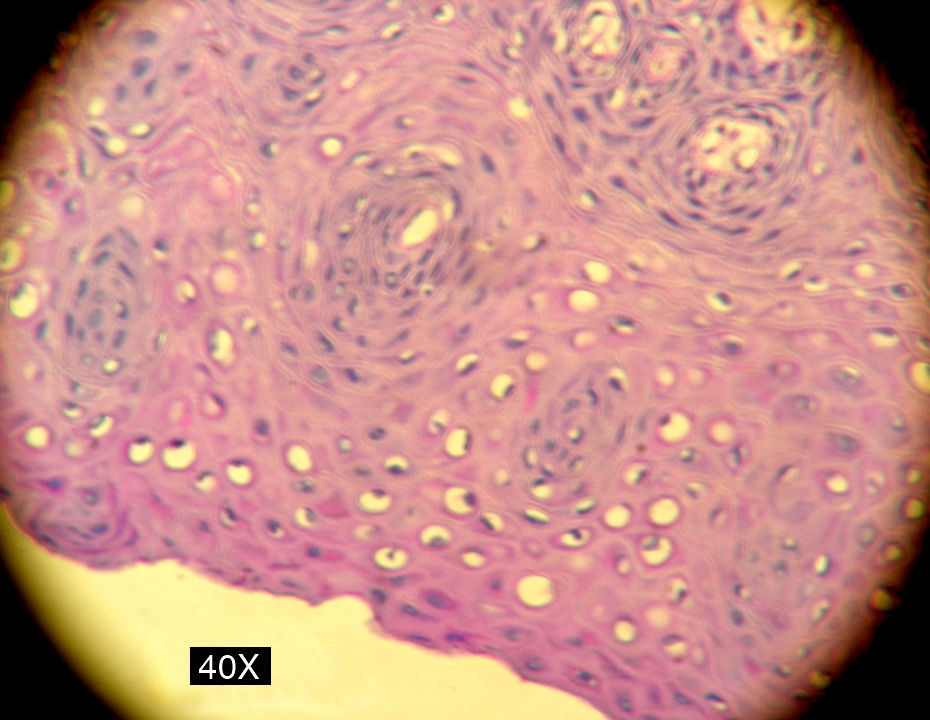
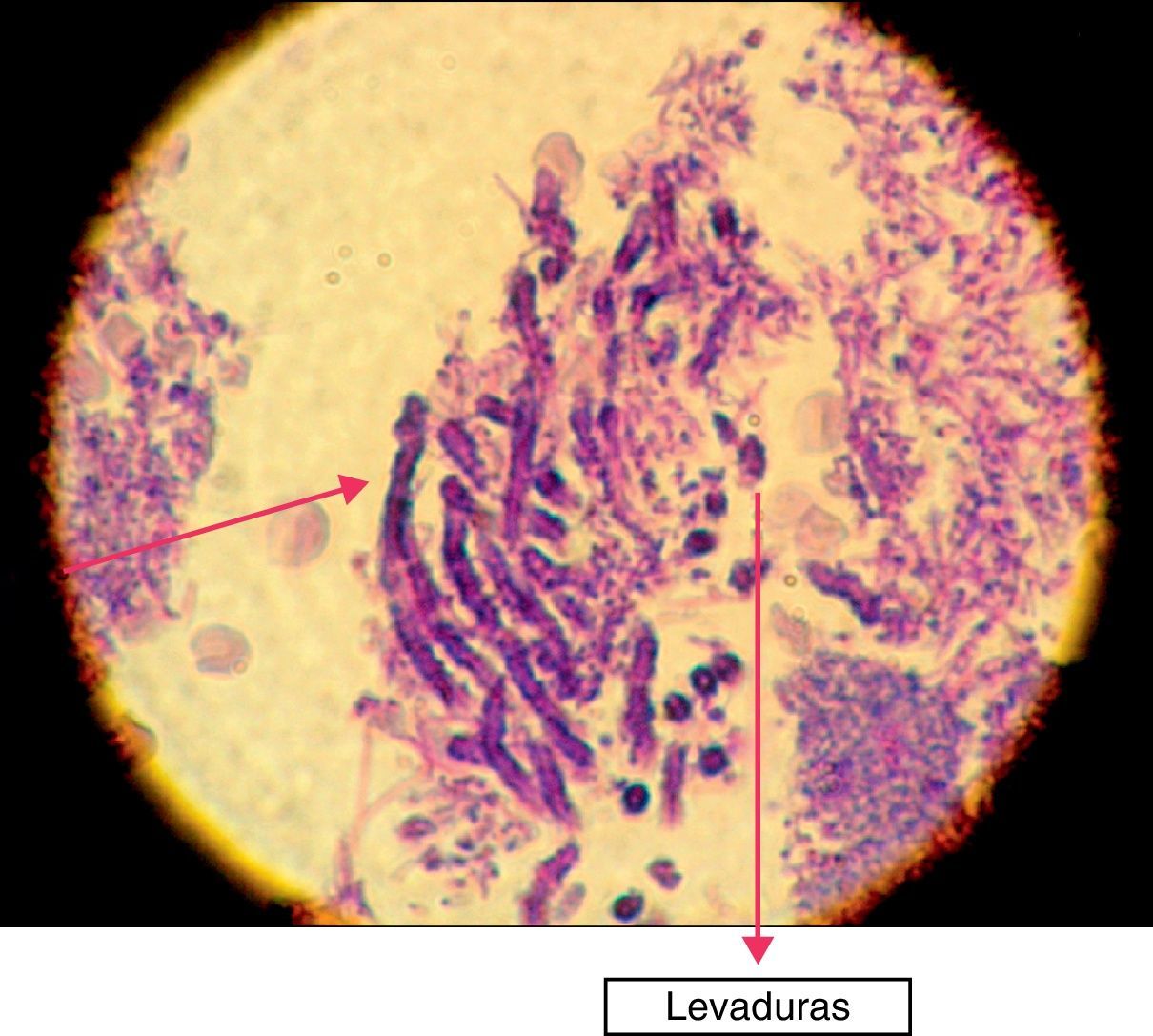
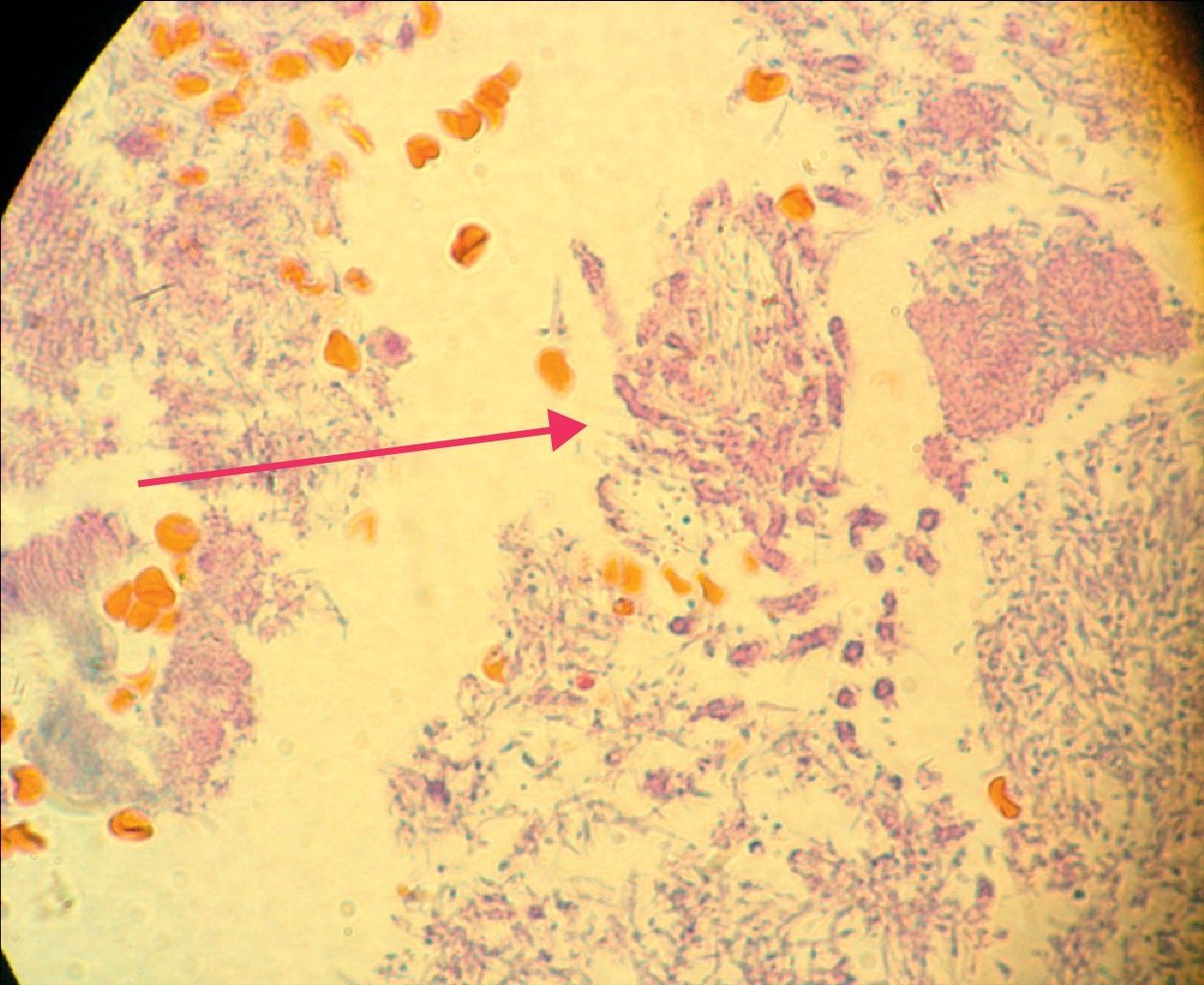
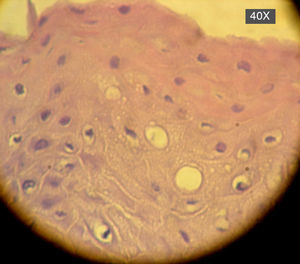
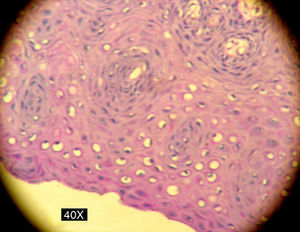
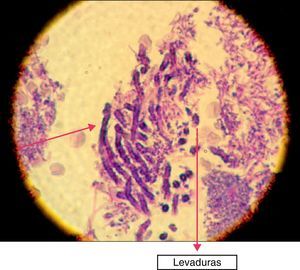
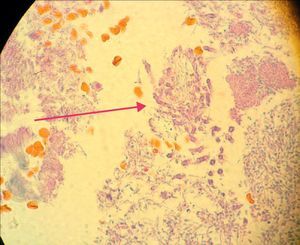
En la siguiente sesión se tomaron biopsias de las bolsas combinadas, incidiendo 2mm supragingivales. Dichas muestras fueron colocadas en formol al 10% y en solución tampón de fosfatos (pH7,4). Estas últimas se trituraron en mortero y luego fueron sembradas. Se efectuaron las mismas técnicas microbiológicas que las descritas para las muestras tomadas de las bolsas subgingivales. Con las muestras provenientes del formol, se realizaron técnicas con coloraciones de PAS, tricrómica de Masson y hematoxilina-eosina (figs. 1 y 2).
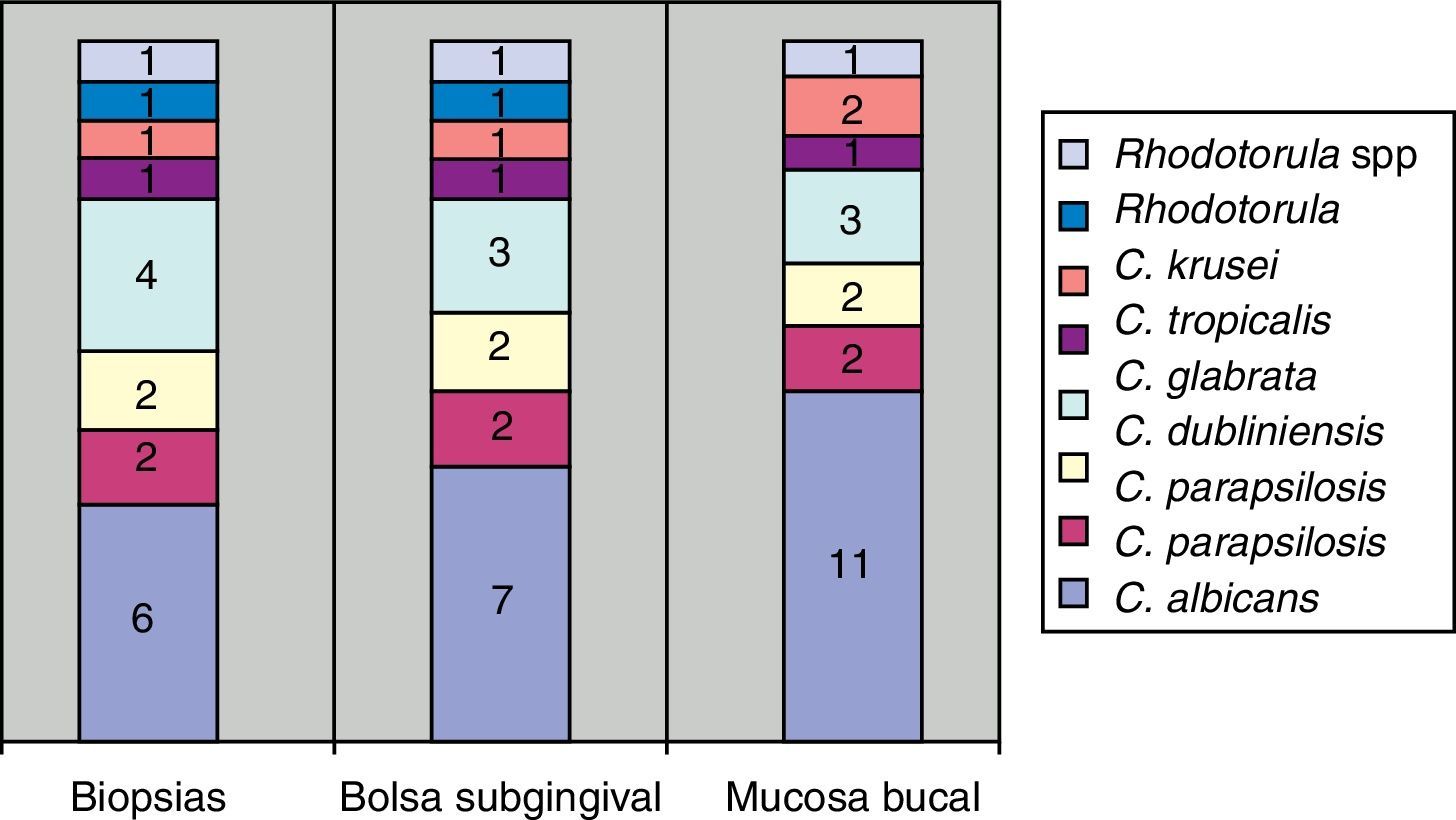
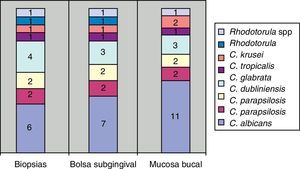
Todas las periodontitis graves fueron positivas para Prevotella intermedia, P. gingivalis y Candida. Destacaba la presencia de C. albicans, Candida krusei, y la aparición de otras dos especies en un mismo paciente: Candida guilliermondii y Candida parapsilosis. Estas especies fueron las menos frecuentes en los casos de invasión de tejidos en los cortes histológicos (fig. 3).
La mayor cantidad de cultivos positivos provenían de las muestras tomadas con hisopo, después las de bolsa y luego las de biopsia. Todos los pacientes con cultivo positivo en biopsia presentaron cultivo positivo en bolsa, excepto uno (paciente con periodontitis moderada).
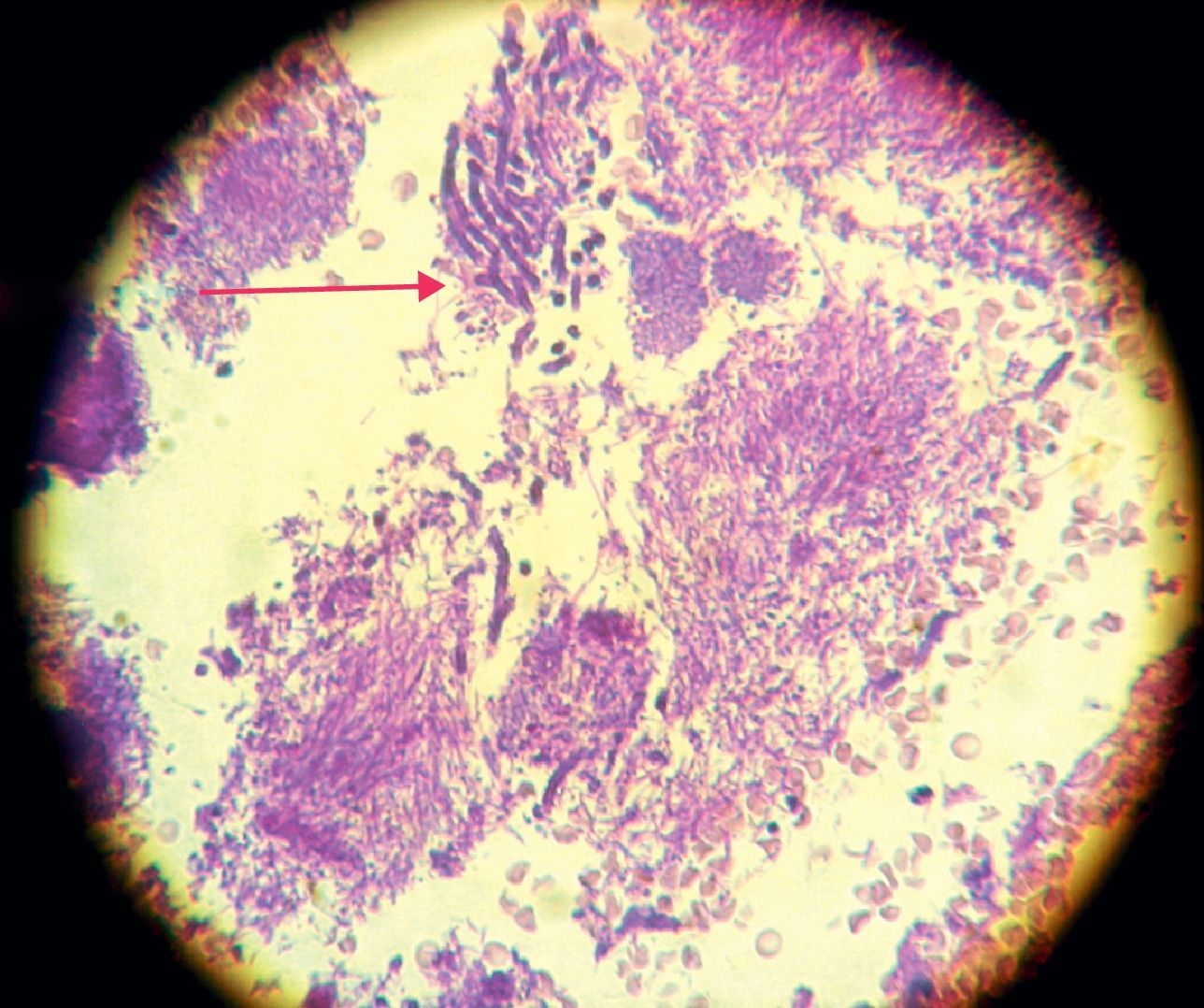
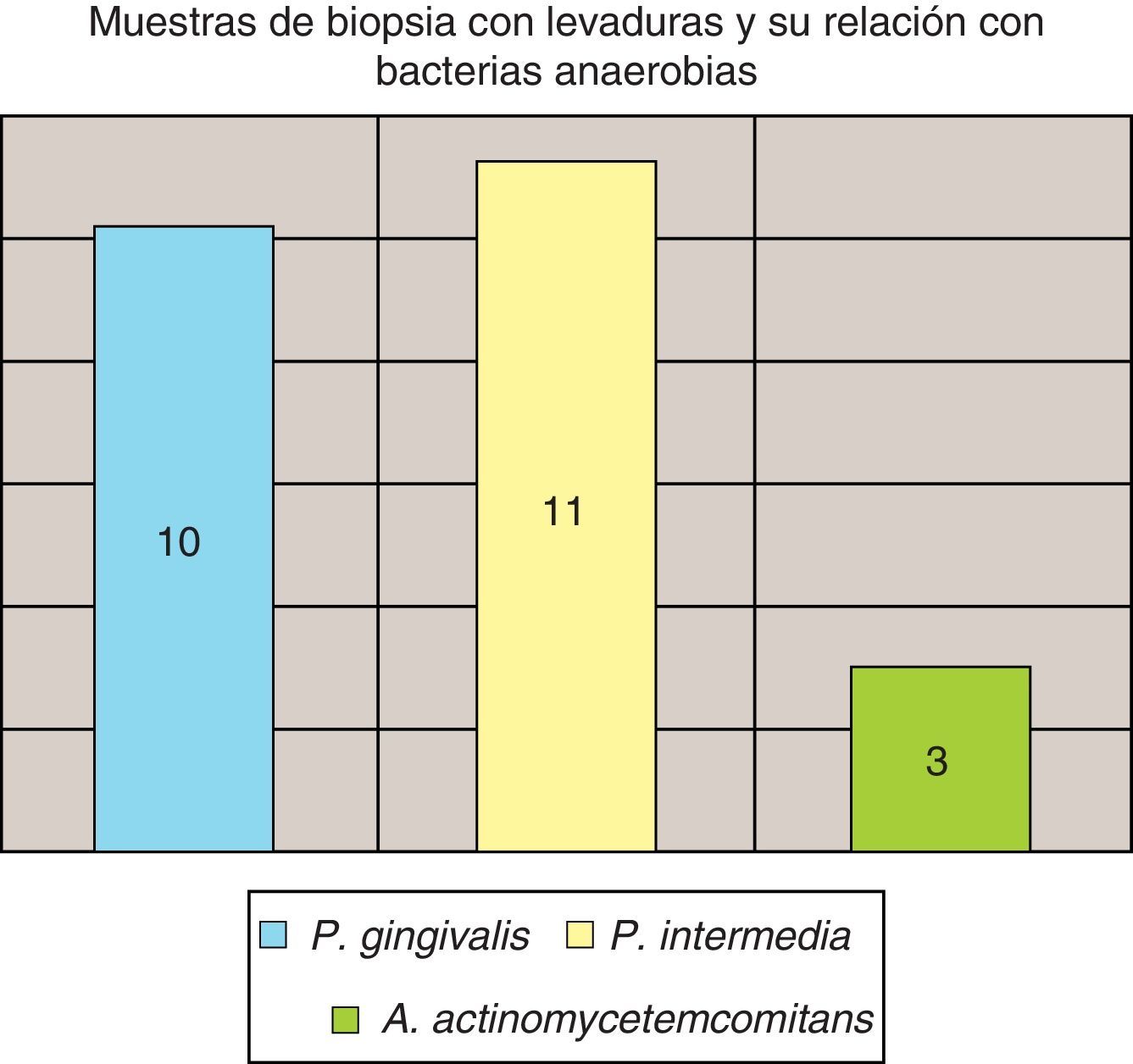
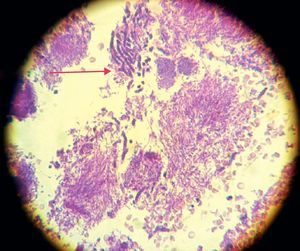
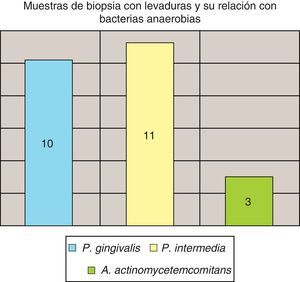
La invasión fúngica tisular se asoció con las formas más graves de la enfermedad periodontal. Las biopsias evidenciaron presencia de levaduras en 15 pacientes, y también de seudomicelios en 6 de ellos (pacientes con periodontitis grave o moderada) (figs. 4–6). Al mismo tiempo, se recuperó P. gingivalis en 10 de las biopsias estudiadas, P. intermedia en 11 de ellas y A. actinomycetemcomitans en 3 casos (fig. 7).
En general, los hallazgos clínicos, microbiológicos e histopatológicos de los pacientes con enfermedad periodontal infectados con Candida no difieren significativamente de los de aquellos enfermos y no infectados. La histología de las muestras fue típica, con un infiltrado inflamatorio inespecífico, similar al que se encuentra cuando existen formas miceliares, y la observación en ocasiones de microabscesos. Estos últimos se encontraron asociados a otros microorganismos de la placa.
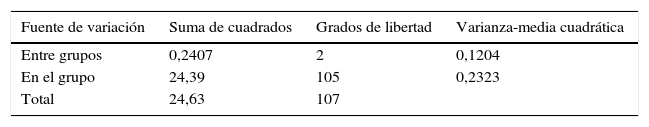
El análisis estadístico de los datos se realizó con el método ANOVA (p<0,05) (tabla 1). Este método permite determinar el efecto que la invasión fúngica del tejido conectivo tiene sobre la patología periodontal.
DiscusiónLa infección periodontal puede considerarse una agresión patógena seguida de una respuesta inmunoinflamatoria continua de alcance sistémico debido a la gran superficie de epitelio ulcerado. Este permite a los patógenos y sus productos difundirse al resto del organismo y causar daños a diferentes niveles.
Por otro lado, desde su hábitat normal, los hongos del género Candida pueden invadir diversos tejidos produciendo alguna patología. Dicha invasión dependerá de alguna alteración en los mecanismos de defensa o de la presencia de factores predisponentes3.
La bolsa y el fluido subgingival son ambientes favorables para el crecimiento de levaduras y su transformación en seudomicelios, hecho demostrado en este trabajo (prevalencia del 30% en este sitio), coincidiendo así con otros trabajos previamente presentados4,9,13, y con las observaciones de las tinciones de los cortes histopatológicos.
Los seudomicelios de Candida tienen la capacidad de penetrar en el tejido del huésped y adherirse a las superficies con mayor facilidad que las formas levaduriformes. Por ello los seudomicelios son importantes en la posterior evolución de la enfermedad.
Nuestros hallazgos sugieren que las especies de Candida podrían formar parte de la placa microbiana periodontal y tener un papel en la adherencia de la misma al tejido periodontal de acuerdo con la gravedad de la enfermedad periodontal9,11. Los tejidos gingivales están compuestos en un 60% por colágeno tipo iv y tipo i. Tanto P. gingivalis como las diferentes especies de Candida se adhieren al mismo, propiedad que podría ser útil para la invasión de los tejidos profundos.
Järvensivu et al.6 demostraron que C. albicans, al desarrollar el seudomicelio, se adhiere al tejido conectivo y forma parte de la placa microbiana durante el proceso de la enfermedad periodontal.
Jobbins et al.8 estudiaron los mecanismos de adhesión intermicrobiana entre C. albicans y diversas bacterias bucales, tales como cepas de Streptococcus sanguis, Streptococcus salivarius, Streptococcus mutans, Streptococcus mitis, Fusobacterium nucleatum y Actinomyces viscosus, sugiriendo que existían diferentes mecanismos de unión entre ellos. Uno de estos se encuentra a cargo de las lectinas (proteínas bacterianas), que favorecen la unión de F. nucleatum y A. viscosus con C. albicans.
En nuestro trabajo encontramos la asociación de Candida con especies anaerobias de importancia en el desarrollo de la enfermedad periodontal, tales como P. intermedia y P. gingivalis (hecho observado microbiológica e histopatológicamente).
El papel de las especies de levaduras en la enfermedad periodontal, incluyendo especies emergentes que se caracterizan por presentar una sensibilidad disminuida a los antifúngicos, como C. dubliniensis o C. guilliermondii, no está totalmente estudiado y es necesario demostrar el significado clínico de estos hallazgos7. Sin embargo, C. albicans es uno de los pocos microorganismos normalmente encontrados en la bolsa subgingival que tiene la capacidad de penetrar la superficie epitelial, invadir tejidos profundos y provocar inflamación.
Las hifas formadas deben considerarse como un factor de virulencia, asociadas con una mayor capacidad invasora, penetración en los tejidos y mayor resistencia a la fagocitosis.
ConclusionesA la luz de lo observado y estudiado, pensamos que las especies de Candida, una vez que forman parte del biofilm subgingival y se asocian a bacterias anaerobias, podrían participar activamente en la patogenia de la enfermedad periodontal, ya que está demostrado que C. albicans puede secretar proteinasas capaces de degradar tejidos del huésped como colágeno y fibronectina, similares a las producidas por ciertas bacterias como P. gingivalis.
En nuestro estudio tuvimos también pacientes con periodontitis infectados con levaduras que en los cortes histopatológicos no evidenciaron el desarrollo de seudomicelios.
Dejamos abierto el camino para investigar con técnicas inmunohistoquímicas las citoquinas que predominan en respuesta a los mecanismos de patogenicidad de las levaduras.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.