La prevalencia de la diabetes mellitus tipo 2 (DM2) se incrementa marcadamente con la edad. El tratamiento antidiabético y los objetivos de control glucémico en el anciano con DM2 deben individualizarse en función de sus características biopsicosociales. En los pacientes de edad avanzada, en los que los beneficios de un tratamiento antidiabético intensivo son limitados, los objetivos básicos deben ser mejorar la calidad de vida, preservar la funcionalidad y evitar los efectos adversos, muy especialmente las hipoglucemias.
El tratamiento de la DM2 en el anciano fue objeto de un consenso, publicado en 2012 y avalado por varias sociedades científicas españolas. Desde entonces, han aparecido nuevos grupos terapéuticos y evidencias que hacen recomendable su actualización. El presente documento se centrará en los aspectos terapéuticos de la DM2 en el paciente anciano, entendiendo como tal el tener una edad mayor de 75 años o presentar fragilidad.
The prevalence of type 2 diabetes mellitus (DM2) increases markedly with age. Antidiabetic treatment and the objectives of glycaemic control in elderly patients with DM2 should be individualised according to their biopsychosocial characteristics. In elderly patients for whom the benefits of intensive antidiabetic treatment are limited, the basic objectives should be to improve the quality of life, preserve functionality and avoid adverse effects, especially hypoglycaemia.
Treatment of DM2 in the elderly was the subject of a consensus document published in 2012 and endorsed by several Spanish scientific societies. Since then, new therapeutic groups and evidence have emerged that warrant an update to this consensus document. The present document focuses on the therapeutic aspects of DM2 in elderly patients, understood as being older than 75 years or frail.
El envejecimiento se caracteriza por una pérdida progresiva de la capacidad funcional de los individuos. La población anciana es heterogénea biológicamente y, en consecuencia, es imprescindible una valoración integral, que incluya los aspectos funcionales, en la toma de decisiones1. Aunque no existe consenso para definir a un individuo como anciano, en el presente documento se utilizará como definición operativa el tener una edad mayor de 75 años o presentar fragilidad2.
Las previsiones demográficas sitúan a España como uno de los países más envejecidos del mundo. En el año 2050 el 12% de la población española tendrá 80 años o más3.
La diabetes mellitus tipo 2 (DM2) es una enfermedad estrechamente ligada al envejecimiento y su prevalencia se incrementa marcadamente con la edad. Esto se debe a la combinación de una deficiencia en la secreción de insulina, resistencia a la insulina (relacionada con el aumento de adiposidad visceral, intermuscular e intramuscular), sarcopenia e inactividad física propias de los sujetos de edad avanzada. En España, el 63% de los pacientes con diabetes (de los que más del 90% presentan DM2) tienen más de 65 años4 y más de un tercio de la población mayor de 75 años padece diabetes5. Se ha estimado que, en las próximas 3 décadas, el número de pacientes con diabetes en sujetos mayores de 70 años se cuadriplicará a nivel mundial, a expensas del incremento de la DM26.
El tratamiento antidiabético y los objetivos de control glucémico del anciano con DM2 deben individualizarse en función de sus características biopsicosociales. En los pacientes de edad avanzada, donde los beneficios del tratamiento antidiabético intensivo son limitados, los objetivos básicos deben ser mejorar la calidad de vida, preservar la funcionalidad y evitar los efectos adversos, muy especialmente las hipoglucemias7.
El tratamiento de la DM2 en el anciano fue objeto de un consenso, publicado en 2012, y avalado por múltiples sociedades científicas españolas8. Desde entonces, han aparecido nuevos grupos terapéuticos y evidencias que hacen recomendable su actualización. El presente documento se centra en los aspectos terapéuticos de la DM2 en el paciente de edad avanzada.
Capacidad funcional, fragilidad y diabetesLa fragilidad es un síndrome clínico asociado al envejecimiento, caracterizado por la presencia de al menos 3 de los siguientes criterios: pérdida involuntaria de peso, agotamiento, debilidad muscular, lentitud de la marcha e hipoactividad física2 (tabla 1). La fragilidad es el principal factor predictivo de discapacidad, dependencia y mortalidad en los ancianos9, incluyendo a aquellos con diabetes10, y es un marcador pronóstico más potente que la carga de comorbilidad11. A su vez, la diabetes es un factor de riesgo para el desarrollo de fragilidad12, tanto por predisponer a la sarcopenia y a la disfunción cognitiva como por las propias complicaciones micro y macrovasculares (retinopatía, polineuropatía, diasautonomía, insuficiencia renal y enfermedad cardiovascular)1.
Criterios de fragilidad de Fried
| Marcador | Herramienta de valoración | |
|---|---|---|
| 1 | Pérdida de peso espontánea | Pérdida inexplicada > 4,5kg o > 5% del peso en el último año |
| 2 | Cansancio | Cansancio autorreferido, identificado por una puntuación > 2 de la escala Center Epidemiological Studies-Depression (0-8) |
| 3 | Debilidad muscular | Fuerza prensora manual (dinamómetro) < 20% de la normalidad, ajustado por IMC y sexo |
| 4 | Enlentecimiento motriz | Velocidad de la marcha para recorrer una distancia de 4,5 m < 20% de la normalidad, ajustado por sexo y talla (> 6-7 s) |
| 5 | Hipoactividad | Gasto calórico semanal por debajo del quintil inferior, ajustado por sexo (hombres < 383 Kcal/semana, mujeres < 270 Kcal/semana) |
Se considera la presencia de fenotipo de fragilidad cuando existen ≥ 3 criterios y de fenotipo prefrágil si existen 1 o 2 criterios.
IMC: índice de masa corporal.
Tomado de Fried et al.2.
La detección precoz de la fragilidad y la sarcopenia son aspectos clave en el manejo del paciente anciano en general13,14 y en el que presenta diabetes en particular1. Los objetivos de control glucémico deberían basarse en el estado funcional del paciente, ya que ni los ancianos frágiles ni aquellos con deterioro funcional establecido se benefician de un control glucémico estricto15, al tiempo que este aumenta el riesgo de hipoglucemias16. Un estudio reciente ha concluido que el grado de control glucémico en ancianos institucionalizados no se relaciona con el deterioro funcional persistente o la muerte, lo que resalta la necesidad de ser conservadores en el manejo de la diabetes en esta población17.
Además, en los pacientes ancianos con DM2, la implementación precoz de intervenciones multimodales y multidisciplinares, basadas en la educación nutricional y la promoción de la actividad física, ha demostrado ser eficaz para mantener la autonomía funcional18.
Hipoglucemias en el paciente ancianoEl riesgo de hipoglucemias graves se incrementa exponencialmente con la edad. Un estudio epidemiológico reciente, realizado en población española, describió que más de 2tercios de las hipoglucemias graves atendidas en servicios de urgencias se producían en personas de más de 60 años y el 46% en mayores de 76 años19.
En España, la edad media de los pacientes con diabetes hospitalizados por hipoglucemia grave supera los 70 años20. Aun así, el sobretratamiento de la hiperglucemia sigue siendo la norma, según demuestran los datos publicados de Estados Unidos21 y España22.
Los sujetos de edad avanzada están más expuestos a la polimedicación, a interacciones farmacológicas y a efectos adversos medicamentosos. Las hipoglucemias secundarias al uso de antidiabéticos (insulina, sulfonilureas) representan la segunda causa de ingreso en urgencias por efectos adversos farmacológicos23.
La mayor tasa de hipoglucemia grave se explica en parte porque las hipoglucemias asintomáticas, debido a la ausencia de síntomas de alarma adrenérgicos, son más frecuentes en los ancianos24, incluso en los que presentan mal control glucémico25. Los ancianos con trastorno cognitivo son un grupo de especial riesgo de hipoglucemia grave26. Las hipoglucemias en los ancianos se asocian a síndrome confusional, deterioro cognitivo, caídas y fracturas, ictus, arritmias cardiacas y mayor mortalidad27-29. Por todo ello, evitar hipoglucemias debe ser un objetivo terapéutico prioritario.
Como norma general, en el paciente anciano es recomendable iniciar el tratamiento con antidiabéticos con bajo riesgo de hipoglucemia (especialmente, metformina e inhibidores de la dipeptidil peptidasa tipo 4 [IDPP-4]) a dosis bajas, con aumento progresivo, monitorizando la respuesta tras cada incremento)30. En la medida de lo posible, se deben evitar los fármacos asociados a alto riesgo de hipoglucemia (sulfonilureas e insulinas, especialmente prandiales y mezclas)8.
Principios generales del tratamiento del paciente anciano con diabetes tipo 2Los principios generales que deben regir el tratamiento del anciano con DM2 son los siguientes:
- 1.
El plan terapéutico y los objetivos de control glucémico deben basarse en una valoración integral del paciente que tenga en cuenta sus comorbilidades, su capacidad funcional y cognitiva, los trastornos afectivos (con especial énfasis en los cuadros depresivos) y el soporte social, que en conjunto permitirán estimar la expectativa de vida total y activa del paciente.
- 2.
Es preciso establecer un proceso de toma de decisiones compartidas con el paciente o su cuidador que contemple los deseos, expectativas, preferencias y capacidades de ambos.
- 3.
Los objetivos del tratamiento antidiabético deben ser la preservación de la capacidad funcional y la mejora de la calidad de vida.
- 4.
Se debe prestar especial atención a las contraindicaciones, los efectos secundarios y las potenciales interacciones medicamentosas de los fármacos antidiabéticos.
Los objetivos de control glucémico en el paciente anciano deberían adaptarse a su situación funcional, estado cognitivo, comorbilidades y expectativa de vida8.
Según la valoración individualizada, se consideran 3posibilidades: 1) ancianos sanos, con buen estado funcional y cognitivo, baja carga de comorbilidad y buena expectativa de vida: las intervenciones terapéuticas y los objetivos pueden ser próximos a los de los adultos jóvenes con diabetes (HbA1c 7-7,5%)31; 2) ancianos frágiles, con discapacidad funcional, demencia o expectativa de vida limitada; debería evitarse la hipoglucemia e hiperglucemia sintomáticas, siendo un objetivo razonable mantener una HbA1c de 7,5-8,5%8,32, y 3) ancianos en situación de cuidados paliativos: la prioridad debe ser preservar la calidad de vida, evitando la hiperglucemia sintomática y la hipoglucemia, y reduciendo las cargas asociadas al tratamiento antidiabético. En este contexto, la determinación de HbA1c no es relevante. Las glucemias deberían mantenerse por debajo del umbral glucosúrico (< 200mg/dl). El tratamiento debería simplificarse, evitando los fármacos que inducen hipoglucemias y los que se asocian a síntomas digestivos e hiporexia. La insulina prandial podría suspenderse o sustituirse por fármacos orales. Es recomendable disminuir, o incluso suprimir, el número de controles de glucemia capilar33.
Tratamiento no farmacológico: nutrición y actividad físicaExisten pocas evidencias sobre los beneficios de la modificación del estilo de vida (educación terapéutica, consejo nutricional, actividad física individualizada) en pacientes ancianos o frágiles con DM231. Actualmente, está en marcha un estudio para analizar el impacto de la modificación del estilo de vida en la capacidad funcional y la calidad de vida del anciano frágil y «prefrágil» con DM234.
En el estudio Look AHEAD, que incluyó a pacientes < 75 años (edad media 59 años) con DM2 y obesidad, una intervención multifactorial intensiva orientada a la pérdida de peso, aunque no consiguió reducir los eventos cardiovasculares35, mejoró la consecución de los objetivos de control metabólico, los factores de riesgo vascular, el estado funcional y la calidad de vida36. Este beneficio fue mayor en el subgrupo de mayor edad (65-75 años)37. Los programas de educación nutricional han demostrado mejorar el control metabólico en ancianos38.
Las dietas excesivamente hipocalóricas deben evitarse en pacientes ancianos porque incrementan el riesgo de hipoglucemias y de malnutrición, aportando habitualmente pocas proteínas. Esto es importante ya que en edades avanzadas es frecuente la obesidad sarcopénica; una situación caracterizada por un índice de masa corporal (IMC) elevado y baja masa muscular, por lo que las dietas muy restrictivas pueden empeorar la sarcopenia, que se asocia a deterioro funcional, riesgo de caídas e institucionalización39,40 Los ancianos pueden requerir además suplementos de calcio y vitaminas D y B12.
A menudo se considera que los ancianos no se benefician de programas de ejercicio físico de intensidad variable, que no pueden realizarlos o que no tienen una buena adherencia. Sin embargo, la actividad física, en especial la multicomponente (aeróbica, resistencia, flexibilidad y balance), ha demostrado su eficacia en ancianos con diabetes, no solo para mejorar el control glucémico, sino su independencia funcional, autoestima y calidad de vida, por lo que su práctica debe ser recomendada41.
La prescripción de actividad física debe adaptarse a las limitaciones y preferencias del paciente. Antes de implementar un programa de actividad física hay que descartar la presencia de potenciales contraindicaciones, síndromes geriátricos y las limitaciones derivadas del tratamiento farmacológico. Al iniciar un programa, es importante la prevención de la hipotensión ortostática, la deshidratación y las hipoglucemias (especialmente en pacientes tratados con insulina o secretagogos)41.
Las actividades aeróbicas deberían indicarse con preferencia, aunque a menudo están limitadas por la comorbilidad asociada (p. ej., enfermedades cardiovasculares y musculoesqueléticas). Los ejercicios aeróbicos previenen las caídas, la sarcopenia y el deterioro funcional en los pacientes con diabetes42 y mejoran el perfil de riesgo cardiovascular43. Incluso un programa sencillo de paseo regular en ancianos con DM2 disminuye la glucemia en ayunas, la HbA1c y los triglicéridos44.
El entrenamiento de resistencia para aumentar la masa muscular se considera un componente esencial para la prevención y el tratamiento de la DM2 en ancianos, y de elección en ancianos frágiles. Los ejercicios de intensidad moderada o alta son, en contra de lo que se pensaba, más efectivos para el control glucémico y generalmente son seguros en la población anciana. Suelen considerarse suficientes los ejercicios del 60-70% de la carga máxima (en el entrenamiento con pesas se llama 1 repetición máxima a la cantidad máxima de peso que se puede llegar a cargar en determinado ejercicio para realizar una repetición). El entrenamiento de resistencia ha demostrado beneficios metabólicos en pacientes de edad avanzada con DM2 (mejora de la sensibilidad a la insulina, reducción de la glucemia en ayunas y de la adiposidad visceral)45 y se asocia a una mejoría de la fuerza muscular y la movilidad y una reducción de caídas46. Sin embargo, para mantener los beneficios del entrenamiento de resistencia suele ser necesaria una supervisión continuada47. Finalmente, el entrenamiento del equilibrio reduce las caídas en ancianos con DM248.
Tratamiento farmacológicoMetforminaAunque no existen ensayos clínicos específicos que evalúen la eficacia y la seguridad de la metformina en los ancianos, la experiencia clínica avala su uso como base del tratamiento de la DM2 en cualquier grupo de edad49-51, especialmente en sujetos con un IMC elevado52, aunque también es eficaz en aquellos con normopeso. La metformina actúa a través de múltiples mecanismos, si bien el principal parece la activación de la adenosina monofosfato-cinasa, que conduce a una disminución de la liberación de glucosa por el hígado.
La metformina no suele producir hipoglucemias y ha demostrado ser útil en pacientes con enfermedad cardiovascular o insuficiencia cardiaca estable53. No obstante, en ancianos puede asociarse con algunos inconvenientes como intolerancia digestiva, disgeusia, hiporexia y déficit de vitamina B1254; esta última debe monitorizarse periódicamente55. La metformina está contraindicada en pacientes con filtrado glomerular < 30ml/min56,57. Aunque la acidosis láctica es poco frecuente, debe recordarse que casi la mitad de los pacientes > 65 años presenta un deterioro de la función renal no diagnosticado58. Por ello, es importante monitorizar periódicamente la función renal y reducir la dosis si el filtrado glomerular es < 45ml/min o suspenderla si es < 30ml/min59,60.
Se debe evitar el uso de metformina en situaciones de hipoxia tisular, insuficiencia respiratoria, insuficiencia cardiaca aguda, insuficiencia hepática, o si existe enfermedad aguda intercurrente, administración de contrastes yodados o riesgo de insuficiencia renal funcional (vómitos, diarrea). Por otro lado, su utilidad es muy limitada en pacientes con anorexia y bajo peso.
Se aconseja comenzar el tratamiento con una titulación progresiva desde 425mg/día (medio comprimido de 850mg) hasta 1.700mg/día; dosis superiores no son recomendables ya que aumentan los efectos secundarios sin mejoría en la eficacia.
En el 5% de los pacientes es preciso suspender el fármaco por mala tolerancia gastrointestinal, porcentaje que puede ser superior en pacientes ancianos61.
SulfonilureasSon fármacos de bajo precio que han sido muy utilizados. Disminuyen las complicaciones microvasculares de la DM262 y aumentan la liberación de insulina por bloqueo de los canales de K dependientes de adenosina trifosfato en las células betapancreáticas. Deben usarse con precaución dado que el riesgo de hipoglucemia grave se incrementa exponencialmente con la edad, especialmente con glibenclamida63, que está contraindicada en ancianos64, siendo preferible la glimepirida65 o, especialmente, la gliclazida66, que es la que menos hipoglucemias produce67,68. También inducen ganancia de peso y se desaconsejan en pacientes con insuficiencia renal o alto riesgo cardiovascular. Las hipoglucemias se favorecen en presencia de insuficiencia renal o hepática, con la administración simultánea de otros antidiabéticos orales o insulina, el alta hospitalaria reciente, la edad avanzada, la ingesta reducida y el uso de ≥ 5 fármacos69. Presentan múltiples interacciones medicamentosas (salicilatos, dicumarínicos, sulfonamidas, fibratos, alopurinol, metotrexato, diuréticos, betabloqueantes, corticoides), lo que complica su uso en pacientes polimedicados.
Meglitinidas (repaglinida, nateglinida)Son fármacos secretagogos, igual que las sulfonilureas, pero de acción más rápida y corta, y de mayor coste. Actúan preferentemente sobre la hiperglucemia posprandial. Su perfil farmacocinético más recortado reduce el riesgo de hipoglucemias en comparación con las sulfonilureas70, especialmente en ancianos con patrones erráticos de comidas71. La repaglinida, por su eliminación fundamentalmente biliar, puede emplearse en pacientes con insuficiencia renal moderada o avanzada72. Está contraindicada su asociación con gemfibrozilo73 y otros medicamentos que actúen activando o inhibiendo el citocromo P450. Deben administrarse unos 15 min antes de las comidas.
Inhibidores de la alfa-glucosidasa (acarbosa, miglitol)Inhiben la alfa-glucosidasa intestinal, enlenteciendo la digestión y absorción intestinal de hidratos de carbono. Son fármacos especialmente orientados al control de la glucemia posprandial, sobre todo en sujetos que siguen dietas ricas en hidratos de carbono. No tienen efectos sistémicos y pueden disminuir el riesgo de eventos cardiovasculares e hipertensión arterial74. Aunque no inducen hipoglucemia y podrían ser potencialmente útiles en algunos pacientes ancianos con diabetes75,76, su uso se ve limitado por su escasa eficacia y la elevada frecuencia de efectos secundarios gastrointestinales (flatulencia, diarrea), tanto en monoterapia como, especialmente, en combinación con metformina. Pueden alterar los niveles de digoxina y de acenocumarol.
Tiazolidinedionas (pioglitazona)Actúan aumentando la sensibilidad periférica a la insulina. Las tiazolidinedionas proporcionan un control glucémico más duradero que la metformina y las sulfonilureas77. La pioglitazona no produce hipoglucemias y actúa favorablemente sobre el perfil lipídico (aumento de colesterol HDL y disminución de triglicéridos). La pioglitazona puede ser beneficiosa en prevención secundaria de eventos cardiovasculares (estudio proACTIVE)78, con disminución de mortalidad por todas las causas79. También ha demostrado mejorar histológicamente la esteatohepatitis no alcohólica en pacientes con prediabetes o DM280. Sin embargo, la pioglitazona presenta diversos efectos secundarios que limitan su empleo en ancianos81,82: ganancia de peso, retención hidrosalina, anemia dilucional, incremento del riesgo de insuficiencia cardiaca83, mayor riesgo de fracturas (sobre todo en mujeres posmenopáusicas)84 y posibilidad de acelerar el deterioro cognitivo85. El incremento del riesgo de cáncer vesical con el uso crónico de pioglitazona es debatido86,87.
Inhibidores de la dipeptidil peptidasa-4 (sitagliptina, vildagliptina, saxagliptina, linagliptina, alogliptina)Actúan inhibiendo la enzima proteolítica dipeptidil peptidasa-4 (DPP-4) que degrada las hormonas incretinas, aumentando la disponibilidad y acción del glucagon-like peptide-1 (GLP-1) endógeno. Los iDPP-4 se han mostrado útiles tanto en monoterapia, como en combinación con otro hipoglucemiante o en triple terapia.
Son fármacos orales bien tolerados, eficaces y seguros a corto88,89 y largo plazo90,91, tanto en diabéticos de edad avanzada como jóvenes92. No tienen efecto sobre el vaciamiento gástrico ni inducen disminución de la ingesta a nivel central; tampoco producen intolerancia digestiva ni pérdida de peso.
Los iDPP-4 no inducen hipoglucemias (mecanismo dependiente de la glucosa), no modifican el peso corporal ni presentan interacciones medicamentosas significativas, lo que les convierte en una opción terapéutica atractiva para el tratamiento de la DM2 en el anciano. No requieren ajuste de dosis en pacientes de edad avanzada. Varios estudios han mostrado la eficacia y seguridad de vildagliptina93-95, sitagliptina96,97, saxagliptina98-101, linagliptina102-104, alogliptina105 en ancianos.
Los iDPP-4 han demostrado su seguridad cardiovascular en ensayos clínicos realizados en pacientes de alto riesgo cardiovascular106-108, incluso en sujetos > 75 años109. En el estudio SAVOR-TIMI 53106, el uso de saxagliptina se asoció a un incremento significativo de hospitalizaciones por insuficiencia cardiaca, especialmente en enfermos con niveles basales elevados de péptido natriurético tipo B, o con historia previa de insuficiencia cardiaca o insuficiencia renal crónica110,111. También en el estudio EXAMINE107 se observó una mayor tendencia (aunque no significativa) a desarrollar insuficiencia cardiaca en los pacientes tratados con alogliptina.
Sin embargo, en estudios observacionales amplios, en práctica clínica habitual112, o en el estudio TECOS con sitagliptina113 no se ha confirmado una asociación de estos fármacos con una mayor incidencia de insuficiencia cardiaca. Asimismo, sendos metaanálisis en pacientes con DM2 tratados con vildagliptina114 o linagliptina115 avalan su seguridad cardiovascular y la ausencia de riesgo de insuficiencia cardiaca.
Vildaglipina es el único iDPP4 que dispone de un ensayo clínico en pacientes con DM2 e insuficiencia cardiaca crónica (clase funcional NYHA I-III) con fracción de eyección del ventrículo izquierdo < 40%116. El tratamiento con vildagliptina, comparado con placebo, no se asoció a cambios significativos en esta última, cumpliendo con el objetivo de no inferioridad116.
Los iDPP-4 pueden usarse con seguridad, sin riesgo de hipoglucemia, en cualquier estadio de insuficiencia renal crónica. Todos requieren ajuste de dosis en casos de insuficiencia renal moderada o grave, salvo linagliptina, que se elimina por vía biliar.
Los iDPP-4 tienen pocas interacciones medicamentosas; una ventaja importante en pacientes ancianos, en los que es frecuente la polimedicación117. Vildagliptina no se metaboliza por el citocromo P450 y, por ello, tiene menor riesgo de interacciones.
Agonistas del receptor del glucagon-like peptide-1 (exenatida, liraglutida, lixisenatida, exenatida LAR, dulaglutida)Los agonistas del receptor GLP-1 (arGLP-1) actúan activando los receptores del GLP-1, lo que da lugar a un aumento de la secreción de insulina y una disminución de la secreción de glucagón, en función del nivel de glucemia. Asimismo, enlentecen el vaciamiento gástrico y aumentan la sensación de saciedad a nivel central.
Estos fármacos inducen una pérdida ponderal significativa, por lo que podrían ser una opción cuando la pérdida de peso es un objetivo prioritario (p. ej., ancianos con gonartrosis avanzada, síndrome de apnea de sueño, hipoventilación, estetatohepatitis o síndrome metabólico). Sin embargo, la pérdida de peso y la disminución del apetito pueden tener efectos no deseables en ancianos frágiles, en los que la hiporexia y la desnutrición son comunes. En el anciano es frecuente la existencia de obesidad sarcopénica (exceso de adiposidad con escasa masa magra por la pérdida de masa muscular). La sarcopenia es un marcador de mal pronóstico funcional y vital, por lo que la pérdida de peso (un objetivo deseable en la mayoría de pacientes con DM2) a costa de la masa magra puede ser contraproducente.
Los arGLP-1 no inducen hipoglucemias, pero se asocian a frecuentes molestias gastrointestinales (náuseas, vómitos y diarrea). Además del elevado coste, requieren administración subcutánea (diaria en 2 dosis en el caso de exenatida; diaria en una dosis para liraglutida y lixisenatida; y semanal con exenatida LAR y dulaglutida), por lo que antes de prescribirlos debemos asegurarnos de que el paciente o su cuidador tienen un nivel adecuado de destreza. Aunque existe controversia sobre la posibilidad de aparición de pancreatitis con el uso de arGLP-1, diversos estudios no han confirmado dicha asociación, considerando que la mayor incidencia de pancreatitis se debe al hecho de presentar diabetes118.
Los arGLP-1 han demostrado un buen perfil de seguridad cardiovascular en pacientes con DM2 de alto riesgo vascular. En comparación con placebo, lixisenatida119 y exenatida LAR120 han mostrado no inferioridad, mientras que liraglutida121 y semaglutida (un arGLP-1 de administración semanal, no comercializado)122 demostraron reducción de eventos cardiovasculares.
No existen estudios específicos con arGLP-1 en personas de edad avanzada. En todos los análisis por subgrupos en pacientes ≥ 65 años consiguen una mayor disminución de la HbA1c, menos hipoglucemias y mayor pérdida de peso, aunque con más efectos gastrointestinales que el comparador (glimepirida123, sitagliptina124,125, insulina glargina126-128 o placebo129). No se han observado diferencias significativas en cuanto a eficacia y seguridad respecto a pacientes más jóvenes130. En un metaanálisis con lixisenatida129 y en un análisis agrupado con liraglutida130, los resultados en pacientes > 65 años fueron similares a los observados en otros grupos de edad. No obstante, en ninguno de estos estudios se incluyeron ancianos vulnerables o frágiles.
En conclusión, los arGLP-1 pueden utilizarse con precaución en ancianos, personalizando su indicación (p. ej., ancianos obesos con buen estado funcional)131. No debe administrase en ancianos frágiles30, con antecedentes de pancreatitis o con filtrado glomerular < 30ml/min132.
Inhibidores del cotransportador sodio-glucosa tipo 2 (dapagliflozina, canagliflozina, empagliflozina)Estos fármacos inhiben el cotransportador sodio-glucosa tipo 2 (SGLT2) en el túbulo renal, impidiendo la reabsorción de glucosa e induciendo glucosuria. Dado que su mecanismo de acción es independiente de la insulina133, son efectivos en todos los estadios de la DM2 y no producen hipoglucemia. Los inhibidores del SGLT2, debido a su efecto glucosúrico, inducen una pérdida ponderal media de 1,8-2 kg, a expensas especialmente de masa grasa, y tienen un efecto hipotensor provocando una disminución media de la presión arterial sistólica de –4,45mmHg134,135. La glucosuria provoca diuresis osmótica y poliuria.
Son fármacos efectivos, que han demostrado superioridad en el control glucémico frente a sulfonilureas136,137 y sitagliptina138. La reducción de la HbA1c esperada oscila entre 0,7 y 1%, mantenida hasta 3 años de seguimiento.
Los inhibidores del SGLT-2 se administran en una dosis única diaria por vía oral, siendo eficaces en monoterapia139 (si hay intolerancia o contraindicación a la metformina), como segundo hipoglucemiante y en triple terapia. Al asociarlos con sulfonilureas o insulina pueden aparecer hipoglucemias, por lo que hay que disminuir la dosis o valorar la discontinuación de las sulfonilureas140.
En el estudio EMPA-REG, realizado en pacientes con DM2, enfermedad cardiovascular y filtrado glomerular > 30ml/min/1,72 m2, empaglifozina disminuyó la mortalidad global en un 32%, las hospitalizaciones por insuficiencia cardiaca en un 35% y la mortalidad por causa cardiovascular en un 38%141. En este mismo estudio, empagliflozina demostró un efecto nefroprotector, retrasando la progresión de la insuficiencia renal y la necesidad de diálisis142. Basándose en estos resultados, las últimas guías de la European Society of Cardiology indican considerar el uso del inhibidor del SGLT-2 empagliflozina en pacientes con insuficiencia cardiaca y DM2143.
Más recientemente, se han publicado los resultados del estudio de seguridad cardiovascular equivalente con canagliflozina144. Se trata de un análisis agrupado de los estudios CANVAS y CANVAS-R, que incluyeron a 10.142 pacientes con DM2 y elevado riesgo cardiovascular. Los pacientes tratados con canagliflozina redujeron en un 14% (hazard ratio [HR] 0,8; intervalo de confianza del 95% [IC del 95%] 0,75-0,97) el riesgo de eventos incluidos globalmente en el resultado primario (un compuesto de muerte por causas cardiovasculares, infarto de miocardio no fatal o accidente cerebrovascular no fatal). No se alcanzó, sin embargo, significación estadística en la reducción de cada uno de estos eventos por separado. La hospitalización por insuficiencia cardiaca se redujo en un 33% (HR 0,67; IC del 95% 0,52-0,87). Los resultados mostraron beneficios renales con canagliflozina, disminuyendo tanto la progresión de la albuminuria (HR 0,73; IC del 95% 0,67-0,79) como el resultado compuesto de una reducción sostenida del 40% en la tasa de filtración glomerular estimada o la muerte por causas renales (HR 0,60; IC del 95% 0,47-0,77). En la actualidad se está realizando un análisis más pormenorizado de estos resultados, que todavía no se han incorporado a las recomendaciones internacionales.
El efecto adverso más común de estos fármacos es la micosis genital, sobre todo en mujeres. También se ha descrito un ligero incremento de las infecciones del tracto urinario144. En personas de edad avanzada hay que tener en cuenta los potenciales efectos adversos relacionados con la depleción de volumen secundario a la diuresis osmótica (deshidratación, trastornos hidroelectrolíticos, hipotensión e insuficiencia renal)145. Dado su efecto hipotensor, es importante descartar la existencia de hipotensión ortostática, frecuente en ancianos con diabetes146. Aunque en un estudio con canaglifozina se observó un mayor número de fracturas (de extremidades, no de cadera)147, en posible relación con un riesgo aumentado de caídas, esta asociación no se confirmó en un estudio posterior148. En el estudio CANVAS se ha confirmado una mayor tendencia a las fracturas en pacientes tratados con canagliflozina frente a placebo (HR 1,23; IC del 95% 0,99-1,52). En este mismo estudio el tratamiento con canagliflozina se asoció a un riesgo mayor de amputación, principalmente sobre los dedos del pie o del metatarso (6,3 frente a 3,4 participantes con amputación por 1.000 pacientes-año, lo que corresponde a una proporción de riesgo de 1,97; IC del 95% 1,41 2,75)144. Finalmente, se han comunicado casos raros de cetoacidosis normoglucémica (con cifras de glucemia poco elevadas), especialmente en DM2 de larga evolución en situación de insulinopenia o con diabetes autoinmune latente del adulto, en los que se realizó una reducción de la dosis de insulina; también se ha descrito en situaciones de ayuno, con consumo excesivo de alcohol, esfuerzos físicos extremos o procesos agudos intercurrentes149.
La acción de estos fármacos depende de la función renal, de forma que su eficacia disminuye cuando el filtrado glomerular es < 60ml/min/1,72 m2. Por debajo de este filtrado no debe administrarse dapagliflozina, mientras que empagliflozina y canagliflozina pueden utilizarse, reduciendo dosis150,151, con filtrados entre 45 y 60ml/min/1,72 m2, y suspenderse con filtrados < 30ml/min/1,72 m2.
Existe poca experiencia de uso de los inhibidores del SGLT2 en población anciana, por lo que deben indicarse con precaución y de manera individualizada en pacientes seleccionados152. Canaglifozina dispone de algunos estudios en pacientes mayores, de hasta 80 años, que demuestran una eficacia y seguridad comparables a la de sujetos más jóvenes145,147,148,153-155. Asimismo, los análisis por subgrupos de edad con empaglifozina139 y dapaglifozina156-158 han mostrado resultados similares a los obtenidos en pacientes más jóvenes.
InsulinaEs el agente hipoglucemiante más potente. Actúa activando los receptores de insulina, disminuyendo la producción de glucosa por el hígado y favoreciendo la utilización periférica de glucosa. En España, el 20% de los pacientes con diabetes > 75 años reciben insulina en monoterapia o combinada con otros antidiabéticos159.
Los ancianos > 80 años tratados con insulina presentan un mayor riesgo de hipoglucemias graves27, de caídas y fracturas160. Para minimizar estos riesgos, la terapia insulínica en el anciano debe individualizarse resaltando la seguridad del paciente. Conviene recordar que los niveles de HbA1c no son un predictor fiable del riesgo de hipoglucemia161.
Insulinización basalLa dosis diaria de inicio debe ser más baja (0,1-0,2 UI/kg) que en sujetos más jóvenes con DM2, especialmente en los ancianos frágiles, de bajo peso o con insuficiencia renal. Los ajustes de dosis deberán realizarse de forma gradual y progresiva.
Cuando se inicia tratamiento con una insulina basal, es recomendable mantener el tratamiento con metformina para reducir los requerimientos de insulina162. La combinación de insulina basal con secretagogos orales (sulfonilureas, glinidas) no es segura en ancianos por el elevado riesgo de hipoglucemias. El mantenimiento o suspensión de otros antidiabéticos no insulínicos deberá valorarse de manera individual, considerando la complejidad del tratamiento y sus costes162.
Los análogos de insulina basal (glargina 100 U y 300 U, detemir, degludec), aunque no han demostrado superioridad en el control glucémico, tienen menos riesgo de hipoglucemias (especialmente nocturnas) que la insulina humana NPH163-165, por lo que pueden ser preferibles en ancianos a pesar de su mayor coste. En comparación con la insulina glargina 100 U, tanto la insulina glargina 300 U166 como la insulina degludec167,168 han demostrado una menor tasa de hipoglucemias, sobre todo nocturnas, y una mayor flexibilidad en el horario de administración, debido a su menor variabilidad y a su mayor duración de acción. Estas características posicionan favorablemente a estas nuevas insulinas para el manejo de los ancianos institucionalizados, aunque se necesitan estudios en esta población169.
Intensificación de la insulina basalCuando no se alcanzan los objetivos de control glucémico con un régimen de insulina basal, es necesario intensificar la terapia insulínica, bien añadiendo dosis de insulina prandial en la comida principal (basal plus), en las 3comidas principales (basal-bolos), o pasando a un régimen de 2o 3dosis diarias de insulinas premezcladas. Estos regímenes complejos de insulinoterapia se asocian a un riesgo significativo de hipoglucemia163,170,171 y suponen una importante carga de cuidados, incluyendo la necesidad de controles repetidos de glucemia capilar.
Si se requiere una insulina prandial, los análogos de insulina rápida son preferibles a la insulina regular por su menor tasa de hipoglucemias172. Las insulinas bifásicas o premezcladas, como la insulina aspart y la insulina glulisina pueden administrarse después de las comidas170,173,174 y mejorar el control glucémico en pacientes mal controlados con insulina basal, pero se asocian a mayor riesgo de hipoglucemias y ganancia de peso171,175. Las insulinas premezcladas tienen un perfil farmacocinético poco flexible, por lo que solo estarían indicadas en ancianos con horarios y patrones de ingesta y actividad física regulares; en estos casos, pueden proporcionar un control glucémico similar a la pauta más compleja basal-bolos176.
En ancianos con DM2 de difícil control o muy evolucionada, en situación de insulinopenia, con buena capacidad de autocuidado, la pauta basal-bolos puede proporcionar un control glucémico adecuado con un buen perfil de seguridad y satisfacción del paciente177.
Dispositivos de insulinaOtro aspecto a considerar son los diferentes dispositivos para la administración de insulina y elegir aquel que mejor se adapte a las habilidades y capacidades del paciente. El más utilizado, con diferencia, es el tipo pluma. El «test del reloj», consistente en que el paciente dibuje en un folio en blanco un reloj que marce las 11y 10, sirve para valorar el deterioro cognitivo y la existencia de apraxia constructiva, y se ha empleado para detectar a aquellos ancianos con problemas para la autoadministración de insulina178.
Terapias combinadasEn los ancianos es fundamental simplificar al máximo el tratamiento insulínico, tanto para reducir el riesgo de hipoglucemias como para minimizar las cargas de cuidados asociadas a las pautas complejas de insulina161. Como se ha comentado, es recomendable mantener los antidiabéticos orales (salvo las sulfonilureas/glinidas) con la insulina basal para reducir los requerimientos de insulina y los riesgos de hipoglucemia162,179. Los iDPP-4 son fármacos con un perfil especialmente adecuado en esta población por su bajo riesgo de hipoglucemia y amplia experiencia de uso en ancianos con fragilidad e insuficiencia renal. Su combinación con insulina basal permite reducir la dosis de insulina y minimizar los efectos adversos de esta última (hipoglucemias, ganancia de peso)180.
La terapia combinada de insulina basal con arGLP-1 proporciona un excelente control glucémico y menos riesgo de hipoglucemias que las pautas insulínicas complejas181. Existen estudios con combinaciones a dosis fijas de insulina basal con arGLP-1 (degludec y liraglutida; glargina y lixisenatida) que facilitan la posología, además de mejorar la tolerancia digestiva a los arGLP-1. Por ello, estas combinaciones pueden desempeñar un papel en el tratamiento de la DM2 en el anciano. No obstante, su menor experiencia de uso en ancianos, la falta de estudios específicos y el coste elevado hacen que sea necesario seleccionar muy bien a los pacientes.
Desintensificación del tratamientoEl sobretratamiento de los pacientes ancianos con diabetes es frecuente21,22. Por lo tanto, tras la valoración geriátrica integral, es conveniente desintensificar la terapia antidiabética, indicando pautas menos complejas y seguras (con menor riesgo de hipoglucemias, menor carga de cuidados, mejor tolerancia y sin interacciones farmacológicas)182. La simplificación de los regímenes complejos de insulina en los ancianos reduce el riesgo de hipoglucemias y la carga de cuidados, sin comprometer el control glucémico161. En este sentido, conviene recordar que una HbA1c elevada no excluye el riesgo de hipoglucemias en ancianos25,161.
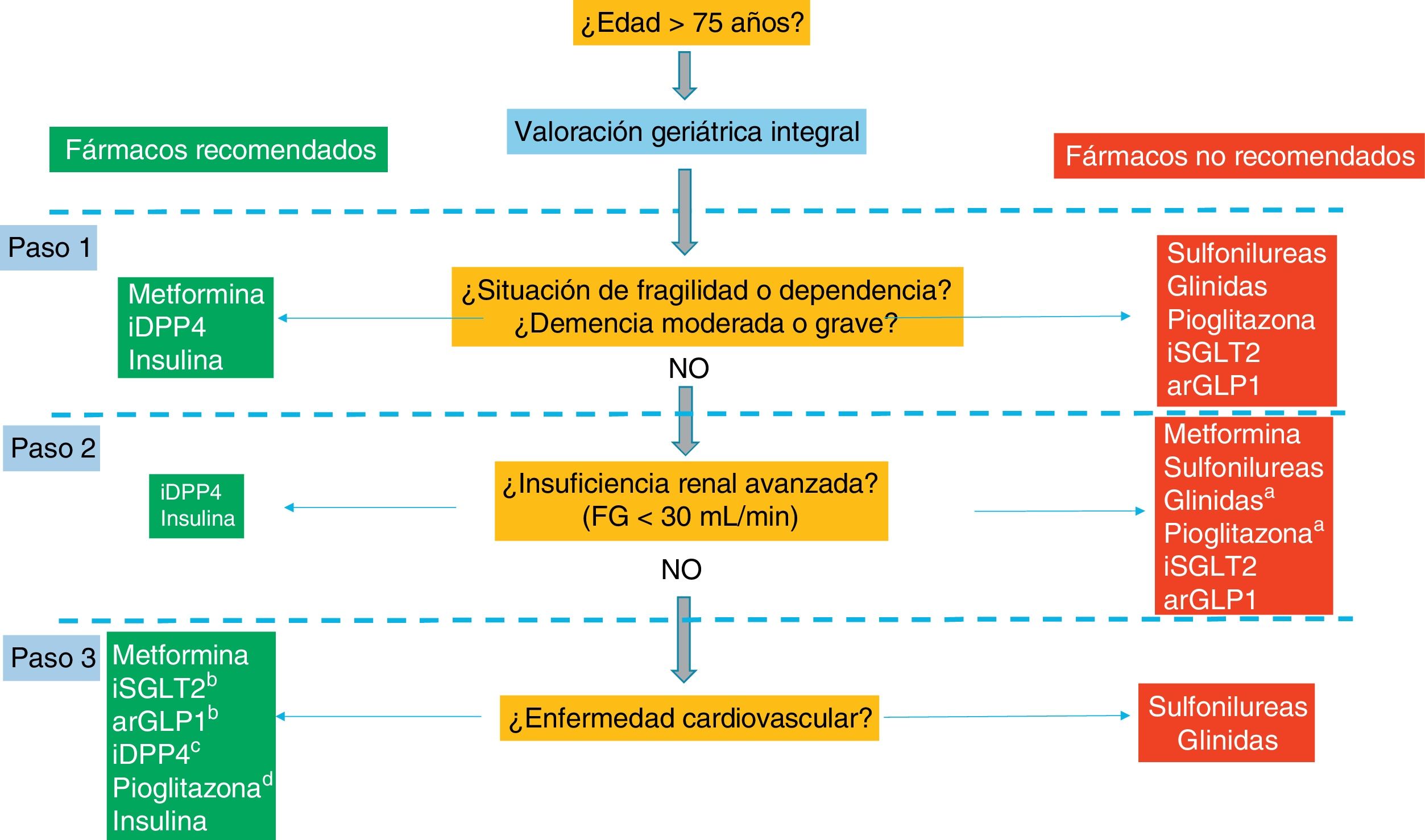
Algoritmo terapéutico de la diabetes tipo 2 en el anciano (fig. 1)La planificación del tratamiento de la DM2 en sujetos de edad avanzada debe basarse en la valoración geriátrica integral. Si el paciente anciano se encuentra en una situación de fragilidad o dependencia o si presenta una demencia moderada o grave, el objetivo prioritario sería evitar las hipoglucemias y la hiperglucemia sintomática. Los antidiabéticos recomendables en estos casos serían la metformina y los iDPP-4. Otros fármacos antidiabéticos que no se asocian a un riesgo significativo de hipoglucemia presentan efectos adversos que limitan su uso en esta población: hipotensión, deshidratación, insuficiencia renal en el caso de los inhibidores de la SGLT-2), y náuseas, vómitos, diarrea y pérdida de peso en los arGLP-1.
Algoritmo del tratamiento de la diabetes mellitus tipo2 en el paciente anciano.
arGLP1: agonistas del receptor del glucagon-like peptide-1; iDPP4: inhibidores de la dipeptidil peptidasa-4; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2.
a Repaglinida y pioglitazona pueden emplearse en pacientes con FG < 30 ml/min, pero su uso no es recomendable por el riesgo de efectos adversos: hipoglucemias (repaglinida); retención hidrosalina, insuficiencia cardiaca y fracturas (pioglitazona).
b Empagliflozina, canagliflozina y liraglutida han demostrado reducción de la morbimortalidad cardiovascular en pacientes con diabetes tipo 2 de alto riesgo vascular.
c Saxagliptina deben evitarse en pacientes con insuficiencia cardiaca.
d Pioglitazona está contraindicada en pacientes con insuficiencia cardiaca o en riesgo de fracturas.
La insuficiencia renal es una comorbilidad prevalente en ancianos con diabetes que condiciona las opciones del tratamiento183. En España, la prevalencia de enfermedad renal crónica en estadios 4 y 5 (filtrado glomerular < 30ml/min/1,73 m2) en pacientes con DM2 de 70-79 años y de ≥ 80 años es cercana al 30 y el 50%, respectivamente184. En estas circunstancias, las opciones terapéuticas preferenciales son los iDPP-4 y la insulina. Aunque desde un punto de vista farmacocinético podrían usarse la repaglinida y la pioglitazona, su perfil de efectos adversos (hipoglucemia con repaglinida; insuficiencia cardiaca y fracturas con pioglitazona) hacen desaconsejable esta opción185.
Finalmente, en ancianos de alto riesgo cardiovascular que no presenten algunas de las limitaciones clínicas anteriormente comentadas (insuficiencia renal moderada-grave, fragilidad, demencia), la prioridad sería la selección de fármacos antidiabéticos que han demostrado beneficio cardiovascular, como la empagliflozina y la liraglutida. Otros fármacos que han demostrado seguridad cardiovascular incluyen la metformina, pioglitazona y los iDPP-4.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo se publica simultáneamente en: Rev Clin Esp. https://doi.org/10.1016/j.rce.2017.12.003, con el consentimiento de los autores y editores.