La enfermedad pulmonar obstructiva crónica (EPOC) es una de las enfermedades más comunes, su prevalencia aumenta con la edad, y comporta una alta morbilidad y mortalidad en la población anciana. En la actualidad, la EPOC se considera una enfermedad inflamatoria caracterizada por una obstrucción pulmonar que no es completamente reversible y que se asocia con una elevada comorbilidad. El tratamiento en los ancianos no difiere mucho del utilizado en adultos jóvenes, aunque la elevada comorbilidad, la polifarmacia y el uso de diferentes dispositivos de inhalación requieren que el tratamiento se adapte a cada paciente. La presencia de exacerbaciones, la inactividad y la inflamación sistémica junto con la disnea causa una disminución en la actividad física y pérdida de la funcionalidad. En esta revisión vamos a actualizar la fisiología, el diagnóstico y tratamiento de la EPOC en los ancianos y la prevención de los síndromes geriátricos en esta enfermedad.
Chronic obstructive pulmonary disease (COPD) is one of the most prevalent diseases. Its prevalence increases with the age, and causes a high morbidity and mortality in the elderly population. COPD is currently considered as an inflammatory disease characterised by a pulmonary obstruction that is not fully reversible, and is associated with a high comorbidity. The treatment in the elderly does not differ much from that used in young adults, although the high comorbidity, the multiple prescription drugs and the use of different inhalation devices means that treatment has to be adapted to each patient. The presence of exacerbations, inactivity, systemic inflammation and dyspnea leads to a decrease in activity and loss of physical function. In this review we will update the physiology, diagnosis and treatment of COPD in the elderly, and the prevention of geriatric syndromes in this disease.
La enfermedad pulmonar obstructiva crónica (EPOC) es una de las afecciones más prevalentes en nuestro medio, con un elevado coste económico y sufrimiento para los pacientes en términos de incapacidad, pérdida de calidad de vida y mortalidad. La EPOC se caracteriza por una lenta progresión hasta las fases avanzadas de la enfermedad, que se suelen producir en sujetos ancianos, en los que se concentran la mayor parte de las hospitalizaciones. Además, la EPOC en el anciano tiene algunas características propias que se suman a las limitaciones habituales de la vejez. De hecho, algunos autores consideran la EPOC un envejecimiento acelerado del pulmón y su afectación extrapulmonar con la presencia de miopatía, malnutrición, pluripatología o inflamación sistémica es común a otras afecciones geriátricas. En la presente revisión profundizaremos en las peculiaridades de la EPOC en el anciano, en cuanto al diagnóstico, tratamiento, e impacto de las exacerbaciones y enfermedades asociadas.
La EPOC afecta en España al 10,2% de la población entre 40 y 80 años, con una tasa de infradiagnóstico superior al 70%. Su prevalencia es mayor en los varones y aumenta con la edad, el historial tabáquico y con el menor nivel educacional. De esta forma la mayor frecuencia se da en el grupo de pacientes comprendidos entre los 70 y los 80 años, en los que se eleva hasta el 23%, alcanzando el 50% en los varones con una historia de tabaquismo acumulado superior a 30 paquetes/año1. Lamentablemente no disponemos de datos epidemiológicos por encima de la octava década aunque muy probablemente el impacto de la enfermedad sea superior. Según los datos del Instituto Nacional de Estadística, la EPOC es en España la quinta causa de muerte en la población general –la cuarta en varones– y es una de las pocas afecciones cuya mortalidad sigue aumentando. De acuerdo con los datos de la Organización Mundial de la Salud (OMS), se espera que en el año 2020 la EPOC sea la quinta causa a nivel mundial de años de vida perdidos o vividos con incapacidad2.
En la última década, nuestro conocimiento sobre la EPOC ha aumentado de forma importante, conocemos mejor su etiopatogenia y su tratamiento, han aparecido nuevos fármacos y se ha abandonado en gran parte el nihilismo terapéutico en el que se encontraba la enfermedad, lo que ha mejorado el pronóstico3. En la actualidad la EPOC se considera una afección prevenible y tratable, con una base inflamatoria y con una alta comorbilidad asociada4.
A pesar de su elevada prevalencia e impacto en los pacientes ancianos, la mayor parte de los ensayos clínicos y de las revisiones no contemplan las peculiaridades de la EPOC en la edad avanzada, la interacción con otras afecciones frecuentes en la vejez o su impacto en los síndromes geriátricos. Sin embargo, sabemos que los pacientes mayores de 80 años hospitalizados por exacerbación de EPOC tienen más comorbilidad y mayor dependencia funcional que los pacientes más jóvenes5 y que los mayores de 85 años ingresados por exacerbación tienen el triple de posibilidades de fallecer durante el ingreso o en los 90 días siguientes al alta que el resto, mientras que la posibilidad de recibir un tratamiento correcto durante la exacerbación es menor6. Es interesante destacar que tanto la EPOC como la senilidad en sí misma se asocian a una inflamación sistémica de bajo grado y que estudios recientes han encontrado un envejecimiento prematuro en el parénquima pulmonar de pacientes con enfisema7.
EPOC y envejecimientoCon la vejez se producen una serie de cambios anatómicos y fisiológicos que en parte se asemejan a los de la misma EPOC. Entre estos cabe destacar un aumento del tejido colágeno pulmonar junto con una disminución de su elasticidad, un aumento de las resistencias respiratorias por la disminución del diámetro bronquiolar y una disminución de los flujos espiratorios con aumento del volumen residual. Además, se producen cambios en la caja torácica por la cifoescoliosis y calcificación de los cartílagos intercostales, disminuye la fuerza de los músculos respiratorios y existe una mayor reactividad bronquial8,9. A las alteraciones fisiológicas que comporta la edad se suman las derivadas de la misma EPOC. Hoy en día se acepta que la EPOC no es una enfermedad limitada a los pulmones, sino que la inflamación característica de la enfermedad afecta prácticamente a todo el organismo. Muchos de los pacientes con EPOC avanzada presentan sarcopenia y pérdida de fuerza muscular por el desuso y la misma inflamación, que empeora en caso de requerir hospitalización con una pérdida media en la fuerza de los cuádriceps de un 7% a los 5 días de ingreso y un aumento de la inactividad que se recupera sólo parcialmente al mes del alta10–12. Esto puede hacer caer a pacientes frágiles en la llamada cascada de la dependencia. Esta pérdida funcional se asocia en los ancianos con una mayor mortalidad en caso de requerir ventilación mecánica invasiva y en una pérdida de las actividades de la vida diaria en los supervivientes13. También son más frecuentes en los pacientes con EPOC grave la depresión14,15, la malnutrición16,el deterioro cognitivo17 o las caídas18. Por el contrario, la ventilación mecánica no invasiva en mayores de 65 años y la rehabilitación respiratoria en los mayores de 75 tienen una utilidad similar a la de los pacientes más jóvenes19–21.
DiagnósticoLa EPOC es una enfermedad lentamente evolutiva, que permite a los pacientes habituarse a los síntomas disminuyendo la actividad y atribuirlos erróneamente al tabaquismo o la edad. La disnea, inicialmente de esfuerzo, genera una disminución de la actividad con disminución en la realización de las actividades habituales, de las relaciones sociales y tendencia al sedentarismo. El diagnóstico de sospecha se basa en la presencia en un paciente con antecedentes de tabaquismo, de disnea o fatiga, inicialmente al esfuerzo, junto con la presencia de tos y expectoración crónica y los signos exploratorios. Sin embargo, en los ancianos son frecuentes las presentaciones atípicas o poco sintomáticas de la enfermedad.
La EPOC es por definición una afección pulmonar obstructiva, lo que obliga en la práctica a realizar una espirometría forzada para confirmar el diagnóstico, estimar su gravedad, valorar la respuesta broncodilatadora y evitar tanto tratamientos innecesarios como el infradiagnóstico. De acuerdo a las normativas actuales, para el diagnóstico espirométrico de EPOC el volumen espiratorio máximo en el primer segundo (VEMS o FEV1 por sus siglas en inglés) después de la prueba broncodilatadora debe ser inferior al 80% del valor teórico de referencia –aquel que le correspondería al sujeto de acuerdo a su talla, peso, sexo y raza– y tener un índice FEV1/capacidad vital forzada (FVC) inferior al 70%. Sin embargo, este cociente disminuye de forma fisiológica con la edad y su uso es motivo de controversia dado que puede catalogar incorrectamente hasta un 35% de los sujetos mayores de 70 años22, por lo que algunos autores han propuesto utilizar otros índices23 o bajar el punto de corte a 65%24. Los estudios realizados en este grupo de edad muestran que también en ellos un menor FEV1 se asocia a peor supervivencia y que más del 80% de los pacientes mayores de 65 años pueden realizar una espirometría de calidad, aunque el tiempo necesario para practicarla es mayor que en los pacientes más jóvenes. A pesar de ello, es evidente la infrautilización de las pruebas espirométricas en la población general y en especial en los ancianos. Un menor nivel educacional, la institucionalización y un mayor grado de deterioro cognitivo y funcional son predictores de una mala técnica, mientras que la edad por sí misma tiene poca relevancia25. La posibilidad de realizar una espirometría forzada convencional es poco probable si el paciente tiene un Minimental State Examination (MMSE) inferior a 24/30 (sensibilidad 81%, especificidad 90%)26. La figura de la intersección de los pentágonos de la misma prueba puede ser utilizada como método predictivo de los pacientes con deterioro cognitivo que no podrán realizar una espirometría correcta (sensibilidad 92%, especificidad 100%)27,28. La utilización de una espirometría en la que se sustituya el cociente FEV1/FVC, por los valores del FEV1/FEV3, es decir sustituir una espiración completa forzada –más difícil– por una espirometría forzada de solo tres segundos, permite recuperar a un 25% de los sujetos que no podían realizar la prueba convencional, incluso con MMSE entre 20 y 2429.
Tratamiento de la EPOC estableEl objetivo del tratamiento en la EPOC es frenar la pérdida de función pulmonar, prevenir las exacerbaciones, mejorar el estado de salud y la capacidad de esfuerzo y en último término disminuir la mortalidad4. Aunque existen diversas revisiones sobre el tratamiento de la EPOC en el anciano se trata más bien de adaptaciones de las guías generales dado que no existen unas pautas de tratamiento exclusivas dirigidas a la EPOC en el anciano. Esto es debido a que en la mayor parte de los ensayos clínicos los pacientes ancianos no han sido incluidos.
Incluso en estos pacientes, el abandono del tabaquismo disminuye la pérdida de función pulmonar y la mortalidad, por lo que el primer escalón del tratamiento es conseguir la abstención tabáquica30,31. La vacunación antigripal anual está recomendada en todos los pacientes con EPOC, y la antineumocócica en aquellos mayores de 65 años o con una EPOC grave.
Respecto al tratamiento farmacológico de la enfermedad, se basa fundamentalmente en fármacos inhalados de tres familias diferentes: betamiméticos, anticolinérgicos y corticoides inhalados. Los betamiméticos de corta duración (salbutamol, terbutalina, etc.) deben reservarse exclusivamente como medicación de rescate añadidos a la medicación de base o a demanda en pacientes con EPOC leve. Los betamiméticos de larga duración (formoterol, salmeterol e indacaterol) son preferibles a los de corta duración. Formoterol y salmeterol se administran cada 12 horas y están disponibles en cartuchos presurizados y polvo seco. Ambos son similares en cuanto a efectividad y duración aunque con un principio de acción más rápido en el caso de formoterol. Indacaterol se ha comercializado este año en nuestro país, tiene mayor potencia broncodilatadora que formoterol y salmeterol, con una vida media más larga que permite su administración cada 24 horas, por el contrario solo está disponible en polvo seco y no existe como terapia combinada.
El único anticolinérgico de acción prolongada comercializado en la actualidad es el tiotropio. Se administra cada 24 horas y junto a la presentación habitual en polvo, se ha comercializado este año con un nuevo dispositivo que facilita su uso en pacientes con poca capacidad inhalatoria (respimat). El tiotropio es claramente superior al bromuro de ipatropio y no tiene efectos secundarios relevantes desde el punto de vista cardiovascular32. No existe un consenso establecido sobre cuál de las dos familias de fármacos –betamiméticos de larga, anticolinérgicos de larga– es la más adecuada como primer tratamiento de la EPOC, ambas son en general bien toleradas, aunque algunos estudios sugieren que la población anciana puede ser menos sensible a los B2 inhalados33. Además, la incidencia de efectos secundarios aumenta con la edad, especialmente la posibilidad de arritmias con los betamiméticos inhalados a dosis altas34, mientras que los fármacos anticolinérgicos suelen ser bien tolerados. Recientemente un estudio comparativo realizado a un año entre tiotropio y salmeterol, demostró una disminución de las exacerbaciones en el grupo de tratamiento con tiotropio35. El siguiente escalón en el tratamiento en caso de persistir los síntomas es la combinación de ambos.
La tercera familia de fármacos son los corticoides inhalados. Al contrario de lo que ocurre en el asma, en que la inflamación es predominantemente eosinofílica, en la EPOC predomina la inflamación neutrofílica y su sensibilidad a los corticoides inhalados es mucho menor. Se hallarían indicados en pacientes con EPOC grave y exacerbaciones frecuentes y en aquellos en que coincidan características de ambas afecciones (EPOC y asma) y siempre en combinación con un betamimético de acción larga.
La terapia triple –betamiméticos de acción prolongada, anticolinérgicos y corticoides inhalados– se reservara para aquellos pacientes que sigan sintomáticos o con exacerbaciones frecuentes, con la terapia dual. En los ensayos clínicos su uso ha demostrado disminuir la necesidad de hospitalizaciones por descompensación de la enfermedad, así como el número de exacerbaciones36,37.
El uso de teofilinas debería reservarse a casos especiales por su toxicidad e interacciones farmacológicas, aunque estudios recientes sugieren que su uso a dosis bajas puede revertir la resistencia a los corticoides inhalados en estos pacientes, son necesarios más trabajos38. Roflumilast, un inhibidor selectivo de la fosfodiesterasa 4, se ha comercializado este año en nuestro país y su uso está indicado en pacientes con EPOC grave (FEV1<50%), criterios de bronquitis crónica y exacerbaciones frecuentes. Su uso se asocia a una mejoría de la función pulmonar y a una disminución del número de descompensaciones por su efecto antiinflamatorio ya que no se trata de un fármaco broncodilatador. Su administración es una vez al día y por vía oral39. La edad media de los pacientes incluidos en los ensayos clínicos fue de 65 años. No se recomienda ajuste de dosis en los pacientes más ancianos.
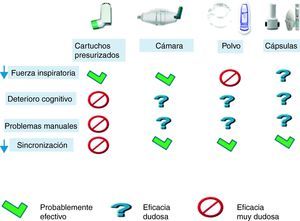
Dado que los fármacos inhalados son la base del tratamiento de la EPOC, deberemos prestar atención tanto al tipo de medicación como al dispositivo inhalador. Los mayores problemas en la población anciana en el uso de inhaladores son la falta de coordinación entre el disparo y la inhalación y la capacidad para «hacer la pinza» y activar los dispositivos de cartucho por artrosis o dispraxia40. La capacidad de aprender a manejar correctamente los inhaladores disminuye con el deterioro cognitivo, con un MMSE por debajo de 22/30 es poco probable que aprendan correctamente el manejo de los cartuchos presurizados41.
Existen discrepancias sobre cuál es el mejor mecanismo inhalatorio en los ancianos, mientras que algunos autores encuentran mejor aprendizaje con los inhaladores de polvo seco42, otros refieren mejor cumplimiento con los cartuchos presurizados, sobre todo asociados a cámara de inhalación. En caso de utilizar cartuchos presurizados es preferible utilizar cámaras de inhalación43,44. La elección del mecanismo deberá basarse en la capacidad inspiratoria del sujeto, así como en su habilidad manual y de aprendizaje. Así mismo debemos intentar simplificar al máximo el tratamiento utilizando siempre que sea posible un solo tipo de inhalador y primar aquellos que lleven combinaciones de fármacos en el mismo dispositivo, si está indicado el tratamiento con dos fármacos. En la figura 1 se resumen los dispositivos que posiblemente sean más útiles dependiendo de la capacidad del paciente. Los dispositivos en polvo seco requieren mayor fuerza inspiratoria, pero no precisan coordinación entre el disparo y la inhalación. Los dispositivos con cápsula permiten asegurar la inhalación del fármaco, comprobando el vaciado de la cápsula tras la inhalación.
ExacerbacionesLa evolución de la EPOC suele ser lentamente progresiva, pero se ve jalonada por episodios de empeoramiento agudo, que conocemos como exacerbaciones. Tradicionalmente, las exacerbaciones de la EPOC han sido entendidas como descompensaciones clínicas más o menos transitorias, cuya repercusión se limitaba a la duración del propio evento. Sin embargo, hoy sabemos que a nivel respiratorio el tiempo de recuperación hasta su situación basal puede ser superior al mes y un 10% no alcanzan su estado previo o presentan una nueva exacerbación en los tres meses siguientes45. Además, las exacerbaciones especialmente cuando son frecuentes, se asocian a mayor mortalidad, mayor pérdida funcional, disminución de la capacidad pulmonar y empeoramiento de la calidad de vida, entre otros factores. Es evidente pues la conveniencia del tratamiento farmacológico detallado más arriba, dado que tanto el tiotropio como la combinación de betamiméticos y corticoides inhalados, la combinación de los tres fármacos y el roflumilast disminuyen el número de exacerbaciones futuras.
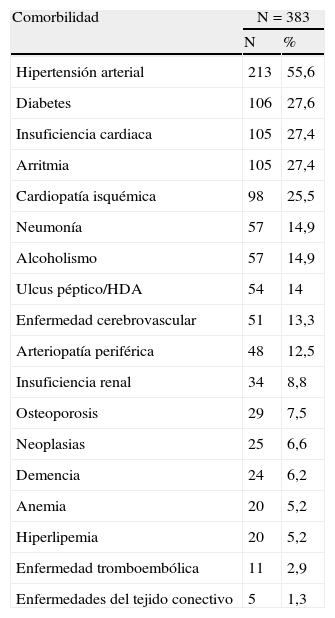
ComorbilidadesLa EPOC se asocia a un mayor número de enfermedades asociadas que las presentes en la población general incluso después de controlar por factores de riesgo como la edad, el sexo o el tabaquismo46. Los estudios realizados a partir de cohortes ambulatorias de individuos con EPOC muestran que las cardiopatías son 4 veces más frecuentes que en el grupo control, seguidas en orden de importancia por la afección digestiva y psiquiátrica47 y que los pacientes con EPOC grave tienen un 50% más de prevalencia de diabetes mellitus, un 60% más de hipertensión arterial y más del doble de riesgo de padecer enfermedad cardiovascular48. Otros estudios señalan que hasta el 75% de los pacientes ambulatorios con EPOC presentan otras afecciones crónicas49. La presencia de comorbilidad es prácticamente la regla en los pacientes hospitalizados50, y se asocia a una mayor mortalidad tras el alta hospitalaria. De hecho, tanto la mortalidad de causa cardiovascular como las neoplasias son causas frecuentes de mortalidad en estos pacientes51. En la tabla 1 se detallan las comorbilidades más frecuentes en los pacientes con EPOC hospitalizados en diferentes servicios de Medicina Interna de nuestro país.
Comorbilidad en pacientes hospitalizados por exacerbación de la enfermedad pulmonar obstructiva crónica
| Comorbilidad | N=383 | |
| N | % | |
| Hipertensión arterial | 213 | 55,6 |
| Diabetes | 106 | 27,6 |
| Insuficiencia cardiaca | 105 | 27,4 |
| Arritmia | 105 | 27,4 |
| Cardiopatía isquémica | 98 | 25,5 |
| Neumonía | 57 | 14,9 |
| Alcoholismo | 57 | 14,9 |
| Ulcus péptico/HDA | 54 | 14 |
| Enfermedad cerebrovascular | 51 | 13,3 |
| Arteriopatía periférica | 48 | 12,5 |
| Insuficiencia renal | 34 | 8,8 |
| Osteoporosis | 29 | 7,5 |
| Neoplasias | 25 | 6,6 |
| Demencia | 24 | 6,2 |
| Anemia | 20 | 5,2 |
| Hiperlipemia | 20 | 5,2 |
| Enfermedad tromboembólica | 11 | 2,9 |
| Enfermedades del tejido conectivo | 5 | 1,3 |
Fuente: Tomado de Almagro P et al.50.
Por otra parte la misma EPOC actúa en muchas ocasiones como enfermedad comórbida, hasta un 30% de los enfermos hospitalizados por insuficiencia cardiaca presentan simultáneamente una EPOC52, un porcentaje similar al observado en un estudio realizado en pacientes con cardiopatía isquémica con demostración angiográfica, de los que además un 80% no habían sido diagnosticados previamente53. Si tenemos en cuenta que el tratamiento de la EPOC disminuye no solo la mortalidad respiratoria sino también la provocada por otras causas, parece razonable concluir, que debemos aumentar nuestro índice de sospecha.
Para finalizar podemos concluir, que la EPOC es una afección con una alta prevalencia en el anciano, a menudo infradiagnosticada, lo que obliga a plantearse su presencia y solicitar una espirometría. Su perfil inflamatorio –que algunos autores comparan al de las enfermedades autoinmunes54– y sus bases genéticas55, que estamos empezando a conocer, deberá servirnos para individualizar más en los tratamientos e incorporar nuevas terapias que en la actualidad se encuentran en investigación. La mejor comprensión de su etiopatogenia, tratamiento y de sus efectos en los ancianos debería hacernos abandonar el nihilismo que hasta épocas recientes acompañaba a la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.