La monitorización neurofisiológica intraoperatoria ha experimentado un espectacular desarrollo en los últimos 20 años, particularmente en campos como la neurocirugía y la cirugía de raquis. Se ha constituido en una herramienta muy útil en la prevención de daño neurológico durante la cirugía, si bien su utilidad en la cirugía del nervio periférico en el área de traumatología y ortopedia no ha sido constatada.
ObjetivoDescribir exhaustivamente la técnica de monitorización neurofisiológica intraoperatoria y secundariamente comunicar la experiencia de nuestro centro.
Pacientes y métodoEstudio descriptivo retrospectivo de 30 casos de cirugía de nervio periférico realizadas en nuestro centro en el período 2009-2013. Descripción pormenorizada de la técnica de monitorización neurofisiológica intraoperatoria utilizada.
ResultadosRegistramos 13 tumores del nervio periférico, de estos, obtuvimos 11 resultados excelentes y 2 buenos, uno con hipoestesia temporal y otro con recuperación motora casi completa aunque no sensitiva. Registramos 17 casos de lesiones traumáticas, en 6 casos fue necesaria la realización de injerto, en los 11 restantes solo realizamos neurolisis, con recuperación sensitiva y motora completa.
ConclusionesLa monitorización neurofisiológica intraoperatoria supone una herramienta útil en la cirugía secundaria de las lesiones del nervio periférico y en la enfermedad tumoral intraneural de dicho nervio.
Intraoperative neurophysiological monitoring has experienced a spectacular development in the past 20 years, particularly in the fields of neurosurgery and spine surgery. it has become a useful, almost indispensable, tool in preventing nerve damage during surgery. The aim of this article is to describe the intraoperative technique and analyze its results in the field of peripheral nerve surgery.
ObjectiveTo describe the usefulness of a technique in peripheral nerve surgery, the technique used and the experience in a centre.
Patients and methodsA retrospective study was conducted on 30 cases of peripheral nerve surgery performed in this centre from 2009 to 2013, using the intraoperative monitoring technique.
ResultsOf the total of 13 peripheral nerve tumors recorded, there were 11 excellent results and 2 good results, one temporary hypoesthesia and one with almost complete sensory, except for motor, recovery. Traumatic injury was recorded in 17 cases, of which 6 required performing a graft, and the remaining 11 cases only neurolysis was performed, with complete motor and sensory recovery.
ConclusionsIntraoperative neurophysiological monitoring is a useful tool in the secondary surgery of peripheral nerve injury and the intraneural tumor pathology.
La microcirugía del nervio periférico en el área de Traumatología y Ortopedia se desarrolla fundamentalmente en el tratamiento de las lesiones neurológicas agudas o sus complicaciones (neuromas) así como en los tumores del nervio periférico1. Las lesiones traumáticas de los nervios periféricos suelen ser secundarias a fracturas (cerradas o abiertas) o a heridas penetrantes en los miembros1. Su diagnóstico es fundamentalmente clínico y afectan a todos los grupos de edad, pudiendo ser devastadoras para los pacientes, al afectar a su desempeño profesional y a las actividades de la vida diaria. Los tumores de los nervios periféricos son lesiones raras desarrolladas a expensas de los elementos que conforman el nervio, siendo la célula de Schwann el principal elemento constituyente2,3. Suelen presentarse como una masa de partes blandas en el recorrido del nervio, que puede ser dolorosa a la palpación y presentar signo de Tinel positivo2,4. El denominado schwannoma o neurilemoma es la tumoración neurogénica más frecuente del nervio periférico, constituyendo aproximadamente el 5% de las neoplasias benignas de los tejidos blandos5–12.
Tanto las lesiones traumáticas, especialmente las secundarias una vez constituido el neuroma, como las tumorales, especialmente las intraneurales, exigen conocimientos avanzados anatómicos y de microcirugía para poder conseguir los objetivos deseados que son la recuperación de la máxima capacidad funcional y la eliminación del dolor1. La reparación nerviosa directa o mediante injerto en el primer caso o la exéresis de la lesión respetando el nervio de origen en el segundo son los tratamientos de elección13,14.
Por tanto, podemos afirmar que un punto fundamental de esta cirugía es la preservación del máximo de fascículos nerviosos indemnes, es decir, no sacrificar nervios sanos, y es en este aspecto donde los estudios de monitorización neurofisiológica intraoperatoria (MNI) son de gran valor, pues proporcionan una información básica, veraz y en tiempo real al equipo quirúrgico sobre la funcionalidad del nervio explorado4,5.
Las principales utilidades de la MNI de los nervios periféricos y del plexo braquial son14,15:
- 1.
Identificar los propios nervios periféricos.
- 2.
Localizar lesiones preexistentes a lo largo del recorrido del nervio.
- 3.
Determinar si existe continuidad a través de una lesión nerviosa.
- 4.
Determinar si existe una avulsión de raíces.
- 5.
Identificar las dianas para la biopsia nerviosa.
- 6.
Monitorizar y prevenir los daños a nervios sanos durante la cirugía.
- 7.
Emitir un pronóstico evolutivo de la lesión neurológica.
El objetivo principal de este estudio es describir la técnica de monitorización neurofisiológica intraoperatoria realizada en nuestro centro y, secundariamente, comunicar la experiencia del equipo quirúrgico en una serie de 30 casos para, finalmente, debatir si estas razones la convierten en una técnica útil en la cirugía del nervio periférico.
Material y métodosEstudio descriptivo retrospectivo realizado en enero de 2014 de 30 pacientes intervenidos en el período de enero de 2009 a septiembre de 2013 por enfermedad del nervio periférico (tabla 1), en el mismo centro (Hospital Universitario de Canarias, tercer nivel asistencial).
| Sexo | Edad | Diagnóstico | ENG previo (SEDDON) | Fármacos utilizados en anestesia | Tipo de MNI | Cirugía previa | Tratamiento | |
|---|---|---|---|---|---|---|---|---|
| 1 | Mujer | 37 | Schw. mediano | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 2 | Varón | 13 | Schw. mediano | Normal | Propofol+remifentanilo | NAP nervio | No | Exéresis |
| 3 | Mujer | 20 | Sección mediano | Neurotmesis | Sevofluorane | NAP nervio | Neurorrafia | Injerto sural |
| 4 | Mujer | 42 | Schw. tibial posterior | Normal | Propofol+remifentanilo | NAP nervio | No | Exéresis |
| 5 | Mujer | 51 | Sección cubital | Neurotmesis | Sevofluorane | NAP nervio | Neurorrafia | Neurolisis |
| 6 | Varón | 5 | Parálisis cubital | Neuroapraxia | Sevofluorane | NAP nervio | No | Neurolisis |
| 7 | Mujer | 72 | Schw. cubital | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 8 | Varón | 41 | Parálisis radial | Neurotmesis | Sevofluorane | NAP nervio | No | Neurolisis |
| 9 | Varón | 23 | Schw. tibial posterior | Normal | Propofol+remifentanilo | NAP nervio | No | Exéresis |
| 10 | Varón | 17 | Parálisis cubital | Neuroapraxia | Sevofluorane | NAP nervio | No | Injerto sural |
| 11 | Mujer | 36 | Sección mediano | Neurotmesis | Sevofluorane | NAP nervio | Neurorrafia | Neurolisis |
| 12 | Mujer | 44 | Sección cubital | Neurotmesis | Sevofluorane | NAP nervio | Neurorrafia | Neurolisis |
| 13 | Varón | 34 | Schw. mediano | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 14 | Mujer | 25 | Schw. mediano | Normal | Propofol+remifentanilo | NAP nervio | No | Exéresis |
| 15 | Varón | 43 | Sección cubital | Neurotmesis | Sevofluorane | NAP nervio | No | Injerto sural |
| 16 | Varón | 71 | Sección radial | Neurotmesis | Sevofluorane | NAP nervio | Neurorrafia | Injerto sural |
| 17 | Varón | 30 | Sección peroneo profundo | Neurotmesis | Sevofluorane | Nap nervio | Neurorrafia | Injerto sural |
| 18 | Varón | 26 | Schw. radial | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 19 | Varón | 55 | Sección radial sensitivo | Neuroapraxia | Sevofluorane | NAP nervio | No | Neurolisis |
| 20 | Varón | 63 | Parálisis radial | Neurotmesis | Sevofluorane | NAP nervio | No | Neurolisis |
| 21 | Varón | 18 | Schw. mediano | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 22 | Mujer | 41 | Sección tibial posterior | Neurotmesis | Sevofluorane | NAP nervio | No | Injerto sural |
| 23 | Varón | 71 | Parálisis ciático | Neuroapraxia | Sevofluorane | NAP nervio | No | Neurolisis |
| 24 | Varón | 45 | Schw. CPE | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 25 | Varón | 57 | Fibrolipoma del mediano | Neuroapraxia | Sevofluorane | NAP nervio | No | Neurolisis |
| 26 | Mujer | 46 | Sección mediano | Neurotmesis | Sevofluorane | NAP nervio | No | Neurorrafia |
| 27 | Varón | 6 | Parálisis cubital | Neuroapraxia | Sevofluorane | NAP nervio | No | Neurolisis |
| 28 | Varón | 4 | Parálisis cubital | Neuroapraxia | Propofol+remifentanilo | NAP nervio | No | Neurolisis |
| 29 | Mujer | 19 | Schw. radial | Normal | Sevofluorane | NAP nervio | No | Exéresis |
| 30 | Varón | 34 | Schw. mediano | Normal | Sevofluorane | NAP nervio | No | Exéresis |
CPE: ciático poplíteo externo; ENG: electroneurograma; MNI: monitorización neurofisiológica intraoperatoria; NAP: potencial de acción nervioso; Schw.: schwannoma.
A todos los pacientes se les realizó una historia clínica y exploración física, especialmente en lo que a la evaluación motora y sensitiva se refiere, antes y después de la cirugía, llevada a cabo por el mismo cirujano responsible (FMM), dado su conocimiento y experiencia en la microcirugía. Seguimos los criterios descritos por el British Medical Research Council o sus versiones modificadas que permiten la clasificación de recuperación sensitiva de S0 a S5 y la motora de M0 a M51.
A todos los pacientes se les realizó estudio neurofisiológico previo por parte del mismo neurofisiólogo responsable de la técnica intraoperatoria (PPL). Se aplicó la clasificación de Seddon, considerándose que es la más utilizada en el mundo, ya que permite no solo comprender la fisiopatología lesional sino también establecer un probable pronóstico y, sobre todo, una conducta terapéutica adecuada1. Esta clasificación distingue entre: la neurapraxia, que es un bloqueo en la conducción nerviosa a nivel local, sin afectación axonal y por lo tanto sin degeneración walleriana distal. La función se recupera en forma rápida, como máximo en un par de semanas y la restitutio ad integrum es la regla. La axonotmesis, que es una lesión propia del axón, asociada a degeneración walleriana distal. El endoneuro y el perineuro están intactos, lo que garantiza una correcta guía del axón en regeneración hasta el extremo distal del sitio de lesión, siendo la velocidad de desplazamiento de las fibras la clásicamente descrita de 1 a 1,5mm diarios. La recuperación de la función también es la regla en este tipo de lesión, aunque con una demora mayor a la neurapraxia, de hasta 6 meses. Y por último, la neurotmesis, que es una lesión más severa, con sección completa del nervio, pérdida absoluta de la función y ausencia de todo tipo de recuperación espontánea1,14.
A todos los pacientes con enfermedad tumoral se les realizó además un estudio por resonancia magnética nuclear (RMN) previo a la cirugía, interpretado por el mismo radiólogo (LDF).
La recogida, análisis e interpretación de los datos fue llevada a cabo por el resto de autores de este trabajo (MHP, JPB).
Todos los pacientes fueron debidamente informados del procedimiento a realizar. No hubo necesidad de aprobación por el Comité Ético de nuestro centro por tratarse de una prueba diagnóstica aceptada en la práctica diaria. Asimismo, en este estudio no se ha proporcionado ningún dato personal de los pacientes, manteniendo su confidencialidad.
Los criterios de inclusión para participar en este estudio fueron los siguientes:
- -
Lesiones neurológicas traumáticas abiertas sin recuperación clínica ni neurológica tras 6 meses de evolución tras la primera cirugía.
- -
Lesiones neurológicas cerradas tratadas conservadoramente con empeoramiento de la clínica y neurofisiología en el seguimiento evolutivo.
- -
Lesiones tumorales neurales o extraneurales del nervio periférico.
- -
Existencia de estudio neurofisiológico previo a la cirugía.
Los criterios de exclusión fueron los siguientes:
- -
Pacientes diabéticos.
- -
Pacientes con alteraciones sensitivomotoras previas.
- -
Pacientes que no firmaran el consentimiento informado.
- -
Pacientes que no cumplieran el seguimiento.
Antes de describir nuestra técnica de exploración, debemos resaltar una serie de cuestiones preliminares a tener en cuenta:
- •
La disminución de la temperatura durante el proceso quirúrgico es algo difícilmente evitable y, por lo tanto, debemos tener en cuenta que con la disminución de la temperatura disminuyen las velocidades de conducción nerviosa.
- •
La disminución de la tensión arterial durante la cirugía reduce las amplitudes de los potenciales evocados somatosensoriales (PESS) y de los potenciales evocados motores (PEM).
- •
La isquemia periférica, provocada por el uso del manguito de isquemia, afecta a las respuestas nerviosas por alteración de los vasa nervorum, pudiendo bloquear las respuestas nerviosas14,16,17. Si un torniquete se encuentra colocado durante más de 60 min, debería retirarse al menos 20-30 min antes de que comiencen los estudios de monitorización intraoperatoria13.
- •
La anestesia tiene efecto en los estudios de MNI al alterar la excitabilidad cortical. Además debemos tener en cuenta el efecto de los agentes relajantes neuromusculares.
En nuestra serie no utilizamos isquemia periférica en ningún caso, la anestesia utilizada fue general con especial precaución del uso de relajantes neuromusculares que alteraran las mediciones intraoperatorias, y la temperatura de los quirófanos fue de 15°C en todos los casos.
Metodología: descripción técnica de la monitorización neurofisiológicaLa técnica comienza una vez identificado y aislado el nervio a explorar. Ya que el propósito principal de los estudios de conducción nerviosa es valorar la integridad del nervio, su continuidad funcional o determinar la localización de una lesión nerviosa periférica, los electrodos de estimulación y de recepción deben estar a ambos lados de esa lesión, es lo que se denomina estimulación bipolar, cuya principal ventaja es que provoca menor dispersión de la corriente. En caso de no poder realizar una estimulación bipolar, se intentará realizar una monopolar con el cátodo sobre el nervio y el ánodo en una superficie inerte a una cierta distancia. El electrodo de estimulación bipolar (se prefieren los electrodos de gancho) sostenido por el cirujano se coloca sobre la superficie del nervio con el electrodo activo dirigido hacia los electrodos de recogida15. La distancia entre los polos de este electrodo bipolar generalmente es de 3-4mm, aunque depende en gran medida del tamaño del nervio, ya que con nervios de gran tamaño pueden ser necesarias distancias entre polos cercanas a los 7mm13.
En primer lugar se evoca la respuesta nerviosa en un lugar sano del nervio colocando tanto los electrodos de estimulación y recepción proximal o distalmente a la lesión. Posteriormete se sitúan los electrodos de estimulación proximalmente y los electrodos de recepción distalmente a la lesión para evocar el NAP a lo largo de la misma.
Durante la estimulación se sugiere elevar el nervio con respecto al campo quirúrgico para evitar el contacto con los fluidos (sangre, suero…) que reducen la intensidad del estímulo recibido por el nervio. Se debe tener en cuenta que una estimulación excesiva aumenta la intensidad de estímulo, lo que puede llegar a ser un gran problema si las distancias entre el electrodo de estimulación y el de recogida son cortas.
Generalmente la duración del estímulo se sitúa entre 0,05-0,1ms con pulso cuadrado7, y no es necesaria una intensidad superior a 1-5mA para producir una despolarización del nervio y evocar una respuesta supramaximal. En los nervios dañados, es necesario estimular con intensidades superiores para poder evocar una respuesta (del orden de 20-25mA o 25-50V)16. Esto provoca un aumento en el artefacto de estímulo que puede interferir con la recogida de la respuesta.
El potencial de acción nervioso (NAP) es un potencial eléctrico que se genera y viaja a través de las fibras nerviosas tras ser estas estimuladas por encima de su umbral, fisiológica o eléctricamente16. Se puede recoger tanto en el conjunto del nervio como en sus diferentes fascículos14. Se considera que la presencia de NAP requiere de al menos 4.000 fibras de más de 5μ de diámetro. Cuando lo que se valora es la continuidad del nervio, debemos tener en cuenta que la presencia de unas pocas fibras nerviosas mielinizadas de gran tamaño (sobre las 4.000), puede evocar un NAP de características normales. El proceso de estudio de un nervio periférico comienza con la estimulación y recepción del NAP en un lugar proximal a la región del nervio dañada, lo que permite valorar la técnica (deben evocarse respuestas normales)13. Posteriormente se sitúan los electrodos a ambos lados de la lesión para valorar la continuidad nerviosa.
La distancia entre los electrodos de estimulación y recogida debe ser superior a 4cm13,16. El electrodo de recogida también debe ser bipolar, con una distancia entre electrodos de 3-5mm (con el electrodo activo colocado más cercano al cátodo del estimulador), con una mayor separación entre ellos si existe una gran distancia entre el estimulador y el receptor.
El electrodo de tierra se puede colocar en una superficie de la piel del paciente, separado de la tierra del bisturí eléctrico13.
Los filtros necesarios para obtener la respuesta del NAP se sitúan entre 5 y 10Hz el de baja frecuencia y entre 2-3 kHz el de alta frecuencia16.
La amplitud del NAP es generalmente baja, de unos 100μV, por lo que la ganancia se sitúa entre los 20-50μV por división. Es precisa la promediación de las respuestas para que pueda ser evaluada (generalmente son necesarios menos de 10 estímulos).
La latencia de la respuesta depende por supuesto de la distancia entre el electrodo de estimulación y el de recogida. Aceptando una velocidad de conducción de 50m/s, situamos 1ms por cada 5cm de distancia de nervio, por lo que el barrido debe estar en 0,5-1ms por división y aumentar a 2ms si la distancia entre ambos electrodos es grande.
Implicación práctica en la toma de decisiones intraoperatoriasLa gran mayoría de las lesiones de nervio periférico no seccionan los nervios, sino que dejan lesiones en continuidad que pueden no objetivarse durante la inspección visual17. La presencia de continuidad estructural no implica la funcionalidad nerviosa, por tanto, la simple inspección visual no debe ser tenida en cuenta únicamente en el proceso quirúrgico, ya que los estudios electrofisiológicos son los que determinan el curso de la intervención. Por tanto, la decisión quirúrgica en las lesiones de nervio periférico se basa en la determinación de la continuidad de la función nerviosa a lo largo de una lesión de dicho nervio (comprobar si existe continuidad)17,18.
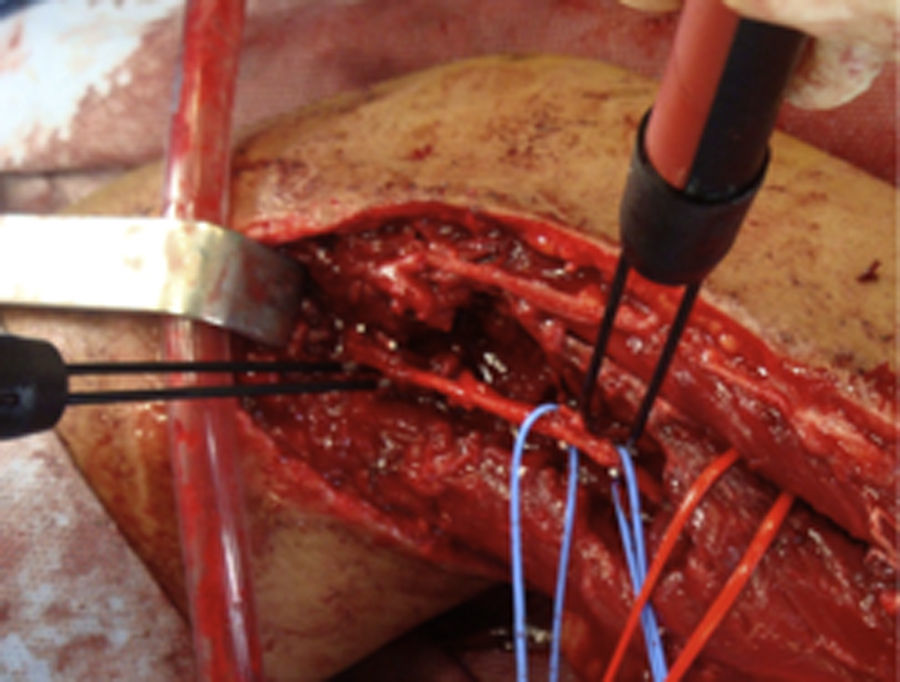
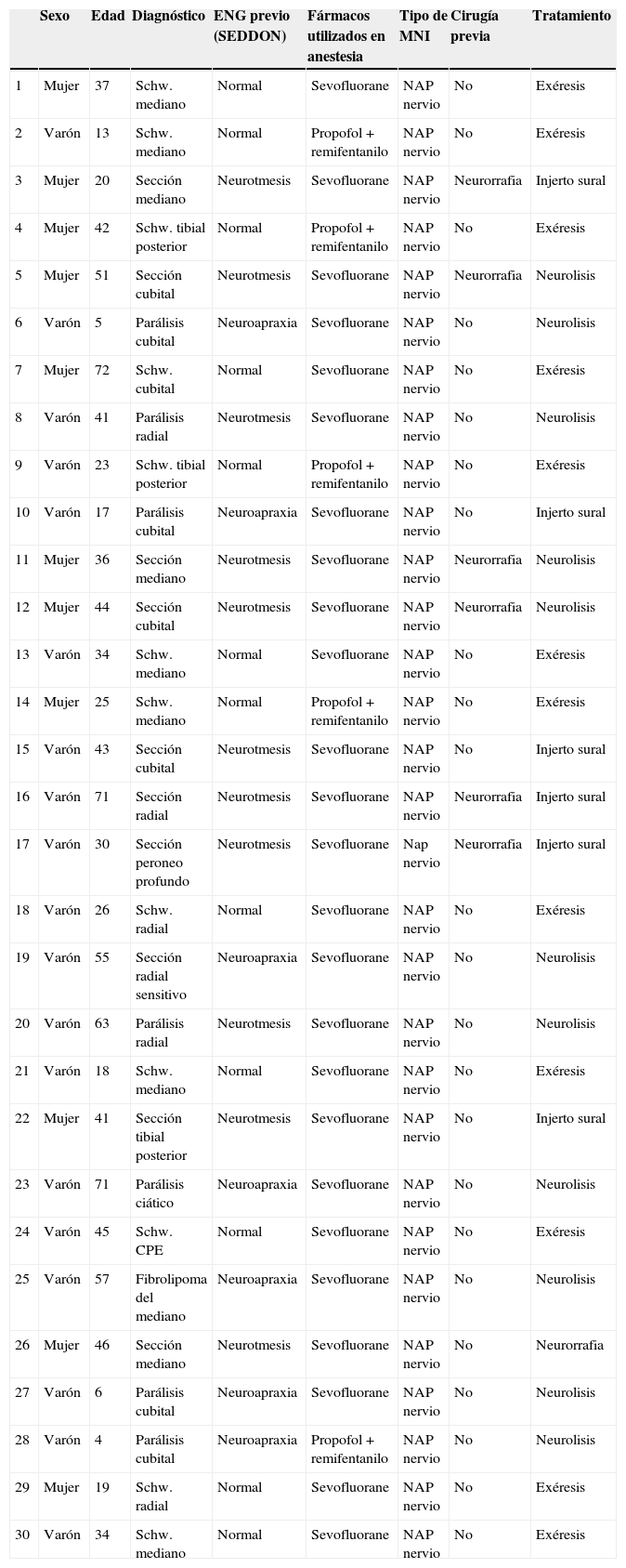
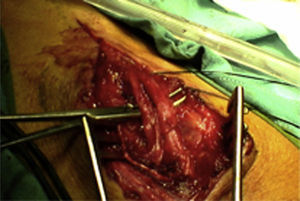
¿Cómo sabemos si un nervio explorado es funcionante y por tanto viable?La presencia del NAP a lo largo de una lesión es la técnica gold standard e indica que existe continuidad nerviosa o reinervación colateral (aunque los estudios neurofisiológicos preoperatorios y la clínica indiquen lo contrario)13,17 y por lo tanto los procedimientos quirúrgicos deben limitarse a la neurolisis (liberación de adherencias del nervio) de la lesión en continuidad14 (fig. 1), siendo este el punto fundamental a tener en cuenta en la toma de decisiones en la cirugía del nervio periférico1.
¿Qué hacer ante la ausencia de respuesta del potencial de acción nervioso?Ante la ausencia de respuesta del NAP, procederemos a realizar secuencialmente los siguientes pasos14,16:
- 1.
Comprobar la hipotensión o la hipotermia.
- 2.
Proximalmente a la lesión o en segmentos sanos, comprobar la posición de los electrodos y que no estén muy cercanos.
- 3.
Comprobar si el electrodo estimulador produce el estímulo.
- 4.
No debe haber fluidos en el campo quirúrgico ni los electrodos deben tocar otros tejidos.
- 5.
No debe existir mucha tensión en el tejido nervioso.
- 6.
Si el campo quirúrgico se ha enfriado, se debe calentar con suero caliente.
- 7.
Si el torniquete no se ha quitado, se retira y se debe esperar unos 20 min para seguir realizando la MNI.
- 8.
No debe existir anestesia local.
- 9.
Si se objetiva un gran artefacto de 60Hz (de red) se debe apagar el filtro de red del equipo además de comprobar que no existan otras máquinas tipo rayos X en el campo.
- 10.
Además se debe comprobar si la señal obtenida no proviene de la estimulación inadvertida de otros nervios.
En general se acepta que las lesiones a lo largo de las cuales no se transmite el NAP tras una evolución de 3-4 meses no tienen posibilidad de recuperación espontánea y deben ser intervenidas mediante injerto o transferencia nerviosa13,16; por otro lado, la presencia de NAP sugiere la recuperación funcional en semanas o meses.
Debemos tener en cuenta por último, las posibilidades de potenciales falsos positivos14,16,17:
- 1.
Las lesiones preganglionares (plexopatías) pueden tener respetadas las fibras sensitivas con daño severo de las motoras y generalmente las velocidades de conducción son muy altas (sobre 65-70m/s de las fibras sensitivas en vez de los 50m/s de las motoras o mixtas).
- 2.
Puede que estemos estimulando y recogiendo en una zona donde no se encuentra la lesión nerviosa.
- 3.
Podemos estar explorando otro nervio o parte del plexo.
- 4.
Explorar el nervio tras un año de evolución de la lesión nerviosa.
- 5.
Una promediación excesiva puede recoger la fibra fina.
- 6.
Hay que tener cuidado con las respuestas motoras cercanas.
En el caso de los tumores de nervio periférico14, el uso de los NAP puede detectar el nervio periférico en los lugares donde la arquitectura o anatomía es confusa e incluso identificar los fascículos funcionales (y protegerlos en la medida de lo posible)13.
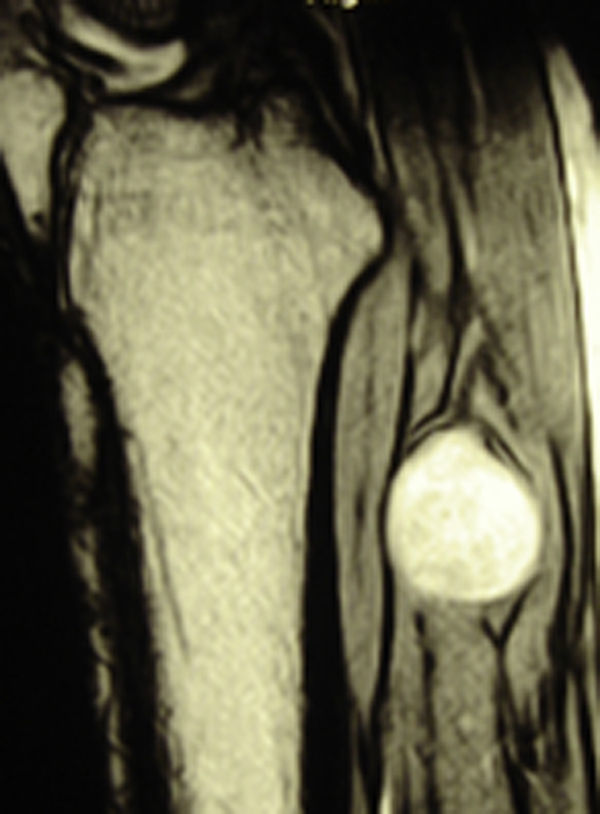
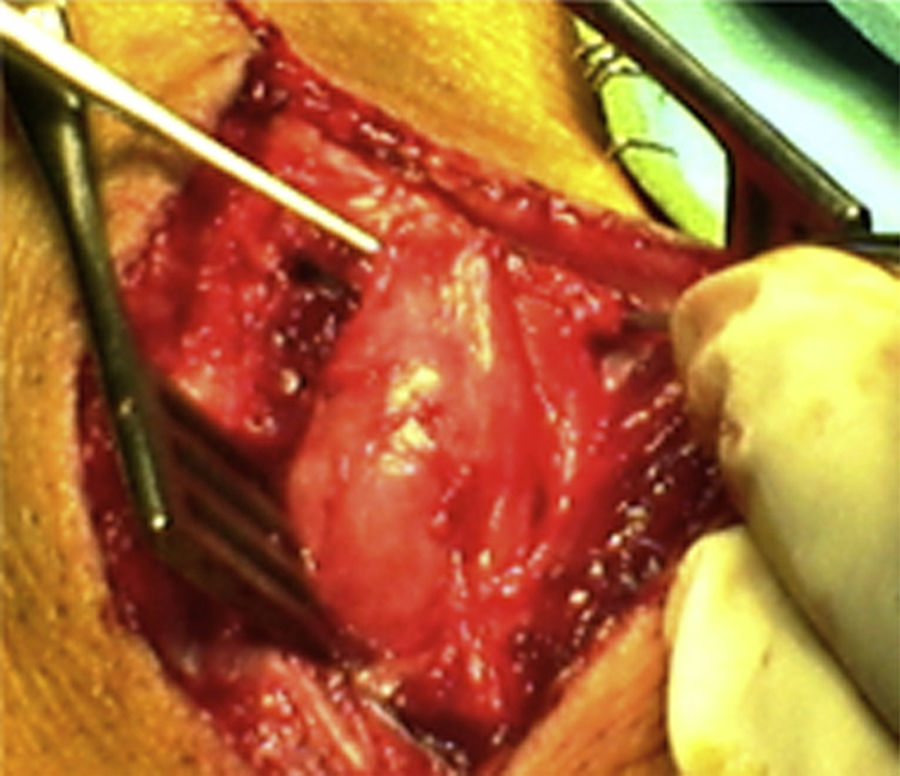
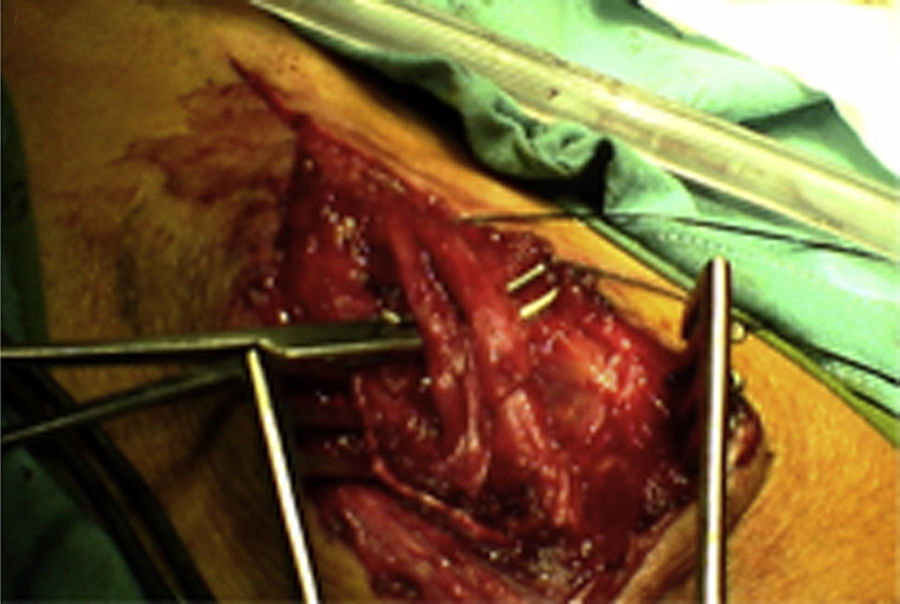
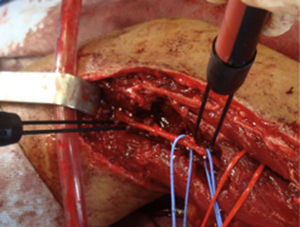
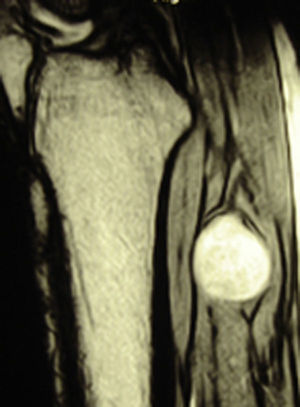
ResultadosRegistramos 12 schwannomas del nervio periférico, 9 en miembro superior y 3 en miembro inferior (tabla 1). En todos los casos la cirugía transcurrió sin incidencias, pudiendo resecar la tumoración del tronco principal del nervio, excepto en un caso donde tuvimos que sacrificar una rama solo sensitiva del nervio tibial posterior, una vez el registro neurofisiológico demostró que no tenía componente motor; en este caso quedó una hipoestesia residual en región gemelar interna (S2 según la clasificación del BMC), que duró 3 meses (figs. 2 y 3). Como secuela permanente, describimos un caso de schwannoma del nervio ciático poplíteo externo que comenzó con afectación sensitiva y motora (M1 y S1) (figs. 4 y 5), con una hipostesia en dorso del pie que persiste (S1 según la clasificación del BMC), aunque sin afectación motora. Registramos un caso de fibrolipoma del nervio mediano, también llamado hamartoma fibrolipomatoso neural, lipoma perineural o infiltración grasa neural, en un varón de 57 años que comenzó con clínica de síndrome de túnel carpiano y aumento de volumen de la cara volar de la muñeca. Pudimos tratarlo mediante sección del retináculo flexor de la muñeca y endoneurolisis del mediano. Por tanto, tenemos 11 casos de resultados excelentes y 2 buenos, uno con hipoestesia temporal y otro con recuperación motora casi completa aunque no sensitiva.
Realizamos monitorización en 17 casos de lesiones traumáticas (tabla 1). Diez casos fueron secundarios a heridas penetrantes; de ellos, en 6 casos se realizó una neurorrafia directa del nervio lesionado. En la cirugía de revisión, pudimos comprobar con la MNI que en 6 casos el neuroma producido no permitía conducción distal, por lo que fue necesaria la realización de injerto tomado del nervio sural según la técnica habitual; en los 4 restantes, fue demostrada la conducción distal y solo realizamos neurolisis.
En el resto de casos, 7 pacientes habían sufrido traumatismo cerrado accidental o bien iatrogénico (nervio cubital en cirugía de fractura supracondílea). En este último grupo, resultó muy útil la monitorización neurofisiológica intraoperatoria en 3 niños con lesión del nervio cubital tras reducción incruenta y fijación percutánea de fractura supracondílea de húmero desplazada, por posible lesión al introducir la aguja desde el lado cubital. Tras no observar recuperación funcional en la exploración física ni en los estudios de neurofisiología seriados pasados 9, 10 y 11 meses respectivamente, decidimos realizar la exploración y monitorización directa (fig. 1). En los 3 casos no observamos lesiones macroscópicas evidentes, y pudimos observar cómo el nervio sí conducía a nivel distal, por lo que simplemente se realizó neurolisis, recuperando la función a los 3, 4 y 4,5 meses de la cirugía respectivamente.
DiscusiónLa cirugía del nervio periférico es un tipo de cirugía muy demandante que exige conocimientos técnicos y anatómicos avanzados para conseguir un buen resultado funcional1,14. La decisión de reparar un nervio lesionado debe tener en cuenta tanto la condición del nervio como las capacidades del equipo quirúrgico y del centro hospitalario18. Uno de los factores más importantes para obtener estos resultados es el momento en el que se efectúa la reconstrucción quirúrgica, es decir, el timing quirúrgico. Dado el hecho de que en muchas ocasiones la función perdida de los nervios retorna en forma espontánea, si la cirugía es realizada demasiado precozmente, estaremos incurriendo en una temeridad terapéutica, es decir, sometiendo al enfermo a una cirugía que no requiere. Por el otro lado, si actuamos demasiado tarde, le estaremos restando opciones de recuperación, ya que el músculo que no recibe inervación se dirige irremediablemente hacia la atrofia, y cuanto mayor sea el tiempo transcurrido desde la lesión hasta su reparación, mayor la atrofia y menores las posibilidades de éxito. En la práctica habitual, es mucho más frecuente encontrar el segundo caso (pacientes derivados en forma tardía) que el primero. Se establecen 2 grandes grupos: lesiones cerradas y abiertas. Las primeras son las que generalmente requieren una conducta inicial expectante y una cirugía en diferido no antes de los 3 meses de transcurrido el trauma. En cambio, las lesiones abiertas se deben explorar de forma rápida para efectuar una neurorrafia directa cuando es factible, o limpiar y reparar los bordes del nervio seccionado cuando no es posible para efectuar una reparación con injerto interpuesto en agudo. Otras indicaciones de exploración del nervio también comprenden: lesiones nerviosas con lesión arterial, lesiones por tracción del plexo braquial, la disminución de la funcionalidad del nervio tras un tratamiento inicial expectante, la falta de mejoría neurológica después de una lesión cerrada, la falta de mejoría después de un bloqueo de la conducción dentro de las 6 semanas de la lesión, y el dolor persistente o la sospecha de formación de un neuroma1,18.
Después de una lesión en el nervio, el estudio neurofisiológico nos sirve para determinar la severidad de la afectación nerviosa así como para detectar signos de su recuperación funcional antes de que se evidencien en la clínica. Hasta ahora, la toma de decisiones en la dolencia del nervio periférico sigue siendo el resultado de una combinación entre los estudios neurofisiológicos y la exploración física seriada, aunque quizás mayor y creciente interés ha despertado la utilización de la MNI, pues nos permite saber a tiempo real y estimulando directamente las estructuras neurales la funcionalidad de los principales ramos nerviosos afectados y la presencia o ausencia de una acción potencial en el nervio distal a la lesión, especialmente cuando el nervio no está completamente seccionado y se ha formado un neuroma13,14,16,17. Esta técnica incluso puede distinguir entre un fascículo intacto y un neuroma. Clínicamente, el tamaño y la dureza del neuroma es un factor negativo para la recuperación, pero las buenas señales de amplitud distales a la lesión del nervio indican un mejor pronóstico porque indican que existen fascículos intactos atravesando el área lesionada15,18. Encontramos esta técnica especialmente interesante en casos de lesiones cerradas postraumáticas o tras la cirugía en determinadas localizaciones, como es el caso del nervio cubital a nivel del codo en fracturas supracondíleas de húmero en niños, presente en 3 casos de nuestra serie. Con esta técnica hemos sido capaces de determinar si el nervio era funcionante o si por el contrario precisaba un injerto nervioso, como así hicimos en uno de los casos descritos. Finalmente, y aunque no forma parte del objetivo de este artículo, la MNI también ha servido de forma experimental en animales para la implementación de técnicas biológicas en la reparación nerviosa que servirán como coadyuvantes a la regeneración nerviosa en un futuro próximo19–24.
En el caso de los tumores que asientan en el nervio periférico, el objetivo del tratamiento es la exéresis completa con el mínimo daño al nervio donde asientan. Dentro de estos tumores deben distinguirse los tumores nerviosos extirpables de los no extirpables. Los primeros evitan los grupos fasciculares sin penetrar en ellos, es decir, son extraneurales, con lo que entonces pueden enuclearse sin romper la continuidad nerviosa, como por ejemplo los schwannomas, con un excelente pronóstico funcional, sin estudio que demuestre que los resultados óptimos no se conseguirían también sin el uso de la MNI.
Por el contrario, es en los tumores inextirpables (neurofibroma solitario, hemangioma de la vaina de Schwann, neurofibrolipoma), donde la MNI resulta más útil. Estos tumores infiltran el conjunto de los elementos constitutivos del nervio y es imposible realizar su exéresis completa sin alterar las fibras nerviosas, como es el caso del fibrolipoma del mediano de nuestra serie. Son por tanto intraneurales y es deseable reconocer qué fascículos son viables funcionalmente y preservarlos, si bien en muchos casos esto no es posible y debemos utilizar injertos nerviosos o neuroconductores18.
En la revisión bibliográfica, encontramos pocas referencias específicas al uso de esta técnica en la cirugía tumoral del nervio periférico en el área de conocimiento de Ortopedia, sin poder avalar su uso generalizado en nuestro campo. Sí contamos con numerosos estudios que comunican excelentes resultados en caso de lesiones traumáticas del nervio periférico y plexo braquial, así como en la cirugía del nervio facial23–25. La mayoría de artículos respecto a esta técnica se refiere al área de Otorrinolaringología y Neurocirugía, en especial en la cirugía de la base del cráneo, y suelen tratarse de revisiones de series de casos o casos clínicos aislados25–28. Cabe destacar la amplia experiencia existente en el caso de schwannomas del nervio estatoacústico (octavo par craneal)25–30, entre ellos el artículo de Oh et al.28, quienes describen perfectamente la técnica de monitorización para neurinomas en esta localización, muy similar a la que empleamos en nuestro centro. Kwok describe sus excelentes resultados en el caso de tumores benignos del plexo braquial, y afirma que su uso generalizado ha minimizado las complicaciones intraoperatorias31.
Encontramos hasta 3 publicaciones de aplicación de esta técnica en el caso de schwannomas del nervio tibial posterior como causa de síndrome de túnel tarsiano, dolencia que entra dentro del diagnóstico diferencial de las talalgias atípicas32–35. En 2 de las publicaciones se concluye recomendando la utilización sistemática de esta técnica para evitar lesiones yatrogénicas derivadas de la cirugía32,33. En nuestra serie, contamos con 3 schwannomas del tibial posterior, en todos los casos con recuperación completa y funcionalidad intacta (figs. 2 y 3).
Siguiendo las consideraciones descritas por Mohler36 en su artículo, existe discrepancia entre la clínica y neurofisiología previa, en caso de lesiones cerradas de nervios periféricos, y los resultados funcionales finales, con gran variabilidad entre los diferentes nervios periféricos y entre un paciente y otro. Por esta razón, necesitamos herramientas más precisas que nos determinen, a la hora de la cirugía, si podemos realizar una cirugía conservadora del nervio afecto.
Los autores por último pensamos que con el advenimiento y desarrollo de dichas técnicas de monitorización, y como ya está sucediendo en Neurocirugía y cirugía de raquis, no estamos lejos de la necesidad, no solo desde el punto de vista terapéutico sino también médico-legal, de poner en manos de nuestros pacientes estas herramientas diagnósticas para conseguir un mejor resultado funcional, objetivo final de nuestro tratamiento. Nuestros resultados son excelentes desde el punto de vista funcional, con solo 2 pacientes con schwannoma con déficit sensitivo parcial, persistiendo este déficit en solo uno de los pacientes a los 3 años de seguimiento. Los mejores resultados en la enfermedad traumática los hemos obtenido en los injertos del nervio mediano.
Limitaciones del estudioLas principales limitaciones de nuestro estudio viene dadas por su metodología, al tratarse de un estudio descriptivo retrospectivo. No hemos comparado nuestros resultados con las cirugías realizadas sin monitorización, si bien cabe decir que desde el año 2009 ya no hacemos este tipo de cirugías sin MNI en nuestro centro.
ConclusionesNuestros resultados indican que el uso de la MNI en la cirugía del nervio periférico es una técnica útil especialmente indicada en la cirugía secundaria de lesiones traumáticas en las que la clínica y la neurofisiología convencionales informan de lesión neurológica irreversible, siendo necesarios estudios prospectivos comparativos para asegurar que se trata de una técnica fundamental e indispensable en la totalidad de la cirugía del nervio periférico.
Nivel de evidenciaNivel de evidencia IV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.