Existen numerosas publicaciones sobre la planificación preoperatoria en los reemplazos de cadera electivos con resultados satisfactorios. Sin embargo, ninguna de ellas se ha enfocado para el tratamiento de las fracturas de cadera. La planificación aumenta su importancia en estos pacientes debido a que la reconstrucción de la biomecánica de la cadera se ve dificultada por la ausencia de un fémur intacto.
En este trabajo se describe un método de planificación preoperatoria basado en la reproducción de la biomecánica de la cadera contralateral no fracturada, siempre y cuando ésta sea anatómicamente normal. El plan registra medidas radiológicas que se reproducen durante la cirugía para lograr una reconstrucción de la biomecánica normal de la cadera fracturada.
There are numerous reports on successful results for total hip replacement being achieved through preoperative planning. However, none of these reports have been focused on the treatment of hip fractures. Preoperative planning has increased importance in this group of patients as the correct biomechanical reconstruction of the hip is made more difficult by the absence of an intact femur.
This report describes a method for preoperative planning based on the reproduction of the biomechanics of the intact contralateral hip, if and when it is anatomically normal. The plan is based on radiological measurements that are reproduced during surgery to achieve normal biomechanical reconstruction for the fractured hip.
En las últimas 2 décadas se ha producido un incremento importante de la incidencia de fracturas de cadera en la población anciana. Este incremento se debe, entre otros factores, al aumento de la población y de la esperanza de vida1–3. Debido al aumento de su frecuencia, a su alta tasa de morbimortalidad, así como a las importantes cargas económicas que se derivan de su tratamiento y secuelas, se considera que las fracturas de cadera en el anciano son un problema grave, no sólo desde el punto de vista del paciente, sino también desde el punto de vista social y de salud pública4.
De entre las fracturas de cadera, la fractura desplazada de cuello femoral (Garden III-IV) se denomina con frecuencia “fractura sin resolver”, debido a que su tratamiento continúa siendo controvertido5 en la actualidad. Las 2 posibilidades terapéuticas existentes son la reducción y fijación de la fractura, conservando la cabeza femoral, y el reemplazo articular total o parcial de la cadera.
En la última revisión de la Cochrane6 sobre tratamiento de fracturas de cuello femoral en adultos se analizaron 17 ensayos controlados aleatorizados que incluían 2.694 pacientes con 2.697 fracturas. La fijación interna de las fracturas intracapsulares de cadera demostró una disminución significativa en el tiempo quirúrgico (promedio de 28min más corta), en la pérdida sanguínea, en la necesidad de transfusión de hemoderivados y en el riesgo de infección profunda, en comparación con la artroplastia de cadera. Sin embargo, la probabilidad de precisar una reintervención quirúrgica fue mayor tras la fijación interna que tras la artroplastia de cadera (el 36 versus el 11%). Las causas principales del fracaso de la fijación interna publicadas fueron la presencia de seudoartrosis de la fractura en un 28% de los casos (20–35%) y la necrosis avascular de la cabeza femoral, que se produjo en el 9,7% de los pacientes (5–30%). En este metaanálisis6 no se demostraron diferencias estadísticamente significativas entre ambos métodos en función de la duración de la estancia hospitalaria, la aparición de complicaciones médicas postoperatorias, el retorno al mismo lugar de residencia o la mortalidad a partir del año de la cirugía.
Más recientemente, en un metaanálisis sobre los métodos de tratamiento de las fracturas intracapsulares realizado por Rogmark y Johnell en 20067 se ha demostrado que tras la artroplastia de cadera se producen menores complicaciones graves secundarias a la cirugía (infecciones, reintervenciones), mejores resultados funcionales y menor dolor que tras la fijación interna. En este metaanálisis se han publicado unas tasas de reintervención del 14–53% tras la fijación interna frente a una tasa del 7% tras la artroplastia de cadera.
La decisión de uno u otro tratamiento depende de la edad fisiológica del paciente, que se determina en función de su capacidad de deambulación previa, estado mental y comorbilidades asociadas. Para determinar la edad fisiológica se han descrito escalas específicas8; sin embargo, una valoración detenida del paciente, basada en estos parámetros, ayudará al cirujano a decidir el tratamiento más adecuado de forma individualizada.
Resumidamente, en un paciente joven, sano y activo (edad fisiológica menor de 65 años, capaz de recibir una nueva cirugía) deben realizarse todos los esfuerzos posibles para preservar la cabeza femoral; su tratamiento de elección es la reducción y fijación interna de la fractura. En este grupo de pacientes también se han demostrado tasas de consolidación superiores que en la población de edad más avanzada, posiblemente debido a su mejor calidad ósea y mayor capacidad de consolidación. Si la osteosíntesis fracasa, la artroplastia total de cadera (THA) se indicará como tratamiento de rescate.
Por el contrario, se recomienda la realización de un reemplazo articular de cadera en pacientes con edad fisiológica superior a 65 años. Esto se debe al detrimento que supone para esta población los largos períodos en descarga y el riesgo que conlleva la necesidad de una reintervención posterior en este grupo de pacientes. También está indicado el reemplazo articular en aquellos casos en los que la calidad ósea aumente el riesgo de fracaso de la osteosíntesis, como en las fracturas patológicas por metástasis, postirradiación, osteodistrofia renal, enfermedad de Paget o hipotiroidismo. Otras indicaciones de artroplastia son la enfermedad de Parkinson y la hemiplejía espástica, por razones de tipo funcional (incapacidad de descarga).
Actualmente, los estudios9,10 se centran en la comparación entre los resultados obtenidos con la utilización de la hemiartroplastia (HA) y la THA para el tratamiento de las fracturas de cuello femoral. En estos estudios no se han evidenciado diferencias estadísticamente significativas al comparar las tasas de mortalidad a corto y largo plazo tras la realización de ambos tipos de artroplastias10,11.
La HA de cadera se caracteriza por ser un procedimiento quirúrgico de menor complejidad, tiempo quirúrgico (58,5min [HA] versus 82,4min [THA]) y coste económico que la THA. Sin embargo, debido a que tras la HA se produce un efecto erosivo de la cabeza femoral protésica sobre el cotilo (cotiloiditis erosiva), a largo plazo11, los pacientes portadores de HA presentan mayor dolor, menor movilidad (distancia caminando: 1,9km [HA] versus 3,6km [THA]) y mayor riesgo de precisar una cirugía de revisión que tras la utilización de una artroplastia total. Por esto, al comparar el coste total de estos procedimientos, incluyendo el precio de la cirugía inicial y de las complicaciones y reintervenciones posteriores, se ha demostrado el menor coste global con la utilización de la THA12.
La elección del tipo de artroplastia que se va a utilizar dependerá principalmente de la edad del paciente, estado general de salud y capacidad de deambulación previa.
En los pacientes con edad fisiológica mayor de 65 años, activos (mayor demanda funcional) y con una expectativa de vida superior a 5 años, se recomienda la realización de una THA13. Este procedimiento también será de elección en los pacientes con artritis reumatoide o coxartrosis en los que se produzca una fractura de cuello femoral.
En los pacientes ancianos con bajas demandas funcionales (deambuladores institucionalizados o deambuladores de bajo grado no institucionalizados) y expectativa de vida inferior a 5 años13, se recomienda la realización de una HA de cadera cementada10. La utilización de una HA bipolar tiene como objetivo disminuir el efecto erosivo doloroso de la cabeza femoral sobre el cotilo; sin embargo, su superioridad sobre las HA monopolares no está todavía suficientemente contrastada14,15.
Una preocupación sobre la realización de artroplastias de cadera en pacientes ancianos con fracturas de cuello femoral desplazadas es el mayor riesgo de luxación protésica (el 6–22 versus el 4–10%) y de fractura periprotésica en comparación con las artroplastias de cadera realizadas en pacientes con coxartrosis primaria16–18.
El mayor riesgo de luxación protésica en este grupo de pacientes es debido a su mayor edad, deterioro cognitivo, déficit neuromuscular, laxitud y riesgo de caídas, en comparación con la población de coxartrosis primaria. No obstante, la adecuada posición y orientación de los componentes protésicos (sobre todo el acetabular) es capaz de reducir la incidencia de luxaciones19.
Existen numerosas publicaciones que demuestran los beneficios de la planificación preoperatoria en los reemplazos de cadera electivos20,21. Sin embargo, ninguna de ellas se ha enfocado para el tratamiento de las fracturas de cadera. En estos pacientes, la restauración de la biomecánica de la cadera tiene mayor complejidad debido a que el cirujano no dispone de un fémur intacto que guíe la reconstrucción del offset y la longitud del miembro fracturado.
El objetivo de este artículo consiste en la descripción detallada de una técnica de planificación preoperatoria, adaptada al tratamiento de las fracturas de cadera, con la que se consigue una mayor precisión en la posición y orientación de los componentes protésicos. Esta técnica está basada en la reproducción de la biomecánica de la cadera contralateral sana (no fracturada) y permite reproducir con precisión la orientación y posición de los componentes mediante la utilización de medidas de referencia22,23.
Anamnesis y examen físicoLa anamnesis y el examen físico detallados ayudan a decidir el tipo de artroplastia (total o parcial), método de fijación y diseño del implante más adecuados para el paciente. Es fundamental conocer su edad, enfermedades concomitantes, medicación habitual, historia de intervenciones quirúrgicas, presencia y grado de deterioro cognitivo, nivel de actividad previo a la fractura, afectación de otras articulaciones vecinas y su expectativa de vida.
El método de planificación preoperatoria descrito en este trabajo se basa en la reproducción de la biomecánica de la cadera contralateral (no fracturada). Por este motivo, es esencial la exploración física minuciosa de esta cadera para descartar la presencia de cualquier tipo de enfermedad congénita o adquirida que pueda afectar a la planificación. Además, se debe interrogar al paciente sobre la presencia de alteraciones en la marcha o dismetría de miembros previas a la fractura.
En aquellos pacientes con riesgo aumentado de luxación protésica24 (pacientes octogenarios, con gran deterioro cognitivo o con enfermedades neuromusculares) pueden utilizarse cabezas protésicas de mayor diámetro25 o HA. En pacientes con mala calidad ósea es preferible el uso de una fijación femoral cementada, y en aquéllos con mayor riesgo de infección (diabéticos, inmunodeprimidos) se puede optar por la utilización de antibióticos en el cemento.
Estudio radiológicoLas radiografías deben ser de buena calidad, obtenidas en una posición determinada y con una magnificación conocida. Si uno o más de estos importantes requisitos no se cumplen, el plan preoperatorio será impreciso. En el paciente fracturado, un buen control del dolor facilita la realización de un estudio radiológico adecuado.
En la mayoría de los pacientes, la planificación se puede realizar basada en una radiografía anteroposterior (AP) de pelvis centrada en la sínfisis pubiana en la que se observen 15 a 17 cm de diáfisis femoral.
El paciente debe colocarse en decúbito supino y con la cadera sana en 15° de rotación interna (AP pura de fémur). Este gesto neutraliza la anteversión fisiológica del cuello femoral y permite observar el verdadero offset de la cadera sana.
La magnificación de las radiografías y de las plantillas de los implantes protésicos deben ser iguales. Para obtener una magnificación aproximada del 20±6% [2 DE]6, el foco de rayos se sitúa a 1 m de distancia de la mesa radiológica, y la placa radiográfica se sitúa 5cm por debajo de la mesa (ranura de la camilla de radiografías); la distancia total entre la fuente de rayos y la placa de impresión es de entre 115–120cm.
Previamente al plantillado, se debe estudiar detenidamente la calidad radiológica, la posición de las estructuras visibles. La calidad radiológica debe permitir al cirujano visualizar con detalle la estructura ósea cortical y trabecular de la pelvis y el fémur. La densidad ósea del cotilo y del fémur27 guían en la elección del sistema de fijación de los implantes (cementación del vástago femoral, utilización de tornillos en el componente acetabular). Además, el estudio de la estructura trabecular del cuello femoral fracturado acompañado de una anamnesis detallada pueden ayudar a sospechar la existencia de una fractura patológica, con sus consiguientes implicaciones terapéuticas y pronósticas.
En una radiografía de frente estricto, el centro del sacro, del cóccix y de la sínfisis pubiana están alineados, y las imágenes de los orificios obturadores son simétricas. Esto no se cumple en las radiografías con rotación pélvica y genera errores de plantillado. Si el tubo de rayos no está orientado correctamente o el paciente presenta una grave contractura en flexión u oblicuidad pélvica, la imagen radiográfica obtenida puede ser de tipo inlet, con la consecuente distorsión de las estructuras óseas que dificulta la realización del plantillado. A nivel femoral, la visualización del trocánter menor ayuda a determinar el grado de rotación de la cadera. Si la imagen de la cadera sana no se obtiene en 15–20° de rotación interna, el offset calculado será menor que el verdadero, e introducirá error en la planificación y la consecuente alteración en la biomecánica de la cadera.
PlantilladoSe describe en primer lugar el método de plantillado para el tratamiento de las fracturas de cuello femoral que precisan de una artroplastia total, y posteriormente se dedica un breve apartado al plantillado de la HA de cadera.
Para el plantillado de los componentes se deben utilizar plantillas con una magnificación similar a la obtenida en las imágenes radiográficas. Las casas comerciales asumen una amplificación fija para los individuos españoles de un 15–20%, y en general, las plantillas suministradas conllevan esta amplificación.
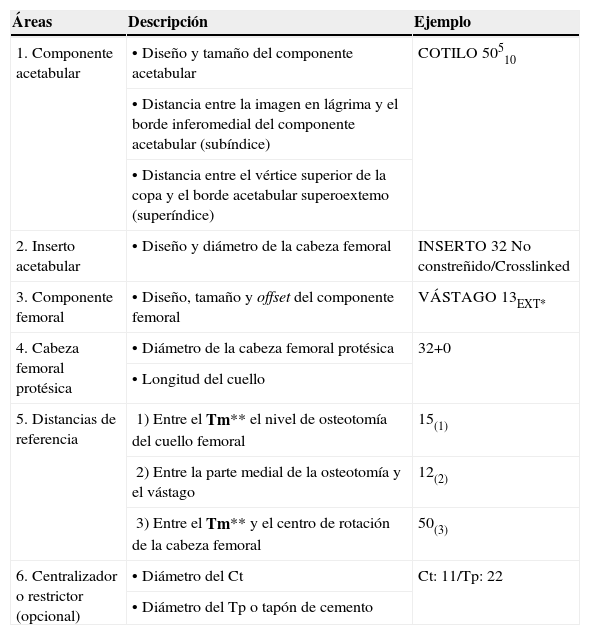
Se debe registrar de forma metódica la información obtenida durante el proceso de plantillado. Esta nota incluye en orden cronológico (primero el cotilo y segundo el fémur) el diseño, tipo y tamaño de los implantes que se van a utilizar y las mediciones para tomar durante la cirugía para reproducir el plan intraoperatoriamente. Para facilitar y agilizar la cirugía, todo el equipo quirúrgico debe estar familiarizado con el significado de estas anotaciones (tabla 1).
| Áreas | Descripción | Ejemplo |
| 1. Componente acetabular | •Diseño y tamaño del componente acetabular | COTILO 50510 |
| •Distancia entre la imagen en lágrima y el borde inferomedial del componente acetabular (subíndice) | ||
| •Distancia entre el vértice superior de la copa y el borde acetabular superoextemo (superíndice) | ||
| 2. Inserto acetabular | •Diseño y diámetro de la cabeza femoral | INSERTO 32 No constreñido/Crosslinked |
| 3. Componente femoral | •Diseño, tamaño y offset del componente femoral | VÁSTAGO 13EXT* |
| 4. Cabeza femoral protésica | •Diámetro de la cabeza femoral protésica | 32+0 |
| •Longitud del cuello | ||
| 5. Distancias de referencia | 1) Entre el Tm** el nivel de osteotomía del cuello femoral | 15(1) |
| 2) Entre la parte medial de la osteotomía y el vástago | 12(2) | |
| 3) Entre el Tm** y el centro de rotación de la cabeza femoral | 50(3) | |
| 6. Centralizador o restrictor (opcional) | •Diámetro del Ct | Ct: 11/Tp: 22 |
| •Diámetro del Tp o tapón de cemento |
Ct: centralizador; Tm: trocánter menor; Tp: restrictor.
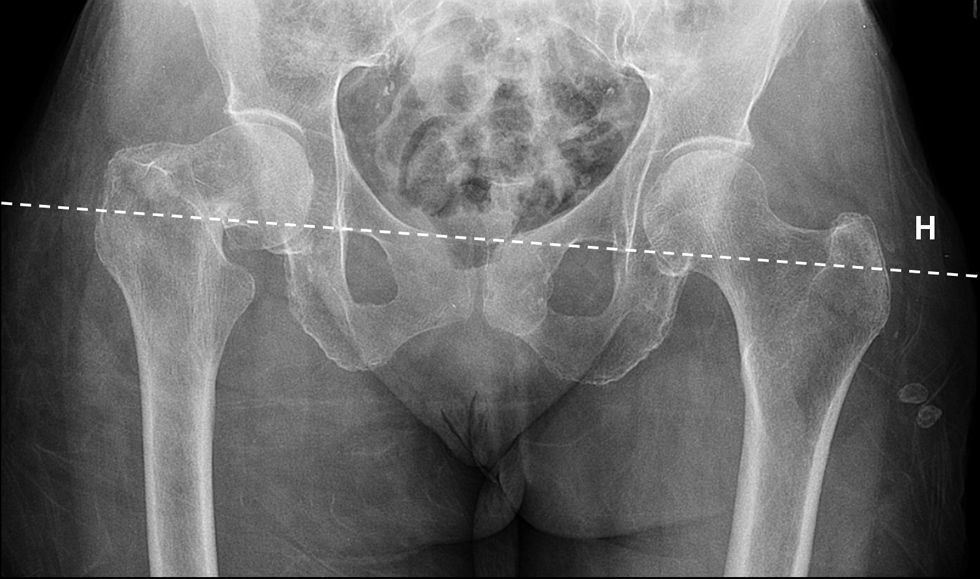
El plantillado acetabular comienza con el trazado de una línea horizontal de referencia para determinar la inclinación correcta del componente acetabular. En la gran mayoría de los casos puede trazarse esta línea a través de los vértices inferiores de ambas imágenes en lágrima28 (fig. 1). Si las imágenes en lágrima no fueran claramente visibles, pueden utilizarse los vértices inferiores de las articulaciones sacroilíacas. Los vértices inferiores de las tuberosidades isquiáticas están frecuentemente distorsionados por rotaciones pélvicas, fracturas previas o variaciones anatómicas.
Si ambos cotilos tienen forma y tamaño similar, el plantillado del componente acetabular puede realizarse en el cotilo de la cadera no fracturada. El plan comienza marcando el borde acetabular superoexterno, la línea ilioisquiática y la imagen en lágrima. La visualización del margen anterior y posterior del cotilo puede guiar al cirujano en la determinación correcta de la anteversión acetabular durante la cirugía.
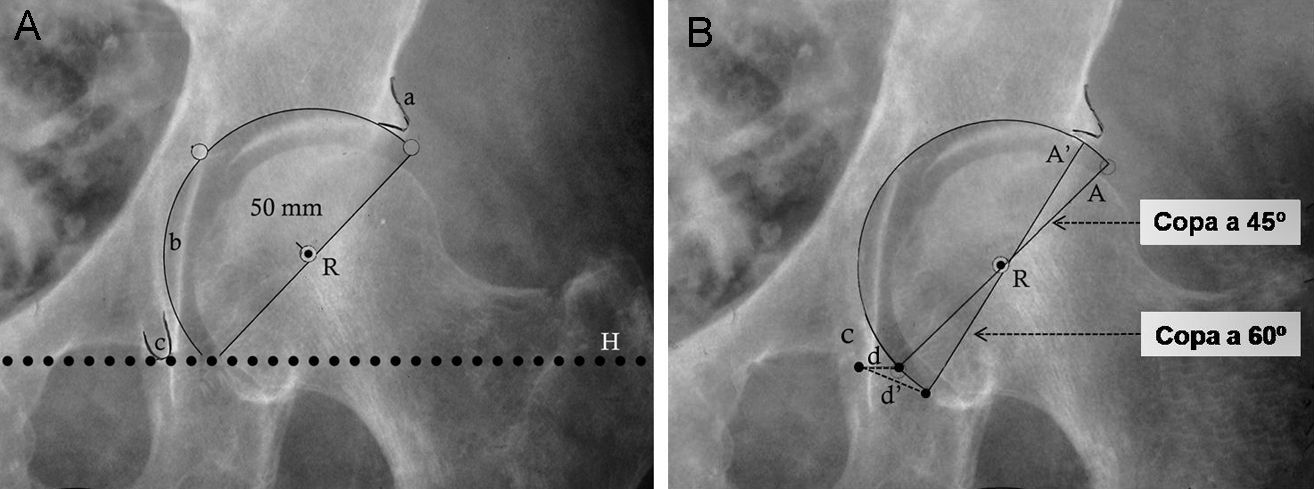
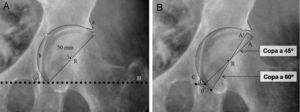
Posteriormente, se determinan la posición y el tamaño del componente acetabular utilizando las plantillas con magnificación adecuada. Mediante la superposición de las plantillas del componente acetabular se busca aquel tamaño que cumpla con las siguientes condiciones: copa con abducción aproximada de 45°, borde medial de ésta, aproximada a la línea ilioisquiática, borde inferior aproximado a la línea horizontal de referencia interlagrimal con el que se obtenga una máxima cobertura lateral ósea con mínima remoción de hueso esclerótico subcondral (fig. 2A). Tras la selección del tamaño y posición del componente acetabular se marca en la radiografía el centro de rotación y el perfil de la copa.
Plantillado del componente acetabular. A) La imagen muestra un componente acetabular de tamaño y posición adecuados. B) Imagen que muestra la utilidad de la distancia (d) entre el borde inferomedial del componente acetabular y el vértice inferior de la imagen en lágrima para determinar la inclinación acetabular precisa. La distancia (d) en una copa con una inclinación correcta (45°) aumenta a una distancia (d’) con el incremento de la inclinación del componente acetabular (A’ a 60° de inclinación). Por otra parte, con el incremento de la inclinación de la copa acetabular, reduciremos la cobertura lateral de la copa, que se ve reflejado en la menor distancia entre el vértice superior de la copa y el borde acetabular superoexterno. a: borde acetabular superoexterno; A: componente acetabular con inclinación correcta; A’: componente acetabular verticalizado; b: línea ilioisquiática; c: imagen en lágrima; d: distancia del componente acetabular correcto; d’: distancia del componente acetabular verticalizado; e: distancia entre el vértice superior de la copa y el borde acetabular superoexterno; H: línea horizontal de referencia; R: centro de rotación del componente acetabular.
Para lograr reproducir intraoperatoriamente la inclinación del componente acetabular planificado deben tomarse 2 medidas radiológicas con la regla magnificada. La primera es la distancia entre el vértice inferior de la copa dibujada y la imagen en lágrima (fig. 2B). Esta distancia suele ser corta (5–10mm) y muy sensible a los cambios de inclinación de la copa. La segunda medida es la distancia entre el vértice superior de la copa acetabular y el borde acetabular superoexterno.
Finalmente, en la primera línea de la nota quirúrgica se anota el tipo y tamaño del componente acetabular, acompañados de las 2 medidas descritas anteriormente como subíndice y superíndice (tabla 1). En la segunda línea se anotan las características del inserto acetabular (material del inserto, diámetro de la cabeza protésica).
Si existieran diferencias anatómicas entre ambos cotilos, es necesario realizar el plantillado en el cotilo sano y en el fracturado y asegurarse que ambos se encuentren a la misma altura. De no ser así, el cirujano debe hacer los ajustes necesarios en la altura del componente femoral para igualar la longitud de los miembros.
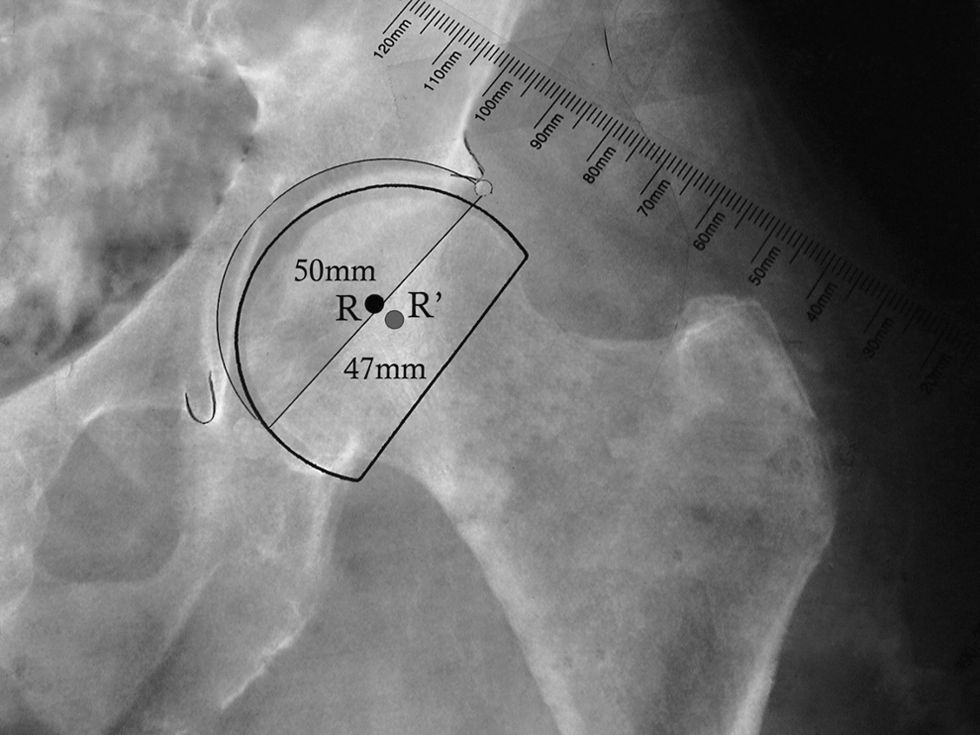
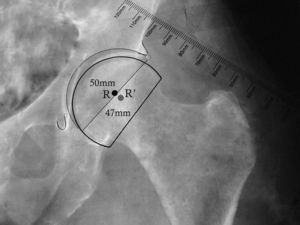
En las artroplastias bipolares, el plantillado del componente acetabular se reemplaza por el de la copa bipolar. El diámetro externo de esta copa debe ser ligeramente mayor al diámetro óseo de la cabeza femoral (fig. 3). Una vez marcado el centro de rotación de la copa bipolar, se procede al plantillado femoral. Frecuentemente, al utilizar una HA, el centro de rotación es ligeramente más caudal y lateral que al realizar un reemplazo total.
Plantillado de la copa bipolar. La imagen muestra la posición más caudal y lateral del centro de rotación de la copa bipolar en comparación con el centro de rotación del componente acetabular. También se muestra el menor diámetro de la copa bipolar (47mm) al compararlo con el componente acetabular (50mm). R: centro de rotación de componente acetabular; R’: centro de rotación de copa bipolar.
Los objetivos del plantillado del componente femoral son la obtención de una correcta fijación y alineación del vástago femoral en el interior del canal, la restauración del offset y la longitud del miembro.
En la mayoría de los pacientes con fractura de cadera no existe una dismetría de miembros preoperatoria. Si el paciente presenta una dismetría previa a la fractura en la que el miembro fracturado era más corto que el sano, el cirujano puede elegir alargar el miembro durante la cirugía. Sin embargo, si previamente el miembro fracturado era más largo que el sano, es importante informar al paciente que la dismetría puede persistir después del reemplazo protésico debido a que el acortamiento intencional del miembro fracturado puede resultar en una inestabilidad protésica no deseable.
La longitud del miembro fracturado está determinada por el nivel de inserción del tallo femoral y la longitud de la cabeza protésica.
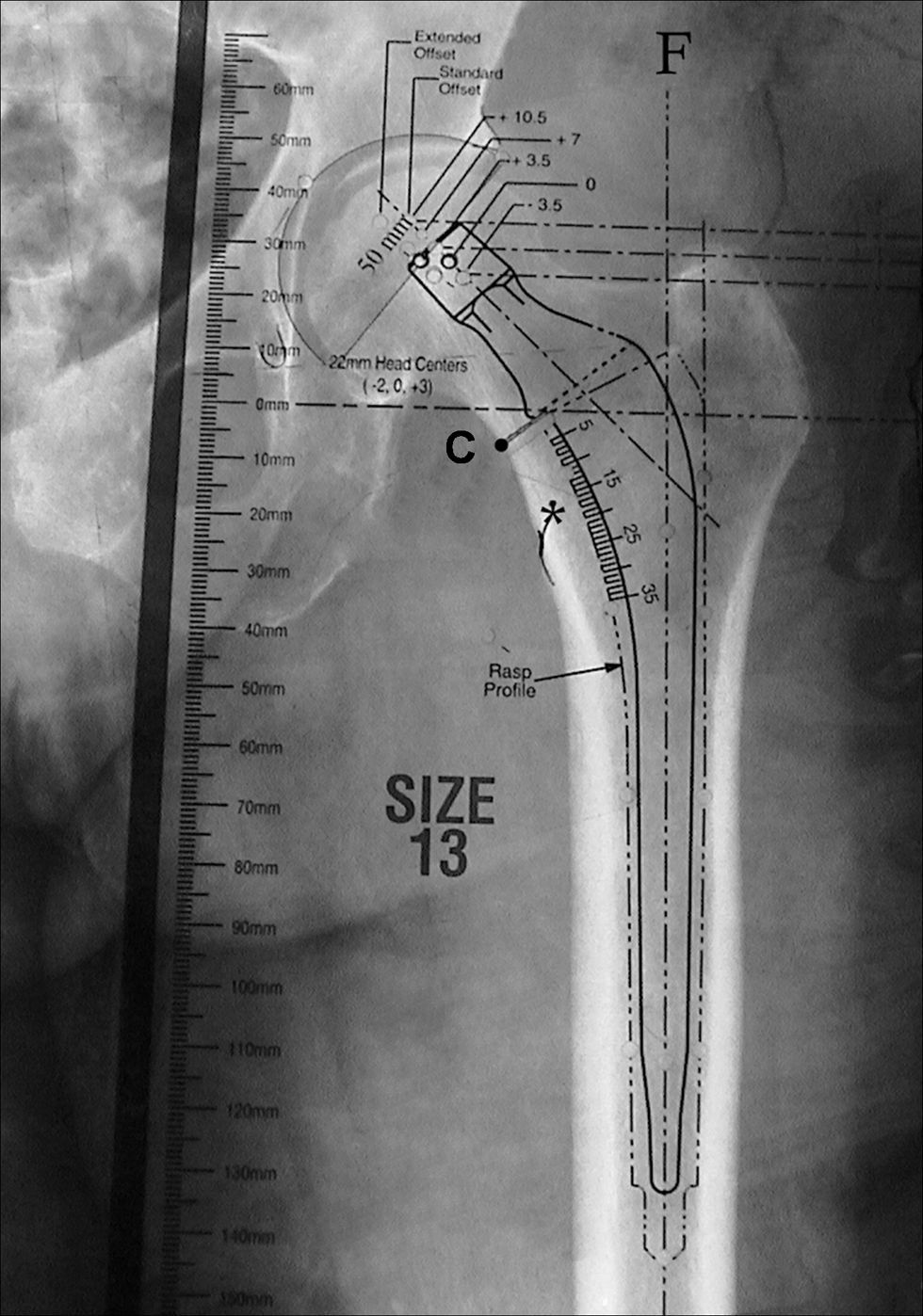
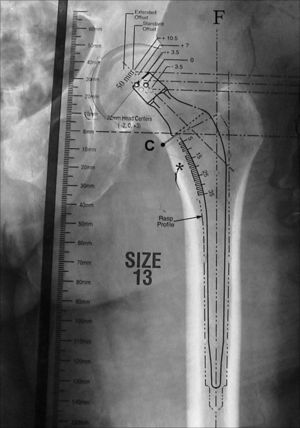
Para seleccionar el tamaño adecuado del vástago femoral se superponen las plantillas del componente femoral hasta seleccionar aquélla cuyo eje se alinee con el eje de la diáfisis femoral y cuyo tallo mejor se ajuste a la metáfisis proximal del fémur y al canal intramedular (paredes internas del fémur). Ante la alta incidencia de osteoporosis en los pacientes ancianos con fractura de cadera, preferimos utilizar una fijación cementada del vástago femoral, por lo que el tamaño seleccionado debe permitir un manto de cemento homogéneo y circunferencial de unos 2 mm (habitualmente marcado en la plantilla con línea discontinua) (fig. 4).
Imagen que muestra el correcto plantillado de un componente femoral en el que el eje del vástago se encuentra alineado con el eje de la diáfisis femoral (F) y cuyo tamaño permite un manto de cemento homogéneo y circunferencial (marcado con la línea de puntos) en la diáfisis femoral. *: zona proximal del trocánter menor; C: zona de elección de la osteotomía del cuello femoral; F: eje de la diáfisis femoral.
Una vez determinado el tamaño del tallo femoral se debe elegir el offset del componente femoral cuyo centro de rotación más se aproxime en la horizontal al centro de rotación acetabular (offset normal, offset extendido). Si el centro de rotación de la cabeza femoral se encuentra medial al centro de rotación de la copa acetabular, el offset aumenta. Contrariamente, el offset disminuye si el centro de rotación de la cabeza femoral es más lateral que el centro de rotación de la copa acetabular.
Posteriormente, desplazaremos ligeramente la plantilla dentro del eje femoral hasta encontrar aquel tamaño de cuello femoral (se mantendrá el offset seleccionado) con el que se consiga aproximar al máximo, en la vertical, el centro de rotación femoral y el acetabular marcado. El cirujano debe intentar utilizar cabezas protésicas que no descubran el cono Morse o que no tengan vainas que generen una relación cuello-cabeza desfavorable.
Una vez determinado el tamaño, el offset, la longitud del cuello y el nivel de implantación del componente femoral, se debe trazar su perfil en la radiografía de pelvis y destacar el nivel de la osteotomía femoral y el centro de rotación femoral. En la tercera línea de la nota quirúrgica se registrará el diseño, el tamaño y el offset del vástago femoral. El diámetro de la cabeza femoral y la longitud del cuello protésicos se anotarán en la cuarta línea de la nota quirúrgica (tabla 1).
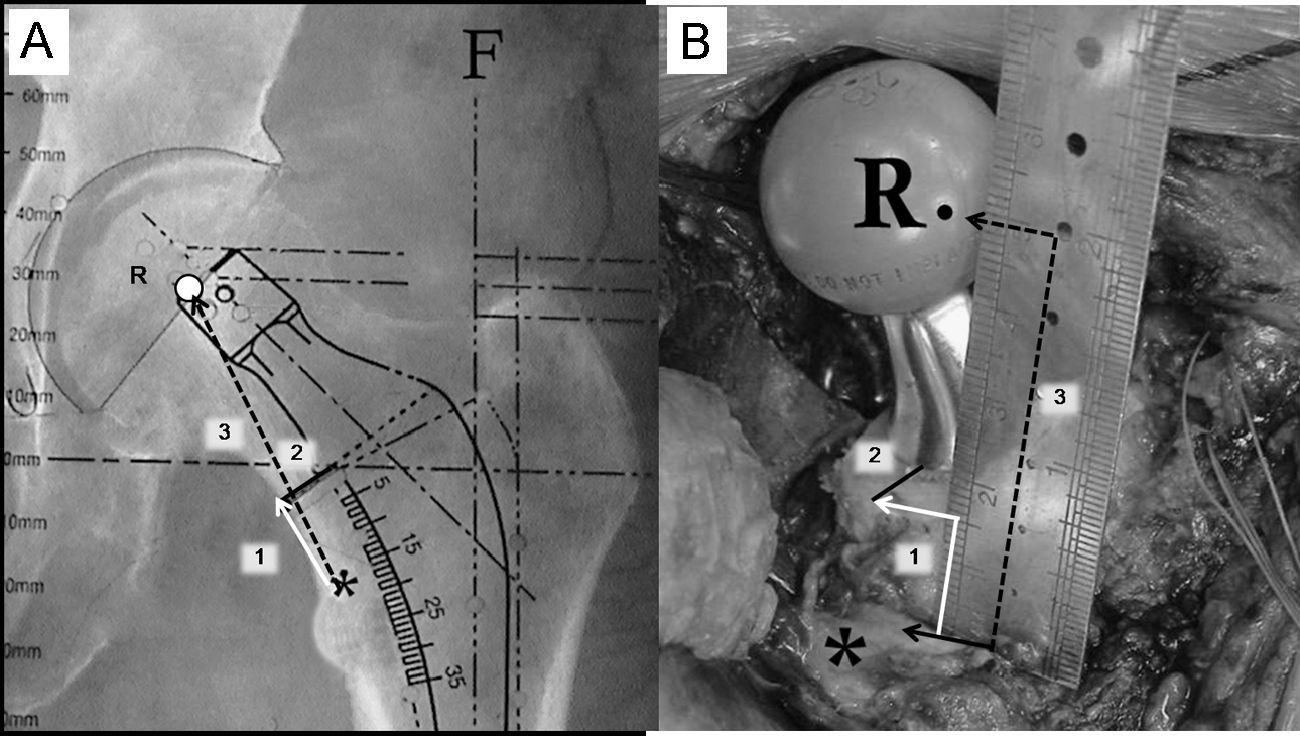
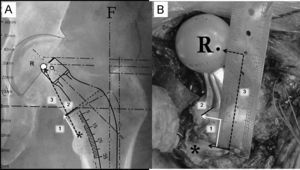
Para reproducir intraoperatoriamente la posición del vástago femoral y determinar el nivel de la osteotomía del cuello deben registrarse 3 medidas utilizando la regla magnificada que suele encontrarse en las plantillas de magnificación seleccionada (fig. 5A). La primera es la distancia entre el vértice proximal del trocánter menor y la zona medial de la osteotomía cervical. Esta medida es fundamental para determinar intraoperatoriamente el nivel de osteotomía cervical. La segunda medida es la distancia entre el vértice proximal del trocánter menor y el centro de rotación de la cabeza femoral protésica seleccionada. Esta medida es fundamental para reproducir el offset y la longitud del miembro elegida. Finalmente, se calcula la distancia entre la parte más medial del cuello femoral y la zona de implantación del vástago femoral a la altura de la osteotomía cervical. Esta tercera medida es fundamental para evitar una posición del tallo en varo o valgo.
A) En esta imagen radiográfica se muestra la forma de calcular las distancias de referencia de la planificación del componente femoral. 1: distancia entre el ángulo superior del trocánter menor y la zona de osteotomía del cuello femoral; 2: distancia entre la zona medial de la osteotomía femoral y el vástago; 3: distancia entre el ángulo superior del trocánter menor y el centro de rotación de la cabeza protésica. B) Imagen intraoperatoria que muestra la forma de reproducir las medidas radiográficas de referencia sobre el fémur del paciente, tras la colocación de los componentes de prueba. Tras la identificación del centro de rotación de la cabeza femoral de prueba, del ángulo proximal del trocánter menor y del borde medial de la osteotomía cervical se utiliza una regla estéril para calcular las distancias previamente descritas (6A). *: zona proximal del trocánter menor; F: eje de la diáfisis femoral; R: centro de rotación de la cabeza protésica.
Otra medida que puede utilizarse es la distancia vertical entre el centro de rotación de la cabeza femoral y la punta del trocánter mayor, como referencia complementaria para asegurar la posición correcta del centro de rotación del vástago femoral. Estas medidas se registran en la nota quirúrgica (tabla 1). Si fuera necesario, también puede anotarse el diámetro del centralizador distal del tallo y el del tapón restrictor de cemento.
Puede utilizarse la radiografía lateral de la cadera sana para planificar el lugar correcto de entrada del vástago femoral a nivel AP mediante el uso de la plantilla lateral femoral.
Ejecución del planLa meticulosa reproducción de las medidas de la nota quirúrgica durante la cirugía aumenta la precisión de la colocación de los componentes seleccionados. Por eso es imprescindible contar con un bolígrafo marcador estéril y una regla milimetrada durante el procedimiento quirúrgico.
El posicionamiento adecuado de la pelvis en la mesa operatoria reduce la variabilidad en la orientación del componente acetabular. Tras el abordaje quirúrgico se localiza el ángulo proximal del trocánter menor y se marca la distancia planificada de la osteotomía (fig. 5A). En ocasiones, la línea de fractura puede estar por debajo del nivel de la osteotomía cervical planificado; en estos casos, el cirujano deberá realizar las modificaciones de técnica quirúrgica o implante necesarias para reproducir la distancia entre el trocánter menor y el centro de rotación femoral.
El componente acetabular debe colocarse entre 40–50° de abducción29 y 15±10° de anteversión y el tamaño de componente acetabular planificado orienta el inicio del fresado del cotilo. Para reproducir de forma precisa la orientación del componente acetabular se utilizan las medidas de referencia registradas en la nota quirúrgica. Es necesario disponer de un instrumento fino milimetrado para calcular estas medidas debido a la profundidad y estrechez de la zona. Tras la colocación del componente acetabular de prueba en la posición adecuada, se palpa la imagen en lágrima (borde más inferomedial de la pared acetabular) con el instrumento fino y se mide la distancia entre este punto y el borde inferior del componente acetabular.
Si esta medida es mayor que la registrada durante la planificación, indica que el componente acetabular está más verticalizado30 y será posible corregir su posición (fig. 2B). Por el contrario, si la medida es menor que la planificada, indica que el componente acetabular está más horizontalizado. La reproducción de la distancia entre el vértice superior de la copa y el margen superoexterno del cotilo (cobertura lateral) confirmará la inclinación adecuada del componente.
Durante el fresado femoral, el cirujano debe guiarse por las anotaciones del plan (tamaño) y por la sensación táctil obtenida.
Una vez introducido el vástago femoral de prueba de tamaño, offset y longitud de cuello elegidos, se debe medir la distancia entre el vértice superior del trocánter menor y el centro de rotación de la cabeza femoral (marcado con rotulador) (fig. 5B). Si esta distancia no coincide con la planificada deben hacerse los ajustes necesarios (offset, longitud de cuello y altura del vástago) para lograr reproducirla intraoperatoriamente.
Finalmente, se reduce la prótesis de cadera con el vástago y la cabeza de prueba, se revisa su estabilidad, el equilibrio de las partes blandas y su rango de movilidad completo. Tras esta prueba, el cirujano confirma los componentes femorales definitivos o realiza los ajustes pertinentes para obtener una adecuada estabilidad y movilidad protésica.
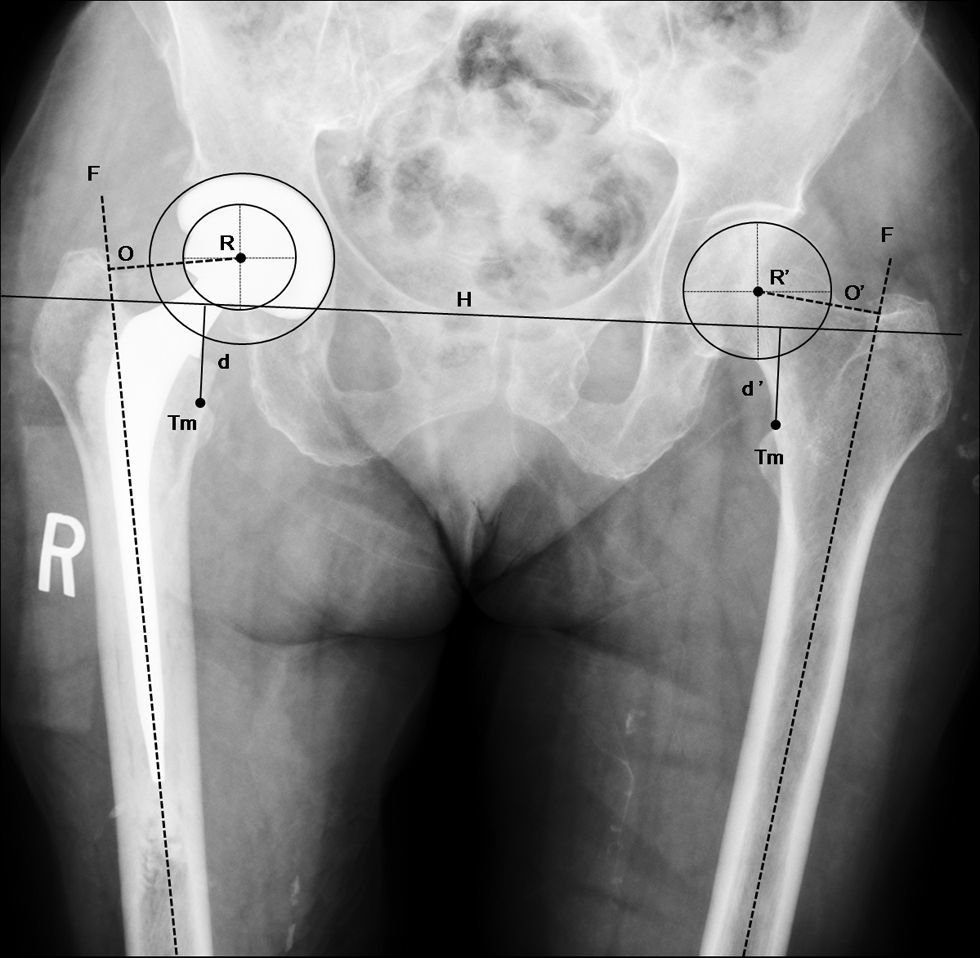
En las radiografías postoperatorias se comprueba la correcta posición y fijación de los implantes. También se comprueba la adecuada restauración de la biomecánica de la cadera fracturada, comparándola con la cadera contralateral, que se ha utilizado como guía de reconstrucción (fig. 6).
Imagen radiográfica anteroposterior de pelvis que muestra una artroplastia total de cadera por fractura (paciente de la fig. 1) implantada tras la realización de la planificación preoperatoria (tabla 1). Se comprueba la correcta posición de los implantes y la restauración anatómica de la biomecánica de la cadera fracturada (centro de rotación, offset [O=O’] y longitud del miembro [d=d’]). d: distancia vertical desde la línea de referencia al ángulo proximal del trocánter menor de la cadera operada; d’: distancia normal; F: eje de la diáfisis femoral; H: línea de referencia horizontal entre ambas imágenes en lágrima; O: offset de la cadera operada; O’: offset normal; R: centro de rotación de la artroplastia; R’: centro de rotación de la cadera normal; Tm: trocánter menor.
Existen numerosas publicaciones sobre la planificación preoperatoria en los reemplazos de cadera electivos con resultados satisfactorios20,21,31. Sin embargo, no se ha enfocado ninguna de estas técnicas para el tratamiento de las fracturas de cadera.
En estos pacientes, la restauración de la biomecánica de la cadera tiene mayor complejidad debido a que el cirujano no dispone de un fémur intacto que guíe la reconstrucción del offset y la longitud del miembro fracturado. El incremento del offset fisiológico impide que el cirujano realice una reparación adecuada de las estructuras capsulares, tendinosas y musculares dañadas durante el traumatismo o el abordaje quirúrgico, y pone en peligro la estabilidad protésica32. Paralelamente, este incremento puede generar contracturas en abducción y rotación interna con la consecuente alteración del patrón de la marcha. La disminución del offset o el acortamiento del miembro incrementan el riesgo de inestabilidad y claudicación a la marcha33,34. Finalmente, si se produce un alargamiento excesivo del miembro pueden generarse contracturas, alteraciones de la marcha y ser causa de litigio35. Para restaurar la biomecánica de la cadera fracturada, este método de planificación se basa en la reproducción de la cadera contralateral sana (no fracturada).
Otra particularidad de esta técnica de planificación consiste en la utilización de puntos y medidas de referencia fácilmente identificables en la radiografía e intraoperatoriamente. Gracias a la utilización de estas medidas es posible reproducir intraoperatoriamente, con precisión, la posición y orientación de los componentes previamente planificada.
Se utilizan las imágenes en lágrima durante la orientación del componente acetabular, por tratarse de los puntos de referencia anatómicos más precisos y constantes de la pelvis28. La imagen en lágrima representa el borde inferomedial de la pared acetabular, su cara externa se corresponde con el trasfondo acetabular (zona más profunda e inferior del acetábulo) y su cara interna corresponde a la porción interna del muro acetabular. En la planificación del componente femoral se utiliza el ángulo superior del trocánter menor por tratarse de un punto de referencia más fácil de localizar a nivel intraoperatorio que su punto medio, utilizado en otras técnicas de planificación31.
Al utilizar este método en artroplastias de cadera electivas y por fractura, hemos sido capaces de reproducir el centro de rotación de la cadera protésica±4mm en el 93,5% de los casos22. La dismetría de miembros obtenida tras el reemplazo articular en fracturas mediante la utilización de este método ha sido de 3,27mm (rango: –3 a 8mm). El 77,3% de los pacientes intervenidos tras fractura de cadera presentó una dismetría menor o igual a 5mm. Se trata de un mayor porcentaje de dismetría en comparación con la población con coxartrosis (el 87,3–86% de dismetrías ≤5mm). Esta diferencia es debida a que en los pacientes con fractura de cadera no es posible determinar con anterioridad la presencia de dismetrías de miembros y, por lo tanto, no es posible corregirlas con exactitud mediante la artroplastia.
No hemos estudiado de forma directa la reducción del índice de luxaciones protésicas; sin embargo, se ha demostrado una mejoría en la precisión de colocación del componente acetabular mediante la utilización de esta técnica30. Se obtuvo una inclinación del componente acetabular dentro de la zona de seguridad (40±10°) en el 100% de los casos y entre 43,8 y 45,4° en el 95%. Además, con el uso de las medidas de referencia femoral se ha obtenido una alineación del vástago femoral neutral en el 87,7% de los pacientes, en varo (<4°) en el 8% y en valgo (<2°) en el 4%.
Otra de las ventajas de la utilización de este método de planificación consiste en la determinación previa del diseño y tamaño de los implantes para utilizar durante la cirugía. Se acertó en el tamaño±1 del componente acetabular y femoral en el 97,4% de los casos. Estos datos permiten reducir el tiempo quirúrgico debido a que el equipo conoce el significado de la nota quirúrgica y es capaz de preparar los implantes con anterioridad.
Otros autores con técnicas de planificación similares han conseguido predecir el tamaño de los implantes acetabulares entre un 62–90% y el de los componentes femorales cementados entre un 78–92%28,29.
Se considera que gracias a la utilización de este método se puede prever la aparición de posibles complicaciones durante la cirugía. Algunas de estas posibles complicaciones son la necesidad de injerto óseo en zonas con grandes defectos, cementación en casos de mala calidad ósea, evitar falsas vías femorales o fracturas periprotésicas mediante la planificación de la correcta orientación fresado del canal femoral, etc.
Como limitaciones de la utilización de este método destaca la presencia de una cadera contralateral anómala, artrítica o con deformidades congénitas (displasias) o adquiridas (postraumáticas). Sin embargo, en los casos en los que la cadera contralateral se haya reemplazado previamente y su biomecánica sea adecuada, el cirujano puede utilizarla como referencia para el plantillado de la cadera fracturada.
La correcta planificación de la posición y predicción del tamaño de los componentes puede afectarse por múltiples factores que deben conocerse con el objetivo de minimizar el riesgo de error. Pueden utilizarse sistemáticamente marcadores de magnificación para reducir el riesgo de error de magnificación. Un equipo de técnicos de radiología entrenados debe realizar las radiografías. El hábito corporal de los pacientes puede afectar la magnificación, que será ligeramente menor en pacientes muy delgados (15%), y ligeramente mayor en pacientes obesos (25%). El conocimiento de este detalle permitirá la realización de los ajustes necesarios para aumentar la precisión del plan. Una magnificación incorrecta afectará la correlación entre las medidas radiológicas y las intraoperatorias. Es necesario conocer que la medida más susceptible de ser afectada por estas variaciones es la medida más larga (distancia entre el trocánter menor y el centro de rotación de la cadera).
Actualmente, en la mayor parte de los hospitales las imágenes radiológicas están digitalizadas, lo que ha incrementado el interés de la planificación digital frente a la analógica21,37. Las bases del método de planificación que describimos pueden adaptarse a la planificación digital, y con la consiguiente obtención de una magnificación conocida aumentará la precisión de esta técnica.
Como conclusión, consideramos que este método de planificación preoperatoria es simple, reproducible, permite una orientación adecuada de los componentes y restablece la biomecánica de la cadera fracturada durante el reemplazo articular de cadera.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Por favor, referencie en el texto las siguientes citas




![Imagen radiográfica anteroposterior de pelvis que muestra una artroplastia total de cadera por fractura (paciente de la fig. 1) implantada tras la realización de la planificación preoperatoria (tabla 1). Se comprueba la correcta posición de los implantes y la restauración anatómica de la biomecánica de la cadera fracturada (centro de rotación, offset [O=O’] y longitud del miembro [d=d’]). d: distancia vertical desde la línea de referencia al ángulo proximal del trocánter menor de la cadera operada; d’: distancia normal; F: eje de la diáfisis femoral; H: línea de referencia horizontal entre ambas imágenes en lágrima; O: offset de la cadera operada; O’: offset normal; R: centro de rotación de la artroplastia; R’: centro de rotación de la cadera normal; Tm: trocánter menor. Imagen radiográfica anteroposterior de pelvis que muestra una artroplastia total de cadera por fractura (paciente de la fig. 1) implantada tras la realización de la planificación preoperatoria (tabla 1). Se comprueba la correcta posición de los implantes y la restauración anatómica de la biomecánica de la cadera fracturada (centro de rotación, offset [O=O’] y longitud del miembro [d=d’]). d: distancia vertical desde la línea de referencia al ángulo proximal del trocánter menor de la cadera operada; d’: distancia normal; F: eje de la diáfisis femoral; H: línea de referencia horizontal entre ambas imágenes en lágrima; O: offset de la cadera operada; O’: offset normal; R: centro de rotación de la artroplastia; R’: centro de rotación de la cadera normal; Tm: trocánter menor.](https://static.elsevier.es/multimedia/18884415/0000005400000002/v1_201305031814/S1888441509002914/v1_201305031814/es/main.assets/thumbnail/gr6.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
