El acetato de eslicarbazepina (ESL), junto con la carbamazepina y oxcarbazepina, pertenece a la familia de las dibenzazepinas. Las últimas guías de práctica clínica consultadas coinciden en señalar que los antidepresivos tricíclicos, duales (venlafaxina/duloxetina) y los antiepilépticos gabapentina/pregabalina, constituyen los fármacos de primera línea en el tratamiento del dolor neuropático. El tramadol, los apósitos de lidocaína al 5% y los parches de capsaicina al 8% son fármacos de segunda línea, mientras que los opioides potentes constituirían una tercera línea de tratamiento. Existen otros antiepilépticos que no tienen indicación en el dolor neuropático por las agencias reguladoras, como lamotrigina o lacosamida, pero se utilizan en la práctica clínica habitual fuera de indicación. Por otro lado, la carbamazepina está indicada en el tratamiento de la neuralgia esencial del trigémino y del glosofaríngeo.
DesarrolloTras una búsqueda bibliográfica, se realizó una revisión sobre el empleo del ESL en dolor neuropático, cefaleas y neuralgias craneales.
ConclusionesNo se dispone apenas de evidencia para recomendar el uso del ESL en dolor neuropático, cefaleas y neuralgias craneales. La mayor parte de la experiencia disponible corresponde a estudios abiertos y observacionales, sin grupo control y con bajo número de pacientes; pero los resultados favorables obtenidos invitan a seguir investigando la utilidad del ESL en dolor neuropático, cefaleas y neuralgias craneales.
Eslicarbazepine acetate (ESL), together with carbamazepine and oxcarbazepine, belongs to the dibenzazepine family. According to the latest clinical practice guidelines, tricyclic antidepressants, dual antidepressants (venlafaxine, duloxetine), and some antiepileptics (gabapentin, pregabalin) are first-line drugs for neuropathic pain; tramadol, lidocaine 5% patches, and capsaicin 8% patches are considered second-line drugs; and strong opioids constitute a third line of treatment. Such other antiepileptics as lamotrigine and lacosamide are not authorised as treatments for neuropathic pain by the regulatory agencies, but are nonetheless prescribed off-label in routine clinical practice. Carbamazepine, on the other hand, is indicated for trigeminal and glossopharyngeal neuralgia.
DevelopmentWe conducted a literature search to gather evidence on the use of ESL for neuropathic pain, headache, and cranial neuralgia.
ConclusionsEvidence is insufficient to recommend ESL for neuropathic pain, headache, and cranial neuralgia. Most of the available evidence comes from open and observational studies with small sample sizes and no control group; however, their favourable results call for further studies on the usefulness of ESL for neuropathic pain, headache, and cranial neuralgia.
El acetato de eslicarbazepina (ESL) es un fármaco antiepiléptico de tercera generación aprobado por la European Medicines Agency en 2009, por la Food and Drug Administration en 2013 y comercializado en España desde febrero del 2011. El fármaco tiene actualmente la indicación como terapia adyuvante en pacientes adultos con convulsiones de inicio parcial, con o sin generalización secundaria. La dosis inicial recomendada es de 400mg una vez por día y deberá aumentarse a 800mg una vez por día después de una o 2semanas. En función de la respuesta individual, la dosis puede incrementarse a 1.200mg una vez al día1.
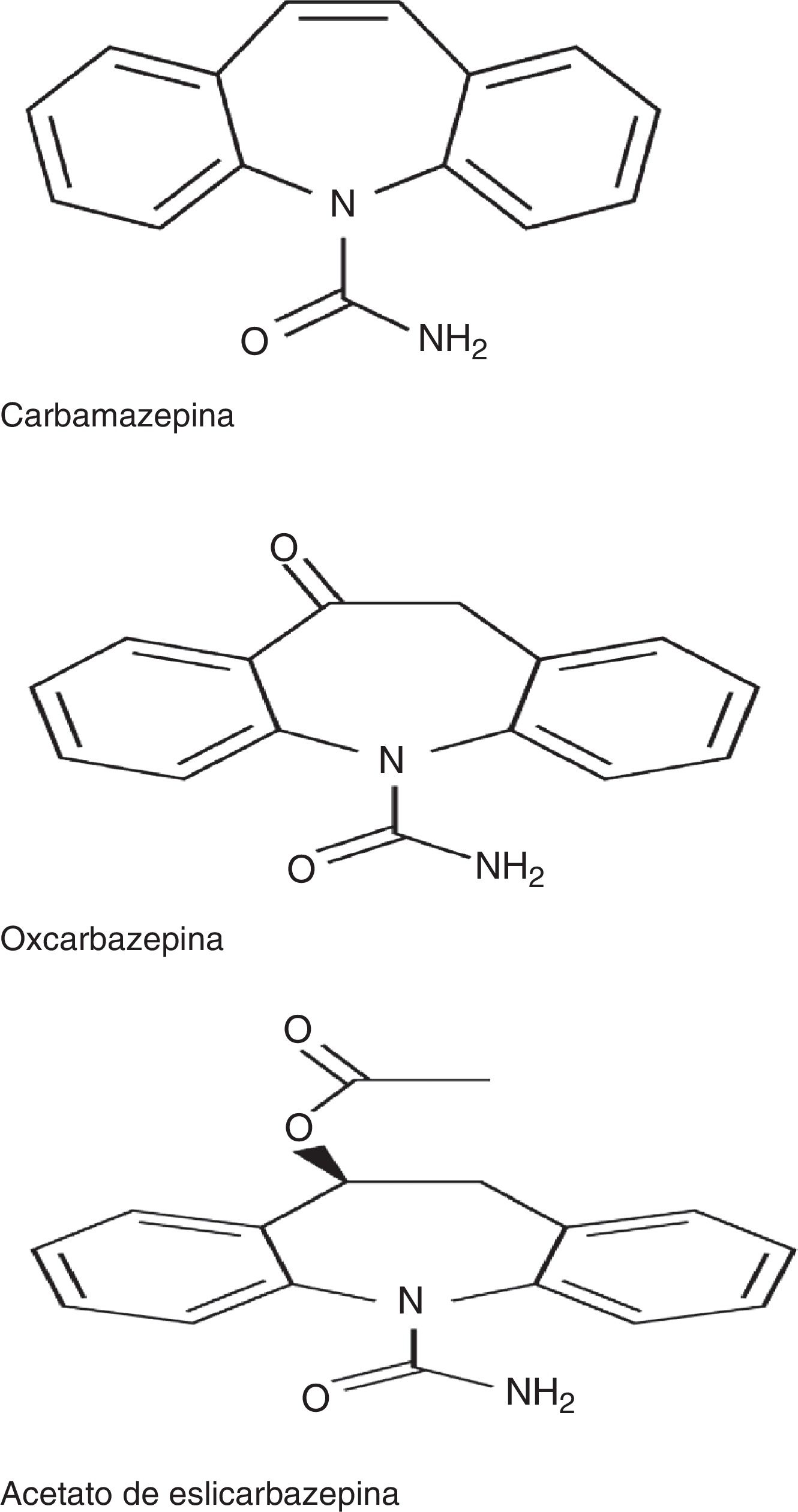
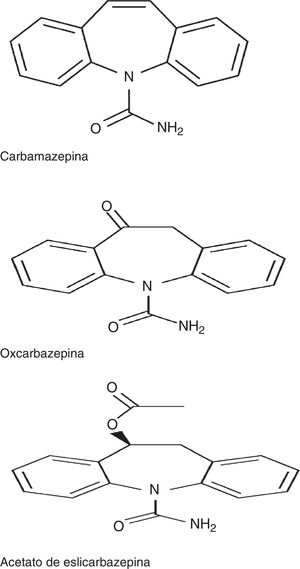
El ESL, junto con carbamazepina (CBZ) y oxcarbazepina (OXC), pertenece a la familia de las dibenzazepinas. Entre estos fármacos existen diferencias desde el punto de vista estructural, en la posición 10,11 del núcleo de las dibenzacepinas, así como desde el punto de vista de la vía metabólica: la CBZ es metabolizada a CBZ 10-11 epóxido, a diferencia de la OXC, que es metabolizada al metabolito activo S (+) licarbacepina (78,1%) y del ESL, que es metabolizado al mismo metabolito en una proporción mayor (93,9%) (fig. 1)2,3. El número de tomas diarias también es diferente: una toma para ESL y OXC de liberación prolongada (no disponible en España), 2 para OXC de liberación inmediata y CBZ de liberación prolongada (no disponible es España) y de 2 a 3 para CBZ de liberación inmediata. Además, con respecto al mecanismo de acción, el ESL presenta algunas particularidades con respecto a los otros fármacos de la familia, sintetizadas recientemente en un estudio de Soares da Silva et al.: 1) interacción selectiva con el estado inactivo de los canales de sodio voltaje dependientes (CSVD); 2) efecto en los CSVD a través de su inactivación lenta, en lugar de la inactivación rápida asociada a CBZ y OXC, y 3) inhibición de las corrientes hCaV3.2 con mayor afinidad que CBZ4.
El perfil toxicológico del ESL es moderado y recuerda al de OXC; los efectos adversos más comunes son mareos, náuseas, vómitos, somnolencia y diplopía. Tiene una semivida de eliminación de 13-24h, lo que permite una única administración oral diaria. Es un inductor leve de la isoforma CYP3A4 del citocromo P-450 y de la UDP-glucuronil- transferasa (UGT1A1). Fruto de esta actividad pueden producirse algunas interacciones de relevancia clínica con fenitoína, warfarina y anticonceptivos hormonales que contengan estrógenos1.
Por otro lado, la CBZ está indicada, además de en epilepsia, en episodio maníaco y tratamiento profiláctico del trastorno afectivo bipolar, neuralgia esencial del trigémino, neuralgia esencial del glosofaríngeo y síndrome de abstinencia al alcohol5; mientras que la OXC está indicada en el tratamiento de las crisis epilépticas parciales con o sin generalización secundaria con crisis tónico-clónicas6.
Las últimas guías de práctica clínica consultadas coinciden en señalar que los antidepresivos tricíclicos, duales (venlafaxina/duloxetina) y los antiepilépticos gabapentina/pregabalina, constituyen los fármacos de primera línea en el tratamiento del dolor neuropático. El tramadol, los apósitos de lidocaína al 5% y los parches de capsaicina al 8% son fármacos de segunda línea, mientras que los opioides potentes constituirían una tercera línea de tratamiento7.
Observamos que, salvo la CBZ, tanto el ESL como la OXC no tienen indicación en el dolor neuropático, en cefaleas ni en neuralgias craneales. Sin embargo, existen otros antiepilépticos que no tienen indicación en estas situaciones clínicas por las agencias reguladoras, como lamotrigina y lacosamida, pero que se utilizan en la práctica clínica habitual fuera de indicación8–12.
El objetivo de este artículo es revisar la bibliografía disponible del ESL en el dolor neuropático, cefaleas y neuralgias craneales para ver si podría ser una opción de tratamiento en aquellos pacientes que no respondan o que presenten intolerancia a los tratamientos habituales.
DesarrolloRealizamos una búsqueda bibliográfica en PubMed y Google académico con las palabras clave: «acetate eslicarbazepine and neuropathic pain» y «acetate eslicarbazepine and headaches». Se tuvieron en cuenta solo artículos científicos indexados en revistas científicas; entre ellos, se seleccionaron tanto artículos originales como casos clínicos, publicados en inglés o español. Como nuestra búsqueda apenas reportó resultados, decidimos ampliar los criterios y seleccionamos resúmenes de pósteres y comunicaciones orales presentados en congresos nacionales de la Sociedad Española de Neurología (SEN) entre los años 2011 y 2015, así como en congresos internacionales disponibles en Internet relacionados con la misma temática: «acetate eslicarbazepine and neuropathic pain» y «acetate eslicarbazepine and headaches». Para facilitar la lectura de este artículo, hemos estructurado el trabajo en varios subapartados.
Estudios experimentales del acetato de eslicarbazepina en dolor neuropáticoEn modelos experimentales en ratones, la actividad analgésica del ESL se ha examinado extensamente en una amplia variedad de estados de dolor inducidos de forma artificial: NT, neuropatía diabética y dolor visceral, y se ha observado que el ESL podría ser útil en el tratamiento clínico del dolor inflamatorio y neuropático13.
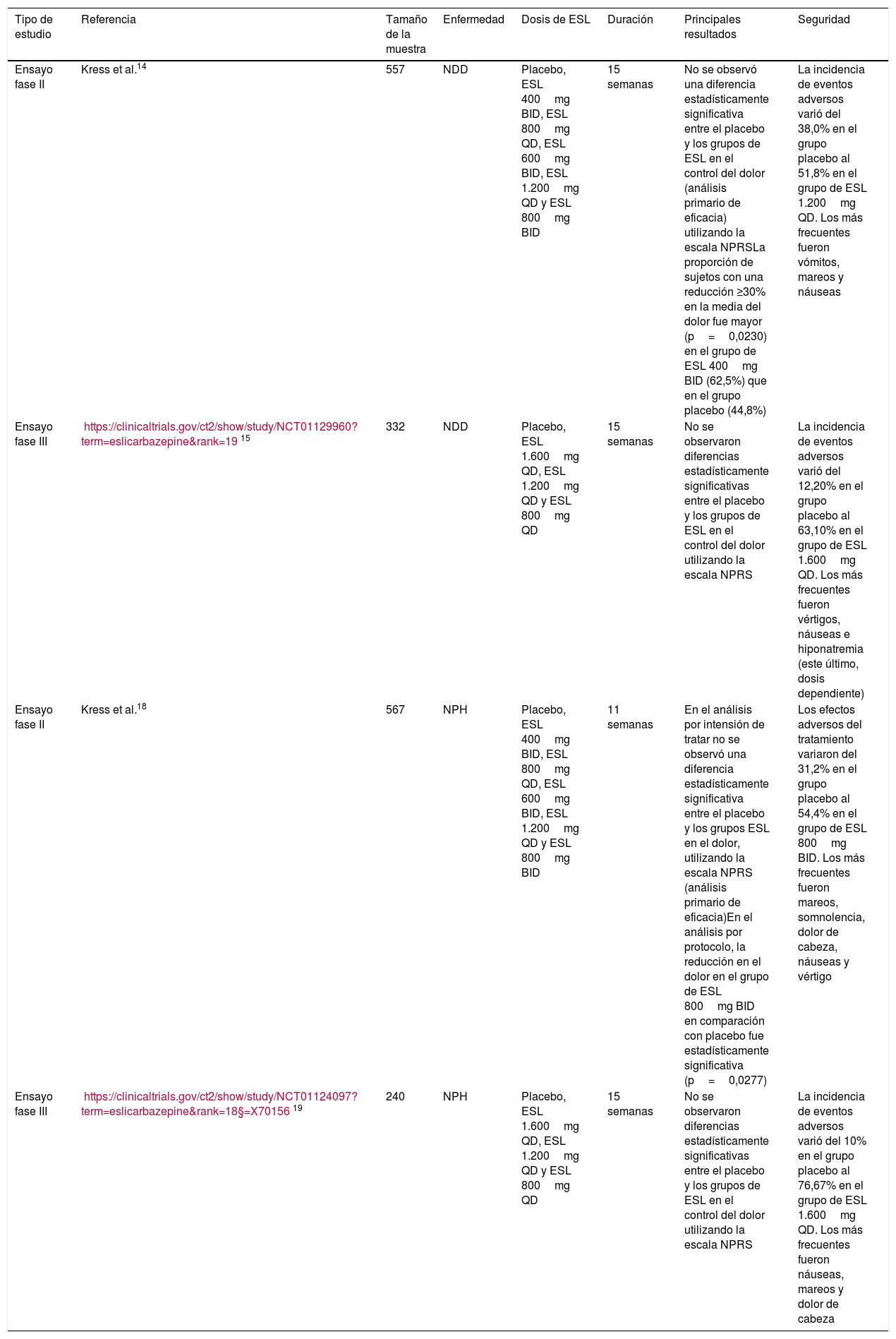
Acetato de eslicarbazepina en neuropatía diabética dolorosaEn la neuropatía diabética dolorosa (NDD) encontramos un póster presentado en el congreso de la EFIC (The European Pain Federation) del 2013. Se trataba de un ensayo aleatorizado, doble ciego, multicéntrico, controlado con placebo, de grupos paralelos, de búsqueda de dosis, estudio de fase II. Dicho ensayo costaba de: periodo de lavado de 2 semanas en el que se suspendían los tratamientos previos para el dolor neuropático, seguido por un período de titulación de una semana, un período de mantenimiento de 12 semanas y un período de seguimiento y seguridad de 2 semanas. Un total de 557 pacientes fueron asignados al azar a: placebo, ESL 400mg 2veces al día (BID), ESL 800mg una vez al día (QD), ESL 600mg BID, ESL 1.200mg QD y ESL 800mg BID. Después de 12 semanas de tratamiento, no se observó una diferencia estadísticamente significativa entre el placebo y los grupos del ESL en el control del dolor (análisis primario de eficacia), utilizando la escala numérica para el dolor Numerical Rating Pain Score (NPRS). Sin embargo, la proporción de sujetos con una reducción ≥30% en la media del dolor fue mayor (p=0,0230) en el grupo de ESL 400mg BID (62,5%) que en el grupo placebo (44,8%). La incidencia de eventos adversos varió del 38,0% en el grupo placebo al 51,8% en el grupo del ESL 1.200mg QD. Los más frecuentes fueron vómitos, mareos y náuseas14.
También se realizó un ensayo fase III, doble ciego, aleatorizado, controlado con placebo, de grupos paralelos, multicéntrico en NDD de 15 semanas de duración (3 semanas de ajuste de dosis y 12 semanas de mantenimiento). La variable primaria de eficacia fue el cambio en la media del dolor al inicio del estudio (basal) hasta el final (15 semanas), empleando la escala NPRS. En total 332 pacientes con NDD fueron aleatorizados a: placebo, ESL 1.600mg QD, ESL 1.200mg QD y ESL 800mg QD. Después de 15 semanas de tratamiento, no se observaron diferencias estadísticamente significativas entre el placebo y los grupos del ESL en el control del dolor. La incidencia de eventos adversos varió entre el 12,20% en el grupo placebo y el 63,10% en el grupo del ESL 1.600mg QD. Los más frecuentes fueron vértigos, náuseas e hiponatremia (este último, dosis dependiente). Los resultados de este ensayo no fueron publicados15.
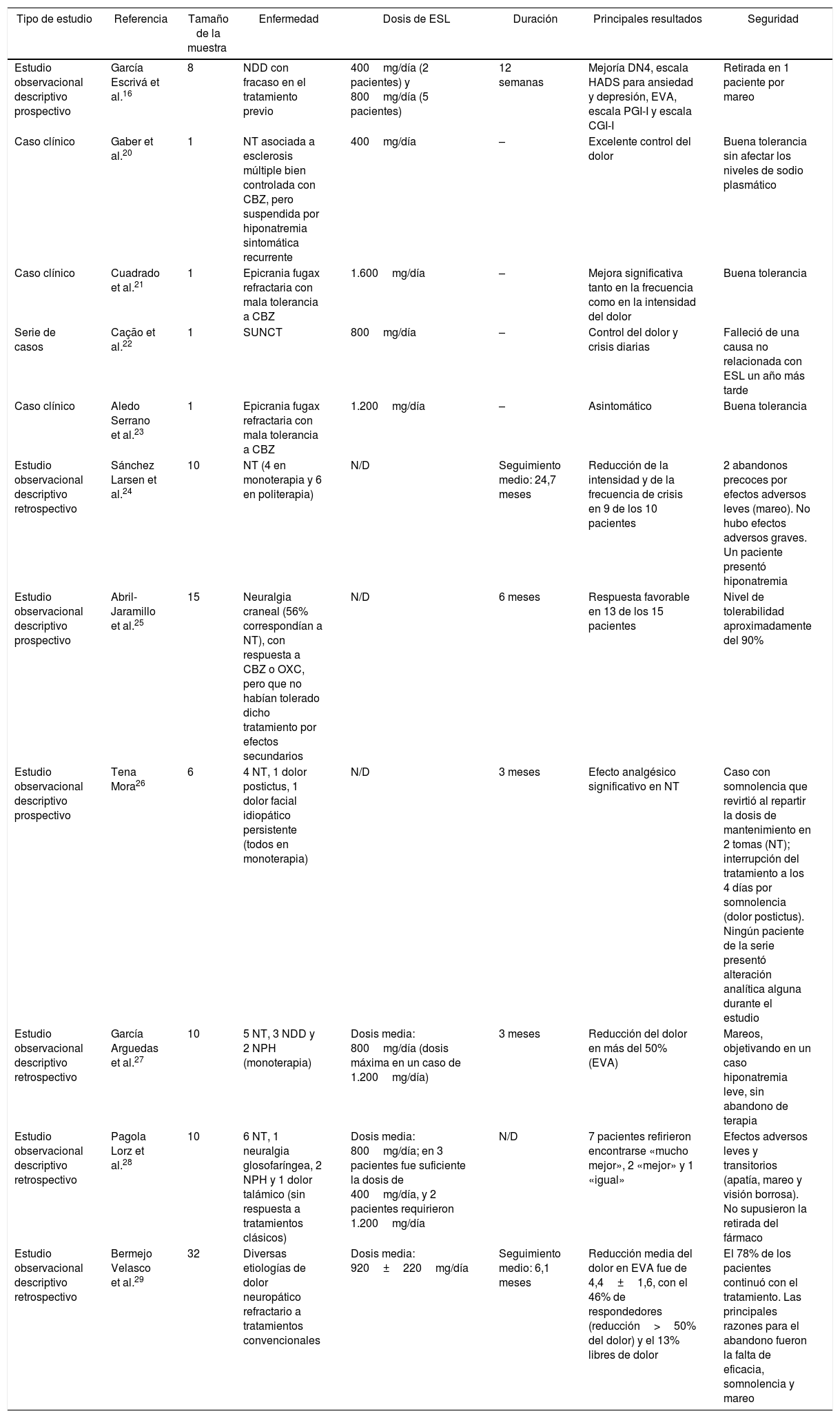
García Escrivá et al. publicaron su experiencia en el tratamiento de la NDD con ESL como tratamiento de segunda línea cuando no había respuesta a los tratamientos clásicos. Durante el año 2013 recogieron 8 pacientes con NDD y mal control del dolor con el tratamiento recibido anteriormente. Se realizó una visita basal en la que se sustituyó el tratamiento para el dolor por ESL, se recabaron los datos demográficos y se rellenaron las siguientes escalas: escala DN4, escala HADS (Hospital Anxiety and Depression Scale) para ansiedad y depresión, escala visual analógica (EVA) para el dolor, escala PGI-I (impresión de mejoría global del paciente) y escala CGI-I (impresión de mejoría global del clínico). Se realizó una visita de control a las 12 semanas del tratamiento, rellenando las mismas escalas y preguntando por los posibles efectos secundarios. Posteriormente se realizó un análisis estadístico. El 75% de los pacientes habían recibido previamente pregabalina, el 25% amitriptilina, el 12,5% clonazepam y el 12,5% fentanilo, como tratamiento único o combinado. Al inicio del tratamiento con ESL, el número medio de fármacos concomitantes fue de 4,6, con un mínimo de uno y un máximo de 11 fármacos (mediana: 4,5 fármacos). No se realizaron cambios en el tratamiento concomitante durante el seguimiento. El dolor neuropático, evaluado mediante la escala DN4, se redujo significativamente a los 3 meses (p=0,026; test de Wilcoxon). No se encontró variación significativa en ninguna de las características concretas de dolor que mide la escala. También se observó una reducción significativa del dolor neuropático evaluado mediante la EVA (p=0,018; test de Wilcoxon). Se observó mejoría en los pacientes, tanto en la escala de ansiedad (p=0,102; test de Wilcoxon) como en la de depresión (p=0,276; test de Wilcoxon), aunque la variación no fue estadísticamente significativa. El 65,5% de los pacientes indicaron estar «mucho mejor» o «mejor». El 87,5% de los clínicos indicaron que los pacientes estaban «mejor» o «mucho mejor». Se retiró ESL en un paciente por efecto adverso (mareo). A los 3 meses, 7 pacientes (87,5%) continuaron con el fármaco: 2 de ellos con dosis de 400mg/día y 5 con dosis de 800mg/día. Para los autores de este trabajo, ESL resultó una alternativa eficaz en el control del dolor neuropático en pacientes con NDD refractaria a los tratamientos convencionales y con una buena tolerabilidad y alta adherencia16,17.
Acetato de eslicarbazepina en neuralgia postherpéticaEn la neuralgia postherpética (NPH) encontramos un póster presentado en el congreso de la EFIC (The European Pain Federation) del 2013. Se trataba de un ensayo aleatorizado, doble ciego, multicéntrico, controlado con placebo, de grupos paralelos, de búsqueda de dosis, estudio de fase II. Dicho ensayo costaba de: periodo de lavado de 2 semanas en el que se suspendían los tratamientos previos para la NPH, seguido por un período de titulación de una semana, un período de mantenimiento de 8 semanas y un período de seguimiento y seguridad de 2 semanas. Un total de 567 pacientes fueron asignados al azar a: placebo, ESL 400mg BID, ESL 800mg QD, ESL 600mg BID, ESL 1.200mg QD y ESL 800mg BID. En el análisis por intención de tratar no se observó una diferencia estadísticamente significativa entre el placebo y los grupos ESL en el dolor, utilizando la escala NPRS (análisis primario de eficacia). Sin embargo, en el análisis por protocolo, la reducción en el dolor en el grupo del ESL 800mg BID en comparación con placebo fue estadísticamente significativa (p=0,0277). Los efectos adversos del tratamiento variaron del 31,2% en el grupo placebo al 54,4% en el grupo de ESL 800mg BID. Los más frecuentes fueron mareos, somnolencia, dolor de cabeza, náuseas y vértigo18.
También se realizó un ensayo fase III, doble ciego, aleatorizado, controlado con placebo, de grupos paralelos, multicéntrico en NPH de 15 semanas de duración. La variable primaria de eficacia fue el cambio en la media del dolor al inicio del estudio (basal) hasta el final (15 semanas), empleando la escala NPRS. En total, 240 pacientes con NPH fueron aleatorizados a: placebo, ESL 1.600mg QD, ESL 1.200mg QD y ESL 800mg QD. Después de 15 semanas de tratamiento, no se observaron diferencias estadísticamente significativas entre el placebo y los grupos de ESL en el control del dolor. La incidencia de eventos adversos varió del 10% en el grupo placebo al 76,67% en el grupo de ESL 1.600mg QD. Los más frecuentes fueron náuseas, mareos y dolor de cabeza. Este estudio finalmente tampoco fue publicado19.
Acetato de eslicarbazepina en cefaleas y neuralgias cranealesGaber et al. publicaron el caso de una paciente de 62 años con neuralgia del trigémino (NT) asociada a esclerosis múltiple bien controlada con CBZ. Sin embargo, se tuvo que suspender este tratamiento debido a una hiponatremia sintomática recurrente. Se intentó tratamiento con varios fármacos, incluyendo topiramato, gabapentina y amitriptilina, pero ninguno tuvo efecto beneficioso sobre la NT. Dosis bajas de ESL (400mg diarios) proporcionaron un excelente control del dolor sin afectar los niveles de sodio plasmático20.
Cuadrado et al. publicaron un caso clínico de un varón de 32 años con una epicrania fugax refractaria a muchos ensayos terapéuticos (bloqueo del nervio occipital con triamcinolona y bupivacaína, gabapentina, lamotrigina, pregabalina, topiramato, zonisamida, valproato sódico, lacosamida, indometacina). La dosis de CBZ de 1.200mg/día fue capaz de reducir la intensidad del dolor, pero tuvo que ser retirada a causa de somnolencia. Se prescribió ESL a una dosis de 800mg/día, y el paciente experimentó una mejora significativa, tanto en la frecuencia como en la intensidad del dolor. Se ajustó la dosis hasta 1.600mg/día, con buena tolerancia, y el paciente consiguió estar asintomático. Si se trataba de reducir la dosis, los síntomas reaparecían21.
Cação et al. describieron una cohorte de 15 pacientes con cefalea neuralgiforme unilateral de breve duración con inyección conjuntival y lagrimeo (SUNCT), en la cual la mayoría de los pacientes respondieron a lamotrigina, uno a topiramato y otro a ESL22.
Aledo Serrano et al. presentaron en la LXVI Reunión Anual de la Sociedad Española de Neurología (2014, Valencia) un caso clínico de un varón de 38 años diagnosticado de epicrania fugax refractario a lamotrigina, pregabalina, gabapentina, topiramato, zonisamida, indometacina, valproato, lacosamida, levetiracetam, bloqueos anestésicos del nervio occipital mayor e infiltración de toxina botulínica en el origen del dolor. Hubo una respuesta parcial a CBZ, aunque con aparición de efectos secundarios importantes. Con 1.200 mg al día de ESL el paciente quedó asintomático23.
Sánchez Larsen et al. presentaron en la LXVI Reunión Anual de la Sociedad Española de Neurología (2014, Valencia) un estudio observacional retrospectivo. Analizaron a pacientes con NT tratados con ESL en monoterapia o politerapia. Las variables principales evaluadas fueron intensidad del dolor (escala visual 0-10) previa y posterior al tratamiento, frecuencia de crisis previa y posterior al tratamiento, y aparición de efectos adversos. Analizaron a un total de 10 pacientes (4 en monoterapia): 7 mujeres, con edad media de 67,9 años y un rango de edad de 28 a 92 años. El seguimiento medio fue de 24,7 meses, salvo 2abandonos precoces por efectos adversos leves (mareo). No hubo efectos adversos graves y un paciente presentó hiponatremia. Hubo una reducción de la intensidad y de la frecuencia de crisis en 9 de los 10 pacientes. En ellos, de media (previa vs. posteriormente a ESL): intensidad=8,7 vs. 2,6; frecuencia de crisis=12,13 crisis/día vs. 2,28 crisis/día (4 quedaron asintomáticos; 3 redujeron a 1-2 crisis/semana; 2 presentaron mejoría leve, manteniendo elevada frecuencia de crisis [5-15 crisis/día]). En esta serie, el ESL parece ser eficaz y seguro en el tratamiento de la NT, con ventajas de seguridad y farmacocinéticas respecto a CBZ, aunque los autores recomiendan el control de la natremia24.
Abril-Jaramillo et al. presentaron en la LXVII Reunión Anual de la Sociedad Española de Neurología (2015, Valencia) un trabajo cuyo objetivo era valorar la respuesta al tratamiento con ESL en aquellos pacientes con diagnóstico de neuralgia craneal (el 56% correspondían a NT), que habían mostrado una respuesta favorable al tratamiento con CBZ o OXC, pero que no habían tolerado dicho tratamiento con estos fármacos al presentar efectos secundarios. Se valoró la respuesta terapéutica a ESL en 15 pacientes en un periodo de 6 meses, con una valoración inicial que incluía historia clínica, exploración, estudios complementarios realizados, tratamientos previos y los efectos secundarios que habían obligado a su retirada. Posteriormente se realizaba un control a los 3y 6meses, con recogida de eficacia y posible presencia de efectos secundarios. Los autores de este trabajo objetivaron una respuesta favorable en 13 de los 15 pacientes, y destacaron una mejor tolerabilidad de ESL respecto a CBZ y OXC25.
Acetato de eslicarbazepina en series de casos de diferentes etiologíasTena Mora presentó en la LXIII Reunión Anual de la Sociedad Española de Neurología (2011, Barcelona) un póster consistente en un estudio descriptivo prospectivo diseñado con el objetivo de evaluar la eficacia y seguridad de ESL, en monoterapia, en 6 pacientes con distintas formas de dolor neuropático. Se realizaron determinaciones analíticas (hemograma, coagulación, sodio, potasio, función renal y hepática) al mes y a los 3meses de iniciar dicho tratamiento, y se pasó la EVA en la primera visita (EVA 1), al mes (EVA 2) y a los 3 meses de seguimiento (EVA 3). Este trabajo incluyó: 4 casos de NT primaria —100% mujeres— (EVA 1: 8-10, EVA 2: 0-3, EVA 3: 0-3), en el que destacamos un caso con somnolencia que revirtió al repartir la dosis de mantenimiento en 2 tomas; dolor postictus —varón de 80 años— (EVA 1: 9; interrupción del tratamiento a los 4 días por somnolencia, de forma concomitante se estaba suspendiendo gradualmente la CBZ); dolor facial idiopático persistente —mujer de 70 años— (EVA 1: 9, EVA 2: 8, EVA 3: 8). Ningún paciente de la serie presentó alteración analítica alguna durante el período de tiempo del estudio (3 meses). El autor destaca el efecto analgésico significativo del ESL en NT primaria26.
García Arguedas et al. presentaron en la LXVI Reunión Anual de la Sociedad Española de Neurología (2014, Valencia) un estudio descriptivo retrospectivo en 10 pacientes con dolor neuropático utilizando en monoterapia ESL. Se analizaron las causas del dolor, la dosis utilizada, la efectividad del tratamiento (utilizando la EVA en la primera visita y en la revisión a los 3 meses), así como su tolerabilidad. Las causas de dolor fueron 5 NT, 3 NDD y 2 NPH. La dosis media más frecuente utilizada fue 800mg (dosis máxima en un caso de 1.200mg). La media en la EVA del dolor en la primera visita fue de 8,2 y en la revisión a los 3meses la media fue de 2,4, con una reducción global en más del 50% del dolor. En cuanto a la tolerabilidad, lo más referido fueron los mareos, con un caso de hiponatremia leve sin abandono del tratamiento27.
Pagola Lorz et al. presentaron en la LXVII Reunión Anual de la Sociedad Española de Neurología (2015, Valencia) su experiencia en el tratamiento del dolor neuropático con ESL como tratamiento de segunda línea cuando no había respuesta a los tratamientos clásicos. Se trataba de un estudio descriptivo retrospectivo, en el que se analizó la respuesta a ESL en 10 pacientes con dolor neuropático mal controlado con el tratamiento recibido anteriormente. Las variables principales evaluadas fueron causas del dolor, dosis del ESL utilizada, mejoría del dolor (utilizando las respuestas «mucho mejor», «mejor», «igual», «peor»), tratamiento neuropático concomitante y efectos adversos. Las causas del dolor fueron 6 NT, una neuralgia glosofaríngea, 2 NPH y un dolor talámico. La dosis media utilizada fue de 800mg; en 3 pacientes fue suficiente la dosis de 400mg y 2 pacientes requirieron 1.200mg. Del total, 7 pacientes refirieron encontrarse «mucho mejor», 2 «mejor» y uno «igual». En cuanto al tratamiento adyuvante, 3 de los pacientes utilizaron gabapentina, un paciente pregabalina y otro paciente amitriptilina. Los efectos adversos (apatía, mareo y visión borrosa) fueron leves y transitorios, y en ningún caso supusieron la retirada del fármaco28.
Bermejo Velasco et al. presentaron en la LXVII Reunión Anual de la Sociedad Española de Neurología (2015, Valencia) un trabajo en el que evaluaron retrospectivamente las historias clínicas de los pacientes con dolor neuropático que habían recibido ESL. Se evaluó la eficacia mediante la EVA, porcentaje de pacientes respondedores (reducción >50% del dolor), porcentaje de pacientes libres de dolor, reducción de la medicación concomitante, efectos adversos, dosis utilizadas, pauta de escalado y etiología del dolor neuropático. El seguimiento medio fue de 6,1 meses. Se incluyó en total a 32 pacientes. La dosis media del ESL fue de 920±220mg/día. La reducción media del dolor en la escala EVA fue de 4,4±1,6, con el 46% de respondedores y el 13% libres de dolor. El 78% de los pacientes continuó con el tratamiento. Las principales razones para el abandono fueron la falta de eficacia, somnolencia y mareo29.
En las tablas 1 y 2 se resumen los ensayos clínicos, estudios observaciones y casos clínicos incluidos en esta revisión.
Síntesis de los ensayos clínicos incluidos en esta revisión
| Tipo de estudio | Referencia | Tamaño de la muestra | Enfermedad | Dosis de ESL | Duración | Principales resultados | Seguridad |
|---|---|---|---|---|---|---|---|
| Ensayo fase II | Kress et al.14 | 557 | NDD | Placebo, ESL 400mg BID, ESL 800mg QD, ESL 600mg BID, ESL 1.200mg QD y ESL 800mg BID | 15 semanas | No se observó una diferencia estadísticamente significativa entre el placebo y los grupos de ESL en el control del dolor (análisis primario de eficacia) utilizando la escala NPRSLa proporción de sujetos con una reducción ≥30% en la media del dolor fue mayor (p=0,0230) en el grupo de ESL 400mg BID (62,5%) que en el grupo placebo (44,8%) | La incidencia de eventos adversos varió del 38,0% en el grupo placebo al 51,8% en el grupo de ESL 1.200mg QD. Los más frecuentes fueron vómitos, mareos y náuseas |
| Ensayo fase III | https://clinicaltrials.gov/ct2/show/study/NCT01129960?term=eslicarbazepine&rank=1915 | 332 | NDD | Placebo, ESL 1.600mg QD, ESL 1.200mg QD y ESL 800mg QD | 15 semanas | No se observaron diferencias estadísticamente significativas entre el placebo y los grupos de ESL en el control del dolor utilizando la escala NPRS | La incidencia de eventos adversos varió del 12,20% en el grupo placebo al 63,10% en el grupo de ESL 1.600mg QD. Los más frecuentes fueron vértigos, náuseas e hiponatremia (este último, dosis dependiente) |
| Ensayo fase II | Kress et al.18 | 567 | NPH | Placebo, ESL 400mg BID, ESL 800mg QD, ESL 600mg BID, ESL 1.200mg QD y ESL 800mg BID | 11 semanas | En el análisis por intensión de tratar no se observó una diferencia estadísticamente significativa entre el placebo y los grupos ESL en el dolor, utilizando la escala NPRS (análisis primario de eficacia)En el análisis por protocolo, la reducción en el dolor en el grupo de ESL 800mg BID en comparación con placebo fue estadísticamente significativa (p=0,0277) | Los efectos adversos del tratamiento variaron del 31,2% en el grupo placebo al 54,4% en el grupo de ESL 800mg BID. Los más frecuentes fueron mareos, somnolencia, dolor de cabeza, náuseas y vértigo |
| Ensayo fase III | https://clinicaltrials.gov/ct2/show/study/NCT01124097?term=eslicarbazepine&rank=18§=X7015619 | 240 | NPH | Placebo, ESL 1.600mg QD, ESL 1.200mg QD y ESL 800mg QD | 15 semanas | No se observaron diferencias estadísticamente significativas entre el placebo y los grupos de ESL en el control del dolor utilizando la escala NPRS | La incidencia de eventos adversos varió del 10% en el grupo placebo al 76,67% en el grupo de ESL 1.600mg QD. Los más frecuentes fueron náuseas, mareos y dolor de cabeza |
BID: 2veces al día; ESL: acetato de eslicarbazepina; NDD: neuropatía diabética dolorosa; NPH: neuralgia postherpética; NPRS: Numerical Rating Pain Score; QD: una vez al día.
Síntesis de los estudios observacionales y casos clínicos incluidos en esta revisión
| Tipo de estudio | Referencia | Tamaño de la muestra | Enfermedad | Dosis de ESL | Duración | Principales resultados | Seguridad |
|---|---|---|---|---|---|---|---|
| Estudio observacional descriptivo prospectivo | García Escrivá et al.16 | 8 | NDD con fracaso en el tratamiento previo | 400mg/día (2 pacientes) y 800mg/día (5 pacientes) | 12 semanas | Mejoría DN4, escala HADS para ansiedad y depresión, EVA, escala PGI-I y escala CGI-I | Retirada en 1 paciente por mareo |
| Caso clínico | Gaber et al.20 | 1 | NT asociada a esclerosis múltiple bien controlada con CBZ, pero suspendida por hiponatremia sintomática recurrente | 400mg/día | – | Excelente control del dolor | Buena tolerancia sin afectar los niveles de sodio plasmático |
| Caso clínico | Cuadrado et al.21 | 1 | Epicrania fugax refractaria con mala tolerancia a CBZ | 1.600mg/día | – | Mejora significativa tanto en la frecuencia como en la intensidad del dolor | Buena tolerancia |
| Serie de casos | Cação et al.22 | 1 | SUNCT | 800mg/día | – | Control del dolor y crisis diarias | Falleció de una causa no relacionada con ESL un año más tarde |
| Caso clínico | Aledo Serrano et al.23 | 1 | Epicrania fugax refractaria con mala tolerancia a CBZ | 1.200mg/día | – | Asintomático | Buena tolerancia |
| Estudio observacional descriptivo retrospectivo | Sánchez Larsen et al.24 | 10 | NT (4 en monoterapia y 6 en politerapia) | N/D | Seguimiento medio: 24,7 meses | Reducción de la intensidad y de la frecuencia de crisis en 9 de los 10 pacientes | 2 abandonos precoces por efectos adversos leves (mareo). No hubo efectos adversos graves. Un paciente presentó hiponatremia |
| Estudio observacional descriptivo prospectivo | Abril-Jaramillo et al.25 | 15 | Neuralgia craneal (56% correspondían a NT), con respuesta a CBZ o OXC, pero que no habían tolerado dicho tratamiento por efectos secundarios | N/D | 6 meses | Respuesta favorable en 13 de los 15 pacientes | Nivel de tolerabilidad aproximadamente del 90% |
| Estudio observacional descriptivo prospectivo | Tena Mora26 | 6 | 4 NT, 1 dolor postictus, 1 dolor facial idiopático persistente (todos en monoterapia) | N/D | 3 meses | Efecto analgésico significativo en NT | Caso con somnolencia que revirtió al repartir la dosis de mantenimiento en 2 tomas (NT); interrupción del tratamiento a los 4 días por somnolencia (dolor postictus). Ningún paciente de la serie presentó alteración analítica alguna durante el estudio |
| Estudio observacional descriptivo retrospectivo | García Arguedas et al.27 | 10 | 5 NT, 3 NDD y 2 NPH (monoterapia) | Dosis media: 800mg/día (dosis máxima en un caso de 1.200mg/día) | 3 meses | Reducción del dolor en más del 50% (EVA) | Mareos, objetivando en un caso hiponatremia leve, sin abandono de terapia |
| Estudio observacional descriptivo retrospectivo | Pagola Lorz et al.28 | 10 | 6 NT, 1 neuralgia glosofaríngea, 2 NPH y 1 dolor talámico (sin respuesta a tratamientos clásicos) | Dosis media: 800mg/día; en 3 pacientes fue suficiente la dosis de 400mg/día, y 2 pacientes requirieron 1.200mg/día | N/D | 7 pacientes refirieron encontrarse «mucho mejor», 2 «mejor» y 1 «igual» | Efectos adversos leves y transitorios (apatía, mareo y visión borrosa). No supusieron la retirada del fármaco |
| Estudio observacional descriptivo retrospectivo | Bermejo Velasco et al.29 | 32 | Diversas etiologías de dolor neuropático refractario a tratamientos convencionales | Dosis media: 920±220mg/día | Seguimiento medio: 6,1 meses | Reducción media del dolor en EVA fue de 4,4±1,6, con el 46% de respondedores (reducción>50% del dolor) y el 13% libres de dolor | El 78% de los pacientes continuó con el tratamiento. Las principales razones para el abandono fueron la falta de eficacia, somnolencia y mareo |
CBZ: carbamazepina; CGI-I: impresión de mejoría global del clínico; ESL: acetato de eslicarbazepina; EVA: escala visual analógica; HADS: Hospital Anxiety and Depression Scale; N/D: no disponible; NDD: neuropatía diabética dolorosa; NPH: neuralgia postherpética; NT: neuralgia del trigémino; OXC: oxcarbazepina; PGI-I: impresión de mejoría global del paciente; SUNCT: cefalea neuralgiforme unilateral de breve duración con inyección conjuntival y lagrimeo.
Como se ha descrito anteriormente, la familia de las dibenzazepinas pueden presentar un problema que puede ser clínicamente importante: la hiponatremia. La hiponatremia, definida como un nivel de sodio <135mmol/l, es un efecto secundario común del tratamiento con CBZ y OXC. La incidencia de la hiponatremia secundaria a la terapia con CBZ oscila entre el 4,8 y el 40%, dependiendo de los estudios30,31. Cada vez más trabajos aportan datos de que la hiponatremia, aunque leve, tiene efectos deletéreos, sobre todo en la población anciana (en la que, por otra parte, se dan con frecuencia cuadros clínicos de dolor neuropático)32,33. La hiponatremia de origen farmacológico debería considerarse un efecto adverso que tener en cuenta y que motivase sopesar un cambio de tratamiento.
Los médicos a menudo nos enfrentamos a un dilema cuando la CBZ es el único agente capaz de controlar un problema clínico específico, como el caso de la NT. El ESL se puede plantear como una alternativa en pacientes que presenten efectos secundarios a CBZ. En los ensayos clínicos y estudios observacionales publicados con ESL en epilepsia, la hiponatremia es prácticamente inexistente34–36, por lo que la sustitución de CBZ y OXC por ESL en pacientes que han desarrollado hiponatremia parece ser una opción eficaz y bien tolerada. Sin embargo, se recomienda mantener el control de la hiponatremia, ya que en algunos pacientes persiste el descenso de sodio en sangre37.
Por otro lado, las diferencias en el perfil de los diferentes fármacos antiepilépticos de la familia de las dibenzazepinas pueden asociarse a cambios relacionados con la efectividad, la tolerabilidad y la adherencia38. Todo esto hace que en la práctica clínica se plantee el cambio de uno a otro de los fármacos de esta familia, para adaptarse lo mejor posible al perfil del paciente. El proyecto EPICON, mediante el empleo de la metodología Delphi entre un grupo de expertos en epilepsia, sometió a evaluación determinadas situaciones y metodología de cambio de CBZ y OXC a ESL. El objetivo del estudio fue tratar de establecer un consenso de recomendaciones que pudieran considerarse para llevar a cabo un cambio adecuado de CBZ u OXC a ESL en determinados pacientes. Las recomendaciones fundamentales fueron: el cambio de CBZ a ESL debe ser realizado en 1-3 semanas, con una equivalencia de dosis CBZ:ESL de 1:1,3; se recomienda en pacientes con olvidos de medicación, trabajos por turnos, polimedicados, problemas cognitivos, osteoporosis-osteopenia severa, dislipidemia o enfermedad hepática (ausencia de fallo hepático grave), así como en varones con disfunción eréctil causada por CBZ. El cambio de OXC a ESL puede realizarse de un día para otro con una equivalencia de dosis 1:1 y se recomienda en pacientes con olvidos de medicación, trabajos por turnos, polimedicados o con problemas cognitivos. Se desaconsejó el cambio en caso de rash con CBZ u OXC39. Aunque estas recomendaciones están realizadas en pacientes con epilepsia, nos pueden servir de orientación en otras circunstancias (diferentes modelos de dolor neuropático, NT y otras cefaleas), en las que se presenten los problemas descritos de adherencia/tolerabilidad con CBZ y OXC.
ConclusionesEl mecanismo de acción del ESL (interacción selectiva con el estado inactivo de los CSVD con efecto a través de su inactivación lenta, en lugar de la inactivación rápida asociada a CBZ y OXC; e inhibición de las corrientes hCaV3.2 con mayor afinidad que CBZ) lo hace un fármaco interesante, a priori, en el tratamiento del dolor neuropático, cefaleas y neuralgias craneales.
Sin embargo, no se dispone apenas de evidencia para recomendar el uso del ESL en dolor neuropático, cefaleas y neuralgias craneales. Por otro lado, la mayor parte de la experiencia disponible corresponde a estudios abiertos y observacionales, sin grupo control y con bajo número de pacientes. Además, algunos estudios incluidos en esta revisión consideraban diferentes entidades clínicas26–29, con mecanismos fisiopatológicos distintos. Por tanto, cualquier tipo de conclusión global sobre su eficacia no permite obtener datos válidos, dado lo heterogéneo de los procesos considerados. Igualmente, resulta llamativo que en los ensayos clínicos del ESL en dolor neuropático (NDD y NPH) no se consiguió encontrar diferencias estadísticamente significativas.
Por otro lado, para la escasez de estudios encontrados podríamos plantear la posibilidad de que existiera un sesgo de publicación. De hecho, los ensayos clínicos de fase III realizados con ESL en dolor neuropático no fueron publicados.
En conclusión, el tratamiento con ESL en dolor neuropático, cefaleas y neuralgias craneales podría considerarse como una alternativa para aquellos pacientes que no respondan o que no toleren los tratamientos estándares, especialmente en NT, pero se necesitarían más estudios aleatorizados y con mayor número de pacientes. La utilidad del ESL en NT podría estar relacionada con la excelente respuesta de esta entidad a CBZ y a las similitudes bioquímicas entre ambas moléculas.
Conflicto de interesesHemos tenido en cuenta las instrucciones y las responsabilidades éticas y cumplimos los requisitos de autoría y declaramos la no existencia de conflicto de intereses.