Evaluar la efectividad del ácido 5-aminolevulínico (5-ALA, Gliolan®) mediante la tasa de resecciones completas (RC) y supervivencia libre de progresión a los 6 meses (SLP6) en pacientes intervenidos quirúrgicamente de glioma maligno, en condiciones de práctica médica habitual en España.
Material y métodosRevisión retrospectiva en 18 servicios de neurocirugía, divididos en centros que usan habitualmente 5-ALA y centros que no. Se incluyó a pacientes adultos con sospecha de glioma maligno, en los que la intención de tratar incluyó resección completa y posterior radioterapia y quimioterapia con temozolomida. Era necesaria la existencia de resonancia magnética posquirúrgica y datos clínicos al menos durante 6 meses. Se comparó la diferencia entre pacientes con o sin 5-ALA en la tasa de RC y en la SLP6.
ResultadosSe obtuvieron 251 casos evaluables. La tasa de RC y la tasa de SLP6 fueron significativamente mayores en el grupo de pacientes operados con 5-ALA: RC, 67% frente a 45%, p=0,000, y SLP6 en el caso de los gliomas de grado IV, 69% frente a 48%; p=0,002. Estas diferencias se mantuvieron relevantes y significativas tras ajustarlas por todas las covariables estudiadas, que incluyeron edad, estado funcional y localización en área elocuente o no.
ConclusionesEn esta serie retrospectiva, el uso de 5-ALA en la cirugía del glioma maligno en la práctica habitual en España se asoció a un incremento en la tasa de resecciones completas y, en el caso de los gliomas de grado IV, a un incremento en la supervivencia libre de progresión a los 6 meses.
To assess effectiveness of 5-aminolevulinic acid (5-ALA, Gliolan®) in patients treated for malignant glioma under typical daily practice conditions in Spain, using complete resection rate (CR) and progression free survival at 6 months (PFS6).
Material and methodsRetrospective review of data from 18 neurosurgery departments that were categorised as either using or not using 5-ALA. The study included adult patients with suspected malignant gliomas for whom the intended treatment plan included complete resection followed by radiotherapy and chemotherapy with temozolomide. Postoperative MRI and clinical data representing at least 6 months were required for inclusion. Rates of CR and PFS6 were compared between patients with 5-ALA treatment and those without.
ResultsThe study included 251 evaluable cases. CR and PFS6 rates were significantly higher in the group of patients treated surgically with 5-ALA: CR, 67% versus 45%, p=.000; PFS6 for patients with grade IV tumours, 69% versus 48%; p=.002. The differences retained their significance and magnitude after adjusting for all covariates including age, functional status, and whether gliomas were located in eloquent areas.
ConclusionsIn this retrospective series, use of 5-ALA during habitual surgical procedures in Spain was associated with a higher complete resection rate for malignant glioma and increased PFS6 for grade iv glioma.
El tratamiento del glioma maligno sigue siendo un problema no resuelto. En el glioblastoma (GBM) se ha observado que la resección quirúrgica completa (RC) de toda la parte del tumor captante de contraste en resonancia magnética (RM) se asocia a un beneficio en la supervivencia1-3. Sin embargo, hasta muy recientemente, estas extirpaciones completas se producían en un porcentaje pequeño de los casos; una revisión de la literatura publicada en 2008 encuentra tasas entre el 30 y el 47% en centros de referencia a nivel mundial4. El bajo índice de RC se debe, en gran medida, a la dificultad para identificar algunas zonas del tumor en el campo quirúrgico. En un estudio en el que se correlacionó la impresión del cirujano con la RM posquirúrgica, los cirujanos creyeron haber realizado una RC en el 54% de los casos, pero la RM mostró solo un 18% de RC5.
La fluorescencia inducida por el ácido 5 aminolevulínico (5-ALA, Gliolan®) en gliomas de alto grado permite al neurocirujano ver el tumor con claridad en el campo quirúrgico6, y en un estudio aleatorizado ha demostrado un aumento en la tasa de RC del 36 a 65%7, acompañado de un beneficio del 21 al 41% en la supervivencia libre de progresión a los 6 meses (SLP6) en GBM. Dado que no se puede diferenciar preoperatoriamente entre GBM y otros gliomas de grado IV o casos de gliomas de grado III, este trabajo incluía varios tipos de histologías. El beneficio en la tasa de RC se apreció para el conjunto de casos, mientras el beneficio en la SLP6 se analizó solo para GBM, por las diferencias de supervivencias asociadas a distintos tipos histológicos y por el bajo número de casos incluidos con gliomas de grado III.
Existen dos dificultades para generalizar este resultado. La primera es el tipo de pacientes incluidos en cada centro como candidatos a cirugía, algo que no se puede estandarizar. La segunda es que, en el momento de realizar ese estudio, la radioterapia con temozolomida concurrente no era todavía el tratamiento estándar de primera línea para GBM8.
El trabajo actual pretende explorar el empleo de esta herramienta quirúrgica en nuestro medio. En cuanto al primer aspecto, cuantificar el efecto sobre la tasa de RC en la cirugía guiada con 5-ALA en los pacientes con gliomas de alto grado considerados candidatos a cirugía en la práctica habitual en España. En cuanto al segundo aspecto, cuantificar el impacto en la SLP6 en el GBM, en un entorno donde la radioterapia con temozolomida es ya el tratamiento estándar, igualmente, dentro de la práctica habitual en España.
La supervivencia global (SG) es la variable de resultado de elección para valorar la eficacia de cualquier tratamiento. Sin embargo, en el momento de diseñar el estudio, no se disponía de casos suficientes de utilización de 5-ALA en España, puesto que ello hubiera requerido un seguimiento de entre 12 y 24 meses tras la cirugía, mientras que el uso de Gliolan® en España es todavía muy reciente, habiéndose utilizado como medicamento de uso compasivo desde julio del 2008. Gliolan® recibió su autorización en España por las autoridades sanitarias en octubre del 2010, iniciándose su comercialización en el año 2011. Un estudio de SG implicaría asimismo una muestra mucho mayor (570 pacientes en el estudio de Stupp et al.8) que resultaría inasumible para los propósitos de este estudio, incluso si hubiese una población tan grande de pacientes tratados con Gliolan®.
Material y métodosEl estudio fue revisado y aprobado por el Comité Ético de investigación clínica del Gobierno de Navarra. Fue asimismo aprobado por la Agencia Española de Medicamentos y Productos Sanitarios. Bajo solicitud local, fue también revisado por los Comités Éticos de los centros participantes, como requisito para obtener la aceptación de la entidad proveedora y/o firma del contrato con los centros. Se realizó de acuerdo con las recomendaciones de la Orden SAS/3470/2009 de 16 de diciembre sobre estudios postautorización de tipo observacional para medicamentos de uso humano.
Este estudio ha seguido un diseño observacional, retrospectivo y multicéntrico, de 2 grupos de pacientes que se distinguen por la utilización o no de 5-ALA (Gliolan®, Laboratorios Gebro Pharma S.A., Barcelona) durante el tratamiento quirúrgico de primera línea de los gliomas malignos (grados iii y ivde la clasificación de la Organización Mundial de la Salud).
Para obtener los 2 grupos para estudio, se remitieron cuestionarios de viabilidad a 27 centros españoles con neurocirugía y se seleccionó un grupo de centros donde la técnica de extirpación con 5-ALA estaba disponible y se usaba habitualmente, y un grupo de centros donde no estaba disponible, por lo tanto, no se había empleado anteriormente.
Para obtener los 2 grupos de pacientes comparables, se establecieron los criterios de inclusión y exclusión recogidos en la tabla 1. Estos criterios incluyen los de indicación clínica que deben cumplir los pacientes para uso de 5-ALA en los centros donde se usa, además de los datos básicos de seguimiento. Al utilizar estos mismos criterios para los pacientes de los centros donde no se disponía de 5-ALA, se intentó seleccionar a grupos de pacientes lo más homogéneos posibles. Según los criterios de inclusión y exclusión, los pacientes operados sin 5-ALA hubieran sido operados con 5-ALA si el centro en el que se operaron hubiera implantado esa técnica. Se recogieron pacientes operados a partir de julio del 2008 y hasta enero de 2011, para asegurar que había al menos 6 meses de seguimiento.
Criterios de selección de pacientes
| Criterios de inclusiónPacientes adultos (≥ 18 años) con diagnóstico clínico de glioma maligno de alto grado (iii y iv) según la clasificación de la OMS, con presencia de una masa tumoral que produjera sintomatología y en los que la imagen de RM preoperatoria mostró un tumor captante de contraste |
| Pacientes en los que fue efectuada (con posterioridad a julio del 2008) una primera resección del tumor por métodos quirúrgicos, en la que se intentaba realizar una exéresis macroscópica total |
| Pacientes en los que fue indicado tratamiento adyuvante de radioterapia junto con temozolomida como intención de tratamiento |
| Pacientes de los que se disponía, al menos, de una RM postoperatoria, realizada como máximo hasta 28 días después de la cirugía, pero en cualquier caso antes del inicio de la radioterapia |
| Pacientes de los que se disponía de información de su evolución de al menos 6 meses después de la cirugía, o bien fallecieron en este periodo (lo que hubiera ocurrido primero) |
| Criterios de exclusión |
| Hipersensibilidad al clorhidrato de ácido 5-aminolevulínico o a las porfirinas |
| Porfiria de tipo agudo o crónico |
| Embarazo |
Se enviaron por correo cuadernos de recogida de datos (CRD) a los investigadores de cada centro. Para cada paciente se recogieron: fecha de la cirugía, edad, estado funcional valorado mediante la escala de Karnofsky (KPS), localización del tumor, volumen tumoral preoperatorio o diámetros máximos, estado neurológico preoperatorio, estado neurológico postoperatorio y evolución posterior si se produjo algún déficit, fecha de resonancia posquirúrgica, volumen tumoral postoperatorio o diámetros máximos, tratamiento adyuvante poscirugía, estado clínico en las revisiones posteriores a 3, 6, 9 y 12 meses, así como fecha de progresión o fallecimiento, si se habían producido. La fecha tope de seguimiento era octubre del 2011. Dentro de la localización del tumor, se recogieron como variables si estaba situado en área elocuente, no elocuente o dudoso, si afectaba al epéndimo, si cruzaba la línea media, así como el lóbulo principal donde estaba situado.
Para la valoración de la existencia o no de RC, se utilizó la RM postoperatoria, debiendo el investigador considerar el resultado como RC, resección incompleta o dudosa. El estándar aceptado para valorar el resto tumoral posquirúrgico es la RM sin y con contraste realizada en los primeros 3 días; sin embargo, los cuestionarios de viabilidad indicaron que ese estudio no está disponible rutinariamente en muchos centros españoles, por lo que se aceptó la valoración por una RM realizada antes de empezar la RT. En el plan de análisis se incluyó considerar de forma diferente las RM dudosas y un análisis por subgrupos de los resultados de RM temprana (cuando esta ha sido realizada antes de 5 días de la cirugía) o tardía (cuando se ha realizado entre los 6 y 28 días de la cirugía).
Variables principales del estudioLas variables principales del estudio fueron la tasa de RC y la SLP6 en GBM. La RC se definió como la proporción de pacientes con glioma de grado iii y iv operados con 5-ALA u operados con la microcirugía tradicional con luz blanca, que no presentaban captación de contraste en la RM postoperatoria de control previa a la radioterapia. La SLP6 se definió como la tasa de pacientes con glioma de grado iv en los que a los 6 meses tras la cirugía no se había producido progresión de la enfermedad o muerte por cualquier causa. Se definió como progresión la aparición de nuevas lesiones captantes de contraste mayores de 1cm, incremento en la extensión del tumor de un 25% o más según la RM, empeoramiento en la condición clínica/neurológica o necesidad de incrementar los corticoides9. Para el análisis de la SLP6 solo se incluyó a los pacientes con GBM, dado que la supervivencia es muy distinta para los pacientes con gliomas de grado iii. Además, su número es insuficiente para efectuar un análisis por separado.
Métodos estadísticosEn todas las pruebas estadísticas realizadas con las variables de resultados se ha utilizado un nivel de significación de 0,05. Para el análisis de las variables principales se utilizó la prueba de la chi cuadrado y además se estimó su asociación con el grupo de tratamiento mediante regresión logística. El análisis de los datos se ha realizado utilizando el programa SPSS, versión 19.
Además, antes de llevar a cabo el análisis principal, se hizo un análisis descriptivo y comparativo de las características demográficas y clínicas de los pacientes.
Para comprobar la homogeneidad entre el grupo de pacientes operados con 5-ALA y el grupo operado con microcirugía tradicional con luz blanca, se utilizaron la prueba del contraste no paramétrico U de Mann-Whitney en el caso de las variables numéricas y la prueba de la chi al cuadrado o Fisher para las variables categóricas. Se complementó el análisis de los datos crudos ajustando por las covariables recogidas.
Con el fin de cumplir con los requisitos de farmacovigilancia requeridos por la legislación para los estudios observacionales, y dado el carácter retrospectivo de este estudio, se ha realizado un análisis descriptivo de los acontecimientos adversos que pueden guardar relación con el producto y los que están relacionados con el procedimiento mediante tablas de frecuencia. Para la comparación entre el grupo operado con 5-ALA y el grupo operado con la microcirugía tradicional con luz blanca se ha utilizado la prueba de la chi al cuadrado.
Para calcular el tamaño muestral del estudio, se estimó un incremento de un 26% de RC y un incremento de un 16% en la SLP6 en el grupo operado con 5-ALA, basado en los resultados de Stummer et al7. A partir de esta estimación, se calculó un tamaño muestral deseable de 142 casos valorables en cada uno de los 2 grupos de tratamiento, fijando un error alfa de 0,05 y un poder de 0,80.
ResultadosEn el estudio se recogieron finalmente 264 casos. 13 casos resultaron no elegibles, 12 porque la fecha de cirugía era posterior a enero del 2011, luego incumplían un criterio de inclusión, y uno porque no constaba la fecha de realización de la RM postoperatoria. Una vez eliminados los casos no elegibles, se analizaron 251 casos (95,1%) en total, 131 pertenecientes al grupo operado con 5-ALA y 120 pertenecientes al grupo operado con microcirugía tradicional con luz blanca.
La mayoría de tumores se correspondió con diagnóstico histológico de GBM multiforme, siendo del 85% en el grupo de luz blanca y del 93,1% con 5-ALA®.
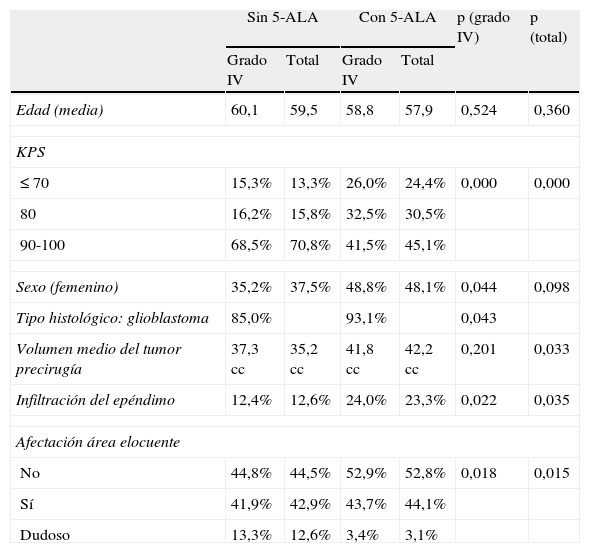
Los principales factores pronósticos de los pacientes tratados se recogen en la tabla 2. Puede verse que había algunas diferencias significativas. En el grupo de pacientes operados sin 5-ALA, había un número claramente mayor de pacientes en grupos de estado funcional bueno (KPS 90-100) y un porcentaje mayor de pacientes con dudosa afectación de área elocuente. En el grupo de pacientes operados con 5-ALA, el volumen preoperatorio del tumor fue algo mayor y hubo más tumores con infiltración del epéndimo.
Características basales y factores pronósticos de los pacientes
| Sin 5-ALA | Con 5-ALA | p (grado IV) | p (total) | |||
| Grado IV | Total | Grado IV | Total | |||
| Edad (media) | 60,1 | 59,5 | 58,8 | 57,9 | 0,524 | 0,360 |
| KPS | ||||||
| ≤ 70 | 15,3% | 13,3% | 26,0% | 24,4% | 0,000 | 0,000 |
| 80 | 16,2% | 15,8% | 32,5% | 30,5% | ||
| 90-100 | 68,5% | 70,8% | 41,5% | 45,1% | ||
| Sexo (femenino) | 35,2% | 37,5% | 48,8% | 48,1% | 0,044 | 0,098 |
| Tipo histológico: glioblastoma | 85,0% | 93,1% | 0,043 | |||
| Volumen medio del tumor precirugía | 37,3 cc | 35,2 cc | 41,8 cc | 42,2 cc | 0,201 | 0,033 |
| Infiltración del epéndimo | 12,4% | 12,6% | 24,0% | 23,3% | 0,022 | 0,035 |
| Afectación área elocuente | ||||||
| No | 44,8% | 44,5% | 52,9% | 52,8% | 0,018 | 0,015 |
| Sí | 41,9% | 42,9% | 43,7% | 44,1% | ||
| Dudoso | 13,3% | 12,6% | 3,4% | 3,1% | ||
p (grado IV): nivel de significación de las diferencias entre los 2 grupos para los tumores de grado iv.
p (total): nivel de significación de las diferencias entre los 2 grupos para todos los tumores.
Respecto a las variables principales, la proporción de RC confirmadas mediante RM en el conjunto de pacientes operados con 5-ALA fue mayor que en el grupo operado con luz blanca, el 67,2 frente al 45%; esta diferencia fue muy significativa, con p=0,000. Del mismo modo, la tasa de pacientes con tumores de grado iv que mantenían SLP6 fue superior en el grupo operado con 5-ALA, el 69,1 frente al 48,1% en los operados con técnica tradicional; esta diferencia también fue significativa, con p=0,002.
Los resultados de las variables principales fueron similares y también significativos cuando se ajustaron por los factores pronósticos conocidos de edad, KPS y afectación o no de áreas elocuentes, y también incluyendo todas las posibles covariables conocidas recogidas en el estudio (tablas 3 y 4).
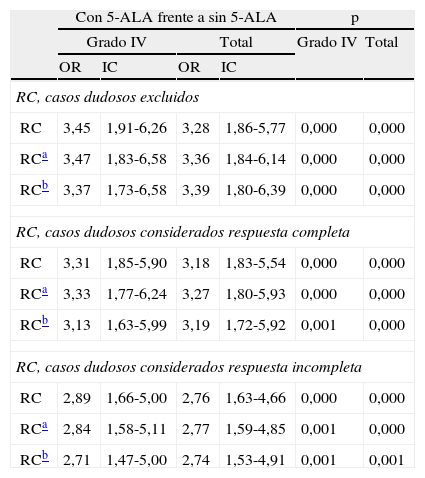
Odds ratio para resecciones completas con el uso de 5-ALA
| Con 5-ALA frente a sin 5-ALA | p | |||||
| Grado IV | Total | Grado IV | Total | |||
| OR | IC | OR | IC | |||
| RC, casos dudosos excluidos | ||||||
| RC | 3,45 | 1,91-6,26 | 3,28 | 1,86-5,77 | 0,000 | 0,000 |
| RCa | 3,47 | 1,83-6,58 | 3,36 | 1,84-6,14 | 0,000 | 0,000 |
| RCb | 3,37 | 1,73-6,58 | 3,39 | 1,80-6,39 | 0,000 | 0,000 |
| RC, casos dudosos considerados respuesta completa | ||||||
| RC | 3,31 | 1,85-5,90 | 3,18 | 1,83-5,54 | 0,000 | 0,000 |
| RCa | 3,33 | 1,77-6,24 | 3,27 | 1,80-5,93 | 0,000 | 0,000 |
| RCb | 3,13 | 1,63-5,99 | 3,19 | 1,72-5,92 | 0,001 | 0,000 |
| RC, casos dudosos considerados respuesta incompleta | ||||||
| RC | 2,89 | 1,66-5,00 | 2,76 | 1,63-4,66 | 0,000 | 0,000 |
| RCa | 2,84 | 1,58-5,11 | 2,77 | 1,59-4,85 | 0,001 | 0,000 |
| RCb | 2,71 | 1,47-5,00 | 2,74 | 1,53-4,91 | 0,001 | 0,001 |
IC: intervalo de confianza del 95%; OR: odds ratio; RC: resecciones completas.
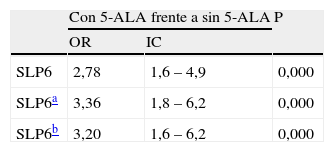
OR para supervivencia libre de progresión a los 6 meses con el uso de 5-ALA
| Con 5-ALA frente a sin 5-ALA | P | ||
| OR | IC | ||
| SLP6 | 2,78 | 1,6 – 4,9 | 0,000 |
| SLP6a | 3,36 | 1,8 – 6,2 | 0,000 |
| SLP6b | 3,20 | 1,6 – 6,2 | 0,000 |
IC: intervalo de confianza del 95%; OR: odds ratio; SLP6: supervivencia libre de progresión a los 6 meses.
Para la valoración de la tasa de RC, se tuvo en cuenta la posibilidad de que la valoración de si había o no tumor residual en la RM fuera dudosa, y se recogió esa opción en el CRD. En el análisis se comparó la tasa de RC para los 3 posibles supuestos: excluir los resultados dudosos, considerarlos como resecciones completas o considerarlos como incompletas. La tasa de RC obtenida con 5-ALA fue significativamente mayor tanto para los pacientes con tumores de grado iv, como para la muestra total, en todos los supuestos. En el modelo de excluir los casos dudosos, la odds ratio sin ajustar para todos los tumores fue de 3,3, con un intervalo de confianza (IC) de 1,9-5,8, un efecto de tratamiento importante y muy significativo (p=0,000); ajustando por edad, KPS y afectación de área elocuente, la odds ratio fue de 3,4, IC de 1,8-6,1 (p=0,000); ajustado por todas las variables con significación: 3,4, IC de 1,8-6,4 (p=0,000). En la tabla 3 se muestra la odds ratio del efecto de 5-ALA sobre la RC para todos los supuestos y solo para los tumores de grado iv, ajustados y sin ajustar. Como puede verse, el efecto es importante y significativo en todos los supuestos del análisis.
Se realizó también una comparación de la tasa de RC sin y con 5-ALA utilizando solo los resultados de los casos en los que se había realizado una RM precoz en los primeros 5 días, 118 en el grupo con 5-ALA y 80 sin 5-ALA. La diferencia fue similar al resultado con la muestra total e igualmente significativa (72,9% con 5-ALA frente a 50,0% sin 5-ALA, p=0,003), sin cambios en las diversas interpretaciones de la RM dudosa.
Para la SLP6, los resultados son similares a los obtenidos para la RC (71,2% con 5-ALA frente a 52,5% sin 5-ALA, p=0,010). Para esta variable, la odds ratio sin ajustar fue de 2,8, con un IC de 1,6-4,9, un efecto de tratamiento importante y muy significativo (p=0,000); ajustando por edad, KPS y afectación de área elocuente, la diferencia es aún mayor, con odds ratio de 3,4, IC de 1,8-6,2 y p=0,000, ajustado por todas las variables significativas (edad, KPS, afectación del área elocuente y el hecho de recibir quimioterapia en monoterapia): 3,20, IC de 1,6-6,2, p=0,001.
Se realizó también, para ambos objetivos del estudio, un análisis de los subgrupos determinados por los principales factores pronósticos, como se detalla a continuación. A la hora de interpretar estos datos, se debe tener en cuenta que el tamaño de algunos de los subgrupos es tan pequeño que no se puede esperar diferencias estadísticamente significativas para ellos.
Para los diversos intervalos de KPS, la diferencia en la tasa de RC se mantuvo similar (KPS ≤ 80: 68,8% frente a 46,9%, p=0,047; KPS > 80: 80,0% frente a 48,8%, p=0,000). Las diferencias en la SLP6 se comportaron igual, se aprecian en todos los intervalos, aunque solo alcanzan significación en el subgrupo más numeroso, el de los pacientes en mejor estado funcional (KPS < 60: 50% frente a 33,3%, p=1,0; KPS 70-80: 61,3% frente a 46,9%, p=0,19, y KPS 90-100: 84,7-51,8%, p=0,000),
Respecto a la localización en área elocuente o no, en los tumores localizados en área no elocuente la tasa de RC fue superior en los operados con 5-ALA, con una diferencia de 74,6 frente a 63,3%, y no significativa, p=0,216. En los tumores localizados en vecindad de área elocuente la diferencia fue mucho mayor, 75,9% frente a 35.8%, con p=0,000. La SLP6 sí mantuvo una diferencia similar y estadísticamente significativa para tumores localizados en área no elocuente (80,6% frente a 54,7%, p=0,003) y para tumores localizados en área elocuente (64,3% frente a 42,9%, p=0,032).
Se analizaron también las complicaciones neurológicas en el intervalo perioperatorio inmediato y al cabo de un mes de la intervención. En postoperatorio inmediato, en el grupo operado con 5-ALA se apreció una tasa significativamente mayor de 2 complicaciones neurológicas: afasia y hemianopsia. Se apreció afasia en un 26,9% frente al 10,0% de los pacientes operados sin 5-ALA (p=0,048). Al mes de la cirugía, se habían resuelto un buen número de estos déficits, persistiendo en un 10,5% del grupo de 5-ALA y en un 5% del grupo sin 5-ALA. Este déficit era más frecuente también antes de la intervención, aunque esa diferencia no alcanzaba significación estadística (el 24,8 frente al 19,8%). También se apreció una diferencia significativa en la aparición de hemianopsia (25,4% frente a 5%, p=0,008), que en casi todos los casos había desaparecido al mes (persistían el 2,3 frente al 2,5%). Al igual que con la afasia, había más pacientes en el grupo de 5-ALA que presentaban hemianopsia antes de la intervención (el 15,2 frente al 8,1%, no siendo significativa la diferencia, p=0,109). El resto de las complicaciones neurológicas se presentaron con frecuencias similares en ambos grupos.
DiscusiónA pesar de tener una muestra ligeramente inferior al objetivo fijado, los resultados de este trabajo son estadísticamente significativos y confirman los objetivos primarios, dentro de las limitaciones metodológicas del estudio. Un análisis de potenciales debilidades indica que, por el carácter observacional y retrospectivo, los datos obtenidos están sujetos a la calidad y cantidad de la información que se haya recogido, en comparación con un estudio prospectivo, controlado. Sin embargo, la relevancia de los resultados es importante para la práctica diaria, porque esto es precisamente lo que se ha recogido. Los resultados reflejan la situación en España, y son ampliamente aplicables, dado que el cuestionario de viabilidad se mandó a la mayoría de centros de gran volumen, incluyendo centros de todas las comunidades autónomas con neurocirugía. La principal limitación para la participación de algunos centros fue el hecho de que la RM de control no es una práctica estándar.
Específicamente, en este estudio se podría plantear la duda de la fiabilidad de la evaluación del grado de resección por el investigador. La fiabilidad lógicamente no es la misma que utilizando un revisor centralizado. Para este aspecto, es importante señalar que los resultados coinciden utilizando todos los posibles modelos, tanto si el efecto se mide sin ajustar, como ajustado por edad, puntuación KPS y afectación del área elocuente, e incluso cuando se ajusta la resección por todas las variables que se asocian a la vez. También son coherentes los resultados de la tasa de RC con los resultados de SLP6, en todos los modelos de ajuste. Esta concordancia refuerza la validez de los resultados, aunque la SLP6 puede verse afectada por otros factores no analizables en un estudio de estas características (retrospectivo, multicéntrico, «no ciego»).
Los resultados de RC observados en la práctica diaria en España se aproximan bastante a los observados en el estudio prospectivo aleatorizado de Stummer et al.7. La tasa de RC en este estudio fue del 67% frente a 45% comparado con el 65% frente a 36% en el de Stummer. Aunque los trabajos son difícilmente comparables, esta concordancia de datos confirma que la utilización del producto proporciona precisamente los resultados esperables a priori.
Estos resultados indican también que el beneficio de la temozolomida (TMZ) se añade al de la resección. En el trabajo aleatorizado previo con 5-ALA7, los pacientes recibieron solo cirugía y radioterapia, ya que es anterior a la aceptación de RT + TMZ como tratamiento estándar. La tasa de SLP6 meses en el presente trabajo es claramente mayor que la observada por Stummer, para ambos grupos (69% con 5-ALA frente a 48% en este estudio, y 41% con 5-ALA frente a 21,1% en el de Stummer). Eso indica que la adición de TMZ proporciona un incremento en torno a un 27% de pacientes en SLP, que se añaden al 20% de incremento que consigue 5-ALA. La tasa de SLP observada en los pacientes tratados con 5-ALA en este estudio supera la del trabajo de Stupp et al., que definió el actual estándar, que fue del 53,9%8. Este hallazgo es especialmente importante para confirmar la aplicabilidad de los resultados del beneficio de 5-ALA a la situación actual en España o en otros países, ya que se ha planteado la duda de si la utilidad de la RC disminuiría al utilizar una quimioterapia eficaz.
Como limitación del estudio, debe señalarse que no puede descartarse la existencia de casos de seudoprogresión, dado que en las fechas en las que se trató a los pacientes los criterios RANO no estaban en vigor. No parece haber ningún motivo, sin embargo, por el que la tasa de seudoprogresión fuera distinta en uno u otro grupo. Por otra parte, en el citado trabajo de Stupp de 2005, de referencia en este campo, no se contempla todavía el fenómeno de la seudoprogresión, por lo que los resultados serían comparables.
La mejoría de la supervivencia global es el objetivo último de todas las actuaciones terapéuticas en este tipo de tumores, por ello puede plantearse si sería el objetivo deseable en un estudio como este. Hay que tener en cuenta que todos los tratamientos que recibe un paciente después de la primera cirugía, y las diferentes respuestas a los mismos, se comportan aquí como factores de confusión. Para compensar esto, se requerirían un enorme número de pacientes y un seguimiento mucho mayor que el poco tiempo transcurrido desde que se dispone del producto en España. Pero además de eso, desde nuestro punto de vista, es esencial recordar que el 5-ALA es química y legalmente un fármaco, pero, funcionalmente, es una herramienta quirúrgica. No tiene efecto sobre el tumor, su única utilidad es ayudar al cirujano a conseguir una extirpación más completa de la lesión. Por ello, entendemos que el objetivo fundamental que debe estudiarse es si cumple bien esa función. Este trabajo multicéntrico observacional coincide con los diversos estudios publicados previamente, con distintos enfoques, en señalar que es eficaz para esa función10-14. La utilidad de la RC forma parte de una discusión mucho más amplia en neurooncología, en la que se incluyen todas las herramientas que pueda utilizar el neurocirujano. Existe actualmente evidencia de nivel 2b de ese beneficio1 y se acepta por los grupos más relevantes que la RC se asocia a mayor supervivencia2,3. Además de proporcionar beneficio por sí misma, los datos sugieren que la RC proporciona la mejor situación de partida para que los tratamientos adyuvantes tengan éxito15.
A la vez que el 5-ALA sirve para conseguir resecciones mayores, se observa en estos resultados que esas resecciones se asocian a un riesgo mayor de lesiones neurológicas. Es conocido que los gliomas malignos son tumores difusos sin bordes definidos que infiltran el parénquima que los rodea, y que el 5-ALA muestra con precisión el tumor sólido, y también, con una intensidad diferente parte del área infiltrada alrededor16,17,14,18. La recomendación del uso del producto recuerda que el beneficio demostrado se asocia a la extirpación de la fluorescencia más intensa y que la fluorescencia débil corresponde a infiltración y debe extremarse la precaución si se usa en vecindad de áreas elocuentes. Se recomienda así mismo la utilización neurofisiológica intraoperatoria si se va a realizar una extirpación completa cerca de un área elocuente11,19. En este estudio, no se controló la utilización o no de monitorización neurofisiológica; el aumento de déficits en el grupo operado con 5-ALA confirma que es recomendable su utilización en los casos de especial riesgo. La mayoría de los déficits neurológicos fueron transitorios y se ha descrito que los pacientes con resecciones incompletas presentan antes deterioro neurológico por la enfermedad20, por ello el equilibrio entre riesgo de déficit inmediato y beneficio futuro debe valorarse cuidadosamente por el neurocirujano y con el paciente en cada caso.
Como conclusiones, el uso de 5-ALA para la cirugía de glioma maligno en la práctica diaria en España se asocia a un incremento estadísticamente significativo en la tasa de extirpación completa y en la SLP6 en GBM. Este incremento es de una magnitud clínicamente relevante y se mantiene significativo tras ajustarse por las diversas covariables.
FinanciaciónEste trabajo ha sido financiado por Laboratorios Gebro Pharma S.A.
Conflicto de interesesJordi Galván, Cristina Arza y Cristina Romáriz son empleados de Laboratorios Gebro Pharma, S.A..
Cristina Vidal, John Slof, y Ricardo Díez Valle han recibido honorarios de Laboratorios Gebro Pharma, S.A..
A todos los investigadores del estudio VISIONA: Dr. Ricardo Díez Valle; Dra. Pilar Teixidor i Rodriguez; Dra. Gloria Villalba Martínez; Dr. Jose Manuel Cabezudo; Dr. Luis Miguel Bernal García; Dr. Josep J. González Sánchez; Dr. Enrique Ferrer Rodríguez; Dr. Miguel Ángel Arraez Sánchez; Dr. Gonzalo Olivares Granados; Dr. Álvaro Toledano Delgado; Dr. Gerardo Conesa Bertrán. Dr. Juan José Acebes Martín; Dr. Gerard Plans Ahicart; Dr. Avelino Parajón Díaz; Dr. Carlos Botella Asunción; Dr. Ricardo Prat Acin; Dra. Marta del Álamo de Pedro; Dr. Luis Ley Urzaiz; Dr. Juan A. Barcia; Dr. Juan R. Brin; Dr. José María Torres Campa-Santamarina; Dr. Ángel Maíllo Sánchez, y Dr. Jesús Merino Peña.
Un resumen oral de este trabajo fue presentado en el XVII Congreso de la Sociedad Española de Neurocirugía en mayo del 2012.