El tratamiento endovascular (trombólisis farmacológica intraarterial y trombectomía mecánica) en el ictus isquémico agudo se está implantando en la práctica clínica cotidiana, aunque continúa en desarrollo su investigación. En ausencia de datos suficientes que permitan fundamentar sólidamente las recomendaciones para su uso, es necesario elaborar protocolos de actuación basados en el conocimiento acumulado, así como monitorizar las actuaciones.
DesarrolloTras revisión bibliográfica, en reuniones de trabajo de expertos para llegar a un consenso, se ha elaborado un protocolo de actuación que incluye indicaciones y contraindicaciones para la aplicación de tratamiento endovascular y recomendaciones referentes a la metodología de diagnóstico y selección de los pacientes, de los procedimientos de revascularización y manejo posterior, con el objetivo de incrementar las probabilidades de eficacia y beneficio del tratamiento y minimizar los riesgos de complicaciones y de recanalización fútil. En función del análisis de las necesidades asistenciales y los recursos disponibles se ha elaborado un sistema organizativo de colaboración interhospitalaria, para asegurar la accesibilidad al tratamiento garantizando el menor tiempo de respuesta y una relación coste/eficacia favorable. Incluye un registro prospectivo común con fines de monitorización para detectar oportunidades de mejora.
ConclusionesPara la implantación de técnicas endovasculares de tratamiento del ictus isquémico agudo es imprescindible la elaboración de protocolos de actuación basados en las evidencias disponibles y el establecimiento de sistemas adecuados de organización asistencial para garantizar el rigor y la eficacia de las actuaciones. Es necesario monitorizar los procedimientos con el fin de optimizar la metodología.
Endovascular therapies (intra-arterial thrombolysis and mechanical thrombectomy) after acute ischaemic stroke are being implemented in the clinical setting even as they are still being researched. Since we lack sufficient data to establish accurate evidence-based recommendations for use of these treatments, we must develop clinical protocols based on current knowledge and carefully monitor all procedures.
DevelopmentAfter review of the literature and holding work sessions to reach a consensus among experts, we developed a clinical protocol including indications and contraindications for endovascular therapies use in acute ischaemic stroke. The protocol includes methodology recommendations for diagnosing and selecting patients, performing revascularisation procedures, and for subsequent patient management. Its objective is to increase the likelihood of efficacy and treatment benefit and minimise risk of complications and ineffective recanalisation. Based on an analysis of healthcare needs and available resources, a cooperative inter-hospital care system has been developed. This helps to ensure availability of endovascular therapies to all patients, a fast response time, and a good cost-to-efficacy ratio. It includes also a prospective register which serves to monitor procedures in order to identify any opportunities for improvement.
ConclusionsImplementation of endovascular techniques for treating acute ischaemic stroke requires the elaboration of evidence-based clinical protocols and the establishment of appropriate cooperative healthcare networks guaranteeing both the availability and the quality of these actions. Such procedures must be monitored in order to improve methodology.
La reperfusión precoz del tejido isquémico es uno de los objetivos fundamentales del tratamiento del ictus isquémico agudo. Esta afirmación es, hoy en día, mucho más que un mero planteamiento teórico, puesto que está sobradamente demostrado que ello es factible y que la evolución de los pacientes en los que se consigue esta reperfusión es significativamente mejor.
La trombólisis sistémica por vía intravenosa (TIV) con activador tisular del plasminógeno intravenoso o alteplasa (rtPA iv) ha demostrado su eficacia en el tratamiento de pacientes con ictus isquémico agudo de menos de 4,5h de evolución que no presenten contraindicación, y está actualmente implantada en la práctica clínica cotidiana. Las limitaciones fundamentales de este tratamiento son la corta ventana terapéutica y su menor eficacia en el caso de oclusiones de gran vaso (carótida interna, segmento inicial de arteria cerebral media, arteria basilar), o de trombos de gran tamaño, junto al hecho de estar contraindicada en algunos pacientes que, por sus características, presentan un riesgo más elevado de complicaciones hemorrágicas1–7.
En los últimos años se han desarrollado distintas terapias endovasculares (TEV) para procurar la recanalización arterial mediante un abordaje endovascular. Estas incluyen la trombólisis farmacológica intraarterial (TIA) y la trombectomía mecánica (TM) mediante distintos dispositivos de extracción8–10. El objetivo fundamental es conseguir una mayor eficacia de recanalización al actuar in situ, especialmente en oclusiones de gran vaso, disminuir las complicaciones hemorrágicas y aumentar la ventana de oportunidad para la intervención, con el fin de poder ser aplicable de forma eficaz en un mayor número de pacientes. Frente a estas ventajas teóricas, el abordaje endovascular tiene el inconveniente de su mayor complejidad, necesitando más tiempo de actuación, y el riesgo de complicaciones intraoperatorias, sin olvidar la posibilidad de conseguir un buen resultado radiológico que no asocie un beneficio clínico (recanalización fútil)11,12. Es por ello que en estos casos es necesaria una estricta y adecuada selección de los pacientes para poder ofrecer un balance riesgo/beneficio favorable. Posiblemente en la definición de los criterios de selección intervengan no solo el factor tiempo o datos clínicos como la edad o la gravedad del ictus11, sino aquellos que permitan identificar tanto la persistencia de tejido viable (área de penumbra), como la existencia de circulación colateral eficaz mediante las técnicas de neuroimagen multimodal7,13–15.
En cuanto a la trombólisis farmacológica por vía intraarterial (IA), existen 2 ensayos clínicos con prourocinasa recombinante16,17 y algunas series de casos con rtPA18–20 que demuestran que estos agentes producen recanalización eficaz cuando se aplican por vía IA, aumentando el porcentaje de pacientes con buena evolución clínica comparado con controles (40-49% vs. 25-39%). La ventana de oportunidad para este tratamiento es 6h en territorio anterior y hasta 24h en posterior9. Sin embargo solo el estudio PROACT II17 obtiene diferencias significativas a favor de la TIA en la evolución de los pacientes. Un metaanálisis de los estudios disponibles muestra que la TIA incrementa la tasa de recanalización así como de buena evolución clínica. También incrementa la tasa de complicaciones hemorrágicas, pero no la mortalidad8. Aunque algunos estudios así lo sugieren20, por el momento no se ha podido demostrar claramente que la TIA sea más eficaz clínicamente que la TIV. Ello se ha puesto en relación con el hecho de que los pacientes se tratan más tarde y están más gravemente afectados por tener oclusiones de gran vaso.
Algunas series y un metaanálisis muestran que la aplicación de trombolíticos por vía IA después de una TIV que resulta fallida es segura y eficaz en cuanto a la obtención de recanalización, aunque no se ha podido demostrar con suficiente nivel de evidencia que tenga mayor eficacia clínica21–25. La terapia combinada (TIV seguida de TEV farmacológica o, preferiblemente, TM) en casos seleccionados en los que fracasa la TIV podría ser una opción razonable, especialmente teniendo en cuenta que la disponibilidad de tratamientos endovasculares no debe excluir la TIV si el paciente se encuentra dentro de ventana temporal y no tiene otra contraindicación26. Sigue habiendo estudios en marcha que investigan esta combinación. El estudio IMS III se ha detenido recientemente por futilidad, si bien los resultados definitivos están pendientes de publicación27.
La TM obtiene una tasa de recanalización entre el 45 y el 81% según el dispositivo utilizado y podría combinarse con la aplicación local de fármacos trombolíticos28–32. Los estudios muestran un aumento de la probabilidad de evolución favorable entre los pacientes que se recanalizan satisfactoriamente, si bien en conjunto, el porcentaje de pacientes con evolución favorable no es más alto que el de los pacientes tratados con TIA o TIV, aunque debe tenerse en cuenta que estos pacientes a priori tienen peor pronóstico pues todos ellos tienen oclusiones de gran vaso cerebral, mayor gravedad clínica con puntuación más alta en la National Institute of Health Stroke Scale (NIHSS) y, en general, se tratan más tarde. Los estudios de TM asocian un porcentaje de hemorragias sintomáticas de hasta el 10% y una mortalidad de hasta el 34%. La ventana terapéutica en estos casos es de hasta 8h en el territorio anterior y podría ser hasta de 24h en el territorio posterior9,10,26,33.
Pese a que la evidencia disponible se basa en pocos ensayos clínicos aleatorizados, en series cortas y en registros prospectivos, la TEV resulta prometedora y cada vez se va implantando más en la práctica clínica34,35. No obstante, la eficacia de este tratamiento continúa siendo objeto de investigación y existen aun muchos aspectos por definir. Como se apuntaba previamente, es necesario establecer criterios fiables que permitan predecir qué pacientes se beneficiarán de tratamiento y cuáles no, con el fin de rentabilizar tanto los riesgos como el coste del proceso. Es por ello necesario establecer protocolos de actuación que obliguen a realizar los tratamientos de forma rigurosa en centros con experiencia y que dispongan de la dotación necesaria (unidades de ictus, sala de intervencionismo vascular) así como establecer los sistemas organizativos extra- e intrahospitalarios que aseguren la asistencia urgente en estos centros de todos los pacientes que puedan beneficiarse de los tratamientos, dando una respuesta adecuada a las necesidades de la población ajustando los recursos disponibles36,37. De la misma manera es necesario cumplimentar registros colaborativos en los que se incluyan todos los casos, los procedimientos y las complicaciones, con el fin de monitorizar la eficacia de la actuación y mejorar aquellos puntos que lo requieran.
Esto solo será posible con una buena planificación y colaboración entre los hospitales para poder organizar una guardia de neurointervencionismo que asegure la disponibilidad del tratamiento endovascular en un área sanitaria determinada. Con este objetivo surge el protocolo que presentamos a continuación.
DesarrolloEste protocolo de tratamiento endovascular del ictus isquémico agudo es fruto del trabajo colaborativo de neurólogos del Foro Ictus de la Asociación Madrileña de Neurología y neurorradiólogos intervencionistas de hospitales de la Comunidad de Madrid. Se encuadra dentro del Plan de Atención del Ictus de la Comunidad de Madrid y se apoya en la organización asistencial de colaboración interhospitalaria promovida por este Plan37.
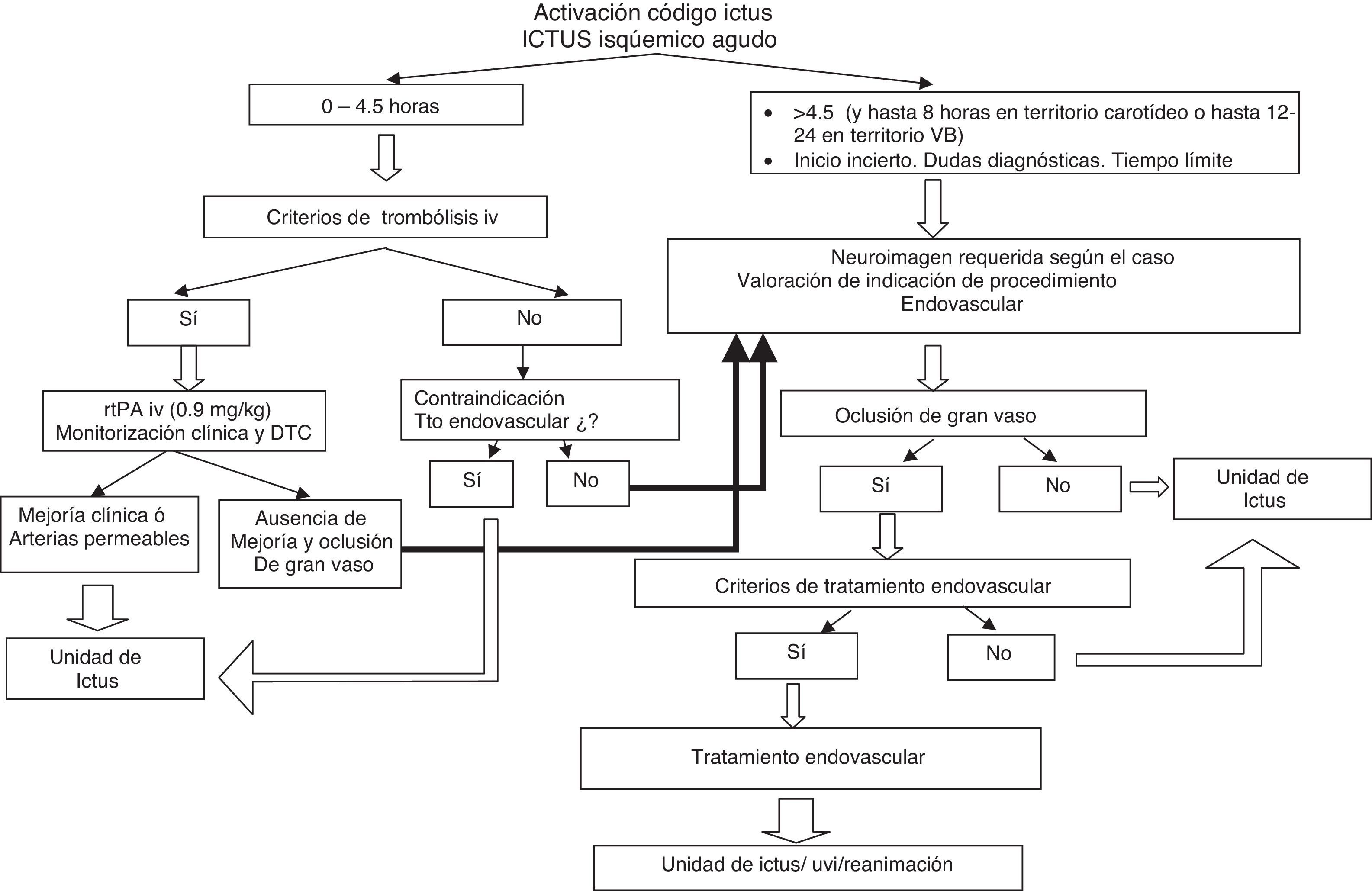
La elaboración del mismo se fundamenta en las evidencias disponibles tras revisión de la bibliografía más relevante y se ha llevado a cabo mediante reuniones de trabajo del Comité de Redacción. Los borradores han sido discutidos posteriormente por el Comité ad Hoc para llegar a un consenso final que se recoge en este trabajo. Incluye las indicaciones y contraindicaciones para la aplicación del tratamiento (tabla 1), recomendaciones referentes a la metodología de diagnóstico y selección de los pacientes, diagrama de flujo para la toma de decisión (fig. 1), recomendaciones en cuanto a los procedimientos de revascularización y un registro prospectivo común en el que se incluyen todos los sujetos en los que se indica el tratamiento, con fines de monitorización del proceso en su conjunto. Las indicaciones y contraindicaciones para el procedimiento se han establecido con el objetivo de incrementar las probabilidades de eficacia y beneficio del mismo y para minimizar los riesgos de complicaciones y la probabilidad de obtener una recanalización fútil.
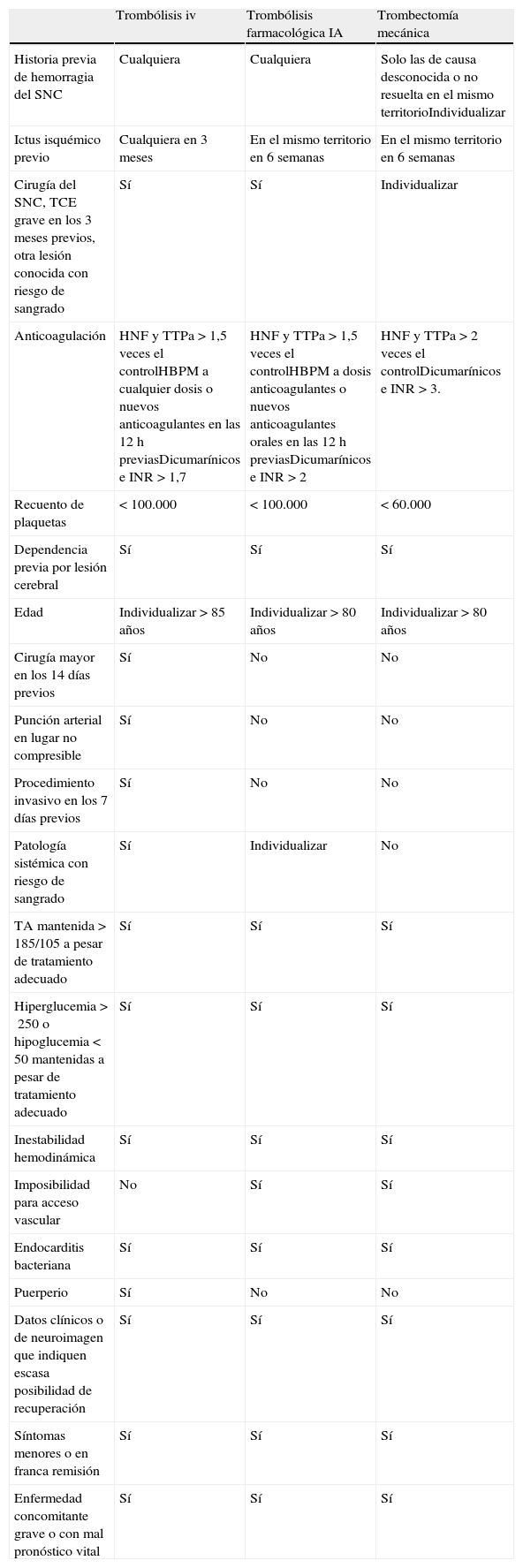
Contraindicaciones para los distintos procedimientos de revascularización en el ictus isquémico agudo
| Trombólisis iv | Trombólisis farmacológica IA | Trombectomía mecánica | |
| Historia previa de hemorragia del SNC | Cualquiera | Cualquiera | Solo las de causa desconocida o no resuelta en el mismo territorioIndividualizar |
| Ictus isquémico previo | Cualquiera en 3 meses | En el mismo territorio en 6 semanas | En el mismo territorio en 6 semanas |
| Cirugía del SNC, TCE grave en los 3 meses previos, otra lesión conocida con riesgo de sangrado | Sí | Sí | Individualizar |
| Anticoagulación | HNF y TTPa >1,5 veces el controlHBPM a cualquier dosis o nuevos anticoagulantes en las 12h previasDicumarínicos e INR>1,7 | HNF y TTPa >1,5 veces el controlHBPM a dosis anticoagulantes o nuevos anticoagulantes orales en las 12h previasDicumarínicos e INR>2 | HNF y TTPa >2 veces el controlDicumarínicos e INR>3. |
| Recuento de plaquetas | <100.000 | <100.000 | <60.000 |
| Dependencia previa por lesión cerebral | Sí | Sí | Sí |
| Edad | Individualizar >85 años | Individualizar >80 años | Individualizar >80 años |
| Cirugía mayor en los 14 días previos | Sí | No | No |
| Punción arterial en lugar no compresible | Sí | No | No |
| Procedimiento invasivo en los 7 días previos | Sí | No | No |
| Patología sistémica con riesgo de sangrado | Sí | Individualizar | No |
| TA mantenida >185/105 a pesar de tratamiento adecuado | Sí | Sí | Sí |
| Hiperglucemia >250 o hipoglucemia <50 mantenidas a pesar de tratamiento adecuado | Sí | Sí | Sí |
| Inestabilidad hemodinámica | Sí | Sí | Sí |
| Imposibilidad para acceso vascular | No | Sí | Sí |
| Endocarditis bacteriana | Sí | Sí | Sí |
| Puerperio | Sí | No | No |
| Datos clínicos o de neuroimagen que indiquen escasa posibilidad de recuperación | Sí | Sí | Sí |
| Síntomas menores o en franca remisión | Sí | Sí | Sí |
| Enfermedad concomitante grave o con mal pronóstico vital | Sí | Sí | Sí |
HBMP: heparina de bajo peso molecular; HNF: heparina no fraccionada; IA: intraarterial; iv: intravenosa; TA: tensión arterial;. SNC: sistema nervioso central; TCE: traumatismo craneoencefálico;. TTPa: tiempo de tromboplastina parcial activada.
Son candidatos a la aplicación de tratamiento endovascular (TIA y/o TM) los pacientes en los que concurran las siguientes condiciones y ninguna de las contraindicaciones que posteriormente se detallan:
- 1.
Ictus isquémico agudo producido por la oclusión demostrada de una o varias arterias cerebrales de gran calibre (carótida interna, tronco de arteria cerebral media (M1, M2), arteria basilar; en el caso de oclusión de otras arterias de gran calibre (ACA o ACP) la indicación se individualizará según el cuadro clínico) y
- 2.
Déficit neurológico moderado-grave (este criterio debe individualizarse en función de la repercusión del déficit sobre el paciente).
- 3.
Los sujetos presentan una o varias de las siguientes condiciones:
3.1 Evolución superior a 4,5h.
- •
En los ictus hemisféricos el límite superior es 8h.
- •
En los ictus por oclusión de arteria basilar el límite superior es 12h en el caso de que se trate de cuadros con déficit máximo establecido desde el inicio y hasta 24h en el caso de cuadros de instauración fluctuante o progresiva.
3.2 Contraindicación para trombólisis intravenosa por alguna de las siguientes causas:
- •
Anticoagulados con heparina y tiempo de cefalina >1,5 que hayan recibido HBPM o nuevos anticoagulantes orales en las 12h previas o en tratamiento con dicumarínicos e INR >1,7.
- •
Plaquetas <100.000.
- •
Cirugía mayor previa reciente (14 días).
- •
Punción arterial en lugar no compresible o procedimiento invasivo recientes (7 días).
- •
Patología sistémica con riesgo de sangrado.
- •
Ictus en los 3 meses previos.
- •
Puerperio.
- •
Historia previa de hemorragia del sistema nervioso central.
- •
Otras.
3.3 Fracaso de TIV (persistencia de oclusión arterial y déficit neurológico) dentro de ventana terapéutica para procedimiento endovascular.
ContraindicacionesEn la tabla 1 se resumen las contraindicaciones para cada uno de los diferentes tratamientos de reperfusión (TIV, TIA, TM) y a continuación se detallan las contraindicaciones específicas para los procedimientos endovasculares.
Contraindicaciones generales para cualquier procedimiento endovascular- •
Ictus hemorrágico.
- •
El criterio de edad como contraindicación se individualizará según la situación del paciente. En general se consideran candidatos pacientes hasta 80 años. Por encima de esta edad la indicación se hará con cautela, pues la probabilidad de evolución favorable con el tratamiento es significativamente menor.
- •
Situación de dependencia (EmR≥3 debido a lesión cerebral previa).
- •
Demencia previa o enfermedad concomitante grave o con mal pronóstico vital a corto plazo.
- •
Evolución o demora hasta el inicio del tratamiento superior a las ventanas terapéuticas mencionadas.
- •
Ausencia de oclusión arterial en gran vaso.
- •
Datos clínicos o de pruebas complementarias que indiquen escasa o nula posibilidad de recuperación:
- a.
Déficit grave establecido (NIHSS>25, salvo en ictus de territorio posterior, coma prolongado (>6h) o abolición completa y persistente de reflejos de troncoencéfalo.
- b.
Evidencia de ausencia de tejido recuperable en técnicas de neuroimagen (una o varias de las siguientes condiciones):
b.1 Con tiempo de evolución dentro de ventana terapéutica:
- 1.
Pacientes con hipodensidad franca en TC superior a un tercio del territorio de la arteria cerebral media.
- 2.
ASPECTS<7 en TC simple.
- 3.
En ictus de territorio posterior evidencia de lesión extensa en troncoencéfalo por TC o RM.
b.2 Con tiempo de evolución desconocido o límite (además de los puntos del apartado anterior, los siguientes pueden ser de utilidad en la toma de decisión).
- 4.
Pacientes con lesiones en RM con secuencias de difusión que superen 2 tercios del territorio de la arteria afectada.
- 5.
Discrepancia <20% entre los parámetros de flujo y daño tisular en TC-perfusión o en RM-difusión/perfusión.
- a.
- •
Síntomas menores o en mejoría franca antes de empezar el procedimiento y ausencia de oclusión arterial demostrada.
- •
Ictus isquémico extenso en el mismo territorio vascular en las 6 semanas previas (ictus en otro territorio no sería contraindicación para el tratamiento endovascular).
- •
Hipertensión arterial mayor de 185/105mmHg al inicio del procedimiento y que se mantiene a pesar de tratamiento adecuado.
- •
Hiperglucemia >250mg/dl o hipoglucemia <50mg/dl mantenida a pesar de tratamiento adecuado.
- •
Inestabilidad hemodinámica.
- •
Imposibilidad para acceso vascular.
- •
Endocarditis bacteriana
- •
Historia previa de hemorragia intracraneal (en caso de hemorragia de causa conocida y tratada con resolución completa o en un territorio vascular diferente puede plantearse trombectomía mecánica).
- •
Cirugía reciente del SNC o traumatismo craneoencefálico grave en los 3 meses previos.
- •
Lesión conocida del SNC con riesgo de sangrado (aneurisma, MAV). En estos casos podría individualizarse la decisión de trombectomía mecánica).
- •
Vasculitis.
- •
Recuento de plaquetas <100.000/mm3.
- •
Tratamiento con heparina y un TTPa >1,5 veces el control, administración de HBPM a dosis anticoagulantes, de anticoagulantes orales no dicumarínicos en las 12h previas, o tratamiento con dicumarínicos con INR>2.
- •
Recuento de plaquetas <60.000/mm3.
- •
Tratamiento con heparina y un TTPa>2. Tratamiento con anticoagulantes orales e INR>3.
En estas se debe individualizar la toma de decisión en función de parámetros adicionales y/o aplicar medidas terapéuticas específicas para evitar complicaciones propias de las mismas.
- •
Embarazo.
- •
Alergia al contraste.
- •
Insuficiencia renal.
Se activará el protocolo de código ictus en todos los pacientes con ictus agudo de menos de 8h de evolución36,37.
Los pacientes con ictus agudo serán valorados en urgencias por el neurólogo de guardia según los protocolos vigentes en el hospital37.
- •
La historia clínica recogerá hora de inicio de los síntomas, tratamientos concomitantes y antecedentes patológicos, comorbilidad y situación basal. La exploración recogerá la puntuación en la escala NIHSS y el peso del paciente.
- •
En todos los pacientes se realizará hemograma, bioquímica y coagulación, ECG, se monitorizarán las constantes y se tratarán desviaciones de la glucemia, la tensión arterial, la oximetría y la temperatura para mantenerlas dentro de los límites recomendados2,33.
- •
En todos los pacientes se realizarán los estudios de neuroimagen necesarios según el caso de forma urgente. Los objetivos serán aplicar el tratamiento necesario lo antes posible e identificar correctamente a aquellos pacientes que puedan ser candidatos a tratamiento endovascular:
TC simple urgente (en todos los pacientes).
Evaluación de la oclusión arterial mediante estudio ultrasonográfico neurovascular (doppler o dúplex de troncos supraaórticos y transcraneal) TC, DTSA; o angiografía no invasiva (angio-TC o angio-RM). La angiografía no invasiva es preferible en todos los casos previo al tratamiento intervencionista, pero de no ser posible su realización, el estudio ultrasonográfico neurovascular puede ser suficiente para demostrar oclusión arterial.
TC perfusión o RM con secuencias de difusión/perfusión. Son necesarias para seleccionar casos en situaciones especiales como tiempo de evolución incierto o límite de ventana terapéutica. No son estrictamente necesarias dentro de ventana terapéutica, pero pueden realizarse si no demoran la aplicación de tratamiento para ayudar a la selección de los pacientes en el caso de que identifiquen la presencia de área de penumbra >20% del territorio de la arteria afectada, o para el rechazo de los mismos si no hay ningún dato de tejido viable. Hay que tener en cuenta que la utilidad del mismatch perfusión/difusión en la selección de pacientes para tratamiento endovascular es cuestionable.
En el caso de que la indicación para TEV se produzca por fracaso de la TIV es necesario activar el procedimiento sin demoras innecesarias. Para ello se recomienda monitorizar la oclusión arterial durante la administración del tratamiento intravenoso, y en caso de persistencia de oclusión de gran vaso y ausencia de mejoría clínica pasados 30min desde la aplicación del mismo, se procederá a la activación del protocolo de TEV.
Procedimiento técnicoEl procedimiento de revascularización y el manejo durante el mismo se individualizará según el caso concreto y se decidirá conjuntamente por el equipo de neurología y el de neurorradiología.
Es necesaria la asistencia de un anestesista para aplicar la sedación/anestesia que se considere oportuna en cada caso. En general se prefiere la sedación frente a la anestesia siempre que se asegure que el paciente va a permanecer quieto y colaborador.
Actuación postratamientoUna vez finalizado el procedimiento el paciente se trasladará a la unidad de ictus o a camas de UVI/reanimación en el caso de que haya requerido anestesia e intubación o presente inestabilidad hemodinámica o compromiso ventilatorio.
El manejo se realizará siguiendo los protocolos de cuidado del paciente con ictus agudo de las unidades de ictus2,33.
Sistema de organización asistencialLa asistencia sanitaria en un sistema público con recursos limitados obliga a establecer sistemas de atención coste/eficaces36,38. Dotar de la tecnología más avanzada de forma general a todos los hospitales no es sostenible y por ello es necesario que los profesionales y las autoridades sanitarias colaboren en el análisis de las necesidades asistenciales de la población con el fin de ajustar los recursos necesarios para satisfacerlas. Aunque no se dispone de datos precisos para determinar con exactitud el número de pacientes que serán candidatos a TEV en la Comunidad de Madrid, se ha realizado una estimación en función de registros hospitalarios. Esto implicaría que por cada día sería suficiente con 2 centros de referencia para realizar TEV. Para asegurar la equidad en la asistencia para toda la población es necesario implementar sistemas organizativos de colaboración interhospitalaria que aseguren la accesibilidad de todos los pacientes a este recurso en condiciones óptimas las 24h del día, los 365 días del año. Gracias a la disponibilidad de un protocolo consensuado al que se adhieren los hospitales dotados para realizar TEV de la Comunidad de Madrid, que asegura su aplicación de forma homogénea, ha sido posible establecer una guardia de intervencionismo en turnos rotatorios semanales entre 3 hospitales. El objetivo de este sistema asistencial colaborativo es garantizar el menor tiempo de respuesta posible para poder indicar y aplicar los tratamientos sin demoras innecesarias, de tal manera que el paciente pueda ser adecuadamente seleccionado y manejado en el hospital de guardia para intervencionismo con prioridad absoluta.
El personal facultativo de neurología y neurointervencionismo así como las direcciones de cada hospital han organizado la actividad del personal necesario y las guardias fuera del periodo laboral según sus propios recursos y necesidades para garantizar dicho objetivo. Por otra parte los, eervicios de urgencia extrahospitalaria (SAMUR/SUMA) participan activamente en dicho sistema organizativo asegurando la respuesta inmediata para el traslado de los pacientes y el manejo de estos según los protocolos establecidos37.
Tras valoración del paciente por el neurólogo del hospital con unidad de ictus e identificado este como candidato a TEV según los criterios de inclusión/exclusión y la realización de las pruebas complementarias necesarias, se contacta con el equipo del hospital de guardia para TEV (neurólogo y neurorradiólogo intervencionista) para consensuar la indicación y el traslado si ha lugar. En caso de que dicho equipo se encuentre en un hospital diferente al que atiende al paciente inicialmente se solicita el consentimiento informado para el traslado. El consentimiento para el procedimiento es solicitado por el equipo que realizará el TEV. Los servicios de urgencia extrahospitalarios dan prioridad absoluta a este traslado, debiendo realizarse en ambulancia medicalizada. Se remite copia de toda la documentación generada incluyendo el consentimiento informado para el traslado al hospital receptor. El equipo del hospital que realiza el tratamiento es responsable de la recogida de datos para el registro.
Las pruebas realizadas deben ser accesibles al equipo de neurología-neurorradiología del hospital receptor (mediante el sistema más sencillo en cada caso: soporte digital, película fotográfica o en la web). El equipo del hospital receptor puede valorar la necesidad de repetir las pruebas complementarias, siempre teniendo como prioridad evitar demoras innecesarias en la aplicación del tratamiento.
Para facilitar la accesibilidad a las pruebas complementarias durante el proceso de toma de decisión entre los hospitales, se implementarán los sistemas informáticos de todos los hospitales y la comunicación entre los mismos a través de la web. La puesta en marcha de sistemas de telemedicina (teleictus) eficaces puede ayudar a la selección de los pacientes38.
Es necesario agilizar el retorno del paciente al hospital remitente una vez finalizado el procedimiento y siempre que se encuentre estable, generalmente en 24h, y así evitar el bloqueo del hospital receptor para que pueda seguir prestando servicio.
DiscusiónEl TEV para conseguir la reperfusión del tejido cerebral y disminuir la morbimortalidad asociada al ictus isquémico agudo es una alternativa terapéutica que cada vez se va implantando más en la práctica cotidiana ejecutada por equipos de neurólogos y neurorradiólogos intervencionistas con experiencia, puesto que ha demostrado ser factible, eficaz y segura en pacientes seleccionados9,26,34,35.
Sin embargo, como técnica novedosa sigue siendo objeto de investigación y desarrollo tecnológico10. Ello incluye no solo la innovación de dispositivos de extracción más seguros y eficaces, sino aspectos como la selección de pacientes en función de criterios que van más allá de la edad, la clínica o el tiempo de evolución, y que permitirán determinar con fiabilidad qué sujetos se beneficiarán del tratamiento frente a aquellos en los que este será ineficaz o con elevado riesgo de complicaciones11,12. Estos criterios pasan por identificar la existencia de tejido potencialmente salvable (penumbra isquémica) y se fundamentan en las nuevas técnicas de imagen, la magnitud del trombo y del vaso afectado, y la cuantificación de la circulación colateral7,13,14.
La implementación de este tipo de técnicas complejas y en desarrollo en la práctica cotidiana precisa no solo de la formación adecuada de los profesionales implicados, sino también de la elaboración de protocolos basados en la evidencia disponible, cuyo cumplimiento asegure el rigor y la ausencia de variabilidad en los criterios de selección de los pacientes y aplicación de los tratamientos para obtener los beneficios esperados con el menor riesgo y adecuación de costes.
En ausencia de ensayos clínicos que puedan dar respuesta a las incertidumbres existentes es necesario que toda la actividad se recoja en registros prospectivos rigurosos cuyo análisis permita la monitorización de los procedimientos, la mejora de los mismos y también los avances científicos necesarios para obtener dichas respuestas. Es posible que con el aumento de la experiencia y los resultados de la monitorización de los procesos, las mejoras técnicas en los procedimientos y los avances que se lleven a cabo a la hora de establecer criterios de selección, los protocolos actualmente vigentes puedan verse modificados.
Estos procedimientos son complejos y costosos y por ello no pueden desarrollarse de forma general en todos los hospitales, sino que deben realizarse en hospitales con unidad de ictus que cuenten con los medios técnicos y los profesionales necesarios. Estos hospitales deben estar bien dotados y su número deberá adecuarse a las necesidades de la población a la que vayan a atender. Pero estas limitaciones no deben serlo también para la accesibilidad a los mismos. Es necesario establecer sistemas de organización asistencial que aseguren que cualquier paciente con un ictus en fase aguda que pueda beneficiarse de TEV tenga acceso a la evaluación y tratamientos específicos de forma urgente independientemente del lugar en el que resida. Para establecer estos sistemas organizativos es necesaria la colaboración de los profesionales y las autoridades sanitarias con el fin de hacer un adecuado análisis de las necesidades y ajuste de los recursos necesarios10,37,39. Ello implica la información a la población, la formación de los profesionales de los servicios de urgencia tanto extra como intrahospitalarios, el establecimiento de una adecuada red de hospitales con buenos sistemas de comunicación entre los mismos para hacer posible las interconsultas y las posibles transferencias de los pacientes de forma ágil y correcta. Finalmente, debe organizarse el transporte urgente de tal manera que se asegure la identificación correcta del hospital de guardia para neurointervencionismo al que debe ser transferido cada paciente concreto según los criterios establecidos, así como la prioridad absoluta en los traslados.
ConclusiónLa implantación de técnicas endovasculares de tratamiento del ictus isquémico agudo requiere de la elaboración de protocolos de actuación basados en las evidencias disponibles y del establecimiento de sistemas adecuados de organización asistencial con el fin de hacerlos accesibles a la población, así como monitorizar los procedimientos para garantizar el rigor metodológico su eficacia y su seguridad.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.
Por sus aportaciones y comentarios en las reuniones de trabajo: Yolanda Aladro (Hospital Universitario de Getafe), Aitziber Aleu, Javier Barriga (Hospital de Fuenlabrada), Julio Domingo (Hospital Universitario Severo-Ochoa), María Araceli Gartia (Hospital Universitario Príncipe de Asturias), Carlos Gómez-Escalonilla (Hospital Universitario Clínico San Carlos), Raquel González (Hospital Universitario Puerta de Hierro), Jaime González-Valcárcel (Hospital Universitario Ramón y Cajal),Concepción Murrieta (Hospital Infanta Leonor), Alicia Parra (Hospital Universitario Príncipe de Asturias), María Rabasa (Hospital de Fuenlabrada), Aurelio Vega (Hospital Universitario Puerta de Hierro).
Coordinadores:
María Alonso de Leciñana (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Ramón y Cajal, IRyCIS), Exuperio Díez Tejedor (Servicio de Neurología y Centro de Ictus, Hospital Universitario La Paz, IdiPAZ).
Redactores:
Jaime Díaz (Unidad de Ictus, Servicio de Neurología, Hospital Universitario 12 de Octubre) José Antonio Egido (Unidad de Ictus Servicio de Neurología, Hospital Universitario Clínico San Carlos), Andrés García Pastor (Unidad de Ictus Servicio de Neurología, Hospital Universitario Gregorio Marañón), Patricia Martínez-Sánchez (Servicio de Neurología y Centro de Ictus, Hospital Universitario La Paz, IdiPAZ), José Vivancos (Unidad de Ictus Servicio de Neurología, Hospital Universitario La Princesa)
Participantes:
Eduardo Bárcena (Neurorradiología Intervencionista, Hospital Universitario La Princesa), Jorge Campello (Neurorradiología Intervencionista, Hospital Universitario 12 de Octubre), Enrique Castro (Neurorradiología Intervencionista, Hospital Universitario Gregorio Marañón), Patricia Calleja (Unidad de Ictus, Servicio de Neurología, Hospital Universitario 12 de Octubre), José Luis Caniego (Neurorradiología Intervencionista, Hospital Universitario La Princesa), Elisa Correas (Servicio de Neurología y Centro de Ictus, Hospital Universitario La Paz, IdiPAZ), Antonio Cruz (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Ramón y Cajal, IRyCIS), Fernando Díaz-Otero (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Gregorio Marañón), Eduardo Fandiño (Neurorradiología Intervencionista, Hospital Universitario Ramón y Cajal, IRyCIS), Andrés Fernández Prieto (Neurorradiología Intervencionista, Hospital Universitario La Paz, IdiPAZ), Fernando Fortea (Neurorradiología Intervencionista, Hospital Universitario Gregorio Marañón), Blanca Fuentes (Servicio de Neurología y Centro de Ictus, Hospital Universitario La Paz, IdiPAZ), Alfonsa Friera (Neurorradiología Intervencionista, Hospital Universitario La Princesa), Remedios Frutos (Neurorradiología Intervencionista, Hospital Universitario La Paz, IdiPAZ), Ana García-García (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Clínico San Carlos), Alberto Gil (Neurorradiología Intervencionista, Hospital Universitario Clínico San Carlos), Antonio Gil-Nuñez (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Gregorio Marañón), Francisco Gilo (Unidad de Ictus, Servicio de Neurología, Hospital Universitario La Princesa), Luis López-Ibor (Neurorradiología Intervencionista, Hospital Universitario Clínico San Carlos), Begoña Marín (Neurorradiología Intervencionista, Hospital Universitario La Paz, IdiPAZ), Antonio Martínez-Salio (Unidad de Ictus, Servicio de Neurología, Hospital Universitario 12 de Octubre), Jaime Masjuan (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Ramón y Cajal, IRyCIS), José Carlos Méndez (Neurorradiología Intervencionista, Hospital Universitario Ramón y Cajal, IRyCIS), Pedro Navia (Neurorradiología Intervencionista, Hospital Universitario 12 de Octubre), Florentino Nombela (Unidad de Ictus, Servicio de Neurología, Hospital Universitario La Princesa), Gemma Reig (Unidad de Ictus, Servicio de Neurología, Hospital Universitario La Princesa), Gerardo Ruiz-Ares (Servicio de Neurología y Centro de Ictus, Hospital Universitario La Paz, IdiPAZ), Carmen Sánchez (Unidad de Ictus, Servicio de Neurología, Hospital Universitario 12 de Octubre), Carmen Serna (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Clínico San Carlos), Patricia Simal (Unidad de Ictus, Servicio de Neurología, Hospital Universitario Clínico San Carlos), Francisco Villoria (Neurorradiología Intervencionista, Hospital Universitario Gregorio Marañón), Álvaro Ximenez-Carrillo (Unidad de Ictus, Servicio de Neurología, Hospital Universitario La Princesa).
Addendum
Recientemente se han publicado tres ensayos clínicos que evalúan la eficacia del tratamiento endovascular en el ictus isquémico40,41,42. Los análisis muestran que, de primera línea, el tratamiento endovascular no es superior al tratamiento con rtPA40 y que, además, tampoco es eficaz su utilización sistemática tras la trombólisis41. Por otra parte, la utilización de técnicas de neuroimagen (TC o RM) multimodal con la intención de identificar persistencia de tejido en penumbra isquémica no aporta ventajas en la selección de los pacientes para el tratamiento endovascular42. Estos resultados deben ser validados en nuevos estudios, pero no modifican las recomendaciones de este protocolo.