El 30% de los pacientes con epilepsia no permanece libre de crisis con los fármacos antiepilépticos (FAE) disponibles actualmente. El objetivo del estudio fue estimar el impacto económico y en calidad de vida de la epilepsia resistente a fármacos (ERF) en España, según la definición de la Liga Internacional contra la Epilepsia (ILAE).
MétodosEstudio observacional retrospectivo (12 meses) que incluyó pacientes adultos con epilepsia focal en tratamiento con, al menos, 2 FAE. Los costes sanitarios directos (€, 2010) se cuantificaron a partir de los recursos sanitarios y de sus costes unitarios. El análisis se realizó desde las perspectivas del Sistema Nacional de Salud (SNS) y la sociedad. El impacto de la ERF en la calidad de vida se valoró mediante los cuestionarios QOLIE 31-P, EQ-5D-3L y NDDIE.
ResultadosSe analizaron 263 pacientes (304 seleccionados). El 70,0% tenía ERF y el 20,3% estaban controlados. Bajo la perspectiva del SNS el coste anual por paciente con ERF y por paciente controlado fue de 4.964 y 2.978 €, respectivamente (p<0,01). En relación con los pacientes con ERF, los pacientes controlados presentaron mejores puntuaciones en el QOLIE-31P (70,8 vs 56,4, p<0,0001) y EQ-5D-3L (75,6 vs 64,7, p<0,001), y menor incidencia de depresión mayor según la escala NDDIE (23 vs 8,3%, p<0,05).
ConclusionesEn relación con la epilepsia controlada, la ERF se asocia a mayor consumo de recursos y costes, peor calidad de vida y mayor incidencia de depresión mayor, resultando, por tanto, en una considerable carga para el SNS y la sociedad.
Despite use of currently available anti-epileptic drugs (AED), 30% of epilepsy patients are not seizure-free. The purpose of this study was to estimate the quality of life and economic impact in Spain of drug-resistant epilepsy (DRE), as defined by the International League Against Epilepsy (ILAE).
MethodsObservational retrospective 12-month study conducted in Spain including adults with focal epilepsy treated with at least two AEDs. Direct costs (€ 2010) were calculated based on health care resources used and their official unit costs. Costs were analysed from the perspectives of the Spanish National Health System (SNS) and society. The impact of DRE on patients’ quality of life was examined using the QOLIE 31-P, EQ-5D-3L, and NDDIE questionnaires.
ResultsWe analysed 263 patients out of the 304 recruited. According to ILAE criteria, 70.0% of the patients had drug-resistant epilepsy, while 20.3% achieved seizure freedom. From the viewpoint of the SNS, annual costs for resistant and seizure-free patients were € 4964 and € 2978 respectively (P<.01). Compared to resistant patients, seizure-free patients showed better scores on QOLIE-31P (70.8 vs 56.4, P<.0001) and EQ-5D-3L (75.6 vs 64.7, P<.001). Seizure-free patients showed a lower incidence of major depression compared to resistant patients according to the NDDIE scale (23 vs 8.3%, P<.05).
ConclusionsResults suggest that DRE is associated with increased use of healthcare resources and consequently with higher costs, poorer quality of life and higher incidence of major depression compared to seizure-free patients, thus representing a considerable burden to the SNS and society.
La epilepsia es una de las enfermedades neurológicas crónicas más frecuentes1. En Europa afecta aproximadamente a 6 millones de personas y 15 millones podrían presentar epilepsia en algún momento de su vida2. En España se estiman entre 360.000 y 400.000 personas afectadas3. La epilepsia focal o parcial representa aproximadamente el 70% de todos los casos de epilepsia4.
El tratamiento convencional de la epilepsia se basa en la administración crónica de fármacos antiepilépticos (FAE). Aunque la politerapia con FAE consigue la remisión a largo plazo de las crisis en la mayoría de los pacientes, aproximadamente el 30% del total, aquellos con epilepsia de difícil control o epilepsia resistente (ERF) no permanecen libres de crisis con los FAE disponibles actualmente5.
La Liga Internacional contra la Epilepsia (ILAE) ha estandarizado la definición de ERF a la cual se habían realizado diferentes aproximaciones no oficiales con anterioridad6. La definición de la ILAE considera la ERF como aquella en la que no se han controlado todos los tipos de crisis tras tratamiento con 2 FAE tolerados, apropiadamente elegidos y tomados de forma adecuada, bien en monoterapia o en combinación, entendiéndose como falta de control cuando aparezcan crisis a lo largo del último año o el paciente las sufra en un tiempo inferior a tres veces el intervalo entre crisis que mostraba antes de iniciar el tratamiento, eligiendo el periodo más largo7. El reciente consenso RATE-España8 confirmó la utilidad y operatividad de la definición de la ILAE para los neurólogos españoles, confirmando, además, la necesidad de tomar una actitud proactiva en el paciente con ERF, con el objetivo de mejorar en lo posible el control de las crisis epilépticas.
La epilepsia es una enfermedad neurológica que supone un gran impacto sociosanitario en la población española3,9. Además del impacto económico, la presencia de crisis supone una limitación importante en las actividades de la vida diaria, una reducción en la calidad de vida percibida por los pacientes y un incremento en la morbilidad y mortalidad8. En España, ha habido intentos previos de cuantificar el coste de la ERF10, sin embargo, la falta de una definición estandarizada hasta la propuesta de la ILAE, hace que el impacto real de la epilepsia resistente en nuestro país sea poco conocido.
El objetivo del estudio ESPERA (European observational Study on ePileptic patiEnts Requiring at least two Antiepileptic drugs) fue estimar el impacto económico y sobre la calidad de vida de la ERF, de acuerdo con la definición de ILAE, en pacientes adultos con epilepsia focal. Este estudio se llevó a cabo simultáneamente en Francia y España, presentándose en este artículo los resultados españoles.
Pacientes y métodosSe llevó a cabo un estudio observacional multicéntrico, transversal y retrospectivo en pacientes adultos (edad ≥ 18 años) con epilepsia focal (crisis focales con o sin generalización secundaria), en tratamiento durante un periodo mínimo de 3 meses en el momento de la inclusión con, al menos, 2 FAE en combinación, estuvieran o no libres de crisis. Se excluyeron aquellos pacientes que estuvieran participando en ensayos clínicos de nuevos fármacos antiepilépticos y a los pacientes hospitalizados. Los investigadores se seleccionaron al azar a partir de 2 listas de profesionales compuestas por 349 neurólogos generales y «epileptólogos», representativos a nivel nacional en términos de distribución geográfica. Cada investigador incluyó, de manera consecutiva, a los pacientes que cumplieron los criterios de selección durante el periodo de inclusión (octubre de 2010-febrero de 2011). Los pacientes se estratificaron en función de su respuesta a FAE según la definición de la ILAE. El estudio cumplió las normas éticas del comité de investigación de cada centro participante y de la Declaración de Helsinki de 1975.
Adicionalmente, los investigadores registraron de modo consecutivo a 20 pacientes adultos con diagnóstico definido de epilepsia focal. Los datos de este registro fueron utilizados posteriormente para la ponderación de la muestra del estudio, como se explica posteriormente.
Además de los datos sociodemográficos, se recogió la historia de la enfermedad desde el momento del inicio de la epilepsia, el tratamiento actual y su cumplimiento, los tratamientos previos desde el inicio de la epilepsia y el uso de recursos durante los 12 meses previos a la inclusión. La información se recopiló a partir de la entrevista con el paciente en el caso de que el uso de recursos no estuviese disponible en la historia clínica.
El análisis de los costes se evaluó desde la perspectiva del Sistema Nacional de Salud (SNS), considerando los recursos ambulatorios y hospitalarios, y desde la perspectiva de la sociedad, considerando adicionalmente la necesidad de cuidadores por parte del paciente. Se tuvieron en cuenta los siguientes recursos: hospitalizaciones (ingreso por urgencias, duración de la estancia en la unidad de cuidados intensivos o en neurocirugía o planta de neurología), visitas médicas (visitas programadas o urgentes al neurólogo, visitas a otros especialistas y visitas al médico de atención primaria), procedimientos ambulatorios (radiología, RM, TC, EEG y otros), tratamiento con FAE y otros tratamientos no farmacológicos como cirugía.
Los costes sanitarios directos se cuantificaron para cada paciente a partir de las unidades naturales de los recursos sanitarios utilizados y del coste unitario de cada uno de ellos. Los costes unitarios de los recursos sanitarios se obtuvieron a partir de las tarifas oficiales de las comunidades autónomas11 y el coste unitario del día de estancia hospitalaria en la unidad de cuidados intensivos, neurocirugía o neurología, a partir del Registro de Altas de los Hospitales del Sistema Nacional de Salud, publicado por el ministerio de Sanidad12. El coste de la hospitalización se calculó multiplicando los días de estancia medios resultantes en el estudio por el coste unitario de cada día de estancia. Los costes de los tratamientos farmacológicos en PVPiva se obtuvieron en la base de datos del Consejo General de Colegios Oficiales de Farmacéuticos13. Para el análisis bajo la perspectiva del SNS se tuvo en cuenta la edad de los pacientes, considerando la aportación del SNS en el coste de los fármacos en función de la edad. El coste por hora de los cuidadores se obtuvo a partir de las tarifas oficiales para empleados del hogar11. Todos los costes se expresaron en euros del año 2010 y no se aplicó ninguna tasa de descuento, por tratarse de un periodo de seguimiento de un año.
La percepción de la calidad de vida relacionada con la epilepsia, la presencia de depresión mayor y la percepción del estado de salud general, se midieron, respectivamente, a través de los cuestionarios QOLIE-31P14, NDDIE15 y EQ-5D-3L16. Los pacientes completaron estos cuestionarios mediante autoadministración.
El cuestionario de calidad de vida relacionada con la epilepsia QOLIE-31P14 está compuesto de 31 ítems agrupados en 7 dimensiones: energía, emociones, actividades diarias, actividad mental, efectos de la medicación, preocupación por las crisis y calidad de vida global. La puntuación obtenida para las 7 dimensiones, y la calidad de vida global está comprendida entre 0 (peor puntuación) y 100 (mejor puntuación).
El cuestionario NDDI-E15 es una herramienta simple y sólida de cribado de depresión mayor en pacientes con epilepsia. Está compuesto por 6 ítems que permiten evaluar el nivel de depresión. Para cada paciente se calculó una puntuación global, y se estimó el porcentaje de pacientes con depresión mayor, definida de acuerdo al cuestionario como una puntuación igual o superior a 15 puntos.
El EQ-5D-3L16 es un cuestionario de calidad de vida general. El EQ-5D-3L integra una escala visual analógica (EVA) y contiene 5 dimensiones: movilidad, cuidado personal, actividades cotidianas, dolor/malestar, y ansiedad/depresión.
El análisis estadístico se llevó a cabo con el programa SAS (versión 9.2). Se realizó un análisis con toda la población de pacientes incluidos y posteriormente un análisis descriptivo y comparativo según la respuesta a FAE. Las variables cuantitativas fueron descritas utilizando la media y desviación estándar (DE). Las variables cualitativas se describieron según número de casos y porcentajes. Los resultados de los diferentes grupos se compararon mediante la prueba de la t de Student, análisis de varianzas o tests no paramétricos en función de su distribución para las variables cuantitativas o el test de la chi al cuadrado de Person, corrección de Yates o el test exacto de Fisher para las variables cualitativas. Las diferencias entre los grupos se consideraron estadísticamente significativas cuando la probabilidad de error fue inferior al 5% (p<0,05).
Los pacientes fueron ponderados de acuerdo a su contribución al total de la población estudiada mediante el uso de los siguientes factores de ponderación: número de pacientes con epilepsia focal atendidos en la consulta del investigador, proporción de pacientes con ERF tratados con politerapia visitados por los investigadores en el periodo de inclusión y frecuencia anual de visitas por paciente.
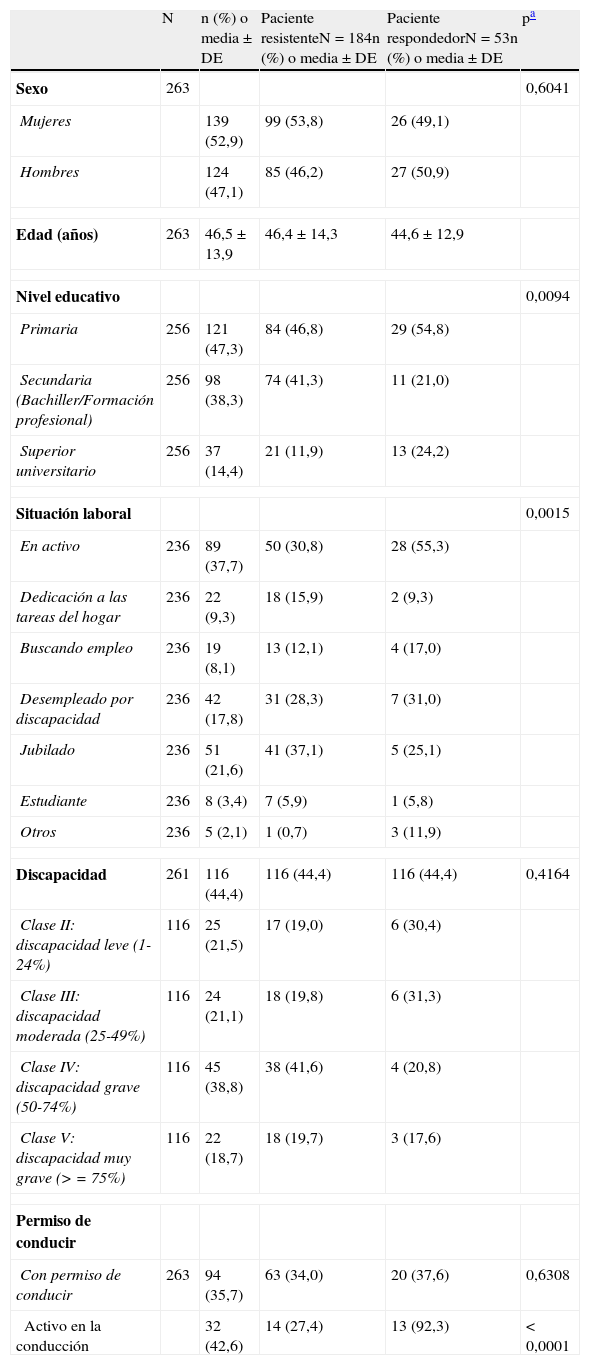
ResultadosParticiparon en el presente estudio 29 investigadores de toda España de los cuales 34,5% podrían ser definidos como «epileptólogos» y el 65,5% como neurólogos generales. De los 304 seleccionados, se analizaron 263 pacientes con epilepsia que cumplieron los criterios de selección: 39 pacientes se desestimaron por no poder realizar la ponderación estadística a partir del registro y 2 pacientes se desestimaron por estar tratados con monoterapia. Las características sociodemográficas y clínicas se presentan en las tablas 1 y 2, respectivamente. Según la definición de ILAE, el 70,0% de los pacientes incluidos presentaba ERF, mientras que el 20,3% fueron pacientes controlados y el 9,7% fueron clasificados como indefinidos.
Características sociodemográficas de pacientes adultos con epilepsia parcial y en tratamiento con al menos 2 fármacos antiepilépticos
| N | n (%) o media±DE | Paciente resistenteN=184n (%) o media±DE | Paciente respondedorN=53n (%) o media±DE | pa | |
| Sexo | 263 | 0,6041 | |||
| Mujeres | 139 (52,9) | 99 (53,8) | 26 (49,1) | ||
| Hombres | 124 (47,1) | 85 (46,2) | 27 (50,9) | ||
| Edad (años) | 263 | 46,5±13,9 | 46,4±14,3 | 44,6±12,9 | |
| Nivel educativo | 0,0094 | ||||
| Primaria | 256 | 121 (47,3) | 84 (46,8) | 29 (54,8) | |
| Secundaria (Bachiller/Formación profesional) | 256 | 98 (38,3) | 74 (41,3) | 11 (21,0) | |
| Superior universitario | 256 | 37 (14,4) | 21 (11,9) | 13 (24,2) | |
| Situación laboral | 0,0015 | ||||
| En activo | 236 | 89 (37,7) | 50 (30,8) | 28 (55,3) | |
| Dedicación a las tareas del hogar | 236 | 22 (9,3) | 18 (15,9) | 2 (9,3) | |
| Buscando empleo | 236 | 19 (8,1) | 13 (12,1) | 4 (17,0) | |
| Desempleado por discapacidad | 236 | 42 (17,8) | 31 (28,3) | 7 (31,0) | |
| Jubilado | 236 | 51 (21,6) | 41 (37,1) | 5 (25,1) | |
| Estudiante | 236 | 8 (3,4) | 7 (5,9) | 1 (5,8) | |
| Otros | 236 | 5 (2,1) | 1 (0,7) | 3 (11,9) | |
| Discapacidad | 261 | 116 (44,4) | 116 (44,4) | 116 (44,4) | 0,4164 |
| Clase II: discapacidad leve (1-24%) | 116 | 25 (21,5) | 17 (19,0) | 6 (30,4) | |
| Clase III: discapacidad moderada (25-49%) | 116 | 24 (21,1) | 18 (19,8) | 6 (31,3) | |
| Clase IV: discapacidad grave (50-74%) | 116 | 45 (38,8) | 38 (41,6) | 4 (20,8) | |
| Clase V: discapacidad muy grave (>=75%) | 116 | 22 (18,7) | 18 (19,7) | 3 (17,6) | |
| Permiso de conducir | |||||
| Con permiso de conducir | 263 | 94 (35,7) | 63 (34,0) | 20 (37,6) | 0,6308 |
| Activo en la conducción | 32 (42,6) | 14 (27,4) | 13 (92,3) | < 0,0001 | |
DE: desviación estándar; N: número de pacientes totales; n: número de pacientes que presentaron la característica expuesta.
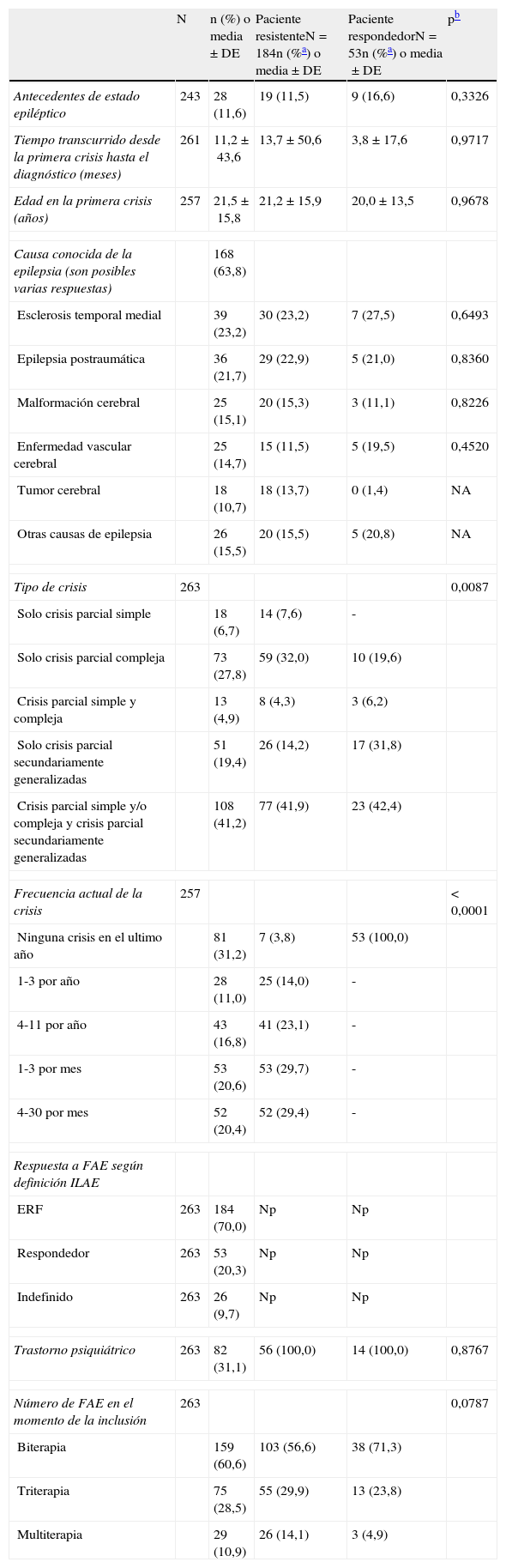
Características clínicas de pacientes adultos con epilepsia parcial y en tratamiento con al menos 2 fármacos antiepilépticos
| N | n (%) o media±DE | Paciente resistenteN=184n (%a) o media±DE | Paciente respondedorN=53n (%a) o media±DE | pb | |
| Antecedentes de estado epiléptico | 243 | 28 (11,6) | 19 (11,5) | 9 (16,6) | 0,3326 |
| Tiempo transcurrido desde la primera crisis hasta el diagnóstico (meses) | 261 | 11,2±43,6 | 13,7±50,6 | 3,8±17,6 | 0,9717 |
| Edad en la primera crisis (años) | 257 | 21,5±15,8 | 21,2±15,9 | 20,0±13,5 | 0,9678 |
| Causa conocida de la epilepsia (son posibles varias respuestas) | 168 (63,8) | ||||
| Esclerosis temporal medial | 39 (23,2) | 30 (23,2) | 7 (27,5) | 0,6493 | |
| Epilepsia postraumática | 36 (21,7) | 29 (22,9) | 5 (21,0) | 0,8360 | |
| Malformación cerebral | 25 (15,1) | 20 (15,3) | 3 (11,1) | 0,8226 | |
| Enfermedad vascular cerebral | 25 (14,7) | 15 (11,5) | 5 (19,5) | 0,4520 | |
| Tumor cerebral | 18 (10,7) | 18 (13,7) | 0 (1,4) | NA | |
| Otras causas de epilepsia | 26 (15,5) | 20 (15,5) | 5 (20,8) | NA | |
| Tipo de crisis | 263 | 0,0087 | |||
| Solo crisis parcial simple | 18 (6,7) | 14 (7,6) | - | ||
| Solo crisis parcial compleja | 73 (27,8) | 59 (32,0) | 10 (19,6) | ||
| Crisis parcial simple y compleja | 13 (4,9) | 8 (4,3) | 3 (6,2) | ||
| Solo crisis parcial secundariamente generalizadas | 51 (19,4) | 26 (14,2) | 17 (31,8) | ||
| Crisis parcial simple y/o compleja y crisis parcial secundariamente generalizadas | 108 (41,2) | 77 (41,9) | 23 (42,4) | ||
| Frecuencia actual de la crisis | 257 | < 0,0001 | |||
| Ninguna crisis en el ultimo año | 81 (31,2) | 7 (3,8) | 53 (100,0) | ||
| 1-3 por año | 28 (11,0) | 25 (14,0) | - | ||
| 4-11 por año | 43 (16,8) | 41 (23,1) | - | ||
| 1-3 por mes | 53 (20,6) | 53 (29,7) | - | ||
| 4-30 por mes | 52 (20,4) | 52 (29,4) | - | ||
| Respuesta a FAE según definición ILAE | |||||
| ERF | 263 | 184 (70,0) | Np | Np | |
| Respondedor | 263 | 53 (20,3) | Np | Np | |
| Indefinido | 263 | 26 (9,7) | Np | Np | |
| Trastorno psiquiátrico | 263 | 82 (31,1) | 56 (100,0) | 14 (100,0) | 0,8767 |
| Número de FAE en el momento de la inclusión | 263 | 0,0787 | |||
| Biterapia | 159 (60,6) | 103 (56,6) | 38 (71,3) | ||
| Triterapia | 75 (28,5) | 55 (29,9) | 13 (23,8) | ||
| Multiterapia | 29 (10,9) | 26 (14,1) | 3 (4,9) | ||
DE: desviación estándar; ERF: epilepsia refractaria a fármacos; FAE: fármaco antiepiléptico; NA: no aplicable; N: número de pacientes totales; n: número de pacientes que presentaron la característica expuesta; Np: no procede.
Las características demográficas fueron generalmente similares entre los pacientes con ERF y los pacientes respondedores (tabla 1). Sin embargo, hubo 3 características relacionadas con la enfermedad en las que hubo diferencias significativas entre ambos grupos. Así, el 24,2% de los pacientes respondedores tenía estudios universitarios, frente al 11,9% de los pacientes con ERF (p=0,0094), el 55,3% de los pacientes respondedores estaba en situación laboral activa frente al 30,8% de pacientes con ERF (p=0,0015) y hasta el 92,3% de los pacientes respondedores que poseía el permiso de conducción eran conductores frente al 27,4% de los pacientes con ERF (p<0,0001).
Las características clínicas de los pacientes se describen en la tabla 2. Respecto al tratamiento farmacológico, el número medio de FAE por paciente fue superior en los pacientes con ERF que en pacientes respondedores, 2,6 (±0,7) vs 2,3 (±0,6), respectivamente (p=0,0037). El 60,6% de los pacientes recibió biterapia con FAE, el 28,5% triterapia y el 10,9% politerapia con más de 3 FAE, siendo los FAE más frecuentes los siguientes: levetiracetam (53,8%), carbamacepina (31,9%), lamotrigina (28,6%), ácido valproico (21,9%), oxcarbacepina (19,2%) y zonisamida (18,2%).
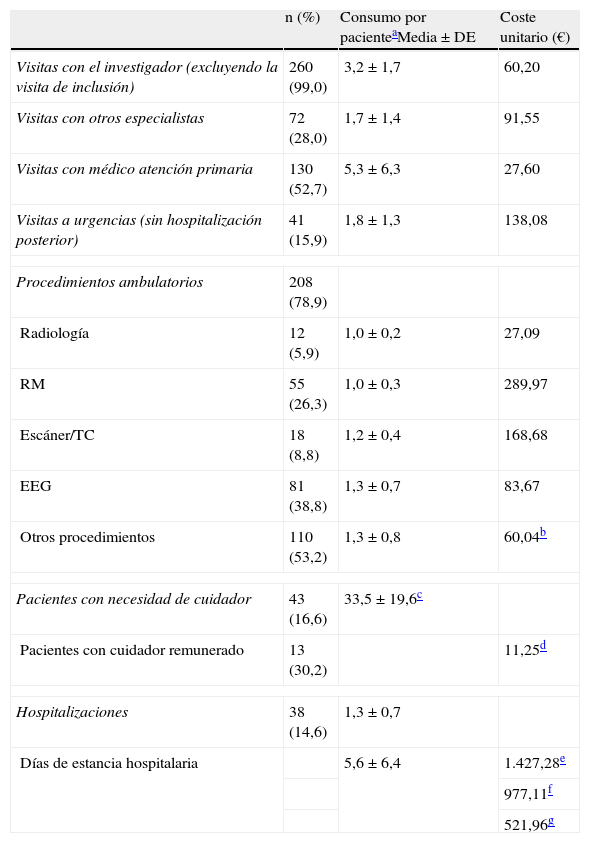
El uso de recursos y los costes unitarios asociados se describen en la tabla 3. Durante los últimos 12 meses, 38 pacientes (14,6%) fueron hospitalizados debido a la epilepsia al menos una vez, con una media de 1,3 (±0,7) hospitalizaciones por paciente y año y una estancia media por ingreso de 5,6 días (±6,4). Las principales causas de hospitalización fueron consecuencias de crisis epilépticas (37,6%), evaluación del estado epiléptico (20,0%) y monitorización mediante vídeo-EEG (24,8%). Once pacientes fueron hospitalizados en la unidad de neurocirugía, con una duración media de la estancia de 8,9 días (±5,7), y 16 pacientes fueron hospitalizados en la unidad de cuidados intensivos, siendo la duración media de la estancia 4,2 días (±3,6). El coste medio por hospitalización fue de 5.234 € (±6.697).
Uso de recursos en los últimos 12 meses asociados a la epilepsia
| n (%) | Consumo por pacienteaMedia±DE | Coste unitario (€) | |
| Visitas con el investigador (excluyendo la visita de inclusión) | 260 (99,0) | 3,2±1,7 | 60,20 |
| Visitas con otros especialistas | 72 (28,0) | 1,7±1,4 | 91,55 |
| Visitas con médico atención primaria | 130 (52,7) | 5,3±6,3 | 27,60 |
| Visitas a urgencias (sin hospitalización posterior) | 41 (15,9) | 1,8±1,3 | 138,08 |
| Procedimientos ambulatorios | 208 (78,9) | ||
| Radiología | 12 (5,9) | 1,0±0,2 | 27,09 |
| RM | 55 (26,3) | 1,0±0,3 | 289,97 |
| Escáner/TC | 18 (8,8) | 1,2±0,4 | 168,68 |
| EEG | 81 (38,8) | 1,3±0,7 | 83,67 |
| Otros procedimientos | 110 (53,2) | 1,3±0,8 | 60,04b |
| Pacientes con necesidad de cuidador | 43 (16,6) | 33,5±19,6c | |
| Pacientes con cuidador remunerado | 13 (30,2) | 11,25d | |
| Hospitalizaciones | 38 (14,6) | 1,3±0,7 | |
| Días de estancia hospitalaria | 5,6±6,4 | 1.427,28e | |
| 977,11f | |||
| 521,96g | |||
Se realizaron una media de 3,2 (±1,7) visitas al año por paciente a la consulta de neurología. Aproximadamente la mitad de pacientes (52,7%) visitaron a su médico de cabecera, con una media de 5,3 (±6,3) visitas al año y aproximadamente un tercio (28,0%) consultó a otros especialistas con 1,7 (±1,4) visitas de media al año. El 15,9% de los pacientes realizaron, al menos, una visita a urgencias. En los últimos 12 meses un total de 208 pacientes (78,9%) necesitaron, al menos, un procedimiento diagnóstico ambulatorio debido a la epilepsia, siendo el EEG el test más utilizado (38,8%). Finalmente, el 16,6% de los pacientes necesitaron de un cuidador, siendo remunerado en el 30,2% de los casos. El número medio de horas por semana de los cuidadores remunerados fue de 33,5 (±19,6).
El coste directo medio anual por paciente adulto con epilepsia focal que recibió al menos 2 FAE, desde la perspectiva del SNS, fue de 4.505 € (±5.920€), resultando de la suma del coste asociado a los FAE (3.027 € [±2.252 €]), el coste de hospitalización (968 € [±5.060 €]), el coste de las visitas (351 € [±285€]) y el coste de las pruebas ambulatorias (158 € [±254 €]). Desde la perspectiva de la sociedad, este coste ascendió a 5.744 € (±7.551 €), resultando de la suma de lo anterior y del coste asociado a los cuidadores remunerados (939 € [±4.395 €]), que supuso la tercera partida más importante bajo esta perspectiva.
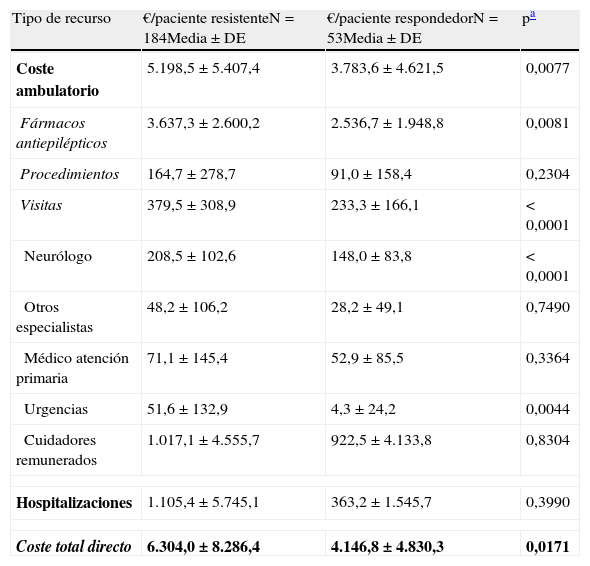
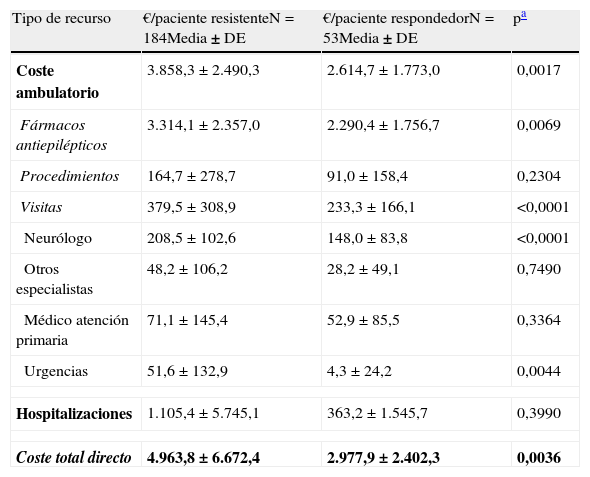
El coste medio anual por paciente fue mayor en los pacientes con ERF que en los pacientes respondedores, tanto desde la perspectiva de la sociedad (6.304 € [±8.286 €] vs 4.147 € [±4.830 €], p=0,0171) como desde la perspectiva del SNS (4.964 € [±6.672 €] vs 2.978 € [±2.402 €]; p=0,0036) (tablas 4 y 5). Bajo ambas perspectivas, los pacientes con ERF incurrieron en más costes asociados al tratamiento con FAE, en más costes asociados a las hospitalizaciones, en más costes asociados a las visitas al neurólogo y en más costes asociados a las visitas a urgencias (tablas 4 y 5). Desde el punto de vista cuantitativo la diferencia entre los pacientes con ERF y los pacientes controlados fue debida principalmente al coste de los FAE (52%) y las hospitalizaciones (37%), representando ambos casi el 90% del coste incremental de los pacientes con ERF.
Coste medio por paciente y año asociado con la epilepsia según la respuesta a los fármacos (perspectiva social)
| Tipo de recurso | €/paciente resistenteN=184Media±DE | €/paciente respondedorN=53Media±DE | pa |
| Coste ambulatorio | 5.198,5±5.407,4 | 3.783,6±4.621,5 | 0,0077 |
| Fármacos antiepilépticos | 3.637,3±2.600,2 | 2.536,7±1.948,8 | 0,0081 |
| Procedimientos | 164,7±278,7 | 91,0±158,4 | 0,2304 |
| Visitas | 379,5±308,9 | 233,3±166,1 | < 0,0001 |
| Neurólogo | 208,5±102,6 | 148,0±83,8 | < 0,0001 |
| Otros especialistas | 48,2±106,2 | 28,2±49,1 | 0,7490 |
| Médico atención primaria | 71,1±145,4 | 52,9±85,5 | 0,3364 |
| Urgencias | 51,6±132,9 | 4,3±24,2 | 0,0044 |
| Cuidadores remunerados | 1.017,1±4.555,7 | 922,5±4.133,8 | 0,8304 |
| Hospitalizaciones | 1.105,4±5.745,1 | 363,2±1.545,7 | 0,3990 |
| Coste total directo | 6.304,0±8.286,4 | 4.146,8±4.830,3 | 0,0171 |
Coste medio por paciente y año asociado con la epilepsia según la respuesta a los fármacos (perspectiva del Sistema Nacional de Salud)
| Tipo de recurso | €/paciente resistenteN=184Media±DE | €/paciente respondedorN=53Media±DE | pa |
| Coste ambulatorio | 3.858,3±2.490,3 | 2.614,7±1.773,0 | 0,0017 |
| Fármacos antiepilépticos | 3.314,1±2.357,0 | 2.290,4±1.756,7 | 0,0069 |
| Procedimientos | 164,7±278,7 | 91,0±158,4 | 0,2304 |
| Visitas | 379,5±308,9 | 233,3±166,1 | <0,0001 |
| Neurólogo | 208,5±102,6 | 148,0±83,8 | <0,0001 |
| Otros especialistas | 48,2±106,2 | 28,2±49,1 | 0,7490 |
| Médico atención primaria | 71,1±145,4 | 52,9±85,5 | 0,3364 |
| Urgencias | 51,6±132,9 | 4,3±24,2 | 0,0044 |
| Hospitalizaciones | 1.105,4±5.745,1 | 363,2±1.545,7 | 0,3990 |
| Coste total directo | 4.963,8±6.672,4 | 2.977,9±2.402,3 | 0,0036 |
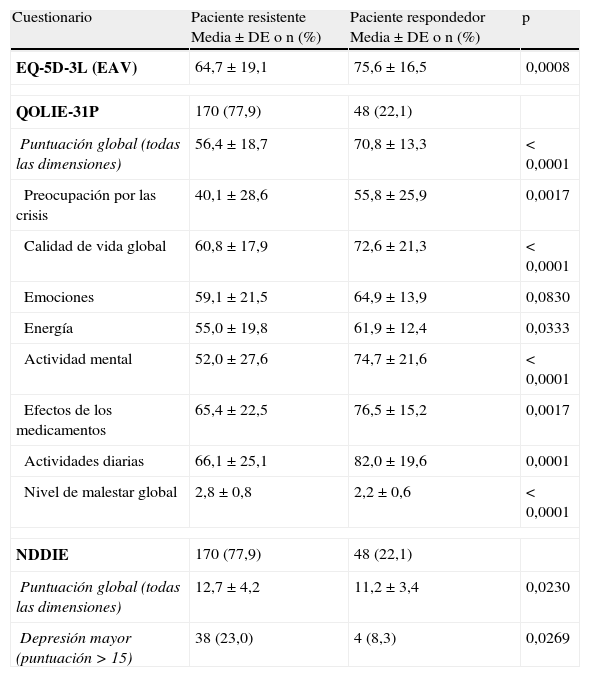
Se obtuvieron las respuestas a los cuestionarios de 243 pacientes (92,4%). La puntuación global de la calidad de vida resultante del cuestionario QOLIE-31P fue de 60,4 (±18,5). Se observó una fuerte relación entre la respuesta a los FAE y la calidad de vida observada (tabla 6). Además, la puntuación global del QOLIE-31P fue disminuyendo conforme la frecuencia de las crisis fue aumentando, observándose una puntuación media de 69,2 (±15,0) en pacientes sin crisis frente a 56,7 (±18,1) en pacientes con al menos una crisis al mes (p<0,0001).
Puntuaciones medias según la respuesta a los fármacos de los cuestionarios autoadministrados
| Cuestionario | Paciente resistente Media±DE o n (%) | Paciente respondedor Media±DE o n (%) | p |
| EQ-5D-3L (EAV) | 64,7±19,1 | 75,6±16,5 | 0,0008 |
| QOLIE-31P | 170 (77,9) | 48 (22,1) | |
| Puntuación global (todas las dimensiones) | 56,4±18,7 | 70,8±13,3 | < 0,0001 |
| Preocupación por las crisis | 40,1±28,6 | 55,8±25,9 | 0,0017 |
| Calidad de vida global | 60,8±17,9 | 72,6±21,3 | < 0,0001 |
| Emociones | 59,1±21,5 | 64,9±13,9 | 0,0830 |
| Energía | 55,0±19,8 | 61,9±12,4 | 0,0333 |
| Actividad mental | 52,0±27,6 | 74,7±21,6 | < 0,0001 |
| Efectos de los medicamentos | 65,4±22,5 | 76,5±15,2 | 0,0017 |
| Actividades diarias | 66,1±25,1 | 82,0±19,6 | 0,0001 |
| Nivel de malestar global | 2,8±0,8 | 2,2±0,6 | < 0,0001 |
| NDDIE | 170 (77,9) | 48 (22,1) | |
| Puntuación global (todas las dimensiones) | 12,7±4,2 | 11,2±3,4 | 0,0230 |
| Depresión mayor (puntuación>15) | 38 (23,0) | 4 (8,3) | 0,0269 |
La puntuación media global en todos los pacientes en el cuestionario NDDI-E fue de 12,3 (±4,1). La puntuación NDDIE global fue mayor (peor estado de salud) en los pacientes con ERF frente a respondedores (12,7 vs 11,2; p=0,0230). Más pacientes con ERF presentaron depresión mayor, frente a pacientes respondedores (23,0 vs 8,3%, p=0,0253). La percepción de los pacientes respecto a la calidad de vida general medida mediante el cuestionario EQ-5D-3L también mostró mejores resultados para los respondedores frente a los pacientes con ERF: puntuación media de 75,6 (±16,5) en pacientes respondedores en comparación con 64,7 (±19,1) en pacientes con ERF (p=0,0008).
DiscusiónA nivel individual la epilepsia puede imponer importantes cargas sociales y psicológicas en los individuos que la presentan: imposibilidad de obtener el permiso de conducir, problemas laborales o educacionales, estigmas sociales, dependencia de la medicación, o trastornos afectivos y depresión. La frecuencia de las crisis es uno de los factores más determinantes en la percepción de la calidad de vida. Así, la calidad de vida de los pacientes con epilepsia controlada es similar a la de las personas sanas17. La epilepsia también impone una carga económica importante para la sociedad en su conjunto y ha sido estudiada tanto en el ámbito español y europeo, como en otros ámbitos9,18–21.
La Liga Internacional contra la Epilepsia (ILAE) ha estandarizado la definición de epilepsia de difícil control o ERF, concepto que era variable con anterioridad a la definición propuesta6. El presente estudio es el primero que, bajo nuestro conocimiento, analiza los costes en que incurren los pacientes con ERF, bajo la definición de la ILAE, así como el impacto de la ERF en la calidad de vida de los pacientes.
Respecto a las características demográficas, en nuestro estudio encontramos diferencias significativas entre los pacientes con ERF, según la definición de ILAE, y pacientes respondedores en varios aspectos relevantes relacionados con la enfermedad. Así, el nivel educativo fue mayor en los pacientes controlados que en los pacientes con ERF, más pacientes controlados se encontraban en situación laboral activa y más pacientes controlados disponían del permiso de conducción. Estos aspectos resaltan la repercusión de la ERF en los individuos que la presentan. En este sentido, el estudio de Marinas et al.22 realizado en España hace 4 años coincide en mostrar que los pacientes con epilepsia controlada tienen más probabilidad de encontrarse en situación laboral activa (64,4%), frente a los pacientes con epilepsia no controlada (44,7%)22. En el estudio ESPERA, la ocupación en la población con ERF (30,8%) fue inferior a la obtenida en el estudio de Marinas y cols22 resultado al que puede haber contribuido el empeoramiento en la situación socioeconómica del país. Cabe señalar que la definición de ERF del estudio de Marinas y cols22 requería el fallo de 3 FAE, lo cual enfatiza el empeoramiento actual de la situación laboral de los pacientes con ERF.
De nuestro estudio se desprende que los pacientes con ERF incurren en un mayor consumo de recursos sanitarios y, en consecuencia suponen un coste más elevado que los pacientes controlados. El paciente con ERF supone, según nuestro estudio, un coste adicional por paciente y año de 2.157 € desde la perspectiva de la sociedad y 1.986 € para el SNS, respecto a los pacientes controlados. Extrapolando estos resultados al 30%5,23 de los 360.000-400.000 pacientes españoles con epilepsia que no consiguen controlarse con el tratamiento, obtenemos que el sobrecoste asociado a la falta de control oscilaría entre 216 y 240 millones de euros al año en nuestro país.
La diferencia en el coste medio anual entre los pacientes con ERF y los respondedores se debe fundamentalmente al coste de los FAE y al coste de las hospitalizaciones. También contribuyen, aunque en menor medida, el mayor coste asociado a las visitas al médico y a los procedimientos de diagnóstico ambulatorios. La carga adicional del coste de los cuidadores, analizada bajo la perspectiva de la sociedad, supone el 4% de la diferencia entre pacientes con ERF y respondedores.
Aunque existen estudios previos que han realizado una estimación de los costes de la epilepsia en adultos9,10, el estudio ESPERA es el primero que adopta la definición de ERF de la ILAE, y realiza una comparación del uso de recursos y costes de los pacientes con ERF frente a pacientes respondedores. En el estudio LINCE10, el coste medio anual de un enfermo con epilepsia resistente, de acuerdo con la definición adoptada en ese estudio, fue de 6.838 €, correspondiendo el 72% a costes directos sanitarios, el 24% a costes indirectos y el 4% a costes directos no sanitarios. Nuestro estudio no ha valorado los costes indirectos asociados a la productividad laboral de los pacientes, por lo que no se puede realizar una comparación directa con el estudio LINCE. A pesar de las diferencias metodológicas, los resultados del estudio ESPERA son congruentes con las estimaciones anteriores. Así, los costes directos no sanitarios derivados de la necesidad de cuidadores remunerados representaron el 16% del coste de los pacientes con ERF en nuestro estudio, mientras que el coste medio anual de los recursos sanitarios directos empleados por el paciente fue de 5.287 €, representando el 84% del coste total. El estudio de Pato et al.9 incluyó hasta un 40% de pacientes con epilepsia controlada, por lo que sus resultados no son comparables con los del presente estudio.
Además de incurrir en más costes, en el estudio ESPERA se observó que los pacientes con ERF presentaban peor calidad de vida, medida con los cuestionarios QOLIE-31P y EQ-5D, y mayor incidencia de depresión mayor, según el cuestionario NDDIE, que los pacientes controlados. En otros estudios se han encontrado resultados similares, resaltando la influencia que tiene no solo la frecuencia de las crisis, sino también la gravedad de las mismas24 en la calidad de vida percibida por el paciente. Igualmente, la asociación de depresión mayor con la frecuencia de crisis, objetivada mediante el cuestionario NDDIE, también ha sido observada en estudios previos25. La importancia que tiene el objetivo de mejorar la calidad de vida en los pacientes con epilepsia ha sido destacada tanto por clínicos26 como por pacientes27. El estudio ESPERA confirma, en una amplia muestra de pacientes españoles, la relevancia del control de las crisis en la percepción de la calidad de vida y en el estado anímico de los pacientes con epilepsia.
En cuanto a las limitaciones de nuestro estudio, se podría cuestionar la posible subestimación de los recursos asociados a la ERF que se deriva de una metodología retrospectiva del estudio y por tanto sujeta al sesgo de recuerdo. Así mismo, el presente estudio podría estar limitando las diferencias en costes entre pacientes con ERF y pacientes controlados debido al sesgo de selección derivado de la inclusión de pacientes en tratamiento con 2 o más antiepilépticos. Así, la diferencia podría ser mayor a la encontrada al excluir a los pacientes que consiguen controlarse con un único fármaco. Otra de las limitaciones atiende a la valoración exclusiva de los costes directos, excluyéndose en este estudio los costes indirectos derivados de la pérdida de productividad de los pacientes o la muerte prematura.
ConclusionesEl coste y la calidad de vida de los pacientes con epilepsia varían considerablemente dependiendo del control de las crisis. Un control inadecuado de la epilepsia supone un incremento de más del 50% del coste de la enfermedad, representando una considerable carga económica potencialmente evitable. Así mismo, el insuficiente control de la enfermedad se asocia con una mayor incidencia de depresión mayor y una peor calidad de vida declarada por el paciente. También el insuficiente control de la enfermedad se asocia a un menor nivel educativo o a menor inserción laboral, aspectos relevantes tanto para el individuo como para la sociedad. Un mejor control de la enfermedad, por tanto, redundaría en mayor calidad de vida para los pacientes y en menores costes para el SNS y para la sociedad.
Conflicto de interesesGlaxoSmithKline ha sido la empresa financiadora del presente estudio.
L. Lévy-Bachelot y L. Hernández son empleados de GlaxoSmithKline; J. Lahuerta era empleado de GlaxoSmithKline durante la realización del presente estudio; M. Doz es empleado de CEMKA-EVAL, consultora independiente contratada para la coordinación del estudio en España y Francia; M. Cuesta es empleado de Oblikue Consulting S.L., consultora independiente contratada para la coordinación del estudio en España.
Manuel Mazabel Flores, H. Ntra Señora de Regla; Dulce Campos Blanco, H. Clínico de Valladolid; Jaume Burcet Darde, H. Comarcal El Vendrell; Francisco Barriga Herández, H. Alcorcón; Apolinar Gómez Díaz-Castroverde, H. de Cabueñes; Joaquin Ojeda Ruiz, H. Infanta Sofia; Javier Abella Corral, H. Arquitecto Marcide; Anne Gómez Caicoya, Clínica Quirón; Meritxell Martinez Ferri, Mútua de Terrassa; Ana Clara Ricciardi Ciocchini, H. Granollers; Mercedes Falip Centelles, H. de Bellvitge; Francisco Javier López González, Complejo Hospitalario Universitario de Santiago; Virgilio Hernando Requejo, H. Severo Ochoa; Albert Molins Albanell, H. Josep Trueta; Xiana Rodriguez Osorio, Complejo Hospitalario Universitario Santiago; Carmina Díaz Martí, H. Villajoyosa; Maria Teresa Adeva Bartolomé, H. Recoletas; Ruth Marrero Abrante, Hospital Universitario de Canarias; Jose Manuel Fernández Carril, H. Guadalajara; José Marin Marin, H. Reina Sofía, Murcia; Nuria García Barragán, H. Universitario Ramón y Cajal; Javier Salas Puig, H. Vall d¿Hebron; Maria Aguirregomozcorta Gil, H. Figueres; Juan Carlos García-Moncó, H. Galdákano; Vicente Ivañez Mora, H. La Paz; Diego Tortosa Conesa, H. Virgen de la Arrixaca; Imanol Iriondo Etxenagusia, H. Basurto; Olga Carmona Codina, H. de Figueres; Antonio José Moreno Rojas, H. Son Dureta; Jorge Ballabriga Planas, H. Son Llatzer; Eloy Elices Palomar, Clínica Rotger.