Numerosos factores influyen en la satisfacción y la calidad de vida del cuidador informal del paciente con enfermedad de Alzheimer (EA) no respondedor. Entre ellos, destacan el curso de la enfermedad, el deterioro cognitivo y los trastornos conductuales de los pacientes, el grado de apoyo familiar y los factores inherentes al cuidador (tiempo de dedicación, estado psicológico y conocimiento de la enfermedad). El objetivo del trabajo fue determinar el perfil del cuidador informal del paciente con EA no respondedor, así como evaluar los diferentes factores que intervienen en su calidad de vida, carga soportada y satisfacción global con el tratamiento.
Pacientes y métodosSe llevó a cabo un estudio epidemiológico, prospectivo, multicéntrico y nacional que incluyó a 249 pacientes con EA no respondedores al tratamiento anticolinesterásico y a sus cuidadores. Se evaluó la calidad de vida del cuidador según el cuestionario de salud Short Form-36 (SF-36) y la carga asociada según escala de sobrecarga del cuidador Zarit, ambas validadas para España. La gravedad y la evolución de la patología se cuantificaron según el Clinical Dementia Rating (CDR) y el estado cognitivo mediante el Mini-Mental State Examination (MMSE).
ResultadosLa sobrecarga del cuidador mostró un incremento significativo en función del tiempo transcurrido desde el inicio del estudio, mientras que la satisfacción con el tratamiento aumentaba ligeramente con este mismo factor. La sobrecarga del cuidador resulta altamente correlacionada con el inventario CDR sobre sintomatología del paciente, tanto en visita inicial (p<0,0001) como final (p=0,0001). La satisfacción del cuidador con el tratamiento se vio afectada por el grado de cambio en el deterioro cognitivo padecido por el paciente entre las dos visitas (p=0,021).
ConclusionesLa satisfacción global con el tratamiento que declara el cuidador no se correlaciona con el cumplimiento terapéutico pero sí con los cambios en el deterioro cognitivo del paciente, factor que también influye sobre la carga soportada.
Many factors influence the satisfaction and quality of life of informal caregivers of non-responder patients with Alzheimer disease (AD). Among these include, the course of the disease, cognitive impairment and behavioural disturbances of the patient, the level of family support and caregiver inherent factors such as, time commitment, psychological status and awareness of the disease. The aim of this work is to determine the profile of informal caregivers of non-responder AD patients and to evaluate the different factors that affect their quality of life, burden and overall satisfaction with treatment.
Patients and methodsWe carried out a prospective and multicentre study in Spain that included a total of 249 AD patients unresponsive to anticholinesterase treatment, and their informal caregivers. We evaluated caregivers’ quality of life with the SF-36 questionnaire and their associated burden with the Zarit scale, both validated for Spain. The severity and progression of the disease was quantified according to Clinical Dementia Rating (CDR) and Mini-Mental State Examination (MMSE).
ResultsCaregiver burden showed a significant increase with the time elapsed since the start of the study, while treatment satisfaction increased slightly with this factor. Caregiver burden is highly correlated with CDR scale on patient symptoms, both in the initial visit (p<.0001) and final visit (p=.0001). Caregiver satisfaction with treatment was mainly affected by the degree of change in cognitive deterioration experienced by the patient between the two visits (p=.021).
ConclusionsOverall satisfaction with the treatment stated by the caregiver does not correlate with compliance to treatment, but it does so with the changes in patient's cognitive impairment, a factor that also influences caregiver's burden.
La enfermedad de Alzheimer (EA) es, en la actualidad, la forma de demencia más común en la vejez. Sus manifestaciones clínicas comprenden pérdida de memoria, deterioro del lenguaje, déficits visuoespaciales y conductuales y, en las últimas fases de la enfermedad, aparecen alteraciones motoras y trastornos de la marcha graves1. La prevalencia de la EA aumenta con la edad, situándose entorno al 5-10% de afectación en el tramo de edad entre los 60 y los 65 años, y aumentando hasta alcanzar al 45-50% de los mayores de 85-90 años2.
Aunque cada vez más se incluyen parámetros relacionados con la calidad de vida y la carga del cuidador en las evaluaciones relativas a la efectividad de los tratamientos para la EA2, ningún estudio ha evaluado de manera prospectiva la evolución de la carga del cuidador informal de pacientes con EA que no responden adecuadamente al tratamiento para su demencia según la práctica clínica habitual. Son diversos los factores que influyen en la carga y la calidad de vida percibida por el cuidador informal de un paciente con EA. Así, un curso agresivo de la enfermedad repercute directamente en una mayor carga sufrida por parte del cuidador3. Otro factor que se debe tener en cuenta es el nivel de percepción de la enfermedad por parte del cuidador y del propio paciente. Se han revelado importantes diferencias entre la percepción del deterioro cognitivo y los trastornos conductuales de los pacientes por parte de los cuidadores o por parte de los propios pacientes, siendo la percepción mucho más acusada en el caso del cuidador4.
En general, los pacientes con menor conciencia de sus pérdidas de memoria y trastornos conductuales representan una mayor carga directa5. Estos resultados previos fueron replicados por Seltzer et al6, que pudieron apreciar además una mayor sobrecarga del cuidador en aquellos pacientes que no eran conscientes de sus pérdidas de memoria, siendo esta independiente del estado actual de la demencia y de otras variables sociodemográficas.
La subjetividad inherente a la hora de evaluar la gravedad de la enfermedad según la propia opinión del paciente ejerce también una influencia decisiva en la efectividad del tratamiento. Así, un estudio prospectivo demostró que los pacientes con mayor autopercepción de sus dificultades cognitivas obtenían mejores resultados en la subsiguiente rehabilitación y, por tanto, sugería que los clínicos podían seleccionar a priori a estos pacientes como mejores candidatos para esta terapia paliativa7. En consecuencia, la opinión del paciente sobre su evolución parece ser especialmente útil para el médico a la hora de seleccionar el tratamiento que se debe aplicar. No obstante, la influencia que ejerce la opinión subjetiva del cuidador sobre la respuesta al tratamiento no ha sido evaluada hasta el momento, siendo esta más evidente en el caso de los cuidadores informales que en el de los profesionales sanitarios. En conjunto, la percepción que un cuidador informal tiene sobre el tratamiento se ve influida esencialmente por el modo de presentación clínica de la enfermedad, por la sintomatología y su gravedad, por el apoyo familiar/social con el que cuenta8, así como por factores inherentes al propio cuidador como el tiempo dedicado, su estado psicológico, su conocimiento de la enfermedad y su situación cultural y profesional9,10.
La hipótesis de partida para el presente estudio es que las características patológicas del paciente con EA no respondedor al tratamiento pueden influir en la carga del cuidador y en la información que éste proporciona al médico11, que a su vez, puede determinar el manejo clínico consiguiente del paciente y el conjunto de costes asociados12. Para evaluar dicha hipótesis se propuso realizar un estudio prospectivo de una cohorte de pacientes con EA que no respondían al tratamiento habitual. Para homogeneizar la cohorte, y dado que el tratamiento sintomático estándar para los pacientes con EA de leve a moderadamente grave son los inhibidores de la colinesterasa1,13,14, se seleccionó únicamente a pacientes no respondedores a este grupo terapéutico.
El objetivo principal del estudio fue describir el perfil basal del cuidador informal en estos pacientes, así como la evolución de dicho perfil a lo largo del tiempo, en relación con la evolución del paciente con EA no respondedor. Respecto a los objetivos secundarios definidos, se pretendió observar y detectar qué factores influyen en la calidad de vida de los cuidadores y que podrían ser tenidos en cuenta en los consiguientes programas de apoyo.
Pacientes y métodosEstudio, epidemiológico, prospectivo y multicéntrico que se realizó sobre una cohorte de pacientes con EA no respondedores al tratamiento con anticolinesterásicos. Los pacientes y sus respectivos cuidadores informales fueron incluidos en el estudio durante un período de 11 meses, según criterio de muestreo consecutivo realizado en consultas privadas y consultas externas hospitalarias. El protocolo del estudio fue sometido a evaluación independiente por parte de un comité ético de investigación clínica (UASP del Hospital Clínic i Universitari de Barcelona).
Se seleccionó a pacientes con enfermedad de Alzheimer según criterios diagnósticos DSM-IV para demencia y NINCDS-ADRDA para EA, con puntuación de leve a moderadamente grave según evaluación mediante Mini-Mental State Examination de Folstein (MMSE: 10-26)15, con cuidador informal, en tratamiento con anticolinesterásicos durante un mínimo de 3 meses previos a la inclusión, que no respondiesen adecuadamente al tratamiento y que hubiesen otorgado su consentimiento informado por escrito. Se definieron como no respondedores a los sujetos que cumplían una o varias de las siguientes condiciones: a) no seguían, según criterio médico, el esquema de tratamiento establecido por el especialista; b) no lo toleraban por aparición de reacciones adversas incompatibles con el mantenimiento de la pauta de administración prescrita, y c) según criterio clínico establecido por Dantoine et al16 (incremento de más de 2 puntos en la escala MMSE en los últimos 6 meses o más de 3 puntos en el último año). Se consideraron criterios de exclusión el diagnóstico de otra demencia distinta de la EA, la EA grave (MMSE < 10) y aquellos pacientes/cuidadores que —según criterio médico— no fuesen aptos para la participación en el estudio.
En el momento de la inclusión, así como en la visita de seguimiento (6 meses), se realizó una evaluación del estado clínico de la demencia, mediante escala Clinical Dementia Rating(CDR)17, del deterioro cognitivo (MMSE) y del estado funcional (índice de Barthel18). Se evaluó la calidad de vida a través del cuestionario SF-36, adaptado al español en 199519, y que explora ocho dimensiones del estado de salud: función física, función social, problemas físicos, problemas emocionales, salud mental, vitalidad, dolor y percepción de salud, cada una con puntuaciones de 0 a 100. Mediante la combinación de estas dimensiones, se pueden calcular también puntuaciones resumen de salud física y mental: Physical Component Summary Scale (PCS) y Mental Component Summary Scale (MCS).
La carga del cuidador se estimó a partir de la escala de Zarit20 validada en castellano, que cuantifica la vivencia subjetiva de carga percibida y asociada al cuidado que realiza. Esta escala oscila entre 22 y 110 puntos, considerándose las puntuaciones entre 47 y 55 como sobrecarga leve y entre 56 y 110 como sobrecarga intensa. También se calculó el grado de ansiedad del cuidador (escala de Hamilton21) y su satisfacción con aspectos relacionados con el tratamiento según el cuestionario de satisfacción construido ad hoc (Anexo). Se describió también el manejo terapéutico y el cumplimiento con el tratamiento (mediante el test de Morisky-Green22). Se cumplimentó, además, el inventario neuropsiquiátrico NPI sobre la sintomatología neuropsiquiátrica y conductual del paciente23. Paralelamente, se diseñó un cuestionario ad hoc para averiguar si la insatisfacción o la sobrecarga que el cuidador informal transmite al investigador influye, y en qué casos, en la toma de decisiones sobre el manejo clínico y terapéutico.
ResultadosCaracterísticas de la poblaciónLa población de pacientes finalmente incluida consistió en 249 pacientes con EA de leve a moderada y no respondedores al tratamiento anticolinesterásico. Cinco pacientes no fueron incluidos, 4 no estaban siendo medicados con tratamiento anticolinesterásico y un paciente acabó respondiendo al tratamiento, por lo que no cumplían con todos los criterios de inclusión y no formaron parte de la población final evaluable. Junto a los pacientes, fueron incluidos sus respectivos 249 cuidadores informales.
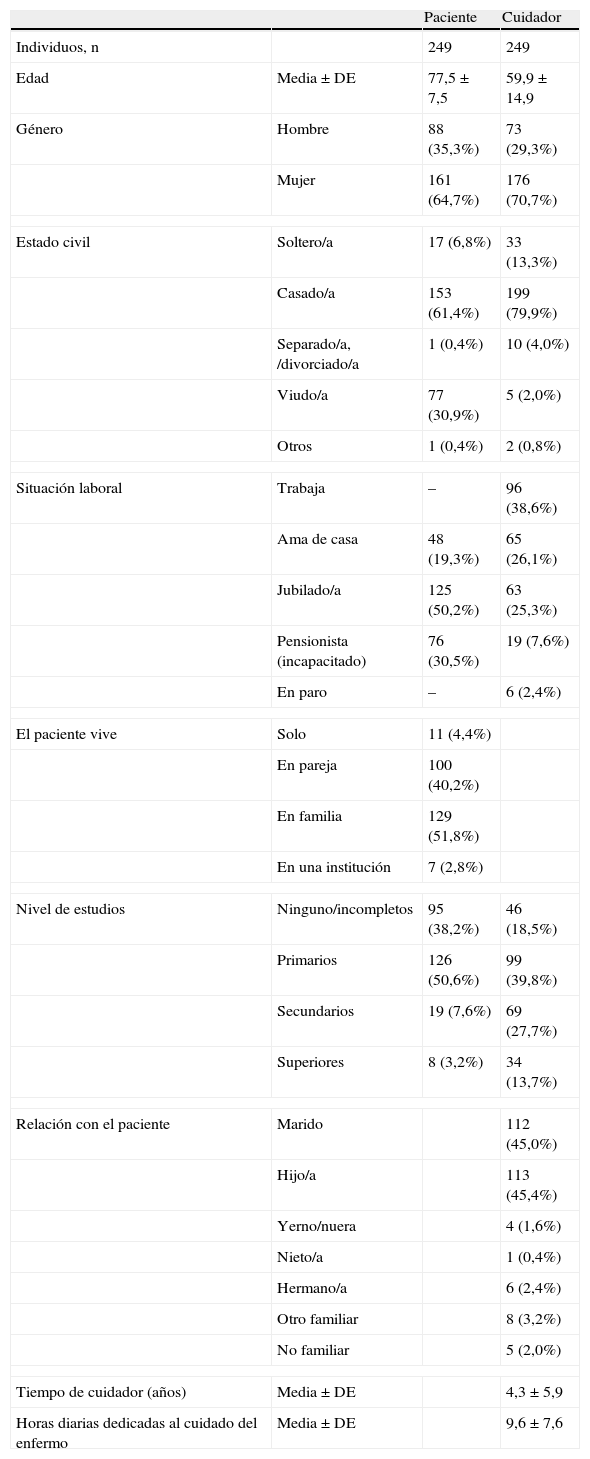
Las características demográficas y basales de la población de estudio en el momento de la inclusión aparecen recogidas en la tabla 1. La edad media ± desviación estándar de los pacientes EA incluidos en el análisis fue de 77,5 ± 7,5 años y la proporción de mujeres en el grupo alcanzó el 64,7% (n=161). Las comorbilidades más habituales presentadas por la población afectada de EA fueron la hipertensión arterial (59,0%), los trastornos del metabolismo lipídico (39,0%), la depresión (37,8%) y los procesos artrósicos asociados a la edad avanzada (26,1%).
Datos biodemográficos del paciente y del cuidador informal
| Paciente | Cuidador | ||
| Individuos, n | 249 | 249 | |
| Edad | Media ± DE | 77,5 ± 7,5 | 59,9 ± 14,9 |
| Género | Hombre | 88 (35,3%) | 73 (29,3%) |
| Mujer | 161 (64,7%) | 176 (70,7%) | |
| Estado civil | Soltero/a | 17 (6,8%) | 33 (13,3%) |
| Casado/a | 153 (61,4%) | 199 (79,9%) | |
| Separado/a, /divorciado/a | 1 (0,4%) | 10 (4,0%) | |
| Viudo/a | 77 (30,9%) | 5 (2,0%) | |
| Otros | 1 (0,4%) | 2 (0,8%) | |
| Situación laboral | Trabaja | – | 96 (38,6%) |
| Ama de casa | 48 (19,3%) | 65 (26,1%) | |
| Jubilado/a | 125 (50,2%) | 63 (25,3%) | |
| Pensionista (incapacitado) | 76 (30,5%) | 19 (7,6%) | |
| En paro | – | 6 (2,4%) | |
| El paciente vive | Solo | 11 (4,4%) | |
| En pareja | 100 (40,2%) | ||
| En familia | 129 (51,8%) | ||
| En una institución | 7 (2,8%) | ||
| Nivel de estudios | Ninguno/incompletos | 95 (38,2%) | 46 (18,5%) |
| Primarios | 126 (50,6%) | 99 (39,8%) | |
| Secundarios | 19 (7,6%) | 69 (27,7%) | |
| Superiores | 8 (3,2%) | 34 (13,7%) | |
| Relación con el paciente | Marido | 112 (45,0%) | |
| Hijo/a | 113 (45,4%) | ||
| Yerno/nuera | 4 (1,6%) | ||
| Nieto/a | 1 (0,4%) | ||
| Hermano/a | 6 (2,4%) | ||
| Otro familiar | 8 (3,2%) | ||
| No familiar | 5 (2,0%) | ||
| Tiempo de cuidador (años) | Media ± DE | 4,3 ± 5,9 | |
| Horas diarias dedicadas al cuidado del enfermo | Media ± DE | 9,6 ± 7,6 | |
La edad media de los cuidadores de pacientes se situó en 59,9 ± 14,9 años y en este grupo la representación del sexo femenino ascendió al 70,7% de la población (n=176). En la mayoría de los casos, el cuidador informal resultó ser su hijo/hija (45,4%) o bien la propia pareja del paciente (45,0%). En el momento de ser incluidos, los cuidadores llevaban una media de 4,3 ± 5,9 años al cuidado del paciente con EA, dedicando una media de horas diarias de 9,6 ± 7,6.
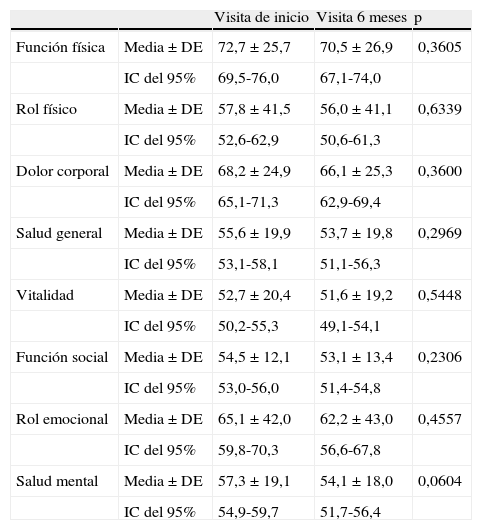
Calidad de vida del cuidador informalLa calidad de vida del cuidador informal del paciente con EA se cuantificó a partir del cuestionario SF-36. En la tabla 2 se observan los resultados obtenidos para las diferentes dimensiones de esta escala de calidad de vida, tanto en visita de inicio (V.0) como final (6 meses [V.6]), apreciándose ciertas dimensiones en las que el empeoramiento que afecta al cuidador tiende a aumentar, sin resultar en ningún caso significativo. Entre estas cabe destacar: la escala transformada de salud mental (que pasa de un valor de 57,3 ± 19,1 a 54,1 ± 18,0), la escala transformada del rol emocional (de 65,1 ± 42,0 a 62,2 ± 43,0) y la escala transformada de función física (de 72,7 ± 25,7 a 70,5 ± 26,9). Algunas de las dimensiones resultaron menos afectadas en el curso de los 6 meses de estudio, aunque siempre mostraron una tendencia en sentido negativo. Este es el caso, por ejemplo, de la escala transformada de vitalidad (pasó de 52,7 ±20,4 en la V.0 a 51,6 ± 19,2 en la V.6) y de la escala transformada de función social (de 54,5 ± 12,1 a 53,1 ± 13,4]).
Puntuación media del cuidador informal para las diferentes dimensiones de la escala de calidad de vida SF-36 en visita basal (V.0) y final (V.6)
| Visita de inicio | Visita 6 meses | p | ||
| Función física | Media ± DE | 72,7 ± 25,7 | 70,5 ± 26,9 | 0,3605 |
| IC del 95% | 69,5-76,0 | 67,1-74,0 | ||
| Rol físico | Media ± DE | 57,8 ± 41,5 | 56,0 ± 41,1 | 0,6339 |
| IC del 95% | 52,6-62,9 | 50,6-61,3 | ||
| Dolor corporal | Media ± DE | 68,2 ± 24,9 | 66,1 ± 25,3 | 0,3600 |
| IC del 95% | 65,1-71,3 | 62,9-69,4 | ||
| Salud general | Media ± DE | 55,6 ± 19,9 | 53,7 ± 19,8 | 0,2969 |
| IC del 95% | 53,1-58,1 | 51,1-56,3 | ||
| Vitalidad | Media ± DE | 52,7 ± 20,4 | 51,6 ± 19,2 | 0,5448 |
| IC del 95% | 50,2-55,3 | 49,1-54,1 | ||
| Función social | Media ± DE | 54,5 ± 12,1 | 53,1 ± 13,4 | 0,2306 |
| IC del 95% | 53,0-56,0 | 51,4-54,8 | ||
| Rol emocional | Media ± DE | 65,1 ± 42,0 | 62,2 ± 43,0 | 0,4557 |
| IC del 95% | 59,8-70,3 | 56,6-67,8 | ||
| Salud mental | Media ± DE | 57,3 ± 19,1 | 54,1 ± 18,0 | 0,0604 |
| IC del 95% | 54,9-59,7 | 51,7-56,4 |
De manera conjunta, las 8 dimensiones de la escala se pueden agrupar globalmente en el componente físico y el componente mental de la calidad de vida. El componente físico mostró un descenso muy leve y no significativo entre las dos visitas del estudio, pasando de 45,4 ± 9,4 a 45,1 ± 9,4). El componente mental de la escala de calidad de vida sufrió un descenso global más acusado, aunque no significativo, en el curso de los 6 meses del estudio: del 39,1 ± 10,2 en V.0 a 37,9 ± 9,9 en la V.6.
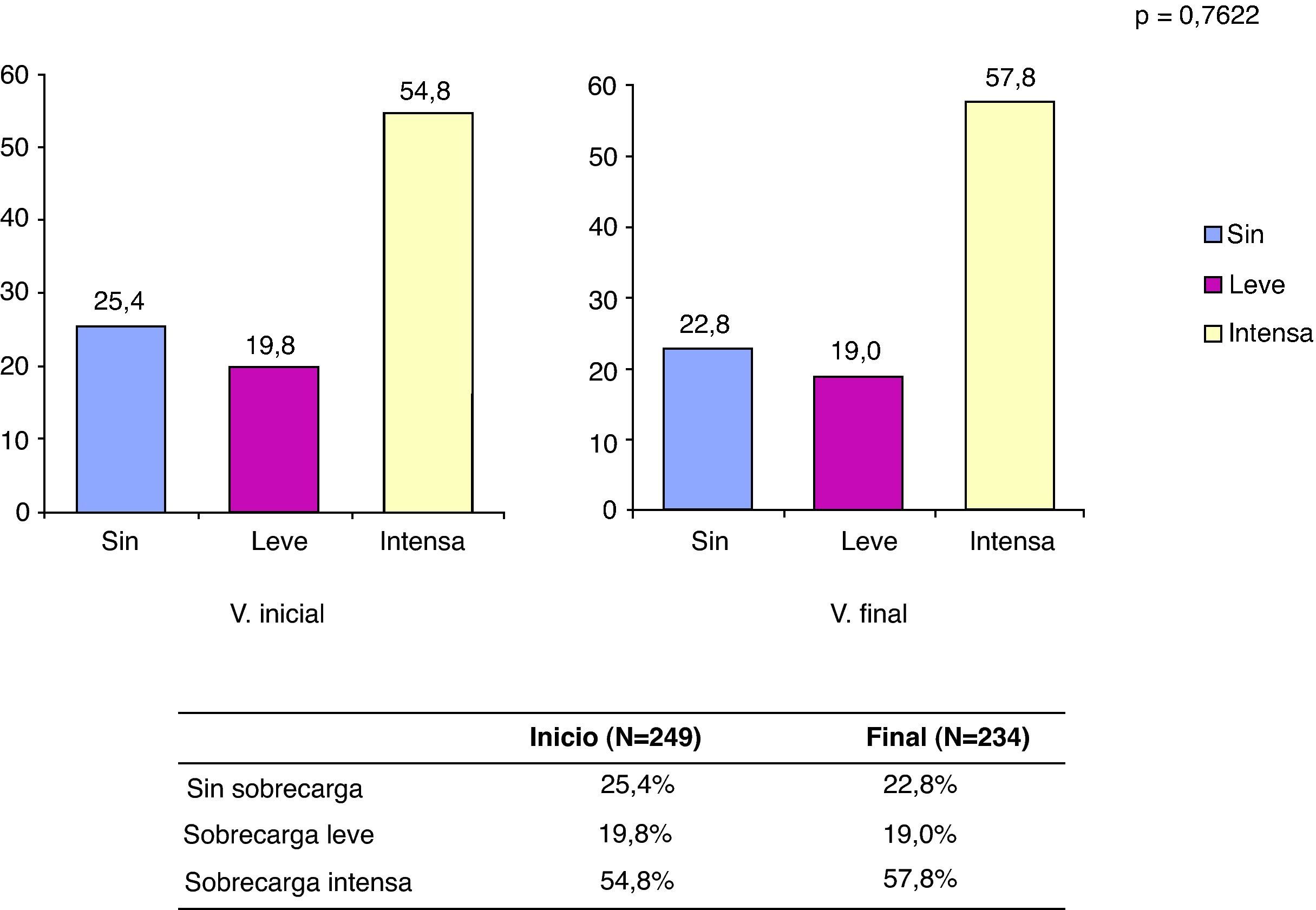
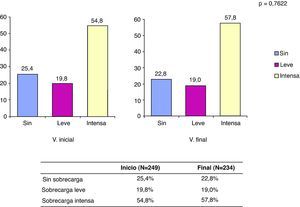
Carga del cuidadorLa escala de carga del cuidador de Zarit en el momento de iniciarse el estudio, y al haber transcurrido 6 meses, muestra puntuaciones medias de 57,8 ± 15,6 y de 59,1 ± 15,4, respectivamente, sin ser significativa la diferencia observada (p=0,359). Se aprecia pues que la carga aumentó progresivamente con el tiempo y que esta se situó como término medio en el primer tramo considerado como sobrecarga intensa. Globalmente, tanto en V.0 como V.6 fue mayoritaria la percepción de sobrecarga intensa, aunque esta aumentó con el tiempo en 3 puntos porcentuales, tal como se aprecia en la figura 1.
Distribución de pacientes según categorías de sobrecarga al inicio y final del estudio. *Las categorías de sobrecarga consideradas fueron las siguientes: sin (sin sobrecarga: puntuación menor a 47 en la escala de Zarit); leve (sobrecarga leve: puntuación entre 47 y 55 en la escala de Zarit); intensa (sobrecarga intensa: puntuación entre 55 y 110 en la escala de Zarit).
Respecto a la satisfacción expresada por el cuidador con respecto al tratamiento, y evaluada a partir de cuestionario elaborado ad hoc, la satisfacción global con el tratamiento tendió a aumentar ligeramente con el paso del tiempo, de modo que el 50% de cuidadores se mostraba satisfecho o muy satisfecho al principio del estudio frente al 52,4% a los 6 meses, sin ser esta tendencia significativa.
Entre los aspectos que menos variaron entre visitas destacan: facilidad de manejo del último tratamiento (87,5% lo consideran fácil o muy fácil en la V.0 y un 87,8% en la V.6), la facilidad para la toma (82,7% al inicio y 81,6% al final) y el grado de influencia de este en la vida diaria (73,4% en la V.0 y 73% en la V.6 del estudio consideran que nunca o raras veces interfiere).
Medidas como la facilidad de la pauta de administración variaron en mayor medida (fácil o muy fácil para el 87,9% al inicio del estudio vs. para el 89,6% en la V.6; p=0,568).
Sin embargo, el aspecto que más varió fue la influencia del tratamiento en la vida personal (el 67% de cuidadores en visita inicial y el 73,8% en la final consideran que nunca o raras veces interfiere, p=0,208).
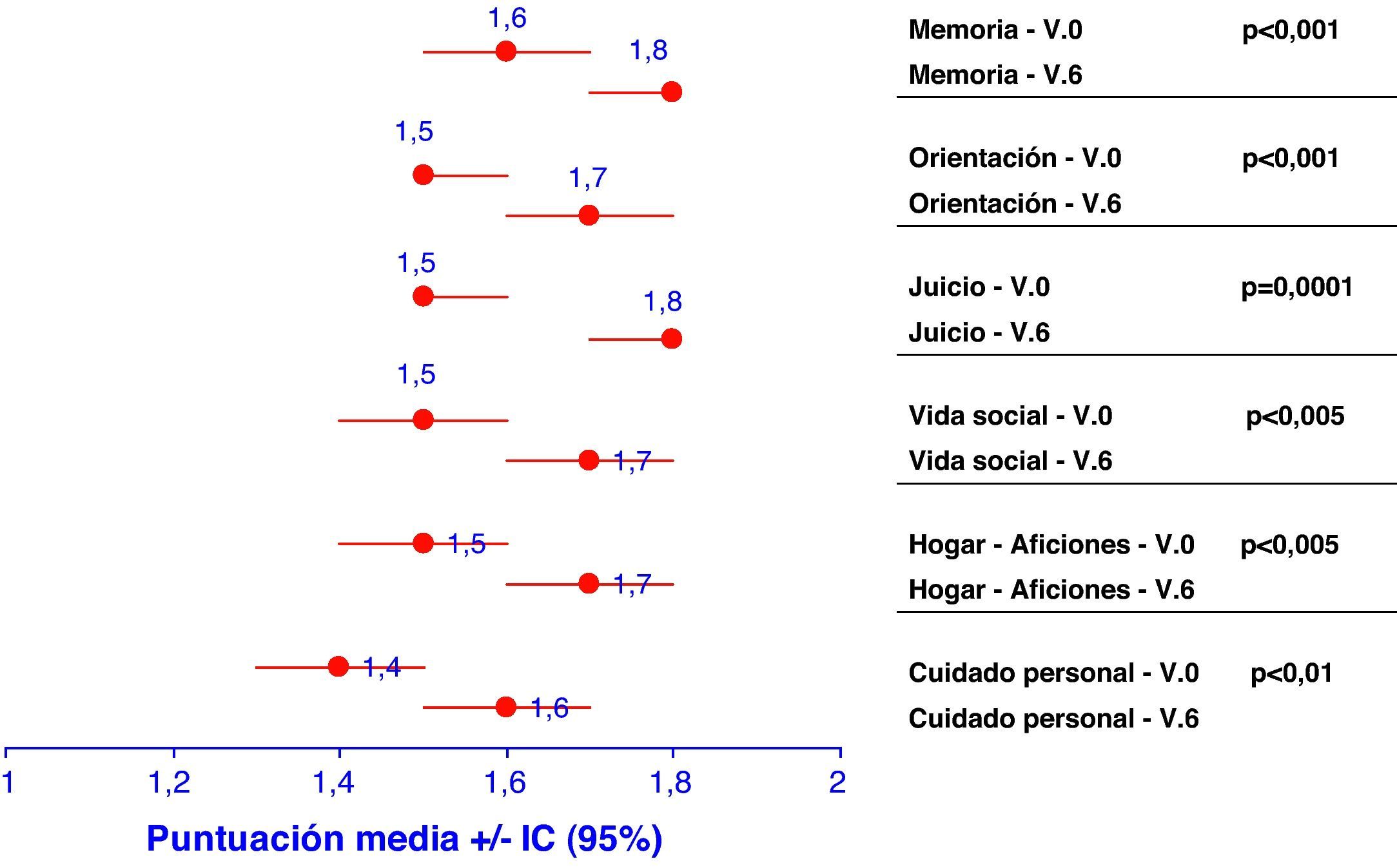
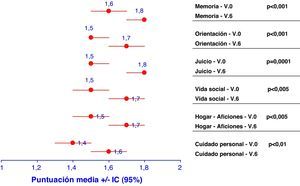
Clasificación clínica de la demencia y estado del pacienteLa escala de clasificación de la demencia (CDR) permite categorizar el grado de demencia en cinco estadios posibles (puntuados entre 0 y 3, según su gravedad). Todas las categorías evaluadas a partir de la clasificación CDR del paciente con EA aumentaron ligeramente con el tiempo, situándose a los 6 meses más cerca de la categoría de demencia moderada que de la categoría leve (fig. 2). Es especialmente significativo el empeoramiento sufrido por la categoría «juicio y resolución de problemas», que pasó de una puntuación 1,5 (IC del 95%, 1,5-1,6) en la V.0 a un 1,8 (IC del 95%, 1,7-1,8) en la V.6 (p=0,0001).
Representación de las medias e intervalos de confianza (IC) para cada uno de los descriptivos incluidos en la Clasificación Clínica de la Demencia (CDR) en la visita inicial (V.0) y final (V.6). A la derecha, aparece la significación estadística para la diferenciación de cada uno de estos descriptivos entre visita basal y a los 6 meses.
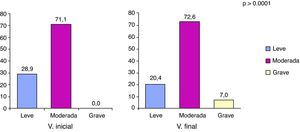
El MMSE permitió evaluar, además, el deterioro cognitivo y su gravedad en el paciente. Al realizar este análisis en el paciente con EA, se observó que el estado cognitivo disminuía de un valor inicial de 17,0 (IC del 95%, 16,5-17,4) a un valor final de 15,8 (IC del 95%, 15,2-16,3). Aunque no existían en la V.0, después de los 6 meses de seguimiento considerados empezaron a registrarse demencias graves (concretamente en el 7% de los pacientes; p<0,001) (fig. 3).
Finalmente, el Inventario Neuropsiquiátrico (NPI) cuantificó la presencia de síntomas neuropsiquiátricos y conductuales en pacientes EA. Como término medio, la puntuación en los aspectos de frecuencia y gravedad de cada una de las categorías del NPI suele ser relativamente baja. En consecuencia, el resultado medio en la V.0 fue de 12,4 (IC del 95%, 10,9-14,0) y aumentó, aunque sin ser diferencialmente significativa, hasta 13,1 (IC del 95%, 11,2-15,1) en la V.6.
Correlaciones entre estado cognitivo del paciente y perfil del cuidadorUno de los objetivos secundarios considerados en el diseño original del presente estudio fue evaluar la posible relación de la calidad de vida del cuidador (así como la sobrecarga sufrida) con el grado de deterioro cognitivo y sintomatología del paciente. En general, y para la mayoría de las dimensiones de la escala de calidad de vida (SF-36), la correlación con el deterioro cognitivo del paciente durante los 6 meses no es estadísticamente significativa. Únicamente una de las dimensiones de la calidad de vida se mostró muy correlacionada con el deterioro cognitivo del paciente EA. Se trata de la escala de salud mental, una dimensión altamente correlacionada con la puntuación MMSE del paciente, tanto al inicio (p=0,0051) como al final del estudio (p=0,013). Únicamente otra dimensión mostró una tendencia similar pero no significativa: la dimensión del rol emocional del cuidador al transcurrir los 6 meses de estudio (p=0,0535).
De manera similar, se evaluó mediante correlación de Spearman la relación entre la calidad de vida y la sintomatología neuropsiquiátrica del paciente (según NPI). Las dimensiones de la escala de calidad que se mostraron correlacionadas con el NPI fueron: el dolor corporal en visita final (se redujo con el incremento de puntuación NPI; p=0,0005), la vitalidad del cuidador tanto en visita inicial como final (esta disminuyó con el incremento de NPI; p<0,001 en ambas visitas), el rol emocional del cuidador en visita inicial (que empeoraba en función del aumento de NPI del paciente; p<0,005), y la salud mental global del cuidador al inicio y al final (que disminuía en relación directa con el incremento de puntuación NPI; p<0,0001 en ambas visitas).
La relación entre la carga sufrida por el cuidador informal y el estado del paciente fue especialmente evidente cuando se testó su correlación con el inventario CDR sobre la sintomatología del paciente con EA, tanto en visita inicial (p<0,0001) como al final del estudio (p=0,0001). De modo similar, se apreció que la sobrecarga del cuidador, calculada a partir de la escala de Zarit, se correlaciona significativamente con la suma total del NPI. Los coeficientes de correlación de Spearman para estas dos variables, tanto al inicio como al final del período del estudio, resultaron estadísticamente muy significativas (p<0,0001). De manera detallada, se evaluó también la asociación de la sobrecarga con los diferentes síntomas ligados al progreso de la demencia en el paciente y considerados por el NPI. Según este análisis detallado, la mayoría de asociaciones significativas se aprecian al inicio del estudio, concretamente, entre la sobrecarga del cuidador y las siguientes sintomatologías en el paciente: delirio, agitación, depresión, ansiedad, apatía, desinhibición y sueño (p<0,05, en todos los casos). En la visita a los 6 meses, esta asociación de la sobrecarga con componentes del NPI solo permanece significativa para la agitación y la actividad incrementadas en el paciente (p<0,05, en ambos casos).
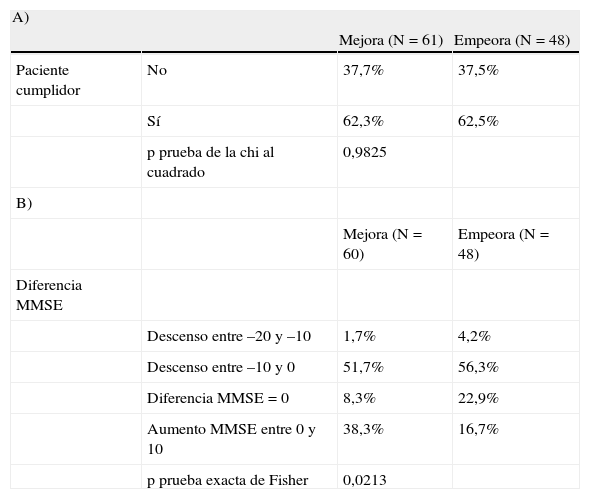
Relación entre satisfacción del cuidador, cumplimiento y deterioro cognitivoEn la tabla 3 se especifica la distribución de aquellos casos en que el cuidador manifiesta cambios en su satisfacción, respecto al cumplimiento del paciente (A) y al grado de deterioro cognitivo (B). Cabe destacar que la satisfacción con el tratamiento manifestada por el cuidador del paciente no se relacionó con el cumplimiento terapéutico evaluado mediante la prueba de Morisky-Green (p=0,982) (tabla 3A).
Cambios en la satisfacción global del cuidador con aspectos del tratamiento para la enfermedad de Alzheimer entre la visita basal y final: A) en función del grado de cumplimiento terapéutico del paciente (prueba de Morisky-Green), y B) en función del deterioro cognitivo (escala MMSE) del paciente
| A) | |||
| Mejora (N=61) | Empeora (N=48) | ||
| Paciente cumplidor | No | 37,7% | 37,5% |
| Sí | 62,3% | 62,5% | |
| p prueba de la chi al cuadrado | 0,9825 | ||
| B) | |||
| Mejora (N=60) | Empeora (N=48) | ||
| Diferencia MMSE | |||
| Descenso entre –20 y –10 | 1,7% | 4,2% | |
| Descenso entre –10 y 0 | 51,7% | 56,3% | |
| Diferencia MMSE=0 | 8,3% | 22,9% | |
| Aumento MMSE entre 0 y 10 | 38,3% | 16,7% | |
| p prueba exacta de Fisher | 0,0213 |
Sin embargo, esta satisfacción con el tratamiento sí que se vio afectada de forma significativa por el grado de cambio del deterioro cognitivo que padeció el paciente entre las dos visitas según la puntuación MMSE (p=0,021) (tabla 3B). Este análisis se realizó considerando cuatro categorías de cambio MMSE según lo observado en los casos: descenso entre –20 y –10 puntos, entre –10 y 0 puntos, sin cambios, y aumento MMSE entre 0 y 10 puntos. Así, únicamente mejoraba la satisfacción del cuidador con el tratamiento en los casos en que se apreciaba también una mejoría en la escala de deterioro cognitivo del paciente (mayor puntuación MMSE).
DiscusiónEl objetivo del presente estudio fue esclarecer los perfiles de calidad de vida y satisfacción que presenta el cuidador informal de pacientes con EA no respondedores al tratamiento anticolinesterásico en España. Los resultados indican que algunos componentes de la calidad de vida del cuidador se ven especialmente afectados con el paso del tiempo, aun considerando períodos breves como los 6 meses del estudio. Entre estos componentes, los más perjudicados por la dedicación al paciente resultan ser los referidos a la salud mental y al rol emocional del cuidador. Estos resultados son coincidentes con los obtenidos por estudios previos que indicaban que la constante dedicación del cuidador a estos pacientes tiene consecuencias en su comportamiento, estabilidad emocional y sobre las relaciones personales que establece24,25.
Asimismo, nuestros resultados muestran cómo en 6 meses de cuidado de un paciente con EA no respondedor tiende a aumentar la percepción de sobrecarga intensa sufrida por el cuidador, al mismo tiempo que desciende ligeramente la proporción de cuidadores que perciben ausencia de sobrecarga. Los estudios más recientes han evidenciado que únicamente los programas de apoyo y actuación específicos, y en su extremo el ingreso del paciente en un hogar de ancianos, son capaces de evitar estas tendencias y la aparición de sintomatologías asociadas a la depresión y al estrés en los cuidadores26. Entre estas estrategias de apoyo cabe destacar el papel que desarrollan los grupos de ayuda entre cuidadores, puesto que se trata de un instrumento fortalecedor del manejo eficiente del paciente a la vez que facilita el establecimiento de técnicas de socialización y cohesión que combaten el progresivo empeoramiento de la salud mental27.
Otro factor que aparentemente debería resultar influenciado por la carga y calidad de vida percibida por el cuidador informal es el grado de satisfacción que manifiesta con el tratamiento que recibe el paciente con EA. Es interesante hacer notar que, con el tiempo, no empeora la percepción del cuidador sobre la facilidad del tratamiento y la toma. Globalmente, tras 6 meses de estudio la satisfacción con el tratamiento aumenta ligeramente, una tendencia que también ha sido observada en estudios con cuidadores informales españoles, especialmente en casos en que el tratamiento se basa en monoterapia con donepezilo28.
Este estudio ha detectado diferencias significativas en la evolución y el curso clínico de la demencia en el paciente durante el tiempo de 6 meses de estudio y que, a su vez, estas diferencias pudieron correlacionarse con el curso de la calidad de vida del cuidador. Esta progresión de la patología es perceptible a partir de las diversas medidas sobre la clasificación de la demencia y el estado del paciente evaluadas —clasificación de la demencia (CDR), Mini-Examen Cognitivo e NPI—, evidenciándose la tendencia sostenida al empeoramiento de la sintomatología asociada. De hecho, se trata de escalas bien establecidas y que han resultado ser buenos predictores del curso progresivo de la neuropatología asociada al Alzheimer, especialmente en el caso de la CDR29.
Siguiendo con los objetivos previstos en el diseño inicial del estudio, se consideró que el grado de correlación del estado del paciente de EA con los cambios en la carga y calidad de vida percibida por el cuidador podría aportar información útil de cara al diseño adecuado de programas de apoyo a familiares y cuidadores informales, que incidieran en las dimensiones de la vida personal más afectadas por el curso progresivo de esta enfermedad, así como en la carga farmacoeconómica asociada tanto al paciente como al cuidador30. En este sentido, el trabajo demuestra que la mayoría de las dimensiones evaluadas sobre calidad de vida del cuidador no se ven afectadas por el deterioro cognitivo (MMSE), a excepción destacada de la dimensión referida a salud mental del cuidador informal y, sin ser significativa, la tendencia a empeorar el rol emocional de este. Estos patrones de afectación de la sintomatología progresiva del Alzheimer en el estrés, la depresión y la salud mental general del cuidador han sido mostrados en algunos estudios que evaluaron los factores asociados al deterioro cognitivo25, mientras que otros estudios parecen mostrar preferentemente una asociación de la depresión y la salud mental del cuidador exclusivamente con factores personales más que con los ligados al curso de la enfermedad del paciente10. En este contexto general, no es baladí prescindir del efecto que determina la percepción de aspectos positivos que tiene el cuidado del paciente, derivados de las intensas relaciones personales que exige. Así, la mayoría de los cuidadores (73%) son capaces de declarar al menos algún aspecto positivo de su labor y esta valoración varía en función de la sobrecarga, la depresión y las molestias31. Esta relación directa resultará determinante a la hora de establecer programas de apoyo adecuados a las circunstancias personales de cada cuidador.
Complementariamente, nuestros resultados permitieron evidenciar la relación existente entre la calidad de vida del cuidador y los síntomas neuropsiquiátricos sufridos por el paciente con EA. Los principales componentes de la calidad de vida del cuidador que se vieron influidos por el deterioro neuropsiquiátrico del paciente fueron el dolor corporal, la vitalidad, el rol emocional y la salud mental. Otros estudios han evidenciado la relación entre sintomatología neuropsiquiátrica y calidad de vida del paciente32-34, pero no son comunes los trabajos en que se analice la influencia de esta sintomatología en componentes de la calidad de vida del cuidador35.
Finalmente, es necesario mencionar que la calidad de vida evaluada en el cuidador informal puede verse afectada por su satisfacción con los tratamientos indicados a los pacientes con EA. De hecho, nuestros análisis evidencian una correspondencia directa de esta satisfacción con el tratamiento y el grado de deterioro cognitivo sufrido por el paciente, mientras que el cumplimiento terapéutico no muestra relación con la satisfacción manifestada por el cuidador. Esta conclusión apoya las evidencias recientes de que una intervención en forma de estimulación cognitiva y motora de los pacientes puede beneficiar, más allá del enlentecimiento del progreso de la enfermedad en el paciente36, aportando mejoras importantes en la carga sufrida por el cuidador, en su evolución, en su satisfacción global con el tratamiento y en los aspectos que valora como cuidador37.
En conjunto, este resultado parece sugerir que tanto los pacientes como los cuidadores informales podrían beneficiarse de programas de apoyo social lo más personalizados posibles, especialmente para hacer frente a necesidades derivadas de las limitaciones a nivel comunicativo de los pacientes y para afrontar las dificultades asociadas a la carga, el estrés y la ansiedad que conlleva el cuidado del paciente con EA38. Un cuidador con sobrecarga y con trastornos psicológicos derivados de su cargo podría conducir a un ingreso prematuro del enfermo con EA en instituciones y, en consecuencia, a un gasto sanitario incrementado tanto para acometer los problemas del paciente como del cuidador. Estos dos argumentos ligados justifican el desarrollo e instauración de este tipo de estrategias educativas y personalizadas a los cuidadores informales de pacientes EA con el objetivo de mitigar la sobrecarga, depresión y alteraciones psicológicas que conlleva su dedicación39,40.
Conflictos de interesesEste estudio ha recibido financiación de Novartis Farmacéutica, S.A. para su realización.
Agradecemos la colaboración en la elaboración del presente manuscrito de Emili González-Pérez del Departamento Científico de Trial Form Support, España.
Grupo de Trabajo del Estudio IMPACT: José Marey (H. Juan Canalejo, La Coruña), Eduardo Aguera (H. U. Reina Sofía, Córdoba), Enrique Arriola (Fundación Matía, San Sebastián, Vizcaya), Manuel Menéndez (H. Álvarez-Buylla, Mieres, Asturias), Laureano Jesús Cacho (H. U. de Salamanca, Salamanca), Antonio del Olmo (H. Doctor Peset, Valencia), Fernando Castellanos (H. Virgen del Puerto, Plasencia, Cáceres), Carlos Marsal (H. Virgen de la Salud, Toledo), Tomás Ojea (H. R.U. Carlos Haya, Málaga), José Rubí (H. del Poniente, El Ejido, Almería), Alberto Villarejo (H. Doce de Octubre, Madrid), Rosario Vela (H. de Torrevieja, Alicante), Eloy Rodríguez (H. Marqués de Valdecilla, Santander, Cantabria), M. del Carmen Pérez (H. Doctor Negrín, Las Palmas de Gran Canaria, Las Palmas), José Bueno (H. U. Señora de la Candelaria, Santa Cruz de Tenerife), Miguel Moya (H. Puerta del Mar, Cádiz), Eloisa Navarro y Miguel Ángel García (EAP Vicente Soldevilla, Madrid), Eva Cuartero (H. U. Virgen de Valme, Sevilla), Elena Muñoz (H. Verge de la Cinta, Tortosa, Tarragona), Miguel Baquero (H. La Fe, Valencia), M. José García (H. Ernest Lluch, Calatayud, Zaragoza), María Dolores Martínez (H. La Magdalena, Castellón), Luis Cabello (H. Santa María del Rosell, Cartagena, Murcia), Ana Espino (H. Son Llàtzer, Palma, Mallorca), M. Pilar Sanz (H. M. de Mataró, Mataró, Barcelona), Raquel Sánchez-Valle (H. Clínic i Universitari, Barcelona), M. Teresa Avellán y M. Dolores López (H. Geriàtric Torribera, Santa Coloma de Gramenet, Barcelona).