Los parches transdérmicos de rivastigmina para el tratamiento de la enfermedad de Alzheimer presentan posibles beneficios respecto a las cápsulas por su absorción sostenida a través de la piel, buena tolerabilidad local y reducción de problemas gastrointestinales.
ObjetivoEvaluar la tolerabilidad gastrointestinal y cutánea y la necesidad de titulación para obtener dosis óptimas de rivastigmina transdérmica en pacientes con Alzheimer previamente tratados oralmente.
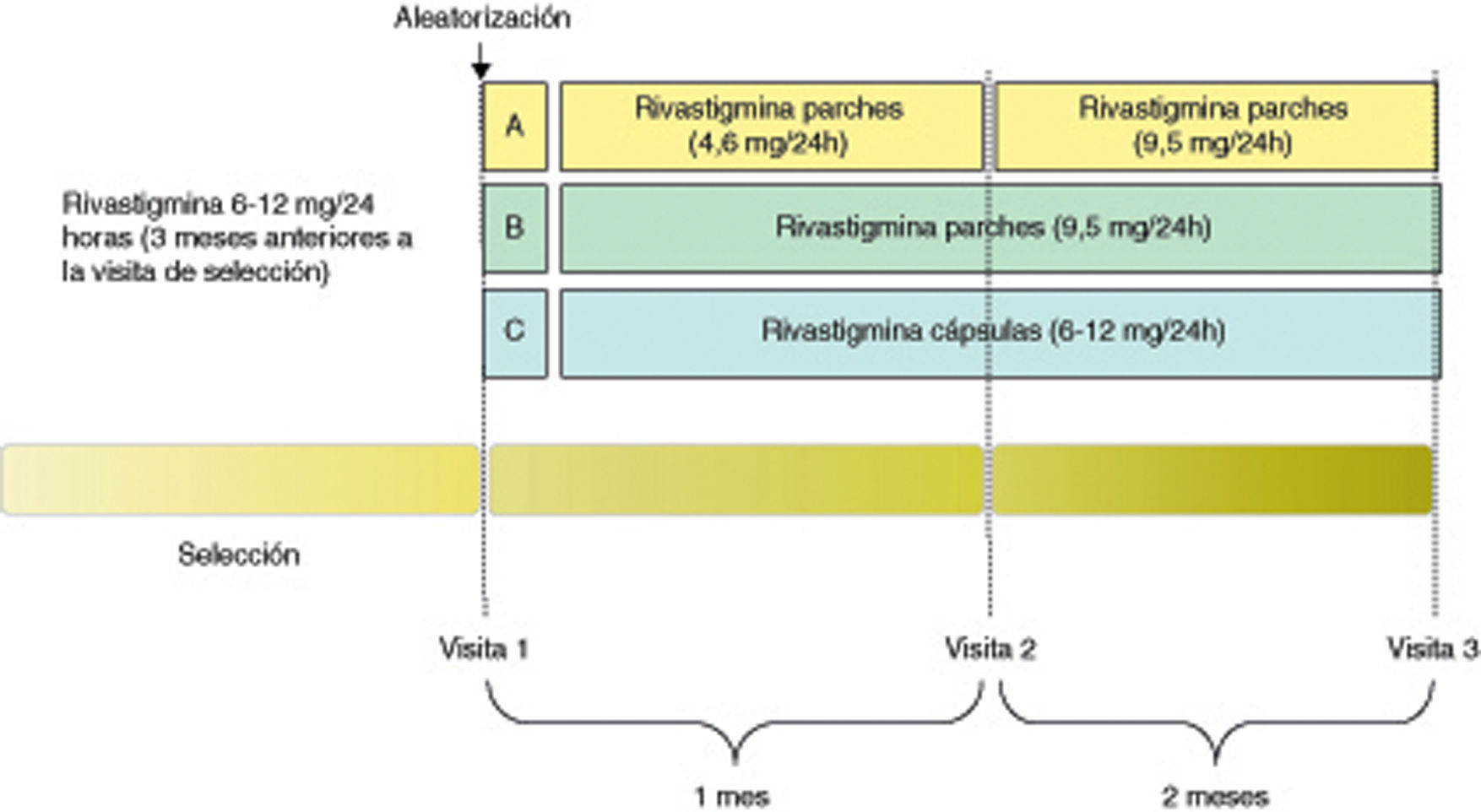
Pacientes y métodosSe llevó a cabo un estudio multicéntrico, aleatorizado y abierto que incluyó a 142 pacientes con Alzheimer de leve a moderado y previamente tratados con rivastigmina oral (6-12mg/día). La muestra fue aleatorizada a: continuar con tratamiento oral durante 3 meses (n=49); cambio al parche sin titulación (9,5mg/día durante 3 meses, n=47) o cambio al parche con titulación (4,6mg/día por 1 mes seguido de 9,5mg/día por 2 meses, n=43).
ResultadosLa incidencia de efectos adversos gastrointestinales fue del 6,1% en el grupo tratado oralmente y del 4,2% en el grupo tratado con parche sin titulación (p=0,908). La tolerabilidad cutánea fue buena (n=15, 16,7%), sin observarse acontecimientos adversos graves. El tratamiento con parche fue considerado muy fácil de utilizar por el 72% de pacientes en comparación con el 30% con tratamiento oral (p=0,0005). El 60% se mostraron satisfechos con el parche, mientras que únicamente un 14% se declaró satisfecho con las cápsulas (p<0,0001).
ConclusionesLos parches de rivastigmina presentan un perfil de tolerabilidad similar a las cápsulas y se asocian con una mayor satisfacción de los pacientes.
Rivastigmine transdermal patches for the treatment of Alzheimer's disease (AD) have potential benefits compared to capsules because of their sustained absorption through the skin, good local tolerability and reduction of gastrointestinal problems.
PurposeTo assess gastrointestinal and skin tolerability and the need for optimal dose titration of rivastigmine transdermal patches in Alzheimer's disease patients previously treated with oral rivastigmine.
Patients and methodsA multicenter, randomized, open-label study including patients with mild to moderate AD (DSM-IV) previously treated with rivastigmine capsules (6-12mg/day) was conducted. Patients were randomized to: continue with capsules for 3 months (n=49) or switch to rivastigmine patch without titration (9.5mg/day for 3 months; n=48), or switch to rivastigmine patch with titration (4.6mg/day for 1 month followed by 9.5mg/day for 2 months, n=43).
ResultsIncidence of gastrointestinal adverse events was 6.1% in the group treated orally and 4.2% in the group treated with non-titrated patches (P=.908). Skin tolerability was good (n=15, 16.7%) without any serious adverse events registered. Patch treatment was considered very easy to use by 72% of patients compared with 30% in the group with oral treatment (P=.0005). 60% of patients were satisfied with the patch, while only 14% were satisfied with capsules (P<.0001).
ConclusionsRivastigmine patches have a tolerability profile similar to that shown by capsules, but are associated with greater patient satisfaction.
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo de tipo progresivo que se manifiesta en forma de un deterioro cognitivo y de memoria, un empeoramiento paulatino de las actividades habituales de la vida diaria y un conjunto diverso de síntomas neuropsiquiátricos y alteraciones del comportamiento1. Como tal, la EA está considerada como la causa más común de demencia en el anciano. La causa de la forma esporádica mayoritaria (no hereditaria) de EA es desconocida, aunque es probable un origen heterogénico, derivado de efectos asociados al envejecimiento en combinación con interacciones complejas entre factores de riesgo de tipo genético y ambientales2.
Entre las estrategias terapéuticas más exitosas para hacer frente al progreso de la enfermedad de Alzheimer, cabe destacar el uso de inhibidores de la acetilcolinesterasa que actúan reforzando la neurotransmisión colinérgica remanente mediante la inhibición de la degradación de la acetilcolina liberada3. Tras la revelación de las limitaciones y potencial hepatotoxicidad de los inhibidores de aceticolinesterasa (AChE) de primera generación, como la tacrina, se han introducido varios inhibidores de aceticolinesterasa de segunda generación, incluida la rivastigmina, que en la actualidad se consideran mucho más eficaces y sin efectos adversos graves4.
Concretamente, la rivastigmina (Exelon®) es un inhibidor de la acetilcolinesterasa y butirilcolinesterasa (BuChE) de tipo carbamato, diseñado para facilitar la neurotransmisión colinérgica a través de un proceso de ralentización de la degradación de la acetilcolina liberada por neuronas colinérgicas funcionalmente intactas5. Los efectos adversos de la rivastigmina son, en general, los habituales en un inhibidor de la AChE de segunda generación: efectos gastrointestinales, especialmente náuseas y vómitos6. Estos efectos adversos suelen ser leves o moderados, de corta duración y con resolución espontánea tras la disminución de la dosis o la supresión del tratamiento.
El modo de acción y el metabolismo particular de la rivastigmina ha sugerido, a través de los estudios previos realizados, que es improbable que ésta interactúe significativamente con otro tipo de fármacos7. Esta característica es de particular relevancia en pacientes ancianos con EA, ya que es muy probable que la mayoría de ellos estén recibiendo medicación concomitante8. Otro de los problemas frecuentes en esta población es la falta de cumplimiento terapéutico, especialmente en una enfermedad crónica como la EA. La administración de tratamientos de liberación sostenida —por su facilidad de uso, tolerabilidad y tipo de absorción— puede contribuir de forma significativa a reducir el incumplimiento9.
Recientemente se ha desarrollado una nueva formulación de rivastigmina en forma de parches de aplicación transdérmica, que proporciona una liberación estable en el tiempo10. Se trata de un sistema seguro y bien tolerado, que simultáneamente permite una buena adherencia y una eficaz penetración del fármaco a través de la piel, con una muy buena tolerabilidad local, y asegurando su comodidad de uso en conjunción con una farmacocinética optimizada11,12.
El objetivo principal del presente estudio fue evaluar la tolerabilidad gastrointestinal del cambio de vía de administración oral a parches transdérmicos de rivastigmina (con o sin período de titulación) en comparación con el grupo de pacientes que permanece en tratamiento oral. Los objetivos secundarios del estudio incluyeron la evaluación de la tolerabilidad sistémica global de los dos tipos de tratamiento considerados, la tolerabilidad cutánea en el caso de la administración transdérmica y el grado de satisfacción que muestran tanto los cuidadores como los pacientes con las distintas vías de administración.
Pacientes y métodosSe seleccionó a pacientes ambulatorios con edad igual o superior a los 60 años, de cualquier raza o sexo, con diagnóstico de EA probable o posible (DSM-IV), con puntuación de leve a moderadamente grave según resultado evaluado mediante el Mini-Examen del Estado Mental de Folstein-MMSE (MMSE ≥ 10)13, que estuviesen en tratamiento con rivastigmina oral a una dosis mínima de 6mg/día y una dosis máxima de 12mg/día durante los 3 meses previos a la entrada en el estudio.
Se consideraron criterios de exclusión la hipersensibilidad demostrada a la rivastigmina, así como la presencia de una enfermedad avanzada, grave, progresiva o inestable de cualquier tipo, que pudiese interferir en las evaluaciones de seguridad y tolerabilidad o bien poner al paciente en riesgo. Además, no fueron considerados aquellos pacientes que presentaron un trastorno neurológico que, sin ser Alzheimer, pudiese justificar la presencia de una demencia (enfermedad de Huntington, enfermedad de Parkinson, resultados anormales en la función tiroidea, deficiencia de vitamina B12 o ácido fólico, condiciones post-traumáticas o sífilis).
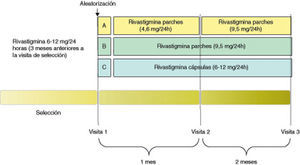
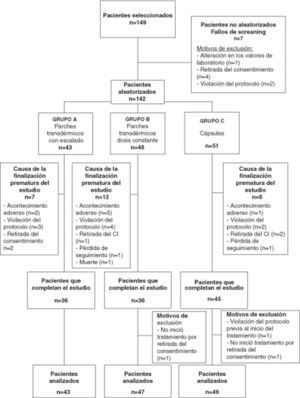
El estudio fue diseñado en forma de ensayo clínico de fase IIIb/IV, de tipo multicéntrico, aleatorizado y abierto. El conjunto de pacientes incluidos fueron aleatorizados a uno de los tres grupos siguientes de tratamiento: a) rivastigmina en parche transdérmico con escalado de dosis (RPE) (aplicación de 1 parche diario de 4,6mg/día durante el primer mes de tratamiento y paso posterior a la aplicación diaria de 1 parche de 9,5mg/día durante los 2 meses siguientes); b) rivastigmina en parche transdérmico sin escalado de dosis (RP) (aplicación de un parche diario de 9,5mg/día durante todo el período de tratamiento); c) rivastigmina en cápsulas (oral) (RO) (continuación de la pauta de tratamiento anterior al inicio del estudio de forma estable, es decir, administración de cápsulas de rivastigmina a dosis entre 6 y 12mg/día) (fig. 1). El período de seguimiento fue de 3 meses y se realizaron 3 visitas (basal, primer mes y tercer mes).
La variable principal evaluada por el estudio fue el porcentaje de pacientes que presentaron acontecimientos adversos de tipo gastrointestinal. Como variables secundarias se definieron las siguientes: la tolerabilidad global (porcentaje de pacientes con al menos un acontecimiento adverso de tipo sistémico), tolerabilidad local (porcentaje de pacientes con algún acontecimiento adverso de tipo cutáneo en los grupos de tratamiento con parches), grado de satisfacción de los pacientes y/o cuidadores con el tratamiento (entrevista semiguiada de 22 ítems con 4 opciones de respuesta (de más fácil a más difícil o de más satisfecho a más insatisfecho) que evaluaban facilidad de uso del tratamiento, facilidad para seguir la pauta, interferencia con la vida diaria y grado de satisfacción con el tratamiento) y estado cognitivo de los pacientes (puntuación del MMSE).
Los análisis de seguridad incluyeron la descripción del número de pacientes que presentaron acontecimientos adversos según sistema/órgano y término preferente, intensidad, relación con el tratamiento y acción de respuesta tomada. Complementariamente, se describieron el peso del paciente a lo largo de las visitas programadas, las constantes vitales por visita y grupo de tratamiento, el número y porcentaje de pacientes con resultado normal del electrocardiograma, y el número y porcentaje de pacientes con resultado normal para cada categoría de la exploración física y neurológica en visita basal y en la visita 3.
El análisis estadístico se realizó según los principios por intención de tratar (ITT). Todos los pacientes aleatorizados que recibieron al menos una dosis de la medicación en estudio fueron incluidos en el análisis (población de seguridad). Las variables fueron descritas por grupo de tratamiento y por visita. Para las variables categóricas, se describió el porcentaje relativo respecto al total de la columna y las n totales. Para las variables continuas se calcularon los estadísticos descriptivos: media, desviación estándar, intervalo de confianza [IC] del 95%, mínimo, máximo, media, percentiles, n y número de datos perdidos.
Para evaluar diferencias en el estado cognitivo (MMSE) según grupo de tratamiento en la segunda visita y la final, estas se estimaron según un IC del 95%. Para obtener este intervalo se usó un análisis de la covarianza (modelo ANCOVA), que incluyó el valor en visita basal como covariable. Todos los análisis se realizaron con el programa SAS, versión 9.1 (SAS Institute Inc., Cary, NC, USA).
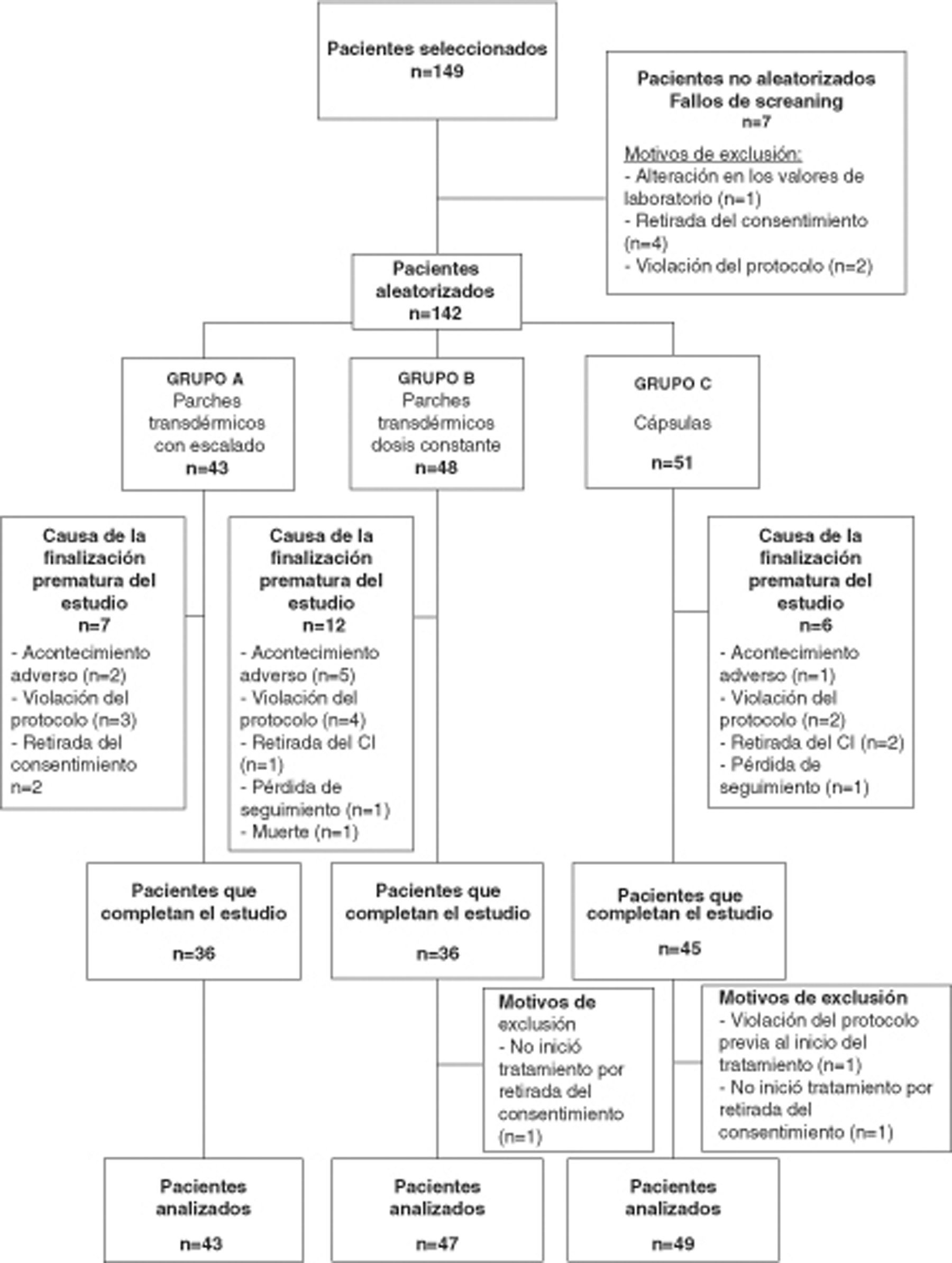
ResultadosPoblación de estudioDe los 149 pacientes seleccionados se aleatorizó a 142 pacientes en 10 centros. Se excluyó a 7 pacientes de la población debido a 4 retiradas del consentimiento, 2 violaciones del protocolo y una alteración de los valores de laboratorio. La figura 2 indica la distribución de la población en estudio y los motivos de exclusión del análisis.
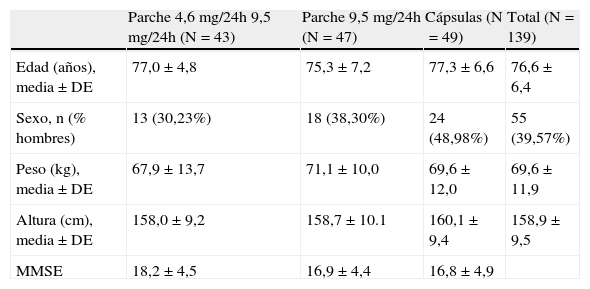
Las características demográficas y basales de la población de estudio en el momento de la inclusión en el mismo fueron comparables entre los tres grupos de tratamiento considerados (tabla 1). El 28,8% (n=40) de los pacientes había presentado previamente algún trastorno gastrointestinal. Esta incidencia de trastornos gastrointestinales previos resultó similar en los tres grupos tratados (p>0,05, test de la χ2).
Características demográficas y basales de la muestra
| Parche 4,6 mg/24h 9,5 mg/24h (N=43) | Parche 9,5 mg/24h (N=47) | Cápsulas (N=49) | Total (N=139) | |
| Edad (años), media±DE | 77,0±4,8 | 75,3±7,2 | 77,3±6,6 | 76,6±6,4 |
| Sexo, n (% hombres) | 13 (30,23%) | 18 (38,30%) | 24 (48,98%) | 55 (39,57%) |
| Peso (kg), media±DE | 67,9±13,7 | 71,1±10,0 | 69,6±12,0 | 69,6±11,9 |
| Altura (cm), media±DE | 158,0±9,2 | 158,7±10.1 | 160,1±9,4 | 158,9±9,5 |
| MMSE | 18,2±4,5 | 16,9±4,4 | 16,8±4,9 |
MMSE: Mini-Examen del Estado Mental.
Se realizó un seguimiento farmacocinético de las concentraciones plasmáticas de rivastigmina y de su metabolito NAP226-90 en los grupos en tratamiento considerados. El perfil farmacocinético de rivastigmina tras su administración en forma de cápsulas se describió adecuadamente a partir de un modelo de un compartimento con una cinética de absorción y de eliminación de primer orden. Cuando la rivastigmina fue administrada en forma de parche, la absorción siguió un proceso de orden cero. Las fluctuaciones en los niveles plasmáticos de rivastigmina fueron menores tras la administración transdérmica que tras la administración oral. Los parches mostraron además un menor pico de concentración máxima y unas concentraciones sostenidas en el tiempo.
La farmacocinética de rivastigmina tras administración transdérmica pudo ser modelada como infusión continua de 18-23h de duración. La relación AUC entre metabolito y rivastigmina fue menor con la administración transdérmica, evidenciando el menor efecto de primer paso (metabólico) con el uso del parche. Se asumió un proceso de primer orden a partir de las concentraciones plasmáticas de rivastigmina y la distribución se ajustó mejor mediante un modelo de un compartimento con eliminación de primer orden. La validación interna del modelo mostró un buen intervalo de predicción.
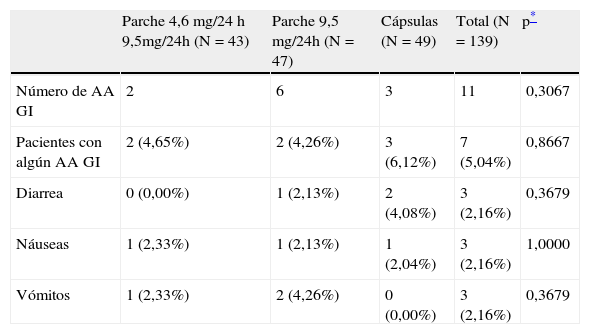
Tolerabilidad gastrointestinalEl porcentaje de pacientes con al menos un acontecimiento adverso (AA) de tipo gastrointestinal (diarrea, náuseas y/o vómitos) fue inferior al 5% en los grupos tratados con parches transdérmicos de rivastigmina (4,7% en RPE y 4,3% en RP). En el grupo tratado con cápsulas este porcentaje de pacientes con AA gastrointestinal ascendió al 6,1% (tabla 2). Las diferencias no fueron significativas (χ2, p=0,8667). Respecto al número de AA gastrointestinales, se contabilizó un total de 11: 2 en pacientes RPE, 6 en pacientes RP y 3 en el grupo RO (χ2; p=0,3067).
Número de acontecimientos adversos gastrointestinales relacionados con el tratamiento con rivastigmina durante el estudio. Población de seguridad
| Parche 4,6 mg/24 h 9,5mg/24h (N=43) | Parche 9,5 mg/24h (N=47) | Cápsulas (N=49) | Total (N=139) | p* | |
| Número de AA GI | 2 | 6 | 3 | 11 | 0,3067 |
| Pacientes con algún AA GI | 2 (4,65%) | 2 (4,26%) | 3 (6,12%) | 7 (5,04%) | 0,8667 |
| Diarrea | 0 (0,00%) | 1 (2,13%) | 2 (4,08%) | 3 (2,16%) | 0,3679 |
| Náuseas | 1 (2,33%) | 1 (2,13%) | 1 (2,04%) | 3 (2,16%) | 1,0000 |
| Vómitos | 1 (2,33%) | 2 (4,26%) | 0 (0,00%) | 3 (2,16%) | 0,3679 |
AA: acontecimiento adverso; GI: gastrointestinal.
La mayoría de los AA de tipo gastrointestinal fueron clasificados como de intensidad leve o moderada. Fueron considerados relacionados con la medicación de estudio un total de 5 AA gastrointestinales: 2 de ellos se produjeron en pacientes del grupo RP (náuseas), 1 en un paciente RPE (náuseas) y 2 más en pacientes tratados con cápsulas (diarrea y náuseas).
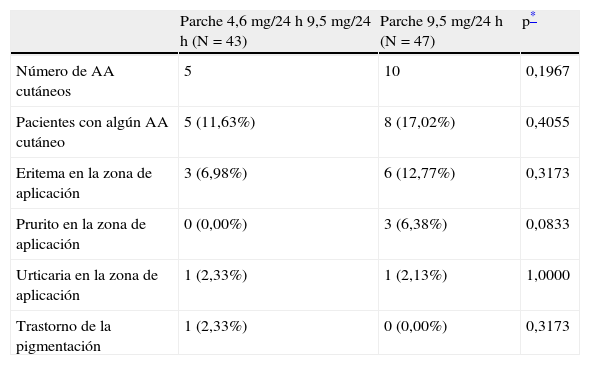
Tolerabilidad localEn referencia a la tolerabilidad cutánea, 5 pacientes (11,6%) del grupo RPE, presentaron algún AA de la piel o del tejido subcutáneo durante el período de estudio (tabla 3). En el grupo RP este porcentaje fue superior, alcanzando el 17% de pacientes con algún AA cutáneo (n=8), pero sin detectarse diferencias significativas entre grupos (χ2; p=0,4055). El número total de AA cutáneos relacionados fue de 15 eventos: 5 en el grupo RPE y 10 en el RP (χ2; p=0,1967).
Número de acontecimientos adversos de la piel y del tejido subcutáneo relacionados con el tratamiento transdérmico de rivastigmina recogidos durante el estudio. Población de seguridad
| Parche 4,6 mg/24 h 9,5 mg/24 h (N=43) | Parche 9,5 mg/24 h (N=47) | p* | |
| Número de AA cutáneos | 5 | 10 | 0,1967 |
| Pacientes con algún AA cutáneo | 5 (11,63%) | 8 (17,02%) | 0,4055 |
| Eritema en la zona de aplicación | 3 (6,98%) | 6 (12,77%) | 0,3173 |
| Prurito en la zona de aplicación | 0 (0,00%) | 3 (6,38%) | 0,0833 |
| Urticaria en la zona de aplicación | 1 (2,33%) | 1 (2,13%) | 1,0000 |
| Trastorno de la pigmentación | 1 (2,33%) | 0 (0,00%) | 0,3173 |
AA: acontecimiento adverso.
Todos los AA referidos a la piel y al tejido subcutáneo reportados durante el estudio se consideraron de intensidad leve o moderada; la mayoría de estos AA estaban relacionados con el proceso de aplicación de los parches (13 de los 15 AA de la piel y del tejido subcutáneo pertenecieron a este subgrupo). Únicamente a 2 pacientes (2,2% del total) se les retiró la medicación establecida como consecuencia de acontecimientos adversos locales (cutáneos).
Tolerabilidad globalLa tolerabilidad global de los diferentes grupos de tratamiento fue similar entre ellos, sin diferencias significativas (χ2; p=0,8239). El porcentaje total de pacientes con algún acontecimiento adverso detectado durante el estudio fue del 48,8% (n=21) en pacientes RPE, del 55,3% (n=26) en pacientes RP y del 53,1% (n=26) en pacientes RO (χ2; p=0,7099). Entre los AA más frecuentemente observados a lo largo del estudio y tras la aplicación del tratamiento, destacan los trastornos psiquiátricos (n=7 en RPE, n=6 en RP y n=8 en RO; p=0,8667), los trastornos del sistema nervioso (n=6 en RPE, n=9 en RP y n=3 en RO; p=0,2231) y los trastornos generales en el lugar de administración (n=5 en RPE y n=10 en RP; p=0,1967).
Cumplimiento terapéuticoRespecto al cumplimiento terapéutico del tratamiento, los mayores porcentajes de pacientes cumplidores tras el primer mes de la aleatorización se alcanzan para el grupo RO (95,7%), aunque los cumplimientos no son significativamente distintos en el resto de los grupos (el 92,5% en RP y el 90,7% en RPE). Por el contrario, al cabo de 3 meses de iniciado el tratamiento, el cumplimiento a medio y largo plazo se convierte en mínimo en el grupo RO (83,3%), máximo para RP (88,4%) e intermedio en RPE (84,6%).
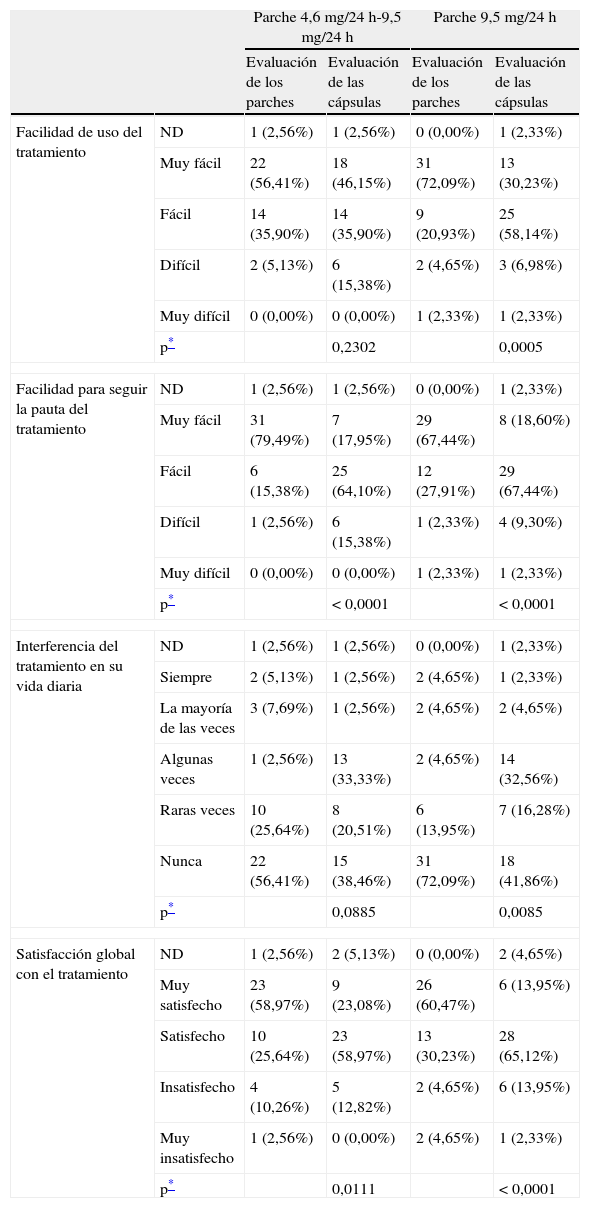
Grado de satisfacción de los pacientes/cuidadores con el tratamientoSe evaluó también la satisfacción expresada tanto por los cuidadores como por los pacientes con Alzheimer respecto al uso del parche de rivastigmina respecto a su experiencia previa con la versión oral del tratamiento. Para todas las preguntas realizadas sobre el grado de satisfacción, la significación obtenida es claramente más destacada al comparar la evaluación de RP frente a RO que al comparar RO con RPE (p<0,0001 en las 4 categorías sobre satisfacción para el primer caso vs p<0,0001 en una única categoría para el segundo caso, test de Mann-Whitney-Wilcoxon) (tabla 4).
Grado de satisfacción de los pacientes/cuidadores con el tratamiento (según entrevista semiguiada)
| Parche 4,6 mg/24 h-9,5 mg/24 h | Parche 9,5 mg/24 h | ||||
| Evaluación de los parches | Evaluación de las cápsulas | Evaluación de los parches | Evaluación de las cápsulas | ||
| Facilidad de uso del tratamiento | ND | 1 (2,56%) | 1 (2,56%) | 0 (0,00%) | 1 (2,33%) |
| Muy fácil | 22 (56,41%) | 18 (46,15%) | 31 (72,09%) | 13 (30,23%) | |
| Fácil | 14 (35,90%) | 14 (35,90%) | 9 (20,93%) | 25 (58,14%) | |
| Difícil | 2 (5,13%) | 6 (15,38%) | 2 (4,65%) | 3 (6,98%) | |
| Muy difícil | 0 (0,00%) | 0 (0,00%) | 1 (2,33%) | 1 (2,33%) | |
| p* | 0,2302 | 0,0005 | |||
| Facilidad para seguir la pauta del tratamiento | ND | 1 (2,56%) | 1 (2,56%) | 0 (0,00%) | 1 (2,33%) |
| Muy fácil | 31 (79,49%) | 7 (17,95%) | 29 (67,44%) | 8 (18,60%) | |
| Fácil | 6 (15,38%) | 25 (64,10%) | 12 (27,91%) | 29 (67,44%) | |
| Difícil | 1 (2,56%) | 6 (15,38%) | 1 (2,33%) | 4 (9,30%) | |
| Muy difícil | 0 (0,00%) | 0 (0,00%) | 1 (2,33%) | 1 (2,33%) | |
| p* | < 0,0001 | < 0,0001 | |||
| Interferencia del tratamiento en su vida diaria | ND | 1 (2,56%) | 1 (2,56%) | 0 (0,00%) | 1 (2,33%) |
| Siempre | 2 (5,13%) | 1 (2,56%) | 2 (4,65%) | 1 (2,33%) | |
| La mayoría de las veces | 3 (7,69%) | 1 (2,56%) | 2 (4,65%) | 2 (4,65%) | |
| Algunas veces | 1 (2,56%) | 13 (33,33%) | 2 (4,65%) | 14 (32,56%) | |
| Raras veces | 10 (25,64%) | 8 (20,51%) | 6 (13,95%) | 7 (16,28%) | |
| Nunca | 22 (56,41%) | 15 (38,46%) | 31 (72,09%) | 18 (41,86%) | |
| p* | 0,0885 | 0,0085 | |||
| Satisfacción global con el tratamiento | ND | 1 (2,56%) | 2 (5,13%) | 0 (0,00%) | 2 (4,65%) |
| Muy satisfecho | 23 (58,97%) | 9 (23,08%) | 26 (60,47%) | 6 (13,95%) | |
| Satisfecho | 10 (25,64%) | 23 (58,97%) | 13 (30,23%) | 28 (65,12%) | |
| Insatisfecho | 4 (10,26%) | 5 (12,82%) | 2 (4,65%) | 6 (13,95%) | |
| Muy insatisfecho | 1 (2,56%) | 0 (0,00%) | 2 (4,65%) | 1 (2,33%) | |
| p* | 0,0111 | < 0,0001 | |||
El tratamiento RP fue definido como muy fácil de usar por el 72% de pacientes, mientras que el RO fue considerado muy fácil de usar por únicamente el 30% de pacientes tratados con cápsulas (p=0,0005). El 67% de los pacientes RP calificaron la pauta de tratamiento como muy fácil de seguir, comparado con un 19% en los pacientes RO (p<0,0001). Finalmente, un 72% de los pacientes RP atestiguaron que el tratamiento nunca interfirió con su vida diaria frente a un 42% en el grupo RO (p=0,0085). En la categoría sobre satisfacción global, las diferencias aun fueron más evidentes, con un 60% de pacientes RP muy satisfechos, en comparación con un 14% en el grupo RO (p<0,0001).
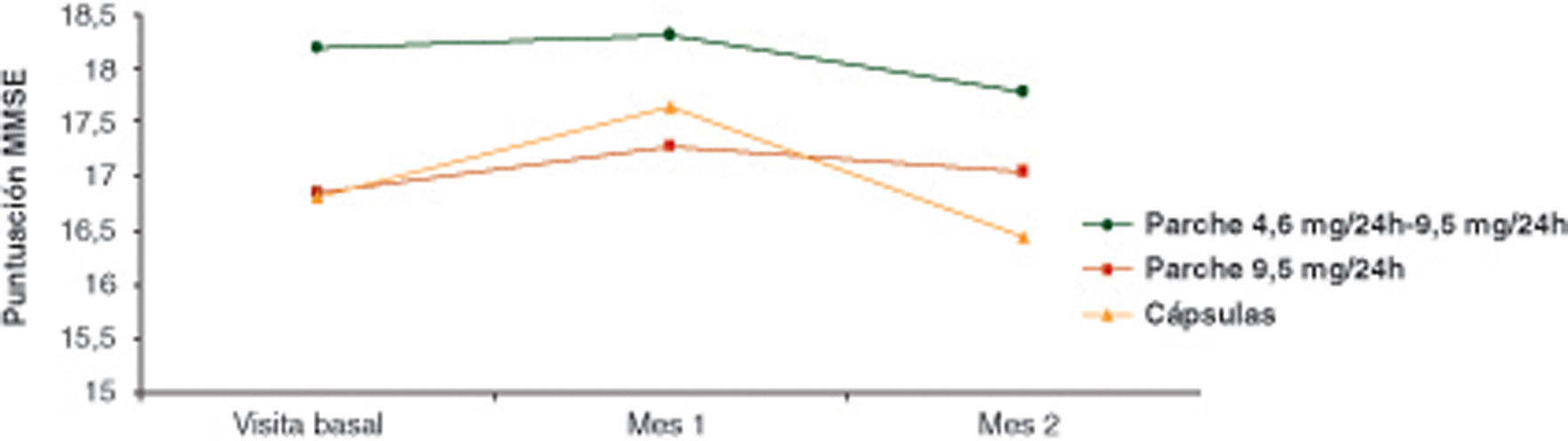
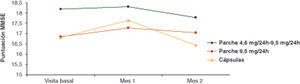
Estado cognitivoEl estado cognitivo del paciente se evaluó mediante la aplicación del cuestionario MMSE y la evaluación de su puntuación a lo largo del estudio y según el grupo de tratamiento. De manera global, no se detectaron diferencias significativas entre los 3 grupos de tratamiento considerados para la puntuación total de MMSE en la visita 2 (tras 1 me de iniciarse el tratamiento) y en la visita 3 (tras 3 meses) (p=0,2432 y p=0,4126, ANCOVA, respectivamente).
Las medias ajustadas de la puntuación del MMSE, en la visita 2 en los diferentes grupos de tratamiento, fueron 18,3 puntos en pacientes RPE, 17,3 puntos en pacientes RP y 17,7 puntos en pacientes RO. En la visita 3, las medias ajustadas de la puntuación del MMSE fueron: 17,8 puntos en RPE, 17,1 puntos en RP y 16,4 puntos en RO (fig. 3).
DiscusiónLa diferenciación entre vías de administración para el tratamiento de la EA puede tener destacadas repercusiones en su eficiencia y estabilidad a medio y largo plazo, especialmente cuando se consideran factores disuasorios del cumplimiento terapéutico y de la satisfacción con el tratamiento, como sería el caso de los efectos adversos, la baja tolerabilidad del medicamento, la complejidad de la pauta de administración asociada y la interacción con medicaciones concomitantes14-16.
Asimismo, y respecto a la tolerabilidad de rivastigmina, los AA son, en general, los esperables para un inhibidor de las colinesterasas. Los efectos indeseables son leves o moderados, de corta duración y se resuelven espontáneamente tras la disminución de la dosis o supresión del tratamiento6. En cuanto a la naturaleza de los mismos, los más frecuentes son los efectos gastrointestinales, concretamente náuseas y vómitos que se relacionan con los efectos colinomiméticos de la rivastigmina. Un estudio sobre los inhibidores de las colinesterasas indica que la incidencia de AA depende del grado y duración de la inhibición enzimática y de la duración de las fluctuaciones diarias en la actividad de la enzima17. Por ello, se ha postulado que la reducción de las fluctuaciones diarias en el patrón farmacocinético de rivastigmina conduce a una reducción en las fluctuaciones en la inhibición enzimática de las colinesterasas, aumentando la tolerabilidad global y manteniendo la eficacia a lo largo del día18.
Para conseguir este patrón farmacocinético estable se han desarrollado recientemente los parches transdérmicos de rivastigmina. Los parches transdérmicos ofrecen destacadas ventajas sobre las formas de administración oral de rivastigmina, como son la liberación continua del fármaco, la reducción de picos de absorción y los niveles estables y prolongados en el tiempo del fármaco en sangre11,12. Teóricamente, estas ventajas pueden mejorar el patrón de tolerabilidad de la rivastigmina, especialmente en lo referido a la tolerabilidad gastrointestinal, permitiendo un acceso más fácil a dosis terapéuticas óptimas. Adicionalmente, la aplicación de rivastigmina en forma de parches transdérmicos puede suponer una clara ventaja en el tratamiento de la EA al incrementar el cumplimiento del tratamiento por las facilidades propias asociadas al uso de los parches.
El objetivo de este trabajo se centraba en la evaluación de la tolerabilidad a rivastigmina en pacientes que habían cambiado su vía de administración habitual, la vía oral a la transdérmica mediante los nuevos parches disponibles, en comparación con los pacientes que mantienen la administración a través de cápsulas. De manera complementaria, el trabajo también pretendía establecer empíricamente la necesidad de un período de titulación para proceder al cambio seguro en la vía de administración hasta alcanzar la dosis óptima. Respecto a la tolerabilidad de la aplicación de rivastigmina, ésta se evaluó a nivel gastrointestinal, a nivel sistémico global para las dos vías de administración y específicamente a nivel cutáneo para la vía transdérmica. Finalmente, se propuso la valoración de los niveles de satisfacción de pacientes y cuidadores con el procedimiento de aplicación del parche de rivastigmina.
El estudio no detectó diferencias significativas en la tolerabilidad de tipo gastrointestinal mostrada por una u otra vía de administración, aunque esta mostró una cierta tendencia a reducirse con la aplicación del parche de rivastigmina. En cualquier caso, cabe destacar, la baja incidencia de acontecimientos adversos de tipo gastrointestinal en los pacientes tratados con cápsulas de rivastigmina en comparación con las incidencias referidas en estudios previos19-21. Probablemente, este relativamente reducido porcentaje de acontecimientos adversos gastrointestinales tanto en los grupos tratados con rivastigmina en parche como oral en comparación con los datos disponibles en trabajos precedentes22 podría explicarse fácilmente por la naturaleza de la población de estudio, constituida en nuestro trabajo por pacientes que habían recibido anteriormente a la inclusión el tratamiento con rivastigmina en forma oral y, por tanto, ya habituados a las dosis de rivastigmina consideradas14.
Debido a que la aplicación transdérmica implica un riesgo adicional de acontecimientos adversos asociados a la vía de administración, en el presente estudio se evaluó adicionalmente la tolerabilidad local (cutánea) de la aplicación de los parches. No se detectaron diferencias significativas en el porcentaje de pacientes con AA de tipo cutáneo entre los dos grupos de tratamiento con parches, lo que demostró una falta de efecto de la titulación en la determinación y aparición de este tipo de acontecimientos adversos. Estos porcentajes son similares22,23 o inferiores24 a los reportados en los estudios previos disponibles.
Siguiendo con los argumentos referidos a la tolerabilidad global del parche de rivastigmina, tanto gastrointestinal como cutánea, ésta fue comparable entre los dos grupos de pacientes tratados con parches transdérmicos (con titulación y sin ella). Globalmente, este resultado parece sugerir que los pacientes podrían beneficiarse de un paso de la vía oral a la transdérmica (parches de 9,5mg/24h de rivastigmina), sin necesidad de un escalamiento previo de la dosis, y confirmando observaciones previas de Aguera et al25 que no encontraban argumentos favorables a una mayor eficiencia o tolerabilidad de los tratamientos transdérmicos basados en el escalado de la dosis. Adicionalmente, este resultado avala las conclusiones de trabajos que confirman la necesidad de alcanzar la máxima dosis tolerable cuanto antes con el objetivo de obtener correlaciones máximas entre la medida MMSE y la dosis final de rivastigmina26.
En cuanto a la naturaleza de los AA más habituales en los grupos en tratamiento con el parche transdérmico de rivastigmina, las categorías más frecuentemente reportadas fueron los trastornos psiquiátricos, los trastornos del sistema nervioso y los trastornos generales en el lugar de administración. Sin embargo, los valores bajos de estas incidencias están de acuerdo con los resultados que destacan la mejor tolerabilidad global asociada a este tipo de tratamiento de los pacientes con EA23.
Respecto a la satisfacción de los cuidadores/pacientes en los distintos grupos de tratamiento, los pacientes tratados con parches transdérmicos de rivastigmina a dosis constante consideraron más fácil el tratamiento con parches que con cápsulas. De modo similar, los pacientes tratados con parches consideraron que su pauta de aplicación y uso era más fácil de seguir, probablemente como consecuencia de una menor interferencia de este tratamiento en su vida diaria. Finalmente, respecto a la satisfacción global con el tratamiento, los dos grupos de pacientes tratados con parches transdérmicos atestiguaron una satisfacción superior a la mostrada con el tratamiento oral previo, especialmente como consecuencia de su mayor facilidad de uso y menor interferencia con la vida diaria. Estas valoraciones son coincidentes con los patrones generales obtenidos en estudios en que se valoraba exclusivamente la satisfacción de los cuidadores27. Asimismo, los parches se asocian con una mayor satisfacción global con el tratamiento por parte de cuidadores y pacientes respecto a la vía oral, un resultado que confirma las preferencias en relación con las bondades inherentes a una farmacocinética más racional y constante asociada a la administración transdérmica18-28.
Cuando se evalúa el estado cognitivo de los pacientes a lo largo del período del estudio, parece evidenciarse una cierta tendencia sostenida contra el deterioro de este estado en los pacientes en tratamiento con el parche transdérmico. Aunque las diferencias no son estadísticamente significativas, el tratamiento oral muestra un mayor empeoramiento cognitivo a partir de la tercera visita. Este resultado podría estar relacionado con una tendencia a un menor cumplimiento terapéutico a largo plazo en este tipo de administración y con una mayor interferencia de la pauta de administración oral en la vida diaria del paciente29.
En conclusión, el cambio de la forma de administración de rivastigmina (de cápsulas a parches transdérmicos) se puede llevar a cabo con buena tolerabilidad gastrointestinal, global y cutánea, y además se ha demostrado que los pacientes pueden beneficiarse de un paso a dosis más altas y, por lo tanto, más efectivas de rivastigmina, sin necesidad de un escalado de la dosis y con el objetivo de alcanzar cuanto antes dosis terapéuticas y máxima eficacia del fármaco30,31.
Conflictos de interesesEste estudio ha recibido financiación de Novartis Farmacéutica, S.A. para su realización.
Agradecemos la colaboración en la elaboración del presente manuscrito de Emili González-Pérez, del Departamento de Medical Writing de Trial Form Support, España.
Jordi Peña-Casanova (Hospital del Mar, Barcelona), Manuel Fernández (Hospital Cruces, Bilbao), Jordi Matías-Guiu (Hospital Clínico San Carlos, Madrid), Alfredo Robles (Hospital Clínico Universitario de Santiago de Compostela), Camino Sevilla (Hospital de la Princesa, Madrid).
En el Anexo 1 se incluye los componentes del grupo.